N-Bromosuksinimida
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
1-Bromo-2,5-pirolidinadion
| |||
| Nama lain
N-bromosuksinimida; NBS
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C4H4BrNO2 | |||
| Massa molar | 177,99 g·mol−1 | ||
| Penampilan | Padatan putih | ||
| Densitas | 2.098 g/cm3 (solid) | ||
| Titik lebur | 175–178 °C (347–352 °F; 448–451 K) | ||
| Titik didih | 339 °C (642 °F; 612 K) | ||
| 14.7 g/L (25 °C) | |||
| Kelarutan dalam CCl4 | Tidak larut (25 °C) | ||
| Bahaya | |||
| Bahaya utama | Iritan | ||
| Lembar data keselamatan | [1] | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
N-Bromosuksinimida atau NBS adalah suatu pereaksi kimia yang digunakan dalam reaksi substitusi dan adisi elektrofilik radikal dalam kimia organik. NBS dapat menjadi sumber bagi Br•, radikal brom.
Preparasi
NBS tersedia secara komersial. Pereaksi ini juga dapat disintesis di laboratorium. Untuk melakukannya, natrium hidroksida dan bromin ditambahkan ke dalam larutan es dari suksinimida. Produk NBS mengendap dan dapat dikumpulkan dengan filtrasi.
NBS mentah memberikan rendemen yang lebih baik dalam reaksi Wohl–Ziegler. Dalam kasus lainnya, NBS tak murni (berwarna agak kuning) Mungkin memberikan hasil yang tidak dapat diandalkan. Hal ini dapat dimurnikan dengan rekristalisasi dari air pada suhu 90–95 °C (10 g NBS untuk 100 mL air).[1]
Reaksi
Adisi pada alkena
NBS akan bereaksi dengan alkena 1 dalam pelarut berair untuk menghasilkan bromohidrin 2. Kondisi yang disukai adalah penambahan NBS secara parsial ke larutan alkena dalam 50% larutan DMSO, DME, THF, atau tert-butanol pada suhu 0 °C.[2] Pembentukan ion bromonium dan serangan langsung dengan air menghasilkan adisi Markovnikov dan selektivitas stereokimia anti.[3]
Reaksi samping meliputi pembentukan senyawa α-bromoketon dan senyawa dibromo. Hal ini dapat diminimalkan dengan penggunaan NBS baru hasil rekristalisasi.
Dengan adisi nukleofilik, dan bukan air, berbagai alkana bifungsional dapat disintesis.[4]
Brominasi alilik dan benzilik
Kondisi standar untuk penggunaan NBS dalam brominasi alilik dan/atau benzilik melibatkan me-refluks larutan NBS dalam CCl4 anhidrat dengan suatu inisiator radikal—biasanya azobisisobutironitril (AIBN) atau benzoil peroksida, iradiasi, atau keduanya untuk memunculkan inisiasi radikal.[5][6] Intermediet radikal alilik dan benzilik yang terbentuk selama reaksi ini lebih stabil daripada radikal karbon lainnya dan produk utamanya adalah bromida alilik dan benzilik. Hal ini juga disebut reaksi Wohl–Ziegler.[7][8]
Karbon tetraklorida harus dipertahankan anhidrat sepanjang reaksi, karena kehadiran air kemungkinan besar menghidrolisis produk yang diinginkan.[9] Barium karbonat sering ditambahkan untuk menjaga kondisi anhidrat dan bebas asam.
Pada reaksi di atas, sementara campuran produk bromida allomerik isomer dimungkinkan, hanya satu yang tercipta karena stabilitas yang lebih besar dari radikal posisi ke-4 di atas radikal yang berpusat pada metil.
Brominasi turunan karbonil
NBS dapat membrominasi turunan α-karbonil melalui baik jalur radikal (seperti di atas) atau melalui katalisis asam. Misalnya, heksanoil klorida 1 dapat dibrominasi dalam posisi alfa oleh NBS dengan menggunakan katalis asam.[10]
Reaksi enolat, enol eter, atau enol asetat dengan NBS adalah metode yang disukai dari α-brominasi karena menghasilkan rendemen yang tinggi dengan sedikit produk samping.[11][12]
Brominasi turunan aromatik
Senyawa aromatik yang kaya-elektron, Seperti fenol, anilin, dan berbagai aromatik heterosiklik,[13] dapat dibrominasi menggunakan NBS.[14][15] Menggunakan DMF Sebagai pelarut memberikan tingkat selektivitas-para yang tinggi.[16]
Penataan ulang Hofmann
NBS, dengan adanya basa yang kuat, seperti DBU, bereaksi dengan spesi utama amida untuk menghasilkan karbamat melalui penataan ulang Hofmann.[17]
Oksidasi selektif alkohol
Merupakan hal yang jarang terjadi, namun memungkinkan bagi NBS untuk mengoksidasi alkohol. E. J. Corey et al. menemukan bahwa seseorang dapat secara selektif mengoksidasi alkohol sekunder dengan adanya alkohol primer menggunakan NBS dalam dimetoksietana (DME) berair.[18]
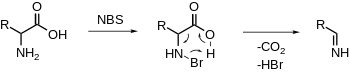
Dekarboksilasi oksifatif asam α-amino
NBS secara elektrofilik membrominasi amina,yang diikuti dengan dekarboksilasi dan pelepasan imina. Hidrolisis lebih lanjut akan menghasilkan aldehida dan amonia.[19][20] (Lih. Dekarboksilasi PLP non-oksidatif)
Perhatian
Meskipun NBS lebih mudah dan aman untuk ditangani daripada brom, tindakan pencegahan harus dilakukan untuk menghindari inhalasi. NBS harus disimpan di kulkas. NBS akan terurai seiring waktu pemberian bromin. NBS murni berwarna putih, tapi sering ditemukan berwarna putih atau coklat yang diwarnai oleh brom.
Secara umum, reaksi yang melibatkan NBS bersifat eksotermik. Karena itu, tindakan pencegahan ekstra harus dilakukan saat digunakan dalam skala besar.
Lihat pula
Referensi
- ^ Dauben, H. J., Jr; McCoy, L. L. (1959). "N-Bromosuccinimide. I. Allylic Bromination, a General Survey of Reaction Variables". J. Am. Chem. Soc. (dalam bahasa Inggris). 81 (18): 4863–4873. doi:10.1021/ja01527a027.
- ^ Hanzlik, R. P.. "Selective epoxidation of terminal double bonds". Org. Synth.; Coll. Vol. 6: 560.
- ^ Beger, J. (1991). "Präparative Aspekte elektrophiler Dreikomponentenreaktionen mit Alkenen" [Preparative aspects of electrophilic three-component reactions with alkenes]. J. Prakt. Chem. 333 (5): 677–698. doi:10.1002/prac.19913330502.
- ^ (2004) "Bromofluorination of alkenes". Org. Synth.; Coll. Vol. 10: 128.
- ^ Djerassi, Carl (1948). "Brominations with N-Bromosuccinimide and Related Compounds. The Wohl–Ziegler Reaction". Chem. Rev. (dalam bahasa Inggris). 43 (2): 271–317. doi:10.1021/cr60135a004. PMID 18887958.
- ^ (1963) "4-Bromo-2-heptene". Org. Synth.; Coll. Vol. 4: 108.
- ^ Wohl, A. (1919). "Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge" [Bromination of unsaturated compounds with N-bromoacetamide, a contribution to the theory of the course of chemical processes]. Berichte der deutschen chemischen Gesellschaft (A and B Series) (dalam bahasa Inggris). 52: 51. doi:10.1002/cber.19190520109.
- ^ Ziegler, K.; Schenck, G.; Krockow, E. W.; Siebert, A.; Wenz, A.; Weber, H. (1942). "Die Synthese des Cantharidins" [The synthesis of cantharidin]. Justus Liebig's Annalen der Chemie (dalam bahasa Inggris). 551: 1. doi:10.1002/jlac.19425510102.
- ^ Binkley, R. W.; Goewey, G. S.; Johnston, J. (1984). "Regioselective ring opening of selected benzylidene acetals. A photochemically initiated reaction for partial deprotection of carbohydrates". J. Org. Chem. (dalam bahasa Inggris). 49 (6): 992. doi:10.1021/jo00180a008.
- ^ (1988) "2-Bromohexanoyl chloride". Org. Synth.; Coll. Vol. 6: 190.
- ^ Stotter, P. L.; Hill, K. A. (1973). "α-Halocarbonyl compounds. II. Position-specific preparation of α-bromoketones by bromination of lithium enolates. Position-specific introduction of α,β-unsaturation into unsymmetrical ketones". J. Org. Chem. 38 (14): 2576. doi:10.1021/jo00954a045.
- ^ Lichtenthaler, F. W. (1992). "Various Glycosyl Donors with a Ketone or Oxime Function next to the Anomeric Centre: Facile Preparation and Evaluation of their Selectivities in Glycosidations". Synthesis (dalam bahasa Inggris). 1992: 179–84. doi:10.1055/s-1992-34167.
- ^ (1998) "Regioselective synthesis of 3-substituted indoles". Org. Synth.; Coll. Vol. 9: 417.
- ^ Gilow, H. W.; Burton, D. E. (1981). "Bromination and chlorination of pyrrole and some reactive 1-substituted pyrroles". J. Org. Chem. (dalam bahasa Inggris). 46 (11): 2221. doi:10.1021/jo00324a005.
- ^ (2005) "Synthesis of 5-bromoisoquinoline and 5-bromo-8-nitroisoquinoline". Org. Synth. 81: 98.
- ^ Mitchell, R. H.; Lai, Y. H.; Williams, R. V. (1979). "N-Bromosuccinimide-dimethylformamide: a mild, selective nuclear monobromination reagent for reactive aromatic compounds". J. Org. Chem. (dalam bahasa Inggris). 44 (25): 4733. doi:10.1021/jo00393a066.
- ^ (2004) "Methyl carbamate formation via modified Hofmann rearrangement reactions". Org. Synth.; Coll. Vol. 10: 549.
- ^ Corey, E. J.; Ishiguro, M (1979). "Total synthesis of (±)-2-isocyanopupukeanane". Tetrahedron Lett. (dalam bahasa Inggris). 20 (30): 2745–2748. doi:10.1016/S0040-4039(01)86404-2.
- ^ Ramachandran, M. S.; Easwaramoorthy, D.; Rajasingh, V.; Vivekanandam, T. S. (1990-01-01). "N-Chlorosuccinimide-Promoted Oxidative Decarboxylation of α-Amino Acids in Aqueous Alkaline Medium". Bulletin of the Chemical Society of Japan (dalam bahasa Inggris). 63 (8): 2397–2403. doi:10.1246/bcsj.63.2397.
- ^ Song, Xuezheng; Ju, Hong; Zhao, Chunmei; Lasanajak, Yi (2014-10-15). "Novel Strategy to Release and Tag N-Glycans for Functional Glycomics". Bioconjugate Chemistry (dalam bahasa Inggris). 25 (10): 1881–1887. doi:10.1021/bc500366v. ISSN 1043-1802. PMC 4197647
 . PMID 25222505.
. PMID 25222505.
Pranala luar
- (Inggris) Penggunaan N-bromosuksinimida dalam sintesis organik Diarsipkan 2012-07-16 di Wayback Machine.
- (Inggris) Reaksi dengan NBS