Klorat

CAS # 14866-68-3[1]
Anion klorat mempunyai rumus ClO. Dalam kasus ini, atom klorin berada pada tingkat oksidasi +5. "Klorat" dapat juga merujuk pada senyawa kimia yang mengandung anion ini; klorat adalah garam dari asam klorat. "Klorat", jika diikuti dengan angka Romawi dalam kurung, misal klorat(VII), merujuk pada oksianion dari klorin.
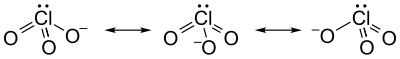
Sesuai prediksi VSEPR, anion klorat mempunyai struktur piramida trigonal.
Klorat adalah oksidator kuat dan harus dijauhkan dari bahan organik atau yang mudah teroksidasi. Campuran garam klorat dengan bahan yang mudah terbakar apa pun (gula, serbuk gergaji, arang, pelarut organik, logam, dll.) akan mudah mengalami deflagrasi (bahasa Inggris: deflagrate). Klorat pernah banyak digunakan dalam piroteknik karena alasan ini, tetapi gagal karena sifatnya yang tidak stabil. Kebanyakan aplikasi piroteknik yang sebelumnya menggunakan klorat beralih menggunakan perklorat yang lebih stabil.
Struktur dan ikatan
[sunting | sunting sumber]Ion klorat tidak dapat disajikan secara sederhana menggunakan struktur Lewis, karena seluruh ikatan Cl−O memiliki panjang yang sama (1,49 Å dalam kalium klorat[2]), dan atom klorin bersifat hipervalen. Sebaliknya, sering dianggap sebagai hibrida dari beberapa struktur resonansi:
Preparasi
[sunting | sunting sumber]Laboratorium
[sunting | sunting sumber]Klorat logam dapat dibuat dengan menambahkan klorin pada logam hidroksida panas seperti KOH:
- 3 Cl + 6 KOH → 5 KCl + KClO + 3 H
Pada reaksi ini, klorin mengalami disproporsionasi, reduksi dan oksidasi sekaligus. Klorin, bilangan oksidasi 0, membentuk klorida Cl (bilangan oksidasi −1) dan klorat(V) ClO (bilangan oksidasi +5). Sebaliknya, reaksi larutan dingin hidroksida logam dengan klorin menghasilkan klorida dan hipoklorit (bilangan oksidasi +1).
Industri
[sunting | sunting sumber]Sintesis natrium klorat skala industri berawal dari larutan natrium klorida (brine) dan bukan dari gas klorin. Jika peralatan elektrolisis memungkinkan untuk mencampur klorin dan natrium hidroksida, maka terjadi reaksi disproporsionasi seperti dijelaskan di atas.
Keberadaan di alam
[sunting | sunting sumber]Studi terbaru mengungkap keberadaan deposit klorat alami di seluruh dunia, dengan konsentrasi relatif tinggi ditemukan di daerah kering dan sangat kering.[3] Klorat juga ditentukan dalam sampel air hujan dengan jumlah klorat sama dengan perklorat. Ditengarai bahwa klorat dan perklorat berbagi mekanisme formasi alami dan merupakan bagian dari siklus biogeokimia klorin.
Dari sudut pandang mikrobial, keberadaan klorat alami dapat pula menjelaskan alasan keberadaan varietas mikroorganisme yang mampu mereduksi klorat menjadi klorida. Lebih lanjut, evolusi klorat reduksi kemungkinan merupakan fenomena purba karena seluruh bakteri pereduksi perklorat yang dijelaskan saat ini juga menggunakan klorat sebagai penerima elektron terminal.[4]
Senyawa (garam)
[sunting | sunting sumber]Contoh klorat antara lain
- kalium klorat, KClO
- natrium klorat, NaClO
- magnesium klorat, Mg(ClO)
2
Oksianion lain
[sunting | sunting sumber]Jika angka Romawi di dalam kurung ditulis setelah kata "klorat", ini menunjukkan oksianion mengandung klorin dalam tingkat oksidasi yang dimaksud, misalnya:
| Nama umum | Nama lain | Tingkat oksidasi | Rumus |
|---|---|---|---|
| Hipoklorit | Klorat(I) | +1 | ClO |
| Klorit | Klorat(III) | +3 | ClO |
| Klorat | Klorat(V) | +5 | ClO |
| Perklorat | Klorat(VII) | +7 | ClO |
Berdasarkan konvensi ini, "klorat" berarti seluruh oksianion klorin. Umumnya, "klorat" hanya merujuk pada klorin dengan tingkat oksidasi +5.
Toksisitas
[sunting | sunting sumber]Klorat relatif beracun, meskipun mereka membentuk klorida yang tak berbahaya pada reaksi reduksi.
Referensi
[sunting | sunting sumber]- ^ "ChemIndustry". Diakses tanggal 9 April 2014.
- ^ J. Danielsen, A. Hazell, F. K. Larsen (1981). "The structure of potassium chlorate at 77 and 298 K". Acta Cryst. B37: 913–915. doi:10.1107/S0567740881004573.
- ^ Rao, B.; Hatzinger, P. B.; Böhlke, J. K.; Sturchio, N. C.; Andraski, B. J.; Eckardt, F. D.; Jackson, W. (2010). "Natural Chlorate in the Environment: Application of a New IC-ESI/MS/MS Method with a Cl18O3− Internal Standard". Environ. Sci. Technol. 44: 8429–8434. doi:10.1021/es1024228. PMID 20968289.
- ^ Coates, J. D.; Achenbach, L. A. (2004). "Microbial perchlorate reduction: rocket-fuelled metabolism". Nature Reviews Microbiology. 2 (July): 569–580. doi:10.1038/nrmicro926. PMID 15197392.