Pengikatan nitrogen

Pengikatan nitrogen atau fiksasi nitrogen adalah proses di mana nitrogen (N2) di atmosfer diubah menjadi amonia (NH3)[1] melalui proses alami maupun sintetik. Nitrogen yang berada di atmosfer berada dalam wujud diatomik N2 dan cenderung inert. Proses pengikatan membebaskan atom nitrogen untuk bereaksi.
Nitrogen merupakan unsur yang penting bagi semua bentuk kehidupan karena nitrogen diperlukan untuk proses biosintesis komponen dasar tumbuhan, hewan, dan bentuk kehidupan lainnya. Nukleotida, komponen penting penyusun DNA dan RNA serta asam amino penyusun protein merupakan contoh komponen dasar penyusun kehidupan makhluk hidup. Dengan memahami hal tersebut, maka pengikatan nitrogen agar dapat digunakan bagi tumbuhan merupakan konsep penting dalam pertanian sehingga manufaktur pupuk berkembang. Pengikatan nitrogen secara sintetis juga digunakan dalam pembuatan bahan peledak. Pengikatan nitrogen di alam dapat terjadi melalui kilat dan aktivitas mikrob.[2][3]
Pengikatan nitrogen juga mengacu pada konversi nitrogen ke bentuk lain, seperti nitrogen dioksida. Beberapa tumbuhan mampu membentuk hibungan simbiosis dengan mikroorganisme yang dapat mengikat nitrogen.
Pengikatan nitrogen biologis
[sunting | sunting sumber]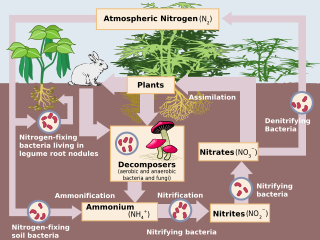
Pengikatan nitrogen biologis pertama kali ditemukan oleh pakar agronomi Jerman, Hermann Hellriegel dan pakar mikrobiologi Belanda, Martinus Beijerinck. Pengikatan nitrogen biologis terjadi ketika nitrogen di atmosfer diubah menjadi amonia oleh enzim nitrogenase.[1] Reaksinya adalah:
- N2 + 8 H+ + 8 e− → 2 NH3 + H2
Proses ini diikuti dengan hidrolisis untuk menghasilkan senyawa yang ekuivalen dengan ATP untuk menghasilkan energi. Pada diazotrof yang hidup bebas, amonia yang dihasilkan enzim nitrogenase diasimilasikan menjadi glutamat.
Enzim nitrogenase rentan terhadap keberadaan oksigen. Banyak bakteri yang menghentikan produksi enzim ini ketika oksigen berada di sekitar mereka.[1] Organisme pengikat nitrogen banyak terdapat di lingkungan anaerobik.[1]
Mikroorganisme pengikat nitrogen disebut dengan diazotrof, yang terdiri dari:
Pengikatan nitrogen oleh cyanobacteria
[sunting | sunting sumber]Cyanobacteria mendiami hampir di setiap tempat yang terpapar cahaya matahari dan berperan penting dalam siklus nitrogen dan karbon biosfer. Secara umum, cyanobacteria mampu memanfaatkan berbagai sumber nitrogen organik dan organik seperti nitrat, nitrit, amonia, urea, dan berbagai asam amino. Beberapa jenis cyanobacteria juga dapat hidup secara diazotrof, sebuah kemampuan yang mungkin dimiliki oleh pendahulu archaea mereka.[4] Pengikatan nitrogen oleh cyanobacteria di terumbu karang dapat terjadi pada laju dua kali lebih cepat dibandingkan pengikatan nitrogen di daratan, sekitar 1.8 kg nitrogen per hektare per hari. Trichodesmium yang membentuk koloni cyanobacteria di lautan diperkirakan melakukan setengah proses pengikatan nitrogen di lautan pada skala global.[5]
Simbiosis pada bintil akar
[sunting | sunting sumber]Famili legum
[sunting | sunting sumber]Tumbuhan yang mampu mengikat nitrogen mencakup famili legum, Fabaceae, seperti kudzu, semanggi, kedelai, kacang tanah, alfalfa, lupin, dan rooibos. Mereka mampu membentuk hubungan simbiosis dengan bakteri rhizobia pada bintil akar di dalam sistem perakaran mereka, menghasilkan senyawa nitrogen yang membantu tanaman untuk tumbuh. Ketika tanaman mati, nitrogen yang telah terikat dilepaskan ke tanah sehingga menjadi tersedia bagi tanaman berikutnya yang tumbuh di tanah tersebut.[1][6] Sebagian besar legum memiliki hubungan ini, kecuali genus Styphnolobium. Pada berbagai praktik tradisional dan organik, ladang ditanam secara rotasi, bergiliran dengan berbagai variasi tanaman, di mana salah satunya adalah tanaman legum. Usaha pertanian di sela-sela tanaman legum seperti pohon dari genus inga dapat menjadi solusi bagi praktik perladangan tebang dan bakar.[7]
Non-legum
[sunting | sunting sumber]

Meski sebagian besar tanaman pembentuk bintil akar ada pada famili Fabaceae, terdapat beberapa yang bukan famili Fabaceae, yaitu:
- Genus Parasponia dalam famili Cannabaceae.[8]
- Tumbuhan actinorhizal seperti alder dan bayberry karena bersimbiosis dengan bakteri genus Frankia. Terdapat 25 genus yang termasuk ke dalam tanaman ini.[9]
Bentuk simbiosis pengikatan nitrogen lainnya dengan cyanobacteria (terutama Nostoc) yaitu:
Pengikatan nitrogen industri
[sunting | sunting sumber]Adanya kemungkinan bagi nitrogen atmosfer untuk bereaksi dengan senyawa kimia tertentu pertama kali diamati oleh Desfosses pada tahun 1828. Ia mengamati campuran oksida logam alkali dan karbon bereaksi pada temperatur tinggi dengan nitrogen. Dengan penggunaan barium karbonat sebagai bahan baku, proses ini dikembangkan oleh Margueritte dan Sourdeval menjadi komersial pada tahun 1860an. Hasil berupa barium sianida dapat direaksikan dengan uap air membentuk amonia. Pada tahun 1898, Adolph Frank dan Nikodem Caro memisahkan prosesnya dan memproduksi kalsium karbida dalam tahapan pereaksian nitrogen dan kalsium sianamida. Proses Ostwald untuk produksi asam nitrat ditemukan pada tahun 1902. Proses Frank-Caro dan Proses Ostwald mendominasi industri pengikatan nitrogen hingga penemuan Proses Haber pada tahun 1909.[10][11]
Proses Haber
[sunting | sunting sumber]Produksi pupuk sintetis merupakan sumber nitrogen terikat yang paling banyak digunakan oleh manusia. Amonia dibutuhkan sebagai bahan awal pembuatan pupuk, bahan peledak, dan produk lainnya. Metode yang paling umum, yaitu Proses Haber, memanfaatkan tekanan tinggi (sekitar 200 atm) dan temperatur tinggi (minimal 400 oC) untuk mendapatkan amonia dari nitrogen di udara, ditambah gas alam sebagai sumber atom hidrogennya.[12]
Berbagai penelitian telah dilakukan untuk mencari katalis dalam proses pengikatan nitrogen sehingga energi yang dibutuhkan untuk proses ini menjadi lebih sedikit. Namun penelitian tersebut cenderung tidak berhasil dan tidak mencapai efisiensi yang lebih baik dari Proses Haber. Kebanyakan senyawa yang digunakan bereaksi dengan nitrogen di atmosfer membentuk senyawa kompleks dinitrogen. Senyawa kompleks dinitrogen yang pertama ditemukan adalah berbasis ruthenium, [Ru(NH3)5(N2)]2+.[13]
Reduksi nitrogen ambien
[sunting | sunting sumber]Nitrogen diubah menjadi ammonia dan hydrazine oleh Alexander E. Shilov pada tahun 1970.[14][15] Beberapa senyawa dapat memecah molekul diatomik N2. Di lingkungan yang penuh dengan nitrogen, logam lithium mampu membentuk lithium nitrida. Perlakuan terhadap senyawa nitrida dapat menghasilkan ammonia. Dua senyawa kompleks berbasis molibdenum mampu bereaksi dengan molekul N2 membentuk senyawa MoN dengan ikatan tiga rangkap.[16] Sejak saat itu, senyawa kompleks berikatan tiga rangkap digunakan untuk membuat nitril.[17]
Lihat pula
[sunting | sunting sumber]- Biopori
- Bintil akar
- Denitrifikasi
- Diazotrof
- Nitrifikasi
- Siklus nitrogen
- Defisiensi nitrogen
- Nitrogenase
- Proses Ostwald
- Proses Haber
- Proses Birkeland–Eyde
Referensi
[sunting | sunting sumber]- ^ a b c d e Postgate, J. (1998). Nitrogen Fixation, 3rd Edition. Cambridge University Press, Cambridge UK.
- ^ Slosson, Edwin (1919). Creative Chemistry. New York: The Century Co. hlm. 19–37.
- ^ http://www.biology.ed.ac.uk/archive/jdeacon/microbes/nitrogen.htm
- ^ "The evolution of nitrogen fixation in cyanobacteria" N. Latysheva, V. L. Junker, W. J. Palmer, G. A. Codd and D. Barker; Bioinformatics; 2012: 28(5) pp 603–606; (Article) doi:10.1093/bioinformatics/bts008
- ^ Bergman, B.; Sandh, G.; Lin, S.; Larsson, H.; and Carpenter, E. J. (2012). "Trichodesmium – a widespread marine cyanobacterium with unusual nitrogen fixation properties". FEMS Microbiology Reviews: 1–17.
- ^ Smil, V (2000). Cycles of Life. Scientific American Library.
- ^ Elkan, Daniel. "Slash-and-burn farming has become a major threat to the world's rainforest". The Guardian, 21 April 2004.
- ^ Op den Camp, Rik; De Mita, S.; Cao, Q.; Polone, E.; Liu, W.; Ammiraju, J. S. S.; Kudrna, D.; Wing, R.; et al. (2010). "LysM-Type Mycorrhizal Receptor Recruited for Rhizobium Symbiosis in Nonlegume Parasponia". Science. 331 (6019): 909–912. doi:10.1126/science.1198181.
- ^ Dawson, J. O. (2008). "Ecology of actinorhizal plants". Nitrogen-fixing Actinorhizal Symbioses. 6. Springer. hlm. 199–234. doi:10.1007/978-1-4020-3547-0_8.
- ^ Nevbner, Rolf (1934). "Die Umwandlungsgleichung Ba(Cn)2 → BaCN2 + C Im Temperaturgebiet von 500 Bis 1000 °C". Zeitschrift für Elektrochemie und angewandte physikalische Chemie. 40 (10): 693–698. doi:10.1002/bbpc.19340401005.
- ^ Curtis, Harry Alfred (1932). Fixed nitrogen.
- ^ http://www.epa.gov/watertrain/nitroabstr.html US Enivronmental Protection Agency: Human Alteration of the Global Nitrogen Cycle: Causes and Consequences by Peter M. Vitousek, Chair, John Aber, Robert W. Howarth, Gene E. Likens, Pamela A. Matson, David W. Schindler, William H. Schlesinger, and G. David Tilman
- ^ A. D. Allen, C. V. Senoff (1965). "Nitrogenopentammineruthenium(II) complexes". Journal of the Chemical Society, Chemical Communications (24): 621. doi:10.1039/C19650000621.
- ^ "Catalytic reduction of molecular nitrogen in solutions" A. E. Shilov Russian Chemical Bulletin Volume 52, Number 12, 2555–2562, doi:10.1023/B:RUCB.0000019873.81002.60
- ^ "Reduction of dinitrogen" Richard R. Schrock PNAS 14 November 2006 vol. 103 no. 46 17087 doi:10.1073/pnas.0603633103
- ^ "Dinitrogen Cleavage by a Three-Coordinate Molybdenum(III) Complex" Catalina E. Laplaza and Christopher C. Cummins Science 12 May 1995: 861–863.10.1126/science.268.5212.861
- ^ "A Cycle for Organic Nitrile Synthesis via Dinitrogen Cleavage" John J. Curley, Emma L. Sceats, and Christopher C. Cummins J. Am. Chem. Soc., 2006, 128 (43), pp. 14036–14037 doi:10.1021/ja066090a
