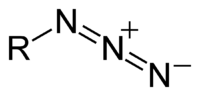Azida
Azida adalah sejenis anion dengan rumus kimia N−3. Anion ini merupakan basa konjugat bagi asam hidrazoat. N3- ialah anion linear yang isoelektronik dengan CO2 dan N2O. Dalam teori ikatan valensi, azida dapat dijelaskan dengan beberapa struktur resonansi dan yang terpenting adalah N-=N+=N-. Azida juga adalah gugus fungsional dalam kimia organik, RN3.[1] Penggunaan azida yang utama adalah sebagai pendorong di dalam kantung udara.
Preparasi
[sunting | sunting sumber]Sumber utama bagi gugus fungsional azida ialah natrium azida. Secara industri, natrium azida dihasilkan melalui reaksi nitrogen oksida, N2O, dengan natrium amida, NaNH2 di dalam amonia cair yang berfungsi sebagai pelarut. Stiokiometri reaksi di atas ialah:[2]
- N2O + 2NaNH2 → NaN3 + NaOH + NH3
Kebanyakan azida organik atau anorganik dihasilkan secara langsung atau tidak langsung oleh natrium azida. Contohnya, timbal azida yang digunakan dalam peledak dapat dipreparasi dari reaksi metatesis antara timbal nitrat dengan natrium azida.[3] Sebagai senyawa pseudohalogen, natrium azida umumnya menggantikan gugus pergi yang sesuai (misalnya, Br, I, OTs) untuk memberikan senyawa azida.
Reaksi
[sunting | sunting sumber]Azida anorganik
[sunting | sunting sumber]Garam azida dapat terurai dengan pelepasan gas nitrogen seperti yang dibahas dalam Aplikasi. Suhu dekomposisi dari azida logam alkali adalah: NaN3 (275 °C), KN3 (355 °C), RbN3 (395 °C), dan CsN3 (390 °C). Metode ini digunakan untuk menghasilkan logam alkali ultra murni.[4]
Protonasi garam azida menghasilkan asam hidrazoat beracun dalam kehadiran asam kuat:
- H+ + N−3 → HN3
Banyak azida kovalen anorganik (misalnya, klorin, bromin, dan iodin azida) telah dijelaskan.[5]
Azida organik
[sunting | sunting sumber]Azida organik terlibat dalam reaksi organik yang berguna. Nitrogen terminal agak nukleofilik. Azida mudah mengusir nitrogen diatomik, kecenderungan yang dimanfaatkan dalam berbagai reaksi seperti ligasi Staudinger atau penataan ulang Curtius atau misalnya dalam sintesis ester γ-imino-β-enamino.[6][7]
Penggunaan
[sunting | sunting sumber]Kira-kira 250 ton senyawa berazida diproduksi setiap tahun, dan kebanyakan dari mereka adalah natrium azida.[8]
Peledak dan pendorong
[sunting | sunting sumber]Natrium azida ialah bahan pendorong di dalam kantong udara pada mobil. Ketika dipanaskan, ia meluruh dan mengeluarkan gas nitrogen yang digunakan untuk mengembangkan kantong udara itu dengan cepat:[8]
- 2NaN3 → 2 Na + 3 N2
Garam logam berat seperti timbal azida, Pb(N3)2, adalah peledak yang sensitif terhadap guncangan yang meluruh menjadi timbal dan nitrogen:[9]
- Pb(N3)2 → Pb + 3 N2
Garam perak dan barium digunakan dengan cara yang sama. Sebagian azida organik, misalnya 2-dimetilaminoetilazida berpotensi menjadi pendorong roket.
Lain-lain
[sunting | sunting sumber]Karena penggunaan azida adalah berbahaya, tidak banyak senyawa azida yang digunakan secara komersial walaupun ia memiliki reaktivitas yang menarik untuk dikaji. Azida dengan berat molekul yang rendah terutama dianggap berbahaya dan dihindari. Di dalam laboratorium penelitian, azida adalah pionir amina. Ia juga dikenal melalui keterlibatan mereka dalam "reaksi klik" dan di dalam reaksi Staudinger. Kedua reaksi ini biasanya dapat diharapkan dan sesuai untuk kimia kombinatorial.
Obat antivirus zidovudin (AZT) mempunyai gugus azido.
Lihat pula
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ S. Bräse; C. Gil; K. Knepper; V. Zimmermann (2005). "Organic Azides: An Exploding Diversity of a Unique Class of Compounds". Angewandte Chemie International Edition (dalam bahasa Inggris). 44 (33): 5188–5240. doi:10.1002/anie.200400657. PMID 16100733.
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, hlm. 433, ISBN 0-7506-3365-4
- ^ "A New Route to Metal Azides". Angewandte Chemie (dalam bahasa Inggris). doi:10.1002/anie.201404561.
- ^ E. Dönges "Alkali Metals" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 475.
- ^ I. C. Tornieporth-Oetting & T. M. Klapötke (1995). "Covalent Inorganic Azides". Angewandte Chemie International Edition (dalam bahasa Inggris). 34 (5): 511–520. doi:10.1002/anie.199505111.
- ^ Mangelinckx, S.; Van Vooren, P.; De Clerck, D.; Fülöp, F.; De Kimpea, N. (2006). "An efficient synthesis of γ-imino- and γ-amino-β-enamino esters". Arkivoc (dalam bahasa Inggris) (iii): 202–209.
- ^ Kondisi reaksi: a) natrium azida 4 eq., aseton, 18 jam refluks rendemen 92% b) isopropil amina, titanium tetraklorida, dietil eter 14 jam refluks rendemen 83%. Azida 2 terbentuk dalam reaksi substitusi nukleofilik alifatik dengan mengganti klor dalam 1 dengan anion azida. Keton bereaksi dengan amina menghasilkan imina yang mengalami tautomerisasi menjadi enamina dalam 4. Dalam reaksi penataan ulang berikutnya nitrogen diusir, lalu proton ditransfer ke 6. Tahap terakhir adalah tautomerisasi lainnya dengan pembentukan enamina 7 sebagai campuran isomer cis dan trans
- ^ a b Horst H. Jobelius, Hans-Dieter Scharff "Hydrazoic Acid and Azides" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a13_193
- ^ Shriver and Atkins. Inorganic Chemistry (Fifth Edition). W. H. Freeman and Company, New York, pp 382.
Pranala luar
[sunting | sunting sumber]- (Inggris) Sintesis azida organik, metode terbaru
- (Inggris) Sintesis, Purifikasi, dan Penanganan Azida Organik