Borat
Borat adalah nama untuk sejumlah besar boron yang mengandung oksianion. Istilah "borat" juga dapat merujuk kepada anion boron tetrahedral, atau deskripsi lebih bebas untuk senyawa kimia yang mengandung anion borat. Borat yang lebih besar terdiri dari trigonal datar BO3 atau unit struktural tetrahedral BO4, bergabung bersama melalui atom oksigen bersama[1] dan mungkin siklik atau linear dalam strukturnya. Boron paling sering keberadaannya di alam sebagai borat, seperti mineral borat dan borosilikat.
Struktur
[sunting | sunting sumber]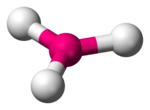
Anion borat sederhana, ion ortoborat, BO33− diketahui dalam keadaan padat, misalnya dalam Ca3(BO3)2.[2] Dalam hal ini, borat mengadopsi struktur trigonal datar dekat. Senyawa ini merupakan analog struktural dari anion karbonat CO32−, dengan mana merupakan isoelektronik. Teori ikatan sederhana menunjuk ke struktur datar trigonal. Dalam hal teori ikatan valens, ikatan dibentuk dengan menggunakan orbital hibrid sp2 pada boron. Beberapa senyawa yang disebut ortoborat tidak selalu mengandung ion trigonal datar, misalnya gadolinium ortoborat, GdBO3 mengandung ion poliborat (B3O9)9−, sedangkan bentuk suhu tinggi mengandung BO33− datar.[3]
Asam borat
[sunting | sunting sumber]
Semua borat dapat dianggap turunan dari asam borat, B(OH)3. Asam borat adalah donor proton lemah yang bersifat asam karena reaksinya dengan air, membentuk tetrahidroksiborat, melepaskan proton:[4]
- B(OH)3 + 2H2O
 B(OH)−4 + H3O+ (pKa = 8.98[5])
B(OH)−4 + H3O+ (pKa = 8.98[5])
Dengan adanya cis-diol seperti manitol, glukosa, sorbitol, dan gliserol pK turun menjadi sekitar 4.[6]
Ion polimer
[sunting | sunting sumber]
Dalam kondisi asam, asam borat mengalami reaksi kondensasi untuk membentuk oksianion polimer:
- 4 [B(OH)4]− + 2 H+
 [B4O5(OH)4]2− + 7 H2O
[B4O5(OH)4]2− + 7 H2O
Anion tetraborat (tetramer) mencakup dua tetrahedral dan dua atom boron trigonal simetris yang berkumpul dalam struktur siklik. Dua atom boron tetrahedral dihubungkan bersama oleh atom oksigen umum dan masing-masing juga membawa muatan negatif yang dibawa oleh OH- tambahan kelompok lateral yang menyertainya. Anion ini merupakan molekul rumit yang juga menunjukkan tiga cincin: dua cincin heksagonal terdistorsi dan satu cincin oktagonal terdistorsi. Setiap cincin terbuat dari suksesi atom boron dan oksigen alternatif.
Anion tetraborat berada di dalam mineral boraks, sebagai oktahidrat,Na2B4O5(OH)4·8H2O. Rumus kimia boraks juga sering ditulis dalam notasi lebih padat tetapi setara sebagai Na2B4O7·10H2O, hanya dengan mengubah stoikiometri 4 OH− menjadi 2 O2− dan 2 H2O.
Natrium borat dapat diperoleh dengan pemurnian tinggi dan dapat digunakan untuk membuat larutan standar dalam analisis titrimetri.[7]
Sejumlah logam borat telah diketahui. Logam tersebut timbul dengan memperlakukan asam borat atau boron oksida dengan logam oksida. Contoh selanjutnya termasuk[1] rantai linear dari 2, 3, atau 4 unit struktural BO3 trigonal, masing-masing berbagi satu atom oksigen dengan unit berdekatan:
- diborat B2O54−, ditemukan pada Mg2B2O5 (suanit)
- triborat B3O75−, ditemukan pada CaAlB3O7 (johakidolit)
- tetraborat B4O96−, ditemukan pada Li6B4O9
Metaborat, seperti LiBO2 mengandung rantai unit struktural BO3 trigonal, masing-masing berbagi dua atom oksigen dengan unit yang berdekatan, sedangkan NaBO2 dan KBO2 mengandung ion B3O62− siklik.[8]
Borosilikat
[sunting | sunting sumber]Kaca borosilikat, juga dikenal sebagai pireks, dapat dilihat sebagai silikat di mana beberapa unit SiO44− digantikan oleh pusat BO45−, bersama-sama dengan kation untuk mengkompensasi perbedaan pada keadaan valensi Si (IV) dan B (III). Karena substitusi ini menyebabkan ketidaksempurnaan, materi lambat mengkristal dan membentuk sebuah kaca dengan koefisien ekspansi termal rendah dan tahan terhadap keretakan ketika dipanaskan, seperti kaca soda.
Mineral dan penggunaan
[sunting | sunting sumber]
Garam borat umum diantarnya natrium metaborat, NaBO2, dan boraks. Boraks larut dalam air, sehingga endapan mineral hanya terdapat di tempat-tempat dengan curah hujan yang sangat rendah. Endapan yang luas ditemukan di Death Valley dan diangkut dengan menggunakan tim dua puluh keledai yang terkenal (1883-1889). Kemudian (1925), endapan ditemukan di Boron, California di tepi Gurun Mojave. Gurun Atacama di Chili juga mengandung konsentrasi borat yang dapat ditambang.
Litium metaborat atau litium tetraborat, atau campuran keduanya, dapat digunakan dalam persiapan sampel peleburan borat dari berbagai sampel untuk analisis dengan XRF, AAS, ICP-OES, ICP-AES, dan ICP-MS. Peleburan borat dan energi dispersif spektrometri fluoresens sinar X dengan eksitasi terpolarisasi telah digunakan dalam analisis tanah yang terkontaminasi.[9]
Dinatrium oktaborat tetrahidrat digunakan sebagai pengawet kayu atau fungisida. Seng borat digunakan sebagai penghambat nyala.
Ester borat
[sunting | sunting sumber]Ester borat adalah senyawa organik dari jenis B(OR)3 dimana R adalah alkil atau aril. Ester ini mudah dibuat dengan reaksi kondensasi dari asam borat dan alkohol:
- B(OH)3 + 3 ROH → B(OR)3 +3 H2O
Agen dehidrasi, seperti asam sulfat pekat biasanya ditambahkan.[10] Ester borat tidak stabil dan dapat dimurnikan dengan destilasi. Prosedur ini digunakan untuk menganalisis jumlah jejak borat dan untuk menganalisis boron dalam baja.[11] Seperti semua senyawa boron, alkil borat terbakar dengan nyala hijau yang khas. Sifat ini digunakan untuk menentukan adanya boron dalam analisis kualitatif.[12]

Ester borat terbentuk lebih spontan ketika terpelaku dengan diol seperti gula.
Trimetil borat, B(OCH3) 3, digunakan sebagai prekursor ke ester boronat untuk penggandengan Suzuki:[13] Ester borat asimetris dibuat dari alkilasi dari trimetil borat:[14]
- ArMgBr + B(OCH3)3 → MgBrOCH3 + ArB(OCH3)2
- ArB(OCH3)2 + 2 H2O → ArB(OH)2 + 2 HOCH3
Ester ini menghidrolisis asam boronat, yang digunakan dalam penggandengan Suzuki.
Lihat pula
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ a b Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5
- ^ Vegas, A. (1985). "New description of the Ca3(BO3)2 structure". Acta Crystallographica Section C Crystal Structure Communications. 41 (11): 1689–1690. doi:10.1107/S0108270185009052. ISSN 0108-2701.
- ^ Ren, M.; Lin, J. H.; Dong, Y.; Yang, L. Q.; Su, M. Z.; You, L. P. (1999). "Structure and Phase Transition of GdBO3". Chemistry of Materials. 11 (6): 1576–1580. doi:10.1021/cm990022o. ISSN 0897-4756.
- ^ Atkins; et al. (2010). Inorganic Chemistry (edisi ke-5th). Oxford University Press. hlm. 334. ISBN 9780199236176.
- ^ N. Ingri, Acta Chem. Scand., 16, 439 (1962)
- ^ Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M.J.K.; Denney, R. C.; Thomas, M. J. K. (2000), Vogel's Quantitative Chemical Analysis (edisi ke-6th), New York: Prentice Hall, hlm. 357, ISBN 0-582-22628-7
- ^ Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M.J.K.; Denney, R. C.; Thomas, M. J. K. (2000), Vogel's Quantitative Chemical Analysis (edisi ke-6th), New York: Prentice Hall, hlm. 316, ISBN 0-582-22628-7
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, hlm. 205, ISBN 0-7506-3365-4
- ^ Hettipathirana, Terrance D. (2004). "Simultaneous determination of parts-per-million level Cr, As, Cd and Pb, and major elements in low level contaminated soils using borate fusion and energy dispersive X-ray fluorescence spectrometry with polarized excitation". Spectrochimica Acta Part B: Atomic Spectroscopy. 59 (2): 223–229. Bibcode:2004AcSpe..59..223H. doi:10.1016/j.sab.2003.12.013.
- ^ Brown, Herbert C.; Mead, Edward J.; Shoaf, Charles J. (1956). "Convenient Procedures for the Preparation of Alkyl Borate Esters". J. Am. Chem. Soc. 78 (15): 3613–3614. doi:10.1021/ja01596a015.
- ^ Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M.J.K.; Denney, R. C.; Thomas, M. J. K. (2000), Vogel's Quantitative Chemical Analysis (edisi ke-6th), New York: Prentice Hall, hlm. 666, ISBN 0-582-22628-7
- ^ Vogel, Arthur I.; Svehla, G. (1979), Vogel's Textbook of Macro and Semimicro Qualitative Inorganic Analysis (edisi ke-5th), London: Longman, ISBN 0-582-44367-9
- ^ Li, W.; Nelson, D. P.; Jensen, M. S.; Hoerrner, R. S.; Cai, D.; Larsen, R. D.; Reider, P. J. (2002). "An Improved Protocol for the Preparation of 3-Pyridyl- and Some Arylboronic Acids". J. Org. Chem. 67. hlm. 5394. Diakses tanggal 2010-12-16.
- ^ R. L. Kidwell, M. Murphy, and S. D. Darling (1969). "Phenols: 6-Methoxy-2-naphthol". Org. Synth. 49: 90; Coll. Vol. 10: 80.
