Mangan(II) klorida
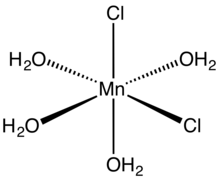 Struktur molekul
| |
 Tetrahidrat
| |
| Nama | |
|---|---|
| Nama IUPAC
Mangan(II) klorida
Mangan diklorida | |
| Nama lain
Mangan klorida
Mangan hiperklorida | |
| Penanda | |
| |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEMBL | |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| MnCl2 | |
| Massa molar | 125.844 g/mol (anhidrat) 161.874 g/mol (dihidrat) 197.91 g/mol (tetrahidrat) |
| Penampilan | padatan merah muda (tetrahidrat) |
| Densitas | 2.977 g/cm3 (anhidrat) 2.27 g/cm3 (dihidrat) 2.01 g/cm3 (tetrahidrat) |
| Titik lebur | 654 °C (1.209 °F; 927 K) (anhidrat) dihidrat terdehidrasi pada 135 °C tetrahidrat terdehidrasi pada 58 °C |
| Titik didih | 1.225 °C (2.237 °F; 1.498 K) |
| 63.4 g/100 ml (0 °C) 73.9 g/100 ml (20 °C) 88.5 g/100 ml (40 °C) 123.8 g/100 ml (100 °C) | |
| Kelarutan | Agak larut dalam piridina, larut dalam etanol tidak larut dalam eter |
| +14,350·10−6 cm3/mol | |
| Struktur | |
| CdCl2 | |
| oktahedral | |
| Bahaya | |
| Titik nyala | Non-flammable |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
250-275 mg/kg (mencit, oral) 1715 mg/kg (tikus, oral)[1] |
| Senyawa terkait | |
Anion lain
|
Mangan(II) fluorida Mangan(II) bromida Mangan(II) iodida |
Kation lainnya
|
Mangan(III) klorida Teknesium(IV) klorida Rhenium(III) klorida Renium(IV) klorida Renium(V) klorida Renium(VI) klorida |
Senyawa terkait
|
Kromium(II) klorida Besi(II) klorida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Mangan(II) klorida menggambarkan serangkaian senyawa dengan rumus MnCl2(H2O)x, di mana nilai x dapat berupa 0, 2, atau 4. Tetrahidratnya merupakan bentuk "mangan(II) klorida" yang paling umum dan merupakan tetrahidrat dengan rumus MnCl2·4H2O. Rumus anhidrat dan dihidrat MnCl2·2H2O juga dikenal. Seperti banyak spesi Mn(II), garam ini berwarna merah muda, dengan pucatnya warna disebabkan karakteristik kompleks logam transisi dengan konfigurasi putaran tinggi d5.[2]
Preparasi[sunting | sunting sumber]
Mangan klorida diproduksi dengan mengolah mangan(IV) oksida dengan asam klorida pekat.
- MnO2 + 4 HCl → MnCl2 + 2 H2O + Cl2
Reaksi ini pernah digunakan untuk pembuatan klorin. Dengan hati-hati menetralkan larutan yang dihasilkan dengan MnCO3, seseorang secara selektif dapat mengendapkan garam besi, yang merupakan pengotor umum dalam mangan dioksida.[3]

Di laboratorium, mangan klorida dapat disiapkan dengan mengolah logam mangan atau mangan(II) karbonat dengan asam klorida:
- Mn + 2 HCl + 4 H2O → MnCl2(H2O)4 + H2
- MnCO3 + 2 HCl + 3 H2O → MnCl2(H2O)4 + CO2
Sifat kimia[sunting | sunting sumber]
Hidrat dari senyawa ini larut dalam air untuk memberikan larutan agak asam dengan pH sekitar 4. Larutan ini terdiri dari kompleks akuo logam [Mn(H2O)6]2+.
Senyawa ini adalah asam Lewis yang lemah, bereaksi dengan ion klorida untuk menghasilkan serangkaian padatan yang mengandung ion berikut [MnCl3]−, [MnCl4]2−, dan [MnCl6]4−. Baik [MnCl3]− dan [MnCl4]2− bersifat polimerik.
Setelah perawatan dengan ligan organik tipikal, mangan(II) mengalami oksidasi melalui udara untuk diberikan kompleks Mn(III). Contoh dari senyawa ini [Mn(EDTA)]−, [Mn(CN)6]3−, dan [Mn(asetilasetonat)3]. Trifenilfosfina membentuk aduk labil 2:1:
- MnCl2 + 2 Ph3P → [MnCl2(Ph3P)2]
Mangan(II) klorida anhidrat berfungsi sebagai titik awal untuk sintesis berbagai senyawa mangan. Sebagai contoh, manganosena disiapkan oleh reaksi MnCl2 dengan larutan natrium siklopentadienida dalam THF.
- MnCl2 + 2 NaC5H5 → Mn(C5H5)2 + 2 NaCl
Aplikasi[sunting | sunting sumber]
Mangan klorida terutama digunakan dalam produksi baterai sel kering. Senyawa ini adalah prekursor senyawa antiketuk metilsiklopentadienil mangan trikarbonil.[3]
Referensi[sunting | sunting sumber]
- ^ "Manganese compounds (as Mn)". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, edisi ke-2, Butterworth-Heinemann, Oxford, UK, 1997.
- ^ a b Reidies, Arno H. (2002), "Manganese Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a16_123, ISBN 978-3-527-30385-4.
