Metalosena

Metalosena adalah suatu senyawa yang biasanya terdiri dari dua anion siklopentadienil (C5H−5, disingkat Cp) yang terikat pada suatu pusat logam (M) dalam keadaan oksidasi II, dengan rumus umum yang dihasilkan (C5H5)2M. Berkaitan erat dengan metalosena adalah turunan metalosena, misalnya titanosena diklorida, vanadosena diklorida. Metalosena tertentu dan turunannya menunjukkan sifat katalitik, meskipun metalosena jarang digunakan secara industri. Turunan metalosena kationik golongan 4 terkait dengan [Cp2ZrCH3]+ yang mengkatalisis polimerisasi olefin.
Beberapa metalosena terdiri dari logam plus dua anion siklooktatetraenida (C8H2−8, disingkat cot2−), yaitu lantanosena dan aktinosena (uranosena dan lainnya).
Metalosena adalah bagian dari kelas senyawa yang lebih luas yang disebut senyawa apit.[1] Dalam struktur yang ditunjukkan di sebelah kanan, dua pentagon adalah anion siklopentadienil dengan lingkaran di dalamnya menunjukkan mereka secara aromatik terstabilkan. Di sini mereka ditampilkan dalam konformasi bersilang.
Sejarah
[sunting | sunting sumber]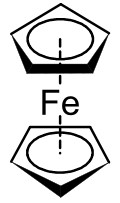
Metalosena pertama yang terklasifikasi adalah ferosena, dan ditemukan bersamaan pada tahun 1951 oleh Kealy dan Pauson,[2] dan Miller et al.[3] Kealy dan Pauson berusaha mensintesis fulvalena melalui oksidasi garam siklopentadienil dengan FeCl3 anhidrat tetapi malah mendapatkan zat C10H10Fe[2] Di waktu yang sama, Miller et al melaporkan produk besi yang sama dari reaksi siklopentadiena dengan besi dalam kehadiran aluminium, kalium, atau molibdenum oksida.[3] Struktur "C10H10Fe" ditentukan oleh Wilkinson et al.[1] dan oleh Fischer et al.[4] Keduanya dianugerahi Hadiah Nobel dalam Kimia pada tahun 1973 untuk karya mereka pada senyawa apit, termasuk penentuan struktural ferosena.[1] Mereka menentukan bahwa atom karbon pada ligan siklopentadienil (Cp) memberikan kontribusi yang sama terhadap ikatan dan pengikatan tersebut terjadi karena orbital-d pada logam dan elektron-π dalam orbital-p pada ligan Cp. Kompleks ini sekarang dikenal sebagai ferosena, dan golongan senyawa logam transisi disiklopentadienil dikenal sebagai metalosena. Metalosena memiliki rumus umum [(η5-C5H5)2M]. Fischer et al. pertama siapkan turunan ferosena yang melibatkan Co dan Ni. Seringkali berasal dari turunan tersubtitusi dari siklopentadienida, metalosena dari banyak unsur telah disiapkan.[5]
Definisi
[sunting | sunting sumber]
Nama umum metalosena berasal dari ferosena, (C5H5)2Fe atau Cp2Fe, secara sistematis bernama bis(η5-siklopentadienil)besi(II). Menurut definisi IUPAC, suatu metalosena mengandung logam transisi dan dua ligan siklopentadienil yang terkoordinasi dalam struktur apit, yaitu, dua anion siklopentadienil berada pada bidang paralel dengan panjang ikatan dan kekuatan yang sama . Menggunakan tata nama "haptisitas", ikatan yang setara dari semua 5 atom karbon dari cincin siklopentadienil dilambangkan sebagai η5, disebut "pentahapto". Terdapat pengecualian, seperti uranosena, yang memiliki dua cincin siklooktatetraena yang mengapit atom uranium.
Dalam nama metalosena, awalan sebelum akhiran -osena menunjukkan unsur logam apa yang berada di antara gugus Cp. Misalnya, dalam ferosena, besi(II), besi fero- terdapat disana.
Berbeda dengan definisi yang lebih ketat yang diajukan oleh IUPAC, yang membutuhkan logam blok d dan struktur apit, istilah metalosena dan dengan demikian denotasi -osena, diterapkan dalam literatur kimia juga untuk senyawa logam non-transisi, seperti barosena (Cp2Ba), atau struktur di mana cincin aromatik tidak paralel, seperti yang ditemukan dalam manganosena atau titanosena diklorida (Cp2TiCl2).
Beberapa kompleks metalosena dari aktinida telah dilaporkan di mana terdapat tiga ligan siklopendadienil untuk kompleks monometalik, ketiganya mengikat η5.[6]
Klasifikasi
[sunting | sunting sumber]Terdapat banyak kompleks logam–(η5-C5H5) dan mereka dapat diklasifikasikan oleh rumus kimia berikut:[7]
| Rumus | Deskripsi |
|---|---|
| [(η5-C5H5)2M] | Struktur 'apit' klasik, simetris |
| [(η5-C5H5)2MLx] | Cincin Cp tekuk atau miring dengan ligan tambahan, L |
| [(η5-C5H5)MLx] | Hanya satu ligan Cp dengan tambahan ligan, L (struktur 'bangku-piano') |
Kompleks metalosena juga dapat diklasifikasikan berdasarkan tipe:[7]
- Paralel
- Multidek
- Senyawa setengah apit
- Metalosena tekuk atau miring
- Lebih dari dua ligan Cp
Sintesis
[sunting | sunting sumber]Tiga rute utama biasanya digunakan dalam pembentukan jenis senyawa ini:[7]
Menggunakan garam logam dan pereaksi siklopentadienil
[sunting | sunting sumber]Natrium siklopentadienida (NaCp) adalah pereaksi yang disukai untuk jenis reaksi ini. Senyawa ini paling mudah diperoleh dengan reaksi natrium cair dan disiklopentadiena.[8] Secara tradisional, titik awalnya adalah cracking disiklopentadienil, dimer dari siklopentadiena. Siklopentadiena dideprotonasi oleh basa kuat atau logam alkali.
- MCl2 + 2 NaC5H5 → (C5H5)2M + 2 NaCl (M = V, Cr, Mn, Fe, Co; pelarut = THF, DME, NH3)
- CrCl3 + 3 NaC5H5 → [(C5H5)2Cr] + 1/2 "C10H10" + 3 NaCl
NaCp bertindak sebagai agen pereduksi dan ligan dalam reaksi ini.
Menggunakan logam dan siklopentadiena
[sunting | sunting sumber]Teknik ini menggunakan atom logam dalam fase gas daripada logam padat. Atom atau molekul yang sangat reaktif dihasilkan pada suhu tinggi di bawah vakum dan dibawa bersama dengan reaktan yang dipilih pada permukaan dingin.
- M + C5H6 → MC5H5 + 1/2 H2 (M = Li, Na, K)
- M + 2 C5H6 → [(C5H5)2M] + H2 (M = Mg, Fe)
Menggunakan pereaksi siklopentadienil
[sunting | sunting sumber]Berbagai pereaksi telah dikembangkan yang mentransfer Cp ke logam. Salah satu pereaksi yang begitu populer adalah talium siklopentadienida. Ia bereaksi dengan halida logam untuk memberikan talium klorida, yang sulit larut, dan kompleks siklopentadienil. Turunan trialkiltimah dari Cp− juga telah digunakan.
Banyak metode lain telah dikembangkan. Kromosena dapat dibuat dari kromium heksakarbonil melalui reaksi langsung dengan siklopentadiena dengan adanya dietilamina; dalam hal ini, deprotonasi formal dari siklopentadiena diikuti oleh reduksi dari proton yang dihasilkan menjadi gas hidrogen, memfasilitasi oksidasi pusat logam.[9]
- Cr(CO)6 + 2 C5H6 → Cr(C5H5)2 + 6 CO + H2
Metalosena umumnya memiliki stabilitas termal yang tinggi. Ferosena dapat tersublimasi di udara pada suhu di atas 100 °C dengan tidak terurai; metalosena umumnya dimurnikan dengan sublimasi vakum. Metalosena bermuatan netral larut dalam pelarut organik umum. Turunan tersubstitusi alkil utamanya larut, bahkan dalam pelarut alkana.
Struktur
[sunting | sunting sumber]Tren struktural untuk deretan MCp2 melibatkan rangkaian ikatan M-C, yang memanjang karena jumlah elektron valensi menyimpang dari 18.[10]
| M(C5H5)2 | rM–C (pm) | Elektron valensi |
|---|---|---|
| Fe | 203.3 | 18 |
| Co | 209.6 | 19 |
| Cr | 215.1 | 16 |
| Ni | 218.5 | 20 |
| V | 226 | 15 |
Dalam metalosena jenis (C5R5)2M, cincin siklopentadienil berputar dengan penghalang yang sangat rendah. Studi difraksi sinar-X kristal tunggal mengungkap baik rotamer eklips atau bersilang. Untuk metalosena non-substitusi, perbedaan energi antara konformasi eklips dan silang hanya beberapa kJ/mol. Kristal ferosena dan osmosena menunjukkan konformasi eklips pada suhu rendah, sedangkan pada kompleks bis(pentametilsiklopentadienil) yang terkait, cincin biasanya mengkristal dalam konformasi bersilang, tampaknya untuk meminimalkan halangan sterik antara gugus metil.
Aplikasi
[sunting | sunting sumber]Banyak turunan dari metalosena logam awal adalah katalis aktif bagi polimerisasi olefin. Tidak seperti katalis tradisional Ziegler-Natta yang bersifat heterogen, katalis metalosena bersifat homogen.[7] Turunan metalosena logam awal, seperti pereaksi Tebbe, pereaksi Petasis, dan pereaksi Schwartz berguna dalam operasi sintetis organik khusus.
Biosensor ferosena/ferosenium telah dibahas untuk menentukan kadar glukosa dalam sampel secara elektrokimia melalui serangkaian siklus redoks yang terhubung.[7]
Metalosena dihalida [Cp2MX2] (M = Ti, Mo, Nb) menunjukkan sifat anti-tumor, meskipun tidak ada yang masuk lebih jauh ke dalam tahap uji klinis.[11]
Lihat pula
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ a b c Wilkinson, G.; Rosenblum, M.; Whiting, M. C.; Woodward, R. B. (1952). "The Structure of Iron Bis-Cyclopentadienyl". J. Am. Chem. Soc. 74 (8): 2125–2126. doi:10.1021/ja01128a527.
- ^ a b Kealy, T. J.; Pauson, P. L. (1951). "A New Type of Organo-Iron Compound". Nature. 168 (4285): 1039. Bibcode:1951Natur.168.1039K. doi:10.1038/1681039b0.
- ^ a b Miller, S. A.; Tebboth, J. A.; Tremaine, J. F. (1952). "114. Dicyclopentadienyliron". J. Chem. Soc. 1952: 632–635. doi:10.1039/JR9520000632.
- ^ Fischer, E. O.; Pfab, W. (1952). "Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels" [On the crystal structure of the di-cyclopentadienyl compounds of divalent iron, cobalt and nickel]. Z. Naturforsch. B. 7: 377–379.
- ^ Chirik, Paul J. (2010). "Group 4 Transition Metal Sandwich Complexes: Still Fresh after Almost 60 Years". Organometallics. 29: 1500–1517. doi:10.1021/om100016p.
- ^ Brennan, J. G.; Andersen, R. A.; Zalkin, A. (1986). "Chemistry of trivalent uranium metallocenes: Electron-transfer reactions. Synthesis and characterization of [(MeC5H4)3U]2E (E= S, Se, Te) and the crystal structures of hexakis(methylcyclopentadienyl)sulfidodiuranium and tris(methylcyclopentadienyl)(triphenylphosphine oxide)uranium". Inorg. Chem. 25 (11): 1761–1765. doi:10.1021/ic00231a008.
- ^ a b c d e Long, N. J. (1998). Metallocenes: Introduction to Sandwich Complexes. London: Wiley-Blackwell. ISBN 978-0632041626.
- ^ Panda, T. K.; Gamer, M. T.; Roesky, P. W. (2003). "An Improved Synthesis of Sodium and Potassium Cyclopentadienide". Organometallics. 22: 877. doi:10.1021/om0207865.
- ^ Fischer, E. O.; Hafner, W. (1955). "Cyclopentadienyl-Chrom-Tricarbonyl-Wasserstoff" [Cyclopentadienylchromium tricarbonyl hydride]. Z. Naturforsch. B (dalam bahasa Jerman). 10 (3): 140–143. doi:10.1515/znb-1955-0303.
- ^ Flower, K. R.; Hitchcock, P. B. (1996). "Crystal and molecular structure of chromocene (η5-C5H5)2Cr". J. Organomet. Chem. 507: 275–277. doi:10.1016/0022-328X(95)05747-D. Tabel berikut membahas semua struktur metalosena yang tersedia.
- ^ Kuo, L. Y.; Kanatzidis, M. G.; Sabat, M.; Marks, T. J.; Marks, Tobin J. (1991). "Metallocene antitumor agents. Solution and solid-state molybdenocene coordination chemistry of DNA constituents". J. Am. Chem. Soc. 113 (24): 9027–9045. doi:10.1021/ja00024a002.
Bacaan lebih lanjut
[sunting | sunting sumber]- Salzer, A. (1999). "Nomenclature of Organometallic Compounds of the Transition Elements". Pure Appl. Chem. 71 (8): 1557–1585. doi:10.1351/pac199971081557. Diarsipkan dari versi asli tanggal 16 Juli 2007.
- Crabtree, Robert H. (2005). The Organometallic Chemistry of the Transition Metals (edisi ke-4). Wiley-Interscience. ISBN 0-471-66256-9.
- Miessler, Gary L.; Tarr, Donald A. (2004). Inorganic Chemistry. Upper Saddle River, NJ: Pearson Education. ISBN 0-13-035471-6.
- Cotton, F. A.; Wilkinson, G. (1988). Inorganic Chemistry (edisi ke-5). Wiley. hlm. 626–7. ISBN 0-471-84997-9.
- Togni, A.; Halterman, R. L. (1998). Metallocenes. Wiley-VCH. ISBN 9783527295395.
Pranala luar
[sunting | sunting sumber] Media tentang Metalosena di Wikimedia Commons
Media tentang Metalosena di Wikimedia Commons
