Model Rutherford
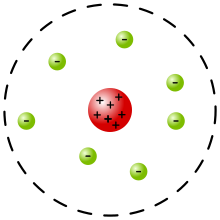
Model Rutherford, dikenal pula sebagai model planet adalah sebuah model atom yang dikemukakan oleh Ernest Rutherford pada tahun 1911. Rutherford, dalam analisisnya, menyangkal model puding prem atom yang dikemukakan oleh J. J. Thomson, berdasarkan percobaan Geiger–Marsden yang dilakukan pada tahun 1909. Pemodelan atom Rutherford yang baru tersebut[1] berdasarkan pada hasil eksperimen, yang mengatakan bahwa atom mempunyai inti yang merupakan pusat massa yang kemudian dinamakan "nukleus", dengan dikelilingi awan elektron bermuatan negatif.
Dasar eksperimen
[sunting | sunting sumber]Percobaan lempeng emas
[sunting | sunting sumber]Pada tahun 1909, Hans Geiger dan Ernest Marsden dengan petunjuk dari Rutherford melakukan eksperimen di Laboratorium Fisika Universitas Manchester untuk membuktikan kebenaran dari teori atom yang dikemukakan oleh Thomson. Dalam makalahnya tahun 1909, On a Diffuse Reflection of the α-Particles,[2] Geiger dan Marsden menjelaskan percobaannya yang membuktikan bahwa partikel alfa dapat dihamburkan dengan sudut lebih dari 90°. Geiger dan Marsden kemudian ingin memperkirakan jumlah total partikel alfa yang dipantulkan. Mereka menempatkan sejumlah kecil radium C (bismut-214) di atas plat timbal, yang memantul pada reflektor platina (R) kemudian ke layar detektor. Mereka menemukan bahwa hanya sebagian kecil dari partikel alfa yang mengenai reflektor memantul ke layar (dalam hal ini, 1 dalam 8000).[2]

Rutherford menyangkal model atom J. J. Thomson pada tahun 1911 dengan percobaan lempeng emasnya,[3] di mana ia menunjukkan bahwa atom memiliki inti berat yang berukuran kecil. Rutherford merancang percobaannya, dengan melanjutkan penelitian Philipp Lenard tahun 1903,[4] hanya saja Rutherford mengganti partikel elektron dengan partikel alfa dan lempeng aluminium dengan lempeng emas. Percobaan ini menggunakan partikel alfa (inti atom helium atau ion helium dengan muatan positif) yang dipancarkan oleh unsur radioaktif (radium) pada lempeng logam emas tipis. Deteksi terhadap partikel alfa yang melewati lempeng tersebut dilakukan dengan menggunakan layar yang dilapisi seng sulfida (ZnS) sebagai detektor. Jika model Thomson tersebut benar, seluruh berkas yang dipancarkan akan melewati lempeng emas tersebut. Namun, pada percobaan tersebut, walaupun sebagian besar berkas partikel alfa melewati lempeng tersebut, beberapa berkas ada yang dipantulkan dan dibelokkan dengan sudut yang besar (lebih dari 90°), bahkan terdapat berkas yang dipantulkan kembali ke arah sumber pancar tanpa sedikitpun menyentuh lapis detektor.
Setelah merunut pola partikel alfa yang ditembakkan ke lempeng emas tersebut, Rutherford kemudian menyimpulkan bahwa sebagian besar ruang dalam atom adalah “ruang kosong”, dan terdapat massa yang terkonsentrasi pada pusat atom yang bermuatan positif dimana ukurannya 10.000 kali lebih kecil dibanding ukuran keseluruhan bagian atom, dan elektron mengelilingi inti atom tersebut seperti planet yang mengelilingi matahari (kemudian disebut sebagai "model planet").[5]
Pemodelan atom
[sunting | sunting sumber]Rutherford mempresentasikan model fisik struktur subatomiknya, sebagai interpretasi atas hasil percobaan yang tak diduga tersebut. Ia membangun model atom yang mirip dengan sistem tata surya. Dalam presentasinya tersebut, atom disusun dari suatu pusat massa (kemudian disebut sebagai nukleus, walaupun Rutherford tidak menggunakan istilah "nukleus" dalam makalahnya)[6] yang dikelilingi oleh awan (yang diduga) merupakan elektron yang berputar.[7]
Terdapat beberapa indikator kunci dalam hipotesis model atom Rutherford, diantaranya:
- Awan elektron tidak mempengaruhi hamburan partikel alfa.
- Banyak dari muatan positif atom terkonsentrasi pada volume yang kecil di pusat atom, yang kemudian dikenal sebagai nukleus. Besarnya muatan ini sebanding dengan massa atom tersebut—massa sisanya kemudian diketahui banyak dipengaruhi oleh neutron. Pusat massa dan muatan terkonsentrasi ini berpengaruh dalam memantulnya baik partikel alfa maupun beta.
- Massa atom-atom berat seperti emas kebanyakan terkonsentrasi pada wilayah pusat muatan, karena perhitungan menunjukkan bahwa kawasan ini tidak dipantulkan atau bergerak oleh adanya partikel alfa berkecepatan tinggi, yang memiliki momentum yang sangat tinggi dibandingkan dengan elektron, tetapi tidak mewakili keseluruhan atom berat tersebut.
- Atom itu sendiri memiliki diameter 100.000 (105) kali lebih besar dari diameter nukleus.[5] Penggambaran tersebut dapat diandaikan seperti ketika meletakkan sebutir pasir di tengah lapangan sepak bola.[8]
Dalam makalahnya pada bulan Mei 1911, Rutherford hanya berfokus pada wilayah pusat muatan positif atau negatif yang sangat tinggi dalam atom tersebut.
Untuk konkretnya, anggap bahwasannya lintasan partikel α yang berkecepatan tinggi melalui atom yang memiliki muatan pusat positif N e, serta dikelilingi oleh suatu muatan elektron N.[3]
Model Rutherford terkonsentrasi pada muatan dan massa atom pada suatu inti yang sangat kecil, tetapi tidak menjelaskan struktur lain dari elektron yang tersisa dan massa atom yang lain. Rutherford menyebut model atom Hantaro Nagaoka, di mana elektron tersusun dalam satu atau lebih cincin, dengan struktur menyerupai cincin Planet Saturnus yang stabil. Model puding prem dari J. J. Thomson juga memiliki cincin orbit elektron. Jean Baptiste Perrin mengklaim dalam kuliah Nobelnya[9] bahwa ia adalah yang pertama mengusulkan model tersebut dalam makalahnya tahun 1901.
Makalah Rutherford menyarankan bahwa muatan pusat dari suatu atom mungkin "sebanding" dengan massa atomnya dalam satuan massa hidrogen u (secara kasar 1/2 darinya, dalam model Rutherford). Untuk emas, nomor massanya adalah 197 (tidak benar-benar akurat) dan karenanya dalam pemodelan Rutherford memiliki massa atom 196 u. Namun, Rutherford tidak mencoba membuat hubungan langsung antara muatan pusat dengan nomor atom, karena "nomor atom" emas (pada saat itu adalah nomor penempatannya dalam tabel periodik) adalah 79, dan Rutherford memodelkan muatan pada sekitar +100 satuan (ia sebenarnya menyarankan 98 satuan muatan positif, setengah dari 196). Karenanya, Rutherford tidak secara formal menyarankan dua angka (posisi dalam tabel periodik, 79, dan muatan inti, 98 atau 100) dapat benar-benar sama.
Satu bulan setelah makalah Rutherford diterbitkan, usulan mengenai identitas pasti dari nomor atom dan muatan inti dibuat oleh Antonius van den Broek, dan kemudian dikonfirmasi secara eksperimen dalam kurun waktu dua tahun, oleh Henry Moseley.
Pengaruh dan kontribusi
[sunting | sunting sumber]Setelah penemuan Rutherford tersebut, para ilmuwan mulai menyadari bahwa atom tidak sepenuhnya merupakan suatu partikel tunggal, melainkan disusun dari partikel-partikel subatomik yang berukuran lebih kecil. Penelitian selanjutnya menentukan struktur atom pasti yang mengarah pada percobaan lempeng emas Rutherford. Para ilmuwan kemudian menemukan bahwa atom memiliki inti bermuatan positif) dengan nomor atom muatan yang pasti) di bagian tengah atom, dengan jari-jari sekitar 1.2 × 10−15 meter × [nomor massa atom]⅓. Elektron ditemukan berukuran jauh lebih kecil dari itu.
Kemudian, ilmuwan menemukan jumlah elektron yang diharapkan (sama dengan nomor massa atom) dalam suatu atom dengan menggunakan sinar-X. Ketika suatu sinar-X melewati atom, beberapa berkas pancarannya akan dihamburkan, sementara sisanya melewati atom tersebut. Karena sinar-X kehilangan intensitasnya akibat hamburan pada elektron, dengan mencatat laju berkurangnya intensitas sinar-X tersebut, jumlah elektron yang terdapat dalam atom tadi dapat secara akurat diestimasi.
Untuk menghargai penelitiannya mengenai radiasi dan inti atom, Rutherford mendapatkan Hadiah Nobel dalam Kimia pada tahun 1908.[10] Ia diberi gelar bangsawan pada 1914, Baron Rutherford of Nelson yang pertama.[11]
Kelemahan
[sunting | sunting sumber]Tak berapa lama setelah Rutherford mengajukan model atomnya tersebut, ternyata terdapat beberapa kelemahan. Model atom Rutherford dianggap bertentangan dengan hukum fisika klasik Maxwell. Berdasarkan hukum tersebut, apabila terdapat partikel bermuatan (elektron) yang mengelilingi inti atom bermuatan sebaliknya (proton) maka elektron akan mengalami percepatan dan memancarkan energi berupa radiasi elektromagnetik.[12] Dengan demikian lama kelamaan elektron akan kehilangan energinya. Akibatnya, jari-jari lintasan semakin kecil, hingga suatu saat elektron akan bergabung dengan inti atom.[13] Karenanya fisika klasik memprediksi bahwa tidak mungkin sebuah atom mencapai kestabilan.[14] Padahal kenyataannya, atom bersifat stabil sehingga elektron tidak bergabung dengan inti atom.
Model atom Rutherford juga tidak menjelaskan susunan elektron-elektron yang mengelilingi nukleus. Model Rutherford tersebut kemudian disempurnakan dalam model atom Bohr (disebut pula sebagai model Rutherford–Bohr) yang diusulkan pada tahun 1913 oleh murid Thomson yang lain, Niels Bohr yang turut mempelopori teori kuantum awal.[15]
Referensi
[sunting | sunting sumber]- ^ Akhlesh Lakhtakia (Ed.); Salpeter, Edwin Ε. (1996). "Models and Modelers of Hydrogen". American Journal of Physics. World Scientific. 65 (9): 933. Bibcode:1997AmJPh..65..933L. doi:10.1119/1.18691. ISBN 981-02-2302-1.
- ^ a b Geiger, Hans; Marsden, Ernest (1909). "On a Diffuse Reflection of the α-Particles" (PDF). Proceedings of the Royal Society of London A. 82 (557): 495–500. Bibcode:1909RSPSA..82..495G. doi:10.1098/rspa.1909.0054.
- ^ a b Rutherford, Ernest (1911). "The Scattering of α and β Particles by Matter and the Structure of the Atom". Philosophical Magazine. Series 6. 21: 669–688. doi:10.1080/14786440508637080.
- ^ "Lenard's Nobel lecture (1906)" (PDF) (dalam bahasa Inggris). Diakses tanggal 25 Agustus 2010.
- ^ a b Nicholas Giordano (1 Januari 2012). College Physics: Reasoning and Relationships. Cengage Learning. hlm. 1051–. ISBN 1-285-22534-1.
- ^ "Atop the Physics Wave: Rutherford back in Cambridge, 1919–1937". Rutherford's Nuclear World: The Story of the Discovery of the Nucleus (dalam bahasa Inggris). American Institute of Physics. Diakses tanggal 25 Juni 2018.
- ^ Longair, M. S. (2003). Theoretical concepts in physics: an alternative view of theoretical reasoning in physics. Cambridge University Press. hlm. 377–378. ISBN 978-0-521-52878-8.
- ^ Constan, Zach (2010). "Learning Nuclear Science with Marbles". The Physics Teacher. 48 (2): 114. Bibcode:2010PhTea..48..114C. doi:10.1119/1.3293660.
- ^ 1926 Lecture for Nobel Prize in Physics
- ^ "Ernest Rutherford – Biography". NobelPrize.org (dalam bahasa Inggris). Diakses tanggal 21 Februari 2013.
- ^ Eve, A. S.; Chadwick, J. (1938). "Lord Rutherford 1871–1937". Obituary Notices of Fellows of the Royal Society (dalam bahasa Inggris). 2 (6): 394. doi:10.1098/rsbm.1938.0025.
- ^ Maxwell, J. C., "A Dynamical Theory of the Electromagnetic Field", Philosophical Transactions of the Royal Society of London 155, 459–512 (1865). (Artikel ini disertai presentasi 8 Desember 1864 oleh Maxwell kepada Royal Society.)
- ^ Olsen, James D.; McDonald, Kirk T. (7 Maret 2005). "Classical Lifetime of a Bohr Atom" (PDF). Laboratorium Joseph Henry, Universitas Princeton (dalam bahasa Inggris). Diarsipkan dari versi asli (PDF) tanggal 2019-09-09. Diakses tanggal 30 September 2014.
- ^ "CK12 – Chemistry Flexbook Second Edition – The Bohr Model of the Atom" (dalam bahasa Inggris). Diakses tanggal 30 September 2014.
- ^ Niels Bohr (1913). "On the Constitution of Atoms and Molecules, Part I" (PDF). Philosophical Magazine (dalam bahasa Inggris). 26 (151): 1–24. doi:10.1080/14786441308634955.
Pranala luar
[sunting | sunting sumber]- (Inggris) Model Rutherford oleh Raymond College
- (Inggris) Model Rutherford oleh Universitas Kyushu


