Monasit
| Monazite | |
|---|---|
 Monazite-(Ce) | |
| Umum | |
| Kategori | Phosphate minerals |
| Rumus (unit berulang) | (Ce,La)PO4 |
| Klasifikasi Strunz | 8.AD.50 |
| Sistem kristal | Monoclinic |
| Grup ruang | P21/n |
| Identifikasi | |
| Warna | Reddish brown, brown, pale yellow, pink, green, gray |
| Perawakan | Commonly as prismatic or wedge-shaped crystals |
| Bentuk kembaran | Contact twins common |
| Belahan | Distinct on [100] poor on [010] |
| Fraktur | Conchoidal to uneven |
| Kekerasan dalam skala Mohs | 5.0–5.5 |
| Kilau | Resinous, vitreous to adamantine |
| Gores | White |
| Diafaneitas | Translucent to opaque |
| Berat jenis | 4.6–5.7 (4.98–5.43 for monazite-Ce) |
| Sifat optik | Biaxial (+) |
| Indeks bias | nα = 1.770–1.793 nβ = 1.778–1.800 nγ = 1.823–1.860 |
| Pleokroisme | Weak |
| Sudut 2V | 10–26° |
| Sifat lain | Radioactive if thorium-rich, dull brown cathodoluminescence, paramagnetic |
| Referensi | [1][2] |
Monasit adalah mineral fosfat berwarna coklat kemerahan yang mengandung logam tanah jarang. Monasit biasanya terbentuk di dalam kristal terisolasi berukuran kecil. Mineral ini memiliki kekerasan mulai dari 5,0 sampai dengan 5,5 skala Mohs dan relatif padat, dengan kepadatan/densitas sebesar 4,6 sampai 5,7 g/cm3. Setidaknya ada empat jenis monasit, tergantung pada komposisi relatif unsur di dalam mineral:[3]
- monasit-(Ce), (Ce, La, Nd, Th)PO4 (anggota yang paling umum ),
- monasit-(La), (La, Ce, Nd)PO4,
- monasit-(Nd), (Nd, La, Ce)PO4,
- monasit-(Sm), (Sm, Gd, Ce, Th)PO4.
Unsur-unsur di dalam tanda kurung tercantum sebagai urutan proporsi relatif dalam mineral: lantanum adalah unsur tanah jarang yang paling umum di dalam monasit-(La), dan seterusnya. Silika (SiO2) hadir dalam jumlah jejak, serta sejumlah kecil uranium dan torium. Karena peluruhan alfa dari thorium dan uranium, monasit mengandung helium dalam jumlah signifikan, yang dapat diekstraksi dengan cara pemanasan.[4]
Monasit adalah bijih penting untuk torium,[5] lantanum, serium.[6] Monasit sering ditemukan dalam endapan plaser. India, Madagaskar dan Afrika Selatan memiliki deposit pasir monasit dalam jumlah besar. Deposit di India utamanya sangat kaya akan monasit.
Monasit bersifat radioaktif karena adanya torium dan, kurang umum, uranium. Karena sifat radioaktifnya, monasit digunakan sebagai geokronologi monasit untuk mempelajari peristiwa geologi, seperti kristalisasi, pemanasan atau deformasi batuan yang mengandung monasit.
Nama monasit berasal dari bahasa Yunani μονάζειν (tersendiri/soliter), melalui terminologi Jerman Monazit, sebagai kiasan untuk kristal yang terisolasi.[7]
Struktur[sunting | sunting sumber]

Semua monasit mengadopsi struktur yang sama, yang berarti bahwa hubungan atom-atomnya sangat mirip dengan senyawa lain dari jenis M(III)PO4. Pusat-pusat M(III) memiliki koordinasi bidang yang telah terdistorsi telah dikelilingi oleh delapan oksida dengan panjang jarak M–O sekitar 2,6 Å. Anion fosfat adalah tetrahedral, seperti biasa. Motif struktur yang sama telah diamati pada timbal kromat (PbCrO4).[8]
Sejarah pertambangan[sunting | sunting sumber]

Pasir monasit dari Brasil pertama kali diketahui dalam muatan pasir di dalam pemberat kapal oleh Carl Auer von Welsbach pada tahun 1880-an. Von Welsbach sedang mencari torium untuk penemuannya pada kaos lampu yang terbaru. Pasir monasit cepat diadopsi sebagai sumber torium dan menjadi dasar di dalam industri tanah jarang.
Pasir monasit pasir juga secara singkat sempat ditambang di Carolina Utara, tapi tak lama setelah itu, deposit yang luas di selatan India ditemukan. Monasit dari Brasil dan India monasit telah mendominasi industri sebelum Perang Dunia II, setelah aktivitas pertambangan yang utama dipindahkan ke Afrika Selatan dan Bolivia. Deposit monasit dalam jumlah besar ditemukan juga di Australia.
Monasit adalah satu satunya sumber komersial produksi lantanida yang signifikan. Akan tetapi, muncul kekhawatiran atas pembuangan produk peluruhan radioaktif dari torium. Bastnasit hadir untuk menggantikan monasit di dalam produksi lantanida pada tahun 1960-an karena kandungan torium yang jauh lebih rendah. Adanya peningkatan ketertarikan penggunaan thorium untuk energi nuklir di masa depan akan membawa monasit kembali ke dalam penggunaan komersial.
Mineralisasi dan ekstraksi[sunting | sunting sumber]

Karena kepadatannya yang tinggi, mineral monasit terkonsentrasi di pasir aluvial ketika dilepas dari pegmatites oleh proses pelapukan. Kondisi ini, disebut deposit plaser, sering kali berupa pasir pantai atau pasir fosil pantai dan mengandung mineral berat lainnya untuk kepentingan komersial seperti zirkon dan ilmenit. Monasit dapat dikumpulkan sebagai konsentrat yang hampir murni dengan menggunakan pemisahan gravitasi, magnetik, elektrostatik.
Deposit pasir monasit pada umumnya berasal berkomposisi monasit-(Ce). Biasanya, lantanida seperti dalam monasit berisi sekitar 45-48% serium, 24% lantanum, 17% neodimium, 5% praseodimium, dan sejumlah kecil samarium, gadolinium dan ittrium. Konsentrasi Eropium cenderung rendah, sekitar 0,05%. Batuan monasit Afrika selatan, dari daerah Steenkampskraal, telah diolah pada tahun 1950-an dan awal 1960-an oleh Divisi Kimia Lindsay dari perusahaan American Potash and Chemical, pada saat itu sebagai produsen terbesar lantanida di dunia. Monasit Steenkampskraal yang telah menyediakan pasokan kumpulan lengkap lantanida. Konsentrasi yang sangat rendah dari lantanida terberat dalam monasit membenarkan istilah tanah "jarang" untuk unsur tersebut, dengan harga yang setara. Kandungan torium dari monasit bervariasi dan kadang-kadang bisa mencapai 20-30%. Monasit dari batuan carbonatit tertentu atau dari bijih urat timah Bolivia pada dasarnya adalah bebas torium. Namun, pasir monasit komersial biasanya mengandung antara 6 dan 12% torium oksida.
Pemecahan dengan asam[sunting | sunting sumber]
Proses asli "pemecahan" (cracking) monasit untuk mengekstrak kandungan torium dan lantanida adalah dengan cara memanaskannya menggunakan konsentrat asam sulfat pada suhu antara 120 dan 150 °C selama beberapa jam. Variasi rasio asam untuk bijih, tingkat pemanasan, dan sejauh mana air kemudian ditambahkan menghasilkan beberapa proses berbeda untuk memisahkan torium dari lantanida. Salah satu dari proses tersebut menyebabkan torium mengendap sebagai fosfat atau pirofosfat dalam bentuk mentah, meninggalkan larutan lantanida sulfat, yang mana lantanida bisa dengan mudah diendapkan sebagai natrium sulfat rangkap. Metode asam menyebabkan pembentukan limbah asam yang harus dipertimbangkan dan hilangnya kandungan fosfat dalam bijih.
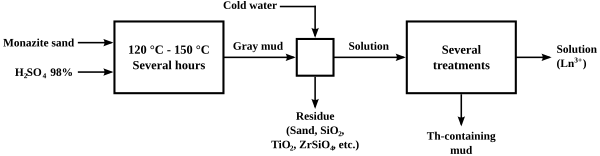
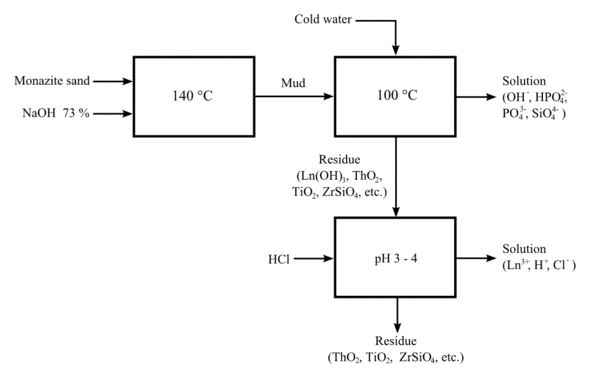
Pemecahan dengan Basa[sunting | sunting sumber]
Proses yang lebih baru menggunakan larutan natrium hidroksida panas (73%) pada sekitar 140 °C. proses Ini memungkinkan kadar fosfat yang berharga dalam bijih dapat dipulihkan menjadi kristal trisodium fosfat. Campuran lantanida/torium hidroksida dapat diolah dengan asam klorida untuk menghasilkan larutan lantanida klorida, dan lumpur yang tidak larut dari torium hidroksida basa rendah.
Ekstraksi logam tanah jarang dari bijih monasit[sunting | sunting sumber]
Berikut langkah-langkah detail ekstraksi logam tanah jarang dari bijih monasit. Proses ini membutuhkan banyak penetralisir dan penyaringan.[9][10]
- Penggiling: Menggiling bijih monasit sampai berukuran ~150 mikrometer. Bijih monasit mengandung 55-60% logam oksida tanah jarang bersama dengan 24-29% P2O5, 5-10% ThO2, dan 0,2-0,4% U3O8.
- Digesti: Monasit yang telah hancur dicampur dengan asam sulfat pekat (93% asam) pada suhu umpan 150-180 °C. Rasio asam untuk bijih bervariasi tergantung pada konsentrasi bijih (kisaran rasio tidak dapat ditemukan). Endapan diaduk dengan pemutar yang kuat dan beroperasi pada suhu antara 200 sampai 300 °C. Asam dimasukkan ke dalam reaktor dan dipanaskan sebelum bijih. Produk yang tidak larut melapisi butiran atau hancuran bijih. Suhu dalam reaktor naik karena panas yang dilepaskan dari reaksi eksotermik. Setelah ~15 menit, viskositas larutan meningkat dan larutan mirip dengan adonan. Produk bereaksi selama 3 sampai 4 jam. Produk kemudian dikeluarkan dari pengendap sebelum larutan mengeras. Rasio asam sulfat untuk melepaskan pasir adalah 1,6-2,5.
- Disolusi: Isi reaktor didinginkan sampai 70 °C dan dilarutkan dengan air bersuhu 30 °C. Rasio 10 bagian air ditambahkan untuk massa bijih awal yang digunakan. Proses pelarutan diteruskan selama 12-15 jam.
- Filtrasi: Semua padatan dari langkah tiga disaring. Padatan meliputi: silika, rutil, zirkon, ilmenit, dan residu monasit yang tidak terdigesti. Larutan yang dihasilkan disebut monasit sulfat.
- Pengenceran: Monasit sulfat diencerkan dengan 6-7 bagian air pada suhu 30 °C.
- Netralisasi: Tambahkan NH3aq untuk menetralkan pH 1.1 untuk membentuk endapan kue thorium-fosfat selektif .
- Filtrasi: Mengumpulkan endapan torium fosfat selama filtrasi larutan monasit yang dinetralkan.
- Pengering: Umpankan kue torium fosfat melalui pengering pada ~120 °C untuk membuat konsentrat thorium fosfat.
- Netralisasi: Tambahkan NH3aq ke larutan monasit tersisa untuk membuat endapan logam tanah jarang pada pH 2.3.
- Filtrasi: Saring keluar endapan tanah jarang untuk menghasilkan konsentrat logam tanah jarang hidroksida.
- Netralisasi: Tambahkan NH3aq pada sisa filtrat sampai pH 6. Proses ini membentuk konsentrat endapan uranium.
- Filtrasi: Saring larutan yang tersisa untuk menghasilkan konsentrat uranium.
Produk akhir yang dihasilkan untuk proses ini adalah konsentrat torium-fosfat hidroksida tanah jarang, dan konsentrat uranium.
Referensi[sunting | sunting sumber]
- ^ Mineralienatlas.
- ^ Monazite. Handbook of Mineralogy. Retrieved on 2011-10-14.
- ^ Monazite group on Mindat.org
- ^ "Helium From Sand", March 1931, Popular Mechanics article bottom of page 460.
- ^ Wolfgang Stoll "Thorium and Thorium Compounds" Ullmann's Encyclopedia of Industrial Chemistry 2012 Wiley-VCH, Weinheim. doi:10.1002/14356007.a27_001.
- ^ McGill, Ian (2005) "Rare Earth Elements" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a22_607.
- ^ Oxford English Dictionary, 3rd edition, 2002.
- ^ Quareni, S.; de Pieri, R. "A three-dimensional refinement of the structure of crocoite, PbCrO4" Acta Crystallographica 1965, volume 19, p. 287–289.
- ^ Gupta, C. K. and T. K. Mukherjee. Hydrometallurgy in Extraction Processes. Boca Raton, FL: CRC, 1990. Print.
- ^ Gupta, C. K., and N. Krishnamurthy. Extraction Metallurgy of Rare Earths. Boca Raton, FL: CRC, 2005. Print.
Bacaan lebih lanjut[sunting | sunting sumber]
- J. C. Bailar et al., Comprehensive Inorganic Chemistry, Pergamon Press, 1973.
- R. J. Callow, The Industrial Chemistry of the Lanthanons, Yttrium, Thorium and Uranium, Pergamon Press tahun 1967. LCCN 67-14541.
- Gupta, C. K. dan N. Krishnamurthy, Extactive Metallurgy of Rare Earths, CRC Press, 2005, ISBN 0-415-33340-7.
- Gupta, C. K. dan T. K. Mukherjee. Hydrometallurgy in Extraction Processes, Boca Raton, FLORIDA: CRC Press, 1990. Cetak.
- Price List, Lindsay Chemical Division, American Potash and Chemical Corporation, 1960.
- R. C. Vickery, Chemistry of the Lanthanons, Butterworths dan Academic Press, tahun 1953.
Pranala luar[sunting | sunting sumber]
- Monasit Diarsipkan 1998-02-15 di Wayback Machine.
- An Unusual State Of Matter Puisi tentang monasit oleh Roald Hoffman
- "British Monazite Mine, Shelby, N. C." in Durwood Barbour Collection of North Carolina Postcards (P077), North Carolina Collection Photographic Archives, Wilson Library, UNC-Chapel Hill
- radiation (in) paradise - the secret of the sand di YouTube; yang ketiga dalam serangkaian video tentang Monasit pantai di Brasil.
- Monasit, thorium, dan mesothorium (1915)
