Sesium bromida
Tampilan
| |
| Nama | |
|---|---|
| Nama IUPAC
Sesium bromida
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| CsBr | |
| Massa molar | 212.809 g/mol[1] |
| Penampilan | Padat putih |
| Densitas | 4.43 g/cm3[1] |
| Titik lebur | 636 °C (1.177 °F; 909 K)[1] |
| Titik didih | 1.300 °C (2.370 °F; 1.570 K)[1] |
| 1230 g/L (25 °C)[1] | |
| -67.2·10−6 cm3/mol[2] | |
| Indeks bias (nD) | 1.8047 (0.3 µm) 1.6974 (0.59 µm) 1.6861 (0.75 µm) 1.6784 (1 µm) 1.6678 (5 µm) 1.6439 (20 µm)[3] |
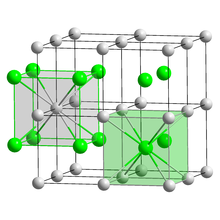
| Struktur | |
| CsCl, cP2 | |
| Pm3m, No. 221[4] | |
a = 0.4291 nm
| |
Volum kisi (V)
|
0.0790 nm3 |
Satuan formula (Z)
|
1 |
| Kubik (Cs+) Kubik (Br−) | |
| Bahaya | |
| Piktogram GHS | 
|
| Keterangan bahaya GHS | {{{value}}} |
| H302, H315, H319, H335 | |
| P261, P264, P270, P271, P280, P301+312, P302+352, P304+340, P305+351+338, P312, P321, P330, P332+313, P337+313, P362, P403+233, P405, P501 | |
| Titik nyala | Tidak mudah terbakar |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
1400 mg/kg (tikus, lewat mulut)[5] |
| Senyawa terkait | |
Anion lain
|
Sesium fluorida Sesium klorida Sesium iodida Sesium astatida |
Kation lainnya
|
Natrium bromida Kalium bromida Rubidium bromida Fransium bromida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Sesium bromida adalah senyawa anorganik yang terdiri dari kation sesium dan anion bromin dengan rumus kimia CsBr. Senyawa ini merupakan senyawa padat berwarna putih atau transparan dengan titik lebur sebesar 636 °C. Senyawa ini mudah larut dalam air.
Pembuatan
[sunting | sunting sumber]Sesium bromida dapat dibuat dari reaksi-reaksi berikut:
- Netralisasi:
- CsOH (aq) + HBr (aq) → CsBr (aq) + H2O (l)
- Cs2(CO3) (aq) + 2 HBr (aq) → 2 CsBr (aq) + H2O (l) + CO2 (g)
- Sintesis langsung:
- 2 Cs (s) + Br2 (g) → 2 CsBr (s)
Sintesis langsung merupakan reaksi yang kuat antara sesium dengan halogen lainnya. Akibat biayanya yang tinggi, metode ini tidak digunakan untuk membuat sesium bromida.
Referensi
[sunting | sunting sumber]Wikimedia Commons memiliki media mengenai Caesium bromide.
