Lantanum
57La Lantanum | |||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Lantanum murni berukuran 1 cm | |||||||||||||||||||||||
Garis spektrum lantanum | |||||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||||
| Pengucapan | /lantanum/[1] | ||||||||||||||||||||||
| Penampilan | putih keperakan | ||||||||||||||||||||||
| Lantanum dalam tabel periodik | |||||||||||||||||||||||
| |||||||||||||||||||||||
| Nomor atom (Z) | 57 | ||||||||||||||||||||||
| Golongan | golongan n/a | ||||||||||||||||||||||
| Periode | periode 6 | ||||||||||||||||||||||
| Blok | blok-f | ||||||||||||||||||||||
| Kategori unsur | lantanida, kadang-kadang dianggap sebagai logam transisi | ||||||||||||||||||||||
| Berat atom standar (Ar) |
| ||||||||||||||||||||||
| Konfigurasi elektron | [Xe] 5d1 6s2 | ||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 18, 9, 2 | ||||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | ||||||||||||||||||||||
| Titik lebur | 1193 K (920 °C, 1688 °F) | ||||||||||||||||||||||
| Titik didih | 3737 K (3464 °C, 6267 °F) | ||||||||||||||||||||||
| Kepadatan mendekati s.k. | 6,162 g/cm3 | ||||||||||||||||||||||
| saat cair, pada t.l. | 5,94 g/cm3 | ||||||||||||||||||||||
| Kalor peleburan | 6,20 kJ/mol | ||||||||||||||||||||||
| Kalor penguapan | 400 kJ/mol | ||||||||||||||||||||||
| Kapasitas kalor molar | 27,11 J/(mol·K) | ||||||||||||||||||||||
Tekanan uap (diekstrapolasi)
| |||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||
| Bilangan oksidasi | 0,[2] +1,[3] +2, +3 (oksida basa kuat) | ||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 1,10 | ||||||||||||||||||||||
| Energi ionisasi | ke-1: 538,1 kJ/mol ke-2: 1067 kJ/mol ke-3: 1850,3 kJ/mol | ||||||||||||||||||||||
| Jari-jari atom | empiris: 187 pm | ||||||||||||||||||||||
| Jari-jari kovalen | 207±8 pm | ||||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||||
| Kelimpahan alami | primordial | ||||||||||||||||||||||
| Struktur kristal | susunan padat heksagon ganda (dhcp) | ||||||||||||||||||||||
| Kecepatan suara batang ringan | 2475 m/s (suhu 20 °C) | ||||||||||||||||||||||
| Ekspansi kalor | α, poli: 12,1 µm/(m·K) (pada s.k.) | ||||||||||||||||||||||
| Konduktivitas termal | 13,4 W/(m·K) | ||||||||||||||||||||||
| Resistivitas listrik | α, poli: 615 nΩ·m (pada s.k.) | ||||||||||||||||||||||
| Arah magnet | paramagnetik[4] | ||||||||||||||||||||||
| Suseptibilitas magnetik molar | +118,0×10−6 cm3/mol (298 K)[5] | ||||||||||||||||||||||
| Modulus Young | bentuk α: 36,6 GPa | ||||||||||||||||||||||
| Modulus Shear | bentuk α: 14,3 GPa | ||||||||||||||||||||||
| Modulus curah | bentuk α: 27,9 GPa | ||||||||||||||||||||||
| Rasio Poisson | bentuk α: 0,280 | ||||||||||||||||||||||
| Skala Mohs | 2,5 | ||||||||||||||||||||||
| Skala Vickers | 360–1750 MPa | ||||||||||||||||||||||
| Skala Brinell | 350–400 MPa | ||||||||||||||||||||||
| Nomor CAS | 7439-91-0 | ||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||
| Penemuan | Carl G. Mosander (1838) | ||||||||||||||||||||||
| Isotop lantanum yang utama | |||||||||||||||||||||||
| |||||||||||||||||||||||
Lantanum adalah sebuah unsur kimia dengan lambang La dan nomor atom 57. Ia adalah sebuah logam yang lunak, ulet, berwarna putih keperakan yang akan ternoda secara perlahan saat terkena udara. Ia adalah eponim dari deret lantanida, sekelompok 15 unsur serupa antara lantanum dan lutesium dalam tabel periodik, dengan lantanum menjadi yang pertama dan prototipenya. Lantanum secara tradisional dihitung sebagai unsur tanah jarang. Seperti kebanyakan unsur tanah jarang lainnya, keadaan oksidasinya yang biasa adalah +3, meskipun beberapa senyawanya diketahui memiliki tingkat oksidasi +2. Lantanum tidak memiliki peran biologis pada manusia tetapi sangat penting untuk beberapa bakteri. Ia tidak terlalu beracun bagi manusia tetapi menunjukkan beberapa aktivitas antimikroba.
Lantanum biasanya terjadi bersama dengan serium dan unsur tanah jarang lainnya. Lantanum pertama kali ditemukan oleh kimiawan Swedia Carl G. Mosander pada tahun 1839 sebagai pengotor dalam serium nitrat – oleh karena itu, ia dinamakan lantanum, dari bahasa Yunani Kuno λανθάνειν (lanthanein), yang berarti 'tersembunyi'. Meskipun diklasifikasikan sebagai unsur tanah jarang, lantanum adalah unsur paling melimpah ke-28 di kerak Bumi, hampir tiga kali lipat dari timbal. Dalam beberapa mineral seperti monasit dan bastnäsit, lantanum menyusun sekitar seperempat dari kandungan lantanida.[6] Ia diekstraksi dari mineral-mineral itu dengan proses yang begitu rumit sehingga logam lantanum murni tidak diisolasi hingga tahun 1923.
Senyawa lantanum memiliki banyak aplikasi sebagai katalis, aditif dalam kaca, lampu busur karbon untuk lampu studio dan proyektor, elemen pengapian pada korek api dan korek obor, katoda elektron, sintilator, elektroda las busur wolfram gas, dan aplikasi lainnya. Lantanum karbonat digunakan sebagai pengikat fosfat dalam kasus kadar fosfat yang tinggi dalam darah yang terlihat pada gagal ginjal.
Karakteristik
[sunting | sunting sumber]Sifat fisik
[sunting | sunting sumber]Lantanum adalah unsur pertama dan prototipe dari deret lantanida. Dalam tabel periodik, ia muncul di sebelah kanan logam alkali tanah barium dan di sebelah kiri lantanida serium. Lanthanum umumnya dianggap sebagai unsur blok-f pertama oleh para penulis yang menulis mengenai subjek tersebut.[7][8][9][10][11] 57 elektron atom lantanum tersusun dalam konfigurasi [Xe]5d16s2, dengan tiga elektron valensi di luar inti gas mulia. Dalam reaksi kimia, lantanum hampir selalu menyerahkan ketiga elektron valensi ini dari subkulit 5d dan 6s untuk membentuk keadaan oksidasi +3, mencapai konfigurasi stabil gas mulia sebelumnya xenon.[12] Beberapa senyawa lantanum(II) juga dikenal, tetapi biasanya kurang stabil.[13][14] Lantanum monoksida (LaO) menghasilkan pita serapan yang kuat pada beberapa spektrum bintang.[15]
Di antara lantanida, lantanum tidaklah biasa karena ia tidak memiliki elektron 4f sebagai atom fase gas tunggal. Jadi, ia hanya bersifat paramagnetik sangat lemah, tidak seperti lantanida akhir yang sangat paramagnetik (dengan pengecualian dua lantanida terakhir, iterbium dan lutesium, di mana kulit 4f benar-benar penuh).[16] Namun, kulit 4f lantanum dapat terisi sebagian di lingkungan kimia sehingga dapat berpartisipasi dalam ikatan kimia.[17] Misalnya, titik lebur lantanida trivalen (semuanya kecuali europium dan iterbium) dikaitkan dengan tingkat hibridisasi elektron 6s, 5d, dan 4f (menurun dengan meningkatnya keterlibatan 4f),[18] dan lantanum memiliki titik lebur terendah kedua di antaranya: 920 °C. (Europium dan iterbium memiliki titik lebur yang lebih rendah karena mereka terdelokalisasi sekitar dua elektron per atom alih-alih tiga.)[19] Ketersediaan kimia orbital f ini membenarkan penempatan lantanum pada blok-f meskipun konfigurasi keadaan dasarnya yang ganjil[20][21] (yang hanya merupakan hasil dari kuatnya tolakan antarelektron sehingga kurang menguntungkan untuk menempati kulit 4f, karena ia berukuran kecil dan dekat dengan inti elektron).[22]
Semakin ke ujung, lantanida akan menjadi semakin keras: seperti yang diperkirakan, lantanum adalah logam yang lunak. Lantanum memiliki resistivitas yang relatif tinggi, yaitu 615 nΩm pada suhu kamar; sebagai perbandingan, nilai aluminium konduktor yang baik hanyalah 26,50 nΩm.[23][24] Lantanum adalah lantanida yang paling tidak volatil.[25] Seperti kebanyakan lantanida, lantanum memiliki struktur kristal heksagon pada suhu kamar. Pada suhu 310 °C, lantanum akan berubah menjadi struktur kubus berpusat-muka, dan pada 865 °C, akan berubah menjadi struktur kubus berpusat-badan.[24]
Sifat kimia
[sunting | sunting sumber]Seperti yang diperkirakan dari tren periodik, lantanum memiliki jari-jari atom terbesar dari semua lantanida. Oleh karena itu, ia adalah yang paling reaktif di antara mereka, ternoda cukup cepat di udara, menjadi gelap sepenuhnya setelah beberapa jam dan dapat dengan mudah terbakar membentuk lantanum(III) oksida, La2O3, yang hampir sama basanya dengan kalsium oksida.[26] Sampel lantanum berukuran beberapa sentimeter akan terkorosi sepenuhnya dalam waktu satu tahun karena oksidanya akan terlepas seperti karat besi, alih-alih membentuk lapisan oksida pelindung seperti aluminium, skandium, itrium, dan lutesium.[27] Lantanum dapat bereaksi dengan halogen pada suhu kamar untuk membentuk trihalida, dan setelah pemanasan akan membentuk senyawa biner dengan nonlogam nitrogen, karbon, belerang, fosforus, boron, selenium, silikon, dan arsen.[12][13] Lantanum akan bereaksi secara lambat dengan air membentuk lantanum(III) hidroksida, La(OH)3.[28] Dalam asam sulfat encer, lantanum siap membentuk ion tripositif yang terakuasi [La(H2O)9]3+: ion ini tidak berwarna dalam larutan berair karena La3+ tidak memiliki elektron d atau f.[28] Lantanum adalah basa terkuat dan terkeras di antara unsur-unsur tanah jarang, yang lagi-lagi diperkirakan karena ia menjadi yang terbesar di antara mereka.[29]
Beberapa senyawa lantanum(II) juga dikenal, tetapi kurang stabil.[13] Oleh karena itu, dalam penamaan resmi dari senyawa lantanum, bilangan oksidasinya selalu disebutkan.
Isotop
[sunting | sunting sumber]
Lantanum alami terdiri dari dua isotop, 139La yang stabil dan radioisotop primordial berumur panjang 138La. 139La sejauh ini merupakan yang paling melimpah, menyusun 99,910% lantanum alami: ia diproduksi dalam proses-s (penangkapan neutron lambat, yang terjadi pada bintang bermassa rendah hingga sedang) dan proses-r (penangkapan neutron cepat, yang terjadi pada supernova keruntuhan inti). Ia adalah satu-satunya isotop lantanum yang stabil.[30] 138La yang sangat langka adalah salah satu dari beberapa inti ganjil–ganjil primordial, yang memiliki waktu paruh panjang, yaitu 1,05×1011 tahun. Ia adalah salah satu inti-p kaya proton yang tidak dapat diproduksi dalam proses-s atau -r. 138La, bersama dengan 180mTa yang lebih langka lagi, diproduksi dalam proses-ν, di mana neutrino berinteraksi dengan inti yang stabil.[31] Semua isotop lantanum lainnya adalah sintetis: kecuali 137La dengan waktu paruh sekitar 60.000 tahun, semuanya memiliki waktu paruh kurang dari dua hari, dan sebagian besar memiliki waktu paruh kurang dari satu menit. Isotop 139La dan 140La terjadi sebagai produk fisi uranium.[30]
Senyawa
[sunting | sunting sumber]Lantanum oksida adalah padatan putih yang dapat dibuat dengan reaksi langsung dari unsur penyusunnya. Karena ukuran ion La3+ yang besar, La2O3 mengadopsi struktur 7-koordinat heksagonal yang berubah menjadi struktur 6-koordinat seperti skandium oksida (Sc2O3) dan itrium oksida (Y2O3) pada suhu tinggi. Ketika ia bereaksi dengan air, lantanum hidroksida akan terbentuk:[32] banyak panas yang akan dihasilkan dan terdengar suara mendesis dalam reaksinya. Lantanum hidroksida akan bereaksi dengan karbon dioksida atmosfer untuk membentuk karbonat basa.[33]
Lantanum fluorida tidak dapat larut dalam air dan dapat digunakan sebagai uji kualitatif untuk keberadaan La3+. Semua lantanum halida yang lebih berat merupakan senyawa delikuesen yang sangat larut. Halida anhidrat dihasilkan melalui reaksi langsung unsur-unsurnya, karena pemanasan hidrat akan menyebabkan hidrolisis: misalnya, pemanasan LaCl3 terhidrasi menghasilkan LaOCl.[33]
Lantanum bereaksi secara eksotermis dengan hidrogen untuk menghasilkan dihidrida LaH2, sebuah senyawa konduktif berwarna hitam, bersifat piroforik, dan rapuh dengan struktur kalsium fluorida.[34] Ini adalah senyawa non-stoikiometri, dan penyerapan hidrogen lebih lanjut dapat terjadi, dengan hilangnya konduktivitas listrik secara bersamaan, hingga LaH3 yang lebih mirip garam tercapai.[33] Seperti LaI2 dan LaI, LaH2 mungkin merupakan senyawa elektrida.[33]
Karena jari-jari ionik dan elektropositivitas La3+ yang besar, tidak banyak kontribusi kovalen pada ikatannya dan oleh karena itu ia memiliki kimia koordinasi yang terbatas, seperti itrium dan lantanida lainnya.[35] Lantanum oksalat tidak terlalu larut dalam larutan oksalat logam alkali, dan [La(acac)3(H2O)2] terurai pada suhu sekitar 500 °C. Oksigen adalah atom donor yang paling umum dalam kompleks lantanum, yang sebagian besar bersifat ionik dan seringkali memiliki bilangan koordinasi yang tinggi di atas 6: 8 adalah yang paling khas, membentuk struktur antiprisma persegi dan dodekadeltahedron. Spesies dengan koordinasi tinggi ini, dapat mencapai bilangan koordinasi 12 dengan menggunakan ligan pengelat seperti pada La2(SO4)3·9H2O, seringkali memiliki derajat simetri yang rendah karena faktor stereo-kimia.[35]
Kimia lantanum cenderung tidak melibatkan ikatan π karena konfigurasi elektron dari unsur tersebut: dengan demikian, kimia organologamnya cukup terbatas. Senyawa organolantanum yang telah dikarakterisasi paling baik adalah kompleks siklopentadienil La(C5H5)3, yang dihasilkan dengan mereaksikan LaCl3 anhidrat dengan NaC5H5 dalam tetrahidrofuran, dan turunannya yang tersubstitusi metil.[36]
Sejarah
[sunting | sunting sumber]
Pada 1751, ahli mineralogi Swedia Axel F. Cronstedt menemukan sebuah mineral berat dari tambang di Bastnäs, yang kemudian diberi nama serit. 30 tahun kemudian, Wilhelm Hisinger yang berusia 15 tahun, dari keluarga pemilik tambang tersebut, mengirimkan sampelnya ke Carl Scheele, yang tidak menemukan unsur baru di dalamnya. Pada tahun 1803, setelah Hisinger menjadi ahli besi, dia kembali meneliti mineral tersebut bersama Jöns J. Berzelius dan mengisolasi sebuah oksida baru yang mereka beri nama seria daei planet katai Ceres, yang telah ditemukan dua tahun sebelumnya.[37] Seria secara bersamaan diisolasi secara mandiri di Jerman oleh Martin H. Klaproth.[38] Antara tahun 1839 dan 1843, seria ditunjukkan sebagai campuran dari beberapa oksida oleh ahli bedah dan kimiawan Swedia Carl G. Mosander, yang tinggal di rumah yang sama dengan Berzelius dan belajar dengannya: dia memisahkan dua oksida lain yang dia beri nama lantana dan didimia.[39][40] Dia menguraikan sebagian sampel serium nitrat dengan memanggangnya di udara dan kemudian mengolah oksida yang dihasilkan dengan asam nitrat encer.[41] Pada tahun yang sama, Axel Erdmann, seorang mahasiswa di Institut Karolinska, menemukan lantanum dalam mineral baru dari pulau Låven yang terletak di sebuah fiord di Norwegia.
Akhirnya, Mosander menjelaskan keterlambatannya, dengan mengatakan bahwa dia telah mengekstraksi unsur kedua dari serium, dan ini dia sebut didimium. Meskipun dia tidak menyadarinya, didimium juga merupakan campuran, dan pada tahun 1885 dipisahkan menjadi praseodimium dan neodimium.
Karena sifat lantanum hanya sedikit berbeda dari serium, dan terjadi bersamaan dengannya dalam garamnya, Mosander menamainya dari bahasa Yunani Kuno λανθάνειν [lanthanein] (terj. har. tersembunyi).[38] Logam lantanum yang relatif murni pertama kali diisolasi pada tahun 1923.[13]
Keterjadian dan produksi
[sunting | sunting sumber]Lantanum adalah yang paling melimpah ketiga dari semua lantanida, membentuk 39 mg/kg kerak Bumi, di belakang neodimium sebesar 41,5 mg/kg dan serium sebesar 66,5 mg/kg. Jumlahnya hampir tiga kali lebih banyak dari timbal di kerak Bumi.[42] Meskipun termasuk ke dalam apa yang disebut "logam tanah jarang", lantanum tidaklah langka sama sekali, tetapi secara historis dinamai demikian karena ia lebih jarang daripada "tanah biasa" seperti kapur dan magnesia, dan secara historis hanya beberapa endapan yang diketahui. Lantanum dianggap sebagai logam tanah jarang karena proses penambangannya yang sulit, memakan waktu, dan mahal.[13] Lantanum jarang menjadi lantanida dominan yang ditemukan dalam mineral tanah jarang, dan dalam formula kimianya biasanya didahului oleh serium. Contoh langka mineral dominan La adalah monasit-(La) dan lantanit-(La).[43]

Ion La3+ memiliki ukuran yang sama dengan lantanida awal dari golongan serium (hingga samarium dan europium) yang segera mengikuti tabel periodik, dan karena itu cenderung muncul bersama mereka dalam mineral fosfat, silikat, dan karbonat, seperti, monasit (MIIIPO4) dan bastnäsit (MIIICO3F), dengan M mengacu pada semua logam tanah jarang kecuali skandium dan prometium yang radioaktif (kebanyakan Ce, La, dan Y).[44] Bastnäsit biasanya kekurangan torium dan lantanida berat, dan pemurnian lantanida ringan darinya kurang terlibat. Bijih tersebut, setelah dihancurkan dan digiling, pertama-tama diolah dengan asam sulfat pekat panas, menghasilkan karbon dioksida, hidrogen fluorida, dan silikon tetrafluorida: produknya kemudian dikeringkan dan dilindi dengan air, menyisakan ion lantanida awal, termasuk lantanum, dalam larutan.[45]
Prosedur untuk monasit, yang biasanya mengandung semua tanah jarang serta torium, lebih rumit. Monasit, karena sifat magnetiknya, dapat dipisahkan melalui pemisahan elektromagnetik berulang. Setelah pemisahan, ia diolah dengan asam sulfat pekat untuk menghasilkan sulfat tanah jarang yang larut dalam air. Filtrat asam dinetralkan sebagian dengan natrium hidroksida hingga pH 3–4. Torium mengendap dari larutan sebagai hidroksida dan dihilangkan. Setelah itu, larutan tersebut diolah dengan amonium oksalat untuk mengubah tanah jarang menjadi oksalat mereka yang tidak larut. Oksalat tersebut diubah menjadi oksida melalui penganilan. Oksida tersebut dilarutkan dalam asam nitrat yang mengecualikan salah satu komponen utama, serium, yang oksidanya tidak larut dalam HNO3. Lantanum dipisahkan sebagai garam ganda dengan amonium nitrat melalui kristalisasi. Garam ini relatif kurang larut dibandingkan garam ganda tanah jarang lainnya sehingga ia tetap berada di residu.[13] Kehati-hatian harus diberikan saat menangani beberapa residu karena mereka mengandung 228Ra, turunan dari 232Th, yang merupakan pemancar gama yang kuat.[45] Lantanum relatif mudah untuk diekstraksi karena hanya memiliki satu lantanida tetangga, serium, yang dapat dihilangkan dengan memanfaatkan kemampuannya untuk dioksidasi menjadi keadaan +4; setelah itu, lantanum dapat dipisahkan melalui metode kristalisasi fraksional La(NO3)3·2NH4NO3·4H2O, atau melalui teknik pertukaran ion ketika kemurnian yang lebih tinggi diinginkan.[45]
Logam lantanum diperoleh dari oksidanya dengan memanaskannya dengan amonium klorida atau fluorida dan asam fluorida pada suhu 300-400 °C untuk menghasilkan lantanum klorida atau fluorida:[13]
- La2O3 + 6 NH4Cl → 2 LaCl3 + 6 NH3 + 3 H2O
Ini diikuti dengan reduksi dengan logam alkali atau alkali tanah dalam atmosfer vakum atau argon:[13]
- LaCl3 + 3 Li → La + 3 LiCl
Juga, lantanum murni dapat diproduksi melalui elektrolisis campuran LaCl3 anhidrat dan NaCl atau KCl pada suhu tinggi.[13]
Aplikasi
[sunting | sunting sumber]
Aplikasi historis lantanum pertama adalah pada mantel lentera gas. Carl A. von Welsbach menggunakan campuran lantanum oksida dan zirkonium oksida, yang dia sebut Actinophor dan dipatenkan pada tahun 1886. Mantel aslinya memberikan cahaya berwarna hijau dan tidak terlalu berhasil, dan perusahaan pertamanya, yang mendirikan pabrik di Atzgersdorf pada 1887, gagal pada tahun 1889.[46]
Penggunaan lantanum modern meliputi:

- Salah satu bahan yang digunakan untuk bahan anodik baterai nikel–logam hidrida adalah La(Ni3,6Mn0,4Al0,3Co0,7). Karena biaya tinggi untuk mengekstrak lantanida lainnya, mischmetal dengan lebih dari 50% lantanum digunakan sebagai pengganti lantanum murni. Senyawa tersebut merupakan komponen antarlogam dari tipe AB5.[47][48] Baterai NiMH dapat ditemukan pada banyak model Toyota Prius yang dijual di Amerika Serikat. Baterai nikel–logam hidrida yang lebih besar ini membutuhkan lantanum dalam jumlah besar untuk produksinya. Baterai NiMH Toyota Prius 2008 membutuhkan 10 hingga 15 kilogram (22 hingga 33 pon) lantanum. Saat para insinyur mendorong teknologi untuk meningkatkan efisiensi bahan bakar, jumlah lantanum yang dibutuhkan akan meningkat dua kali lipat per kendaraan.[49][50][51]
- Paduan spons hidrogen dapat mengandung lantanum. Paduan ini mampu menyimpan hingga 400 kali volume gas hidrogennya sendiri dalam proses adsorpsi reversibel. Energi panas akan dilepaskan setiap kali mereka melakukannya; oleh karena itu, paduan ini memiliki kemungkinan dalam sistem penghematan energi.[24][52]
- Mischmetal, paduan piroforik yang digunakan dalam rijang korek api, mengandung 25% hingga 45% lantanum.[53]
- Lantanum oksida dan borida digunakan dalam tabung vakum elektronik sebagai bahan katoda panas dengan emisivitas elektron yang kuat. Kristal LaB6 digunakan dalam sumber emisi elektron termionik dengan kecerahan tinggi dan umur panjang untuk mikroskop elektron dan pendorong efek Hall.[54]
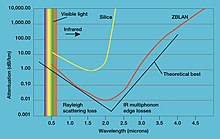
- Lanthanum trifluorida (LaF3) adalah komponen penting dari sebuah kaca fluorida berat bernama ZBLAN. Kaca ini memiliki transmitansi superior dalam jangkauan inframerah sehingga digunakan untuk sistem komunikasi serat optik.[55]
- Lantanum bromida dan lantanum klorida yang didoping serium adalah sebuah sintilator anorganik yang memiliki kombinasi hasil cahaya tinggi, resolusi energi terbaik, dan respons cepat. Hasil tinggi mereka diubah menjadi resolusi energi yang unggul; selain itu, keluaran cahayanya sangat stabil dan cukup tinggi pada kisaran suhu yang sangat luas, membuatnya sangat menarik untuk aplikasi suhu tinggi. Sintilator ini sudah banyak digunakan secara komersial dalam pendeteksi neutron atau sinar gama.[56]
- Lampu busur karbon menggunakan campuran unsur tanah jarang untuk meningkatkan kualitas cahaya. Aplikasi ini, terutama oleh industri film untuk pencahayaan studio dan proyeksi, mengonsumsi sekitar 25% dari senyawa tanah jarang yang diproduksi hingga lampu busur karbon habis dipakai.[24][57]
- Lantanum(III) oksida (La2O3) dapat meningkatkan ketahanan kaca terhadap alkali dan digunakan dalam pembuatan kacamata optik khusus, seperti kaca penyerap inframerah, serta lensa kamera dan teleskop, karena indeks biasnya yang tinggi dan dispersinya yang rendah dari kacamata tanah jarang.[24] Lantanum oksida juga digunakan sebagai aditif pertumbuhan butir selama penyinteran fase cair silikon nitrida dan zirkonium diborida.[58]
- Sejumlah kecil lantanum yang ditambahkan pada baja akan meningkatkan kelenturan, ketahanan terhadap benturan, dan keuletannya, sedangkan penambahan lantanum pada molibdenum akan menurunkan kekerasan dan kepekaannya terhadap variasi suhu.[24]
- Sejumlah kecil lantanum hadir di banyak produk kolam untuk menghilangkan fosfat yang memberi makan alga.[59]
- Aditif lantanum oksida untuk wolfram digunakan dalam elektroda las busur wolfram gas, sebagai pengganti torium yang radioaktif.[60][61]
- Berbagai senyawa lantanum dan unsur tanah jarang lainnya (oksida, klorida, triflat, dll.) merupakan komponen dari berbagai katalisis, seperti katalis perengkahan minyak bumi.[62]
- Penanggalan radiometrik lantanum–barium digunakan untuk memperkirakan usia beberapa batuan dan bijih, meskipun teknik ini memiliki popularitas yang terbatas.[63]
- Lantanum karbonat disetujui sebagai obat (Fosrenol, Shire Pharmaceuticals) untuk menyerap kelebihan fosfat dalam kasus hiperfosfatemia yang terlihat pada penyakit ginjal stadium akhir.[64]
- Lantanum fluorida digunakan dalam pelapis lampu fosfor. Dicampur dengan europium fluorida, itu juga diterapkan dalam membran kristal elektroda selektif ion fluorida.[13]
- Seperti lobak pedas peroksidase, lantanum digunakan sebagai pelacak padat elektron dalam biologi molekuler.[65]
- Bentonit yang dimodifikasi lantanum (atau Phoslock) digunakan untuk menghilangkan fosfat dari air dalam perawatan danau.[66]
- Lantanum telurida (La3Te4) dianggap dapat diterapkan pada bidang sistem tenaga radioisotop (pembangkit listrik tenaga nuklir) karena kemampuan konversinya yang signifikan. Unsur dan isotop yang ditransmutasikan di segmen tersebut tidak akan bereaksi dengan material itu sendiri, sehingga tidak membahayakan keselamatan pembangkit listrik. Meskipun iodin, yang dapat dihasilkan selama transmutasi, diduga bereaksi dengan segmen La3Te4, kuantitas iodin terlalu kecil untuk dapat mengancam sistem pembangkit listrik tersebut.[67]
Peran biologis
[sunting | sunting sumber]Lantanum tidak memiliki peran biologis yang diketahui pada manusia. Unsur ini diserap dengan sangat buruk setelah pemberian oral dan ketika disuntikkan, eliminasinya sangat lambat. Lantanum karbonat (Fosrenol) disetujui sebagai pengikat fosfat untuk menyerap kelebihan fosfat dalam kasus penyakit ginjal stadium akhir.[64]
Walaupun lantanum memiliki efek farmakologis pada beberapa reseptor dan saluran ion, spesifisitasnya untuk reseptor GABA terbilang unik di antara kation trivalen. Lantanum bertindak di situs modulasi yang sama pada reseptor GABA sebagai seng, sebuah modulator alosterik negatif yang dikenal. Kation lantanum La3+ adalah modulator alosterik positif pada reseptor GABA asli dan rekombinan, meningkatkan waktu saluran terbuka dan menurunkan desensitisasi dengan cara yang bergantung pada konfigurasi subunit.[68]
Lantanum adalah kofaktor penting untuk metanol dehidrogenase dari bakteri metanotrofik Methylacidiphilum fumariolicum SolV, meskipun kesamaan kimia yang besar dari lantanida mengartikan bahwa ia dapat diganti dengan serium, praseodimium, atau neodimium tanpa efek buruk, dan dengan samarium, europium, atau gadolinium yang lebih kecil tidak akan memberikan efek samping selain pertumbuhan yang lebih lambat.[69]
Pencegahan
[sunting | sunting sumber]| Bahaya | |
|---|---|
| Piktogram GHS | 
|
| Keterangan bahaya GHS | {{{value}}} |
| H260 | |
| P223, P231+232, P370+378, P422[70] | |
Lantanum memiliki tingkat toksisitas rendah hingga sedang dan harus ditangani dengan hati-hati. Injeksi larutan lantanum akan menghasilkan hiperglikemia, tekanan darah rendah, degenerasi limpa dan perubahan hati.[butuh rujukan] Aplikasi dalam lampu busur karbon dapat menyebabkan seseorang terpapar oksida dan fluorida unsur tanah jarang, yang terkadang menyebabkan pneumokoniosis.[71][72] Karena ion La3+ memiliki ukuran yang mirip dengan ion Ca2+, ia kadang-kadang digunakan sebagai pengganti yang mudah dilacak untuk Ca2+ dalam studi medis.[73] Lantanum, seperti lantanida lainnya, diketahui dapat memengaruhi metabolisme manusia, menurunkan kadar kolesterol, tekanan darah, nafsu makan, dan risiko pembekuan darah. Ketika diinjeksikan ke dalam otak, ia bertindak sebagai obat penghilang rasa sakit, mirip dengan morfin dan opiat lainnya, meskipun mekanisme di baliknya masih belum diketahui.[73]
Harga
[sunting | sunting sumber]Harga untuk satu ton (metrik) [1000 kg] Lantanum oksida 99% (FOB Tiongkok dalam USD/Mt) diberikan oleh Institut Unsur Tanah Jarang dan Logam Strategis di bawah AS$2.000 untuk sebagian besar periode dari awal 2001 hingga September 2010 (pada AS$10.000 dalam jangka pendek pada tahun 2008); harganya naik tajam menjadi AS$140.000 pada pertengahan 2011 dan turun kembali dengan cepat menjadi AS$38.000 pada awal 2012.[74] Harga rata-rata selama enam bulan terakhir (April hingga September 2022) diberikan oleh Institut tersebut sebagai berikut: Lantanum Oksida - 99,9%min FOB Tiongkok - 1308 EUR/mt dan untuk Logam Lantanum - 99%min FOB Tiongkok - 3706 EUR/mt.[75]
Lihat pula
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ (Indonesia) "Lantanum". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ Yttrium and all lanthanides except Ce and Pm have been observed in the oxidation state 0 in bis(1,3,5-tri-t-butylbenzene) complexes, see Cloke, F. Geoffrey N. (1993). "Zero Oxidation State Compounds of Scandium, Yttrium, and the Lanthanides". Chem. Soc. Rev. 22: 17–24. doi:10.1039/CS9932200017. and Arnold, Polly L.; Petrukhina, Marina A.; Bochenkov, Vladimir E.; Shabatina, Tatyana I.; Zagorskii, Vyacheslav V.; Cloke (2003-12-15). "Arene complexation of Sm, Eu, Tm and Yb atoms: a variable temperature spectroscopic investigation". Journal of Organometallic Chemistry. 688 (1–2): 49–55. doi:10.1016/j.jorganchem.2003.08.028.
- ^ La(I), Pr(I), Tb(I), Tm(I), dan Yb(I) telah teramati dalam gugus MB8−; lihat Li, Wan-Lu; Chen, Teng-Teng; Chen, Wei-Jia; Li, Jun; Wang, Lai-Sheng (2021). "Monovalent lanthanide(I) in borozene complexes". Nature Communications. 12: 6467. doi:10.1038/s41467-021-26785-9.
- ^ Lide, D. R., ed. (2005). "Magnetic susceptibility of the elements and inorganic compounds". CRC Handbook of Chemistry and Physics (PDF) (edisi ke-86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110. ISBN 0-8493-0464-4.
- ^ "Monazite-(Ce) Mineral Data". Webmineral. Diakses tanggal 9 Juli 2023.
- ^ Fluck, E. (1988). "New Notations in the Periodic Table" (PDF). Pure Appl. Chem. 60 (3): 431–36. doi:10.1351/pac198860030431. Diarsipkan dari versi asli (PDF) tanggal 25 Maret 2012. Diakses tanggal 9 Juli 2023.
- ^ L. D. Landau, Evgeny Lifshitz, E. M. Lifshitz (1958). Quantum Mechanics: Non-Relativistic Theory. 3 (edisi ke-1). Pergamon Press. hlm. 256–7.
- ^ William B. Jensen (1982). "The Positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the Periodic Table". J. Chem. Educ. 59 (8): 634–636. Bibcode:1982JChEd..59..634J. doi:10.1021/ed059p634.
- ^ Jensen, William B. (2015). "The positions of lanthanum (actinium) and lutetium (lawrencium) in the periodic table: an update". Foundations of Chemistry. 17: 23–31. doi:10.1007/s10698-015-9216-1. Diakses tanggal 9 Juli 2023.
- ^ Scerri, Eric (18 Januari 2021). "Provisional Report on Discussions on Group 3 of the Periodic Table". Chemistry International. 43 (1): 31–34. doi:10.1515/ci-2021-0115.
- ^ a b Greenwood dan Earnshaw, hlm. 1106
- ^ a b c d e f g h i j Patnaik, Pradyot (2003). Handbook of Inorganic Chemical Compounds. McGraw-Hill. hlm. 444–446. ISBN 978-0-07-049439-8. Diakses tanggal 9 Juli 2023.
- ^ Hitchcock, Peter B.; Lappert, Michael F.; Maron, Laurent; Protchenko, Andrey V. (2008). "Lanthanum Does Form Stable Molecular Compounds in the +2 Oxidation State". Angewandte Chemie. 120 (8): 1510. Bibcode:2008AngCh.120.1510H. doi:10.1002/ange.200704887.
- ^ Jevons, W. (1928). "The band spectrum of lanthanum monoxide". Proceedings of the Physical Society. 41 (1): 520. Bibcode:1928PPS....41..520J. doi:10.1088/0959-5309/41/1/355.
- ^ Cullity, B. D. dan Graham, C. D. (2011) Introduction to Magnetic Materials, John Wiley & Sons, ISBN 9781118211496
- ^ Wittig, Jörg (1973). "The pressure variable in solid state physics: What about 4f-band superconductors?". Dalam H. J. Queisser. Festkörper Probleme: Plenary Lectures of the Divisions Semiconductor Physics, Surface Physics, Low Temperature Physics, High Polymers, Thermodynamics and Statistical Mechanics, of the German Physical Society, Münster, March 19–24, 1973. Advances in Solid State Physics. 13. Berlin, Heidelberg: Springer. hlm. 375–396. doi:10.1007/BFb0108579. ISBN 978-3-528-08019-8.
- ^ Gschneidner, Karl A. Jr. (2016). "282. Systematics". Dalam Jean-Claude G. Bünzli; Vitalij K. Pecharsky. Handbook on the Physics and Chemistry of Rare Earths. 50. hlm. 12–16. ISBN 978-0-444-63851-9.
- ^ Krishnamurthy, Nagaiyar dan Gupta, Chiranjib Kumar (2004) Extractive Metallurgy of Rare Earths, CRC Press, ISBN 0-415-33340-7
- ^ Hamilton, David C. (1965). "Position of Lanthanum in the Periodic Table". American Journal of Physics. 33 (8): 637–640. Bibcode:1965AmJPh..33..637H. doi:10.1119/1.1972042.
- ^ Jensen, W. B. (2015). "Some Comments on the Position of Lawrencium in the Periodic Table" (PDF). Diarsipkan dari versi asli (PDF) tanggal 23 Desember 2015. Diakses tanggal 9 Juli 2023.
- ^ Jørgensen, Christian (1973). "The Loose Connection between Electron Configuration and the Chemical Behavior of the Heavy Elements (Transuranics)". Angewandte Chemie International Edition. 12 (1): 12–19. doi:10.1002/anie.197300121.
- ^ Greenwood dan Earnshaw, hlm. 1429
- ^ a b c d e f Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (edisi ke-86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ "The Radiochemistry of the Rare Earths, Scandium, Yttrium, and Actinium" (PDF). Diarsipkan dari versi asli (PDF) tanggal 31 Agustus 2021. Diakses tanggal 9 Juli 2023.
- ^ Greenwood dan Earnshaw, hlm. 1105–7
- ^ "Rare-Earth Metal Long Term Air Exposure Test". Diakses tanggal 9 Juli 2023.
- ^ a b "Chemical reactions of Lanthanum". Webelements. Diakses tanggal 9 Juli 2023.
- ^ Greenwood dan Earnshaw, hlm. 1434
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Woosley, S. E.; Hartmann, D. H.; Hoffman, R. D.; Haxton, W. C. (1990). "The ν-process". The Astrophysical Journal. 356: 272–301. Bibcode:1990ApJ...356..272W. doi:10.1086/168839.
- ^ E.V. Shkolnikov (2009). "Thermodynamic Characterization of the Amphoterism of Hydroxides and Oxides of Scandium Subgroup Elements in Aqueous Media". Russian Journal of Applied Chemistry. 82 (2): 2098–2104. doi:10.1134/S1070427209120040.
- ^ a b c d Greenwood dan Earnshaw, hlm. 1107–8
- ^ Fukai, Y. (2005). The Metal-Hydrogen System, Basic Bulk Properties, 2d edition. Springer. ISBN 978-3-540-00494-3.
- ^ a b Greenwood dan Earnshaw, hlm. 1108–9
- ^ Greenwood dan Earnshaw, hlm. 1110
- ^ "The Discovery and Naming of the Rare Earths". Elements.vanderkrogt.net. Diakses tanggal 10 Juli 2023.
- ^ a b Greenwood dan Earnshaw, hlm. 1424
- ^ Weeks, Mary Elvira (1956). The discovery of the elements (edisi ke-6). Easton, PA: Journal of Chemical Education.
- ^ Weeks, Mary Elvira (1932). "The Discovery of the Elements: XI. Some Elements Isolated with the Aid of Potassium and Sodium:Zirconium, Titanium, Cerium and Thorium". The Journal of Chemical Education. 9 (7): 1231–1243. Bibcode:1932JChEd...9.1231W. doi:10.1021/ed009p1231.
- ^ Lihat:
- (Berzelius) (1839) "Nouveau métal" (Logam baru), Comptes rendus, 8 : 356-357. Dari hlm. 356: "L'oxide de cérium, extrait de la cérite par la procédé ordinaire, contient à peu près les deux cinquièmes de son poids de l'oxide du nouveau métal qui ne change que peu les propriétés du cérium, et qui s'y tient pour ainsi dire caché. Cette raison a engagé M. Mosander à donner au nouveau métal le nom de Lantane." (Oksida cerium, yang diekstraksi dari serit dengan prosedur biasa, mengandung hampir dua perlima beratnya dalam oksida logam baru, yang hanya sedikit berbeda dari sifat serium, dan yang disimpan di dalamnya sehingga bisa dikatakan "tersembunyi". Alasan ini memotivasi Tn. Mosander untuk memberikan nama Lantane pada logam baru itu.)
- (Berzelius) (1839) "Latanium — a new metal," Diarsipkan 2022-11-15 di Wayback Machine. Philosophical Magazine, new series, 14 : 390-391.
- ^ "It's Elemental — The Periodic Table of Elements". Jefferson Lab. Diarsipkan dari versi asli tanggal 29 April 2007. Diakses tanggal 10 Juli 2023.
- ^ Hudson Institute of Mineralogy (1993–2018). "Mindat.org". www.mindat.org. Diakses tanggal 10 Juli 2023.
- ^ Greenwood dan Earnshaw, hlm. 1103
- ^ a b c Greenwood dan Earnshaw, hlm. 1426–9
- ^ Evans, C. H., ed. (6 Desember 2012). Episodes from the History of the Rare Earth Elements. Kluwer Academic Publishers. hlm. 122. ISBN 9789400902879.
- ^ "Inside the Nickel Metal Hydride Battery" (PDF). Diarsipkan dari versi asli (PDF) tanggal 27 Februari 2009. Diakses tanggal 10 Juli 2023.
- ^ Tliha, M.; Mathlouthi, H.; Lamloumi, J.; Percheronguegan, A. (2007). "AB5-type hydrogen storage alloy used as anodic materials in Ni-MH batteries". Journal of Alloys and Compounds. 436 (1–2): 221–225. doi:10.1016/j.jallcom.2006.07.012.
- ^ "As hybrid cars gobble rare metals, shortage looms". Reuters. 31 Agustus 2009.
- ^ Bauerlein, P.; Antonius, C.; Loffler, J.; Kumpers, J. (2008). "Progress in high-power nickel–metal hydride batteries". Journal of Power Sources. 176 (2): 547. Bibcode:2008JPS...176..547B. doi:10.1016/j.jpowsour.2007.08.052.
- ^ "Why Toyota offers 2 battery choices in next Prius". 19 November 2015.
- ^ Uchida, H. (1999). "Hydrogen solubility in rare earth based hydrogen storage alloys". International Journal of Hydrogen Energy. 24 (9): 871–877. doi:10.1016/S0360-3199(98)00161-X.
- ^ C. R. Hammond (2000). The Elements, in Handbook of Chemistry and Physics (edisi ke-81st). CRC press. ISBN 978-0-8493-0481-1.
- ^ Jason D. Sommerville; Lyon B. King. "Effect of Cathode Position on Hall-Effect Thruster Performance and Cathode Coupling Voltage" (PDF). 43rd AIAA/ASME/SAE/ASEE Joint Propulsion Conference & Exhibit, 8–11 July 2007, Cincinnati, OH. Diarsipkan dari versi asli (PDF) tanggal 20 Juli 2011. Diakses tanggal 10 Juli 2023.
- ^ Harrington, James A. "Infrared Fiber Optics" (PDF). Universitas Rutgers. Diarsipkan dari versi asli (PDF) tanggal 2 Agustus 2010.
- ^ "BrilLanCe-NxGen" (PDF). Diarsipkan dari versi asli (PDF) tanggal 29 April 2011. Diakses tanggal 10 Juli 2023.
- ^ Hendrick, James B. (1985). "Rare Earth Elements and Yttrium". Mineral Facts and Problems (Laporan). Bureau of Mines. hlm. 655. Bulletin 675.
- ^ Kim, K; Shim, Kwang Bo (2003). "The effect of lanthanum on the fabrication of ZrB2–ZrC composites by spark plasma sintering". Materials Characterization. 50: 31–37. doi:10.1016/S1044-5803(03)00055-X.
- ^ Pool Care Basics. hlm. 25–26.
- ^ Howard B. Cary (1995). Arc welding automation. CRC Press. hlm. 139. ISBN 978-0-8247-9645-7.
- ^ Larry Jeffus. (2003). "Types of Tungsten". Welding : principles and applications. Clifton Park, N.Y.: Thomson/Delmar Learning. hlm. 350. ISBN 978-1-4018-1046-7. Diarsipkan dari versi asli tanggal 23 September 2010.
- ^ C. K. Gupta; Nagaiyar Krishnamurthy (2004). Extractive metallurgy of rare earths. CRC Press. hlm. 441. ISBN 978-0-415-33340-5.
- ^ S. Nakai; A. Masuda; B. Lehmann (1988). "La-Ba dating of bastnaesite" (PDF). American Mineralogist. 7 (1–2): 1111. Bibcode:1988ChGeo..70...12N. doi:10.1016/0009-2541(88)90211-2.
- ^ a b "FDA approves Fosrenol(R) in end-stage renal disease (ESRD) patients". 28 Oktober 2004. Diarsipkan dari versi asli tanggal 26 April 2009. Diakses tanggal 10 Juli 2023.
- ^ Chau YP; Lu KS (1995). "Investigation of the blood-ganglion barrier properties in rat sympathetic ganglia by using lanthanum ion and horseradish peroxidase as tracers". Acta Anatomica. 153 (2): 135–144. doi:10.1159/000313647. ISSN 0001-5180. PMID 8560966.
- ^ Hagheseresht; Wang, Shaobin; Do, D. D. (2009). "A novel lanthanum-modified bentonite, Phoslock, for phosphate removal from wastewaters". Applied Clay Science. 46 (4): 369–375. doi:10.1016/j.clay.2009.09.009.
- ^ R. Smith, Michael B.; Whiting, Christopher; Barklay, Chad (2019). "Nuclear Considerations for the Application of Lanthanum Telluride in Future Radioisotope Power Systems". 2019 IEEE Aerospace Conference: 1–11. doi:10.1109/AERO.2019.8742136. ISBN 978-1-5386-6854-2. OSTI 1542236.
- ^ Boldyreva, A. A. (2005). "Lanthanum Potentiates GABA-Activated Currents in Rat Pyramidal Neurons of CA1 Hippocampal Field". Bulletin of Experimental Biology and Medicine. 140 (4): 403–5. doi:10.1007/s10517-005-0503-z. PMID 16671565.
- ^ Pol, Arjan; Barends, Thomas R. M.; Dietl, Andreas; Khadem, Ahmad F.; Eygensteyn, Jelle; Jetten, Mike S. M.; Op Den Camp, Huub J. M. (2013). "Rare earth metals are essential for methanotrophic life in volcanic mudpots". Environmental Microbiology. 16 (1): 255–64. doi:10.1111/1462-2920.12249. PMID 24034209.
- ^ "Lanthanum 261130". Sigma-Aldrich.
- ^ Dufresne, A.; Krier, G.; Muller, J.; Case, B.; Perrault, G. (1994). "Lanthanide particles in the lung of a printer". Science of the Total Environment. 151 (3): 249–252. Bibcode:1994ScTEn.151..249D. doi:10.1016/0048-9697(94)90474-X. PMID 8085148.
- ^ Waring, P. M.; Watling, R. J. (1990). "Rare earth deposits in a deceased movie projectionist. A new case of rare earth pneumoconiosis". The Medical Journal of Australia. 153 (11–12): 726–30. doi:10.5694/j.1326-5377.1990.tb126334.x. PMID 2247001.
- ^ a b Emsley, John (2011). Nature's building blocks: an A-Z guide to the elements. Oxford University Press. hlm. 266–77. ISBN 9780199605637.
- ^ Specifications and notation: "lanthanum". Diakses tanggal 10 Juli 2023.
- ^ Information and notation: "ISE Metal-qoutes". Diakses tanggal 10 Juli 2023.
Bibliografi
[sunting | sunting sumber]- Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. ISBN 0-08-022057-6.
Bacaan lebih lanjut
[sunting | sunting sumber]- The Industrial Chemistry of the Lanthanons, Yttrium, Thorium and Uranium, by R. J. Callow, Pergamon Press, 1967
- Extractive Metallurgy of Rare Earths, by C. K. Gupta and N. Krishnamurthy, CRC Press, 2005
- Nouveau Traite de Chimie Minerale, Vol. VII. Scandium, Yttrium, Elements des Terres Rares, Actinium, P. Pascal, Editor, Masson & Cie, 1959
- Chemistry of the Lanthanons, by R. C. Vickery, Butterworths 1953
Pranala luar
[sunting | sunting sumber]- (Inggris) Los Alamos National Laboratory – Lanthanum Diarsipkan 8 Desember 2010 di Wayback Machine.
- (Inggris) WebElements.com – Lanthanum
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||


