Aluminium klorida: Perbedaan antara revisi
Tidak ada ringkasan suntingan |
Add 1 book for Wikipedia:Pemastian (20231209)) #IABot (v2.0.9.5) (GreenC bot |
||
| (15 revisi perantara oleh 5 pengguna tidak ditampilkan) | |||
| Baris 1: | Baris 1: | ||
{{chembox |
{{chembox |
||
| |
|Verifiedfields = changed |
||
| |
|Watchedfields = changed |
||
| |
|verifiedrevid = 477245740 |
||
| |
|Name = |
||
| |
|ImageFile1 = Aluminium-trichloride-hexahydrate-white-and-yellow.jpg |
||
<!-- |
<!--|ImageSize = 150px --> |
||
| |
|ImageName1 = Aluminium klorida |
||
| |
|ImageFile2 = |
||
| |
|ImageName2 = Aluminium(III) Klorida |
||
| |
|ImageFile3 = Aluminium-trichloride-dimer-3D-balls.png |
||
<!-- |
<!--|ImageSize1 = 150px --> |
||
| |
|ImageName3 = Dimer aluminium triklorida |
||
| |
|IUPACName = aluminium klorida |
||
| |
|OtherNames = aluminium(III) klorida<br/>aluminum triklorida |
||
|Section1={{Chembox Identifiers |
|Section1={{Chembox Identifiers |
||
| |
|UNII_Ref = {{fdacite|correct|FDA}} |
||
| |
|UNII = LIF1N9568Y |
||
| |
|InChI = 1/Al.3ClH/h;3*1H/q+3;;;/p-3 |
||
| |
|ChEBI_Ref = {{ebicite|correct|EBI}} |
||
| |
|ChEBI = 30114 |
||
| |
|SMILES = Cl[Al](Cl)Cl |
||
| |
|InChIKey = VSCWAEJMTAWNJL-DFZHHIFOAR |
||
| |
|SMILES1 = [Al](Cl)(Cl)Cl |
||
| |
|StdInChI_Ref = {{stdinchicite|correct|chemspider}} |
||
| |
|StdInChI = 1S/Al.3ClH/h;3*1H/q+3;;;/p-3 |
||
| |
|StdInChIKey_Ref = {{stdinchicite|correct|chemspider}} |
||
| |
|StdInChIKey = VSCWAEJMTAWNJL-UHFFFAOYSA-K |
||
| |
|CASNo = 7446-70-0 |
||
| |
|CASNo_Ref = {{cascite|correct|CAS}} |
||
| |
|CASNo_Comment = (anhidrat) |
||
| |
|CASNo1_Ref = {{cascite|changed|??}} |
||
| |
|CASNo1 = 10124-27-3 |
||
| |
|CASNo1_Comment = (hidrat) |
||
| |
|CASNo2_Ref = {{cascite|changed|??}} |
||
| |
|CASNo2 = 7784-13-6 |
||
| |
|CASNo2_Comment = (heksahidrat) |
||
| |
|ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}} |
||
| |
|ChemSpiderID=22445 |
||
| |
|PubChem = 24012 |
||
| |
|RTECS = BD0530000 |
||
}} |
}} |
||
|Section2={{Chembox Properties |
|Section2={{Chembox Properties |
||
| |
|Formula = AlCl<sub>3</sub> |
||
| |
|MolarMass = 133,34 g/mol (anhidrat)<br />241,43 g/mol (heksahidrat) |
||
| |
|Appearance = padatan putih atau kuning pucat,<br />[[higroskopis]] |
||
| |
|Density = 2,48 g/cm<sup>3</sup> (anhidrat)<br> 1,3 g/cm<sup>3</sup> (heksahidrat) |
||
| |
|Solubility = 43,9 g/100 ml (0 °C)<br />44,9 g/100 ml (10 °C)<br />45,8 g/100 ml (20 °C)<br />46,6 g/100 ml (30 °C)<br />47,3 g/100 ml (40 °C)<br />48,1 g/100 ml (60 °C)<br />48,6 g/100 ml (80 °C)<br />49 g/100 ml (100 °C) |
||
| |
|SolubleOther = larut dalam [[hidrogen klorida]], [[etanol]], [[kloroform]], [[karbon tetraklorida]] <br> sedikit larut dalam [[benzena]] |
||
| |
|MeltingPt = {{convert|192.4|C|F K}} |
||
| |
|MeltingPt_notes = <br> (anhidrat)<br> {{convert|100|C|F K}}<br> (heksahidrat)<br> {{convert|180|C|F K}}<br> (menyublim) |
||
| |
|BoilingPt = {{convert|120|C|F K}} |
||
| |
|BoilingPt_notes = (heksahidrat) |
||
| |
|pKa = |
||
| |
|Viscosity = 0,35 cP (197 °C)<br> 0,26 cP (237 °C)<ref name=chemister>{{cite|url=http://chemister.ru/Database/properties-en.php?dbid=1&id=353|title=Properties of substance: aluminium chloride|website=chemister.ru}}</ref> |
||
| |
|VaporPressure = 133,3 Pa (99 °C)<br> 13,3 kPa (151 °C)<ref name=chemister /> |
||
}} |
}} |
||
|Section3={{Chembox Structure |
|Section3={{Chembox Structure |
||
| |
|MolShape = Trigonal planar<br />(uap [[monomer]]ik) |
||
| |
|Coordination = Oktahedral (padat)<br />Tetrahedral (cair) |
||
| |
|CrystalStruct = [[Monoklinik]], [[Pearson symbol|mS16]] |
||
| |
|SpaceGroup = C12/m1, No. 12 |
||
}} |
}} |
||
|Section5={{Chembox Thermochemistry |
|Section5={{Chembox Thermochemistry |
||
| |
|DeltaHf = −704,2 kJ/mol<ref name=chemister /><ref name = zumdahl>{{cite book|author = Zumdahl, Steven S.|title =Chemical Principles|url = https://archive.org/details/chemicalprincipl0000zumd_u9g0|edition = 6th|publisher = Houghton Mifflin Company|year = 2009|isbn = 0-618-94690-X}}</ref> |
||
| |
|Entropy = 111 J/mol·K<ref name = zumdahl/> |
||
| |
|DeltaGf = −628,6 kJ/mol<ref name=chemister /> |
||
| |
|HeatCapacity = 91 J/mol·K<ref name=chemister /> |
||
}} |
}} |
||
|Section6={{Chembox Pharmacology |
|Section6={{Chembox Pharmacology |
||
| |
|ATCCode_prefix = D10 |
||
| |
|ATCCode_suffix = AX01 |
||
}} |
}} |
||
|Section7={{Chembox Hazards |
|Section7={{Chembox Hazards |
||
| |
|GHSPictograms = {{GHS05}}<ref name="sigma">{{Sigma-Aldrich|id=563919|name=Aluminum chloride|accessdate=2014-05-05}}</ref> |
||
| |
|GHSSignalWord = Danger |
||
| |
|HPhrases = {{H-phrases|314}}<ref name="sigma" /> |
||
| |
|PPhrases = {{P-phrases|280|310|305+351+338}}<ref name="sigma" /> |
||
| |
|NFPA-H = 3 |
||
| |
|NFPA-F = 0 |
||
| |
|NFPA-R = 2 |
||
| |
|EUClass = {{Hazchem C}} |
||
| |
|RPhrases = {{R34}} |
||
| |
|SPhrases = {{S1/2}}, {{S7/8}}, {{S28}}, {{S45}} |
||
| |
|LD50 = ''anhidrat:'' <br> 380 mg/kg, mencit (oral) <hr> ''heksahidrat:'' <br> 3311 mg/kg, mencit (oral) |
||
| |
|IDLH = N.D.<ref name=PGCH>{{PGCH|0024}}</ref> |
||
| |
|PEL = none<ref name=PGCH>{{PGCH|0024}}</ref> |
||
| |
|REL = 2 mg/m<sup>3</sup><ref name=PGCH>{{PGCH|0024}}</ref> |
||
}} |
}} |
||
|Section8={{Chembox Related |
|Section8={{Chembox Related |
||
| |
|OtherAnions = [[Aluminium fluorida]]<br />[[Aluminium bromida]]<br />[[Aluminium iodida]] |
||
| |
|OtherCations = [[Boron triklorida]]<br />[[Galium triklorida]]<br />[[Indium(III) klorida]]<br />[[Magnesium klorida]] |
||
| |
|Function = [[Asam Lewis]] |
||
| |
|OtherFunctn = [[Besi(III) klorida]]<br />[[Boron trifluorida]] |
||
}} |
}} |
||
}} |
}} |
||
| Baris 98: | Baris 98: | ||
'''Aluminium klorida''' (AlCl<sub>3</sub>) adalah [[senyawa kimia]] utama dari [[aluminium]] dan [[klorin]]. Senyawa ini berwarna putih, tetapi sampelnya sering terkontaminasi dengan [[Besi(III) klorida|besi triklorida]], yang memberikan pewarnaan kuning. Padatannya mempunyai titik leleh dan titik didih rendah. Senyawa ini terutama diproduksi dan dikonsumsi dalam produksi logam aluminium, tetapi sejumlah besar juga digunakan dalam bidang industri kimia. Senyawa ini sering digolongkan sebagai [[asam Lewis]]. Ini merupakan contoh senyawa anorganik yang ''[[Keretakan (kimia)|retak]]'' pada temperatur rendah, berubah bolak-balik dari [[polimer]] menjadi [[monomer]]. |
'''Aluminium klorida''' (AlCl<sub>3</sub>) adalah [[senyawa kimia]] utama dari [[aluminium]] dan [[klorin]]. Senyawa ini berwarna putih, tetapi sampelnya sering terkontaminasi dengan [[Besi(III) klorida|besi triklorida]], yang memberikan pewarnaan kuning. Padatannya mempunyai titik leleh dan titik didih rendah. Senyawa ini terutama diproduksi dan dikonsumsi dalam produksi logam aluminium, tetapi sejumlah besar juga digunakan dalam bidang industri kimia. Senyawa ini sering digolongkan sebagai [[asam Lewis]]. Ini merupakan contoh senyawa anorganik yang ''[[Keretakan (kimia)|retak]]'' pada temperatur rendah, berubah bolak-balik dari [[polimer]] menjadi [[monomer]]. |
||
==Struktur== |
== Struktur == |
||
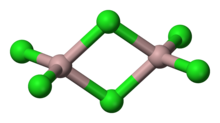
{{chem2|AlCl|3}} memiliki tiga struktur yang berbeda, bergantung pada temperatur dan fasenya (padat, cair, gas). {{chem2|AlCl|3}} padat berbentuk seperti lembaran dengan kisi kristal ''closed packed cubic''. Dalam bentuk ini, pusat Al menunjukkan [[geometri koordinasi oktahedral]].<ref name="Wells">Sebaliknya, AlBr<sub>3</sub> memiliki lebih banyak struktur molekul, dengan pusat Al<sup>3+</sup> berada pada lubang tetrahedral dari kisi ''closed-packed'' ion Br<sup>−</sup>{{cite|author=A.F. Wells|title=Structural Inorganic Chemistry|publisher=Oxford Press|location=[[Oxford]], United Kingdom|year=1984}}</ref> Dalam lelehannya, aluminium triklorida berada sebagai [[Dimer (kimia)|dimer]] {{chem2|Al|2|Cl|6}}, dengan aluminium tetrakoordinasi. Perubahan struktur ini terkait dengan rendahnya massa jenis fasa cairnya (1,78 g/cm<sup>3</sup>) vs aluminium triklorida padat (2,48 g/cm<sup>3</sup>). Dimer Al<sub>2</sub>Cl<sub>6</sub> juga dijumpai dalam fasa uap. Pada [[temperatur]] yang lebih tinggi, dimer Al<sub>2</sub>Cl<sub>6</sub> [[Disosiasi (kimia)|terdisosiasi]] menjadi {{chem2|AlCl|3}} trigonal planar, yang secara struktur analog dengan [[Boron trifluorida|{{chem2|BF|3}}]]. Lelehannya memiliki [[Konduktansi listrik|daya hantar listrik]] rendah,<ref name="Greenwood">{{cite|author1=N.N. Greenwood|author2=A. Earnshaw|title=Chemistry of the Elements|publisher=Pergamon Press|location=[[Oxford]], United Kingdom|year=1984}}</ref> tidak seperti [[halida]] [[ikatan ionik|ionik]] lainnya misalnya [[natrium klorida]]. |
{{chem2|AlCl|3}} memiliki tiga struktur yang berbeda, bergantung pada temperatur dan fasenya (padat, cair, gas). {{chem2|AlCl|3}} padat berbentuk seperti lembaran dengan kisi kristal ''closed packed cubic''. Dalam bentuk ini, pusat Al menunjukkan [[geometri koordinasi oktahedral]].<ref name="Wells">Sebaliknya, AlBr<sub>3</sub> memiliki lebih banyak struktur molekul, dengan pusat Al<sup>3+</sup> berada pada lubang tetrahedral dari kisi ''closed-packed'' ion Br<sup>−</sup>: {{cite|author=A.F. Wells|title=Structural Inorganic Chemistry|publisher=Oxford Press|location=[[Oxford]], United Kingdom|year=1984}}</ref> Dalam lelehannya, aluminium triklorida berada sebagai [[Dimer (kimia)|dimer]] {{chem2|Al|2|Cl|6}}, dengan aluminium tetrakoordinasi. Perubahan struktur ini terkait dengan rendahnya massa jenis fasa cairnya (1,78 g/cm<sup>3</sup>) vs aluminium triklorida padat (2,48 g/cm<sup>3</sup>). Dimer Al<sub>2</sub>Cl<sub>6</sub> juga dijumpai dalam fasa uap. Pada [[temperatur]] yang lebih tinggi, dimer Al<sub>2</sub>Cl<sub>6</sub> [[Disosiasi (kimia)|terdisosiasi]] menjadi {{chem2|AlCl|3}} trigonal planar, yang secara struktur analog dengan [[Boron trifluorida|{{chem2|BF|3}}]]. Lelehannya memiliki [[Konduktansi listrik|daya hantar listrik]] rendah,<ref name="Greenwood">{{cite|author1=N.N. Greenwood|author2=A. Earnshaw|title=Chemistry of the Elements|publisher=Pergamon Press|location=[[Oxford]], United Kingdom|year=1984}}</ref> tidak seperti [[halida]] [[ikatan ionik|ionik]] lainnya misalnya [[natrium klorida]]. |
||
== Reaksi == |
|||
<!-- |
|||
Aluminium klorida anhidrat adalah [[asam Lewis]] kuat, mampu membentuk adisi asam-basa Lewis dengan [[basa Lewis]] seperti [[benzofenon]] dan [[mesitilena]].<ref name="Friedel">{{cite|editor=G.A. Olah|title=Friedel-Crafts and Related Reactions|volume=1|publisher=[[John Wiley & Sons|Interscience]]|location=[[New York]]|year=1963}}</ref> Ia membentuk [[tetrakloroaluminat]] {{chem2|AlCl|4|-}} dengan adanya ion [[klorida]]. |
|||
==Reactions== |
|||
Anhydrous aluminium chloride is a powerful [[Lewis acid]], capable of forming Lewis acid-base adducts with even weak [[Lewis base]]s such as [[benzophenone]] and [[mesitylene]].<ref name="Friedel">G. A. Olah (ed.), ''Friedel-Crafts and Related Reactions'', Vol. 1, [[John Wiley & Sons|Interscience]], [[New York]], 1963.</ref> It forms [[tetrachloroaluminate]] AlCl<sub>4</sub><sup>−</sup> in the presence of [[chloride]] ions. |
|||
Aluminium |
Aluminium klorida bereaksi dengan [[Kalsium hidrida|kalsium]] dan [[magnesium hidrida]] dalam [[tetrahidrofuran]] membentuk tetrahidroaluminat. |
||
=== |
=== Reaksi dengan air === |
||
Aluminium |
Aluminium klorida bersifat higroskopis, mempunyai afinitas yang kuat terhadap air. Ini menguap di udara lembap dan mendesis ketika dicampur dengan air karena ion Cl<sup>−</sup> digantikan dengan molekul H<sub>2</sub>O dalam kisi-kisinya untuk membentuk heksa[[hidrate]] AlCl<sub>3</sub>·6H<sub>2</sub>O (juga berwarna putih kekuningan). Fase anhidrat tidak dapat diperoleh kembali pada pemanasan karena HCl hilang menyisakan aluminium hidroksida dan alumina (aluminium oksida): |
||
:Al(H<sub>2</sub>O)<sub>6</sub>Cl<sub>3</sub> → Al(OH)<sub>3</sub> + 3 HCl + 3 H<sub>2</sub>O |
|||
On strong heating (~400°C), the aluminium oxide is formed from the aluminium hydroxide via: |
|||
:2 Al(OH)<sub>3</sub> → Al<sub>2</sub>O<sub>3</sub> + 3 H<sub>2</sub>O |
|||
<center><math>\text{Al(H}_2\text{O)}_6\text{Cl}_3 \longrightarrow \text{Al(OH)}_3 + 3\text{ HCl} + 3\text{ H}_2\text{O}</math></center> |
|||
[[Aqueous solution]]s of AlCl<sub>3</sub> are ionic and thus conduct [[electricity]] well. Such solutions are found to be [[acid]]ic, indicative of partial [[hydrolysis]] of the Al<sup>3+</sup> ion. The reactions can be described (simplified) as: |
|||
:[Al(H<sub>2</sub>O)<sub>6</sub>]<sup>3+</sup> {{unicode|⇌}} [Al(OH)(H<sub>2</sub>O)<sub>5</sub>]<sup>2+</sup> + H<sup>+</sup> |
|||
Pada pemanasan kuat (~400 °C), aluminium oksida terbentuk dari aluminium hidroksida melalui: |
|||
Aqueous solutions behave similarly to other [[aluminium]] [[salt]]s containing hydrated Al<sup>3+</sup> [[ion]]s, giving a gelatinous [[precipitate]] of [[aluminium hydroxide]] upon reaction with dilute [[sodium hydroxide]]: |
|||
:AlCl<sub>3</sub> + 3 NaOH → Al(OH)<sub>3</sub> + 3 [[sodium chloride|NaCl]] |
|||
<center><math>2\text{ Al(OH)}_3 \longrightarrow \text{Al}_2\text{O}_3 + 3\text{ H}_2\text{O}</math></center> |
|||
==Synthesis== |
|||
Aluminium chloride is manufactured on a large scale by the [[exothermic]] reaction of [[aluminium]] metal with chlorine or [[hydrogen chloride]] at temperatures between {{convert|650|to|750|C}}.<ref name="Greenwood"/> |
|||
:2 Al + 3 Cl<sub>2</sub> → 2 AlCl<sub>3</sub> |
|||
:2 Al + 6 HCl → 2 AlCl<sub>3</sub> + 3 H<sub>2</sub> |
|||
[[Larutan akuatik]] {{chem2|AlCl|3}} adalah ionik sehingga menghantarkan [[listrik]] dengan baik. Larutan semacam ini dijumpai bersifat [[asam]], menandakan [[hidrolisis]] parsial ion {{chem2|Al|3+}}. Reaksinya dapat dijelaskan secara sederhana sebagai: |
|||
Aluminum chloride may be formed via a single displacement reaction between copper chloride and aluminum metal. |
|||
:2Al +3 CuCl<sub>2</sub> →2AlCl<sub>3</sub> + 3Cu |
|||
<center><math>\left[\text{Al(H}_2\text{O)}_6\right]^{3+} \rightleftharpoons \left[\text{Al(OH)(H}_2\text{O)}_5\right]^{2+} + \text{H}^{+}</math></center> |
|||
In the US in 1993, approximately 21,000 tons were produced, not counting the amounts consumed in the production of aluminium.<ref name=Ullmann/> |
|||
Larutan akuatik berperlaku sama seperti [[garam (kimia)|garam]] [[aluminium]] lainnya yang mengandung [[ion]] {{chem2|Al|3+}} terhidrasi, membentuk [[endapan]] gelatin [[aluminium hidroksida]] pada saat direaksikan dengan [[natrium hidroksida]] encer: |
|||
Hydrated aluminium trichloride is prepared by dissolving aluminium oxides in [[hydrochloric acid]]. Metallic aluminum also readily dissolves in Hydrochloric acid ─ releasing hydrogen gas and generating considerable heat. Heating this solid does not produce anhydrous aluminium trichloride, the hexahydrate decomposes to [[aluminium oxide]] when heated to {{convert|300|C}}:<ref name=Ullmann/> |
|||
: 2 AlCl<sub>3</sub> + 3 H<sub>2</sub>O → Al<sub>2</sub>O<sub>3</sub> + 6 HCl |
|||
<center><math>\text{AlCl}_3 + 3\text{ NaOH} \longrightarrow \text{Al(OH)}_3 + 3\text{ NaCl}</math></center> |
|||
[[Aluminium]] also forms a lower [[chloride]], [[aluminium(I) chloride]] (AlCl), but this is very unstable and only known in the vapour phase.<ref name="Greenwood"/> |
|||
== |
== Sintesis == |
||
Aluminium klorida diproduksi dalam skala besar dengan cara reaksi [[eksotermik]] logam [[aluminium]] dengan klorin atau [[hidrogen klorida]] pada temperatur antara {{convert|650|to|750|C}}.<ref name="Greenwood"/> |
|||
===Anhydrous aluminium trichloride=== |
|||
AlCl<sub>3</sub> is probably the most commonly used [[Lewis acid]] and also one of the most powerful. It finds application in the [[chemical industry]] as a [[catalyst]] for [[Friedel–Crafts reaction]]s, both acylations and alkylations. Important products are [[detergent]]s and [[ethylbenzene]]. It also finds use in [[polymerization]] and [[isomerization]] reactions of [[hydrocarbon]]s. |
|||
<center><math>2\text{ Al} + 3\text{ Cl}_2 \longrightarrow 2\text{ AlCl}_3</math></center> |
|||
The Friedel–Crafts reaction<ref name="Friedel"/> is the major use for aluminium chloride, for example in the preparation of [[anthraquinone]] (for the [[dye]]stuffs industry) from [[benzene]] and [[phosgene]].<ref name="Greenwood"/> In the general Friedel–Crafts reaction, an [[acyl chloride]] or [[alkyl halide]] reacts with an [[aromatic]] system as shown:<ref name="Friedel"/> |
|||
<center><math>2\text{ Al} + 6\text{ HCl} \longrightarrow 2\text{ AlCl}_3 + 3\text{ H}_2</math></center> |
|||
:[[File:Benzene Friedel-Crafts alkylation-diagram.svg|330px]] |
|||
Aluminium klorida dapat terbentuk melalui reaksi pengusiran tunggal antara tembaga klorida dan logam aluminium. |
|||
The alkylation reaction is more widely used than the acylation reaction, although its practice is more technically demanding because the reaction is more sluggish. For both reactions, the aluminium chloride, as well as other materials and the equipment, should be dry, although a trace of moisture is necessary for the reaction to proceed.{{cn|date=May 2013}} A general problem with the Friedel–Crafts reaction is that the aluminium chloride [[catalyst]] sometimes is required in full [[stoichiometry|stoichiometric]] quantities, because it [[Complex (chemistry)|complex]]es strongly with the products. This complication sometimes generates a large amount of corrosive waste. For these and similar reasons, more [[recycling|recyclable]] or [[green chemistry|environmentally benign]] catalysts have been sought. Thus, the use of aluminium trichloride in some applications is being displaced by [[zeolite]]s. |
|||
<center><math>2\text{ Al} + 3\text{ CuCl}_2 \longrightarrow 2\text{ AlCl}_3 + 3\text{ Cu}</math></center> |
|||
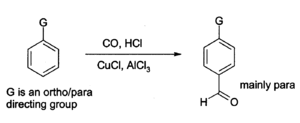
Aluminium chloride can also be used to introduce [[aldehyde]] groups onto [[aromatic]] rings, for example via the [[Gattermann-Koch reaction]] which uses [[carbon monoxide]], [[hydrogen chloride]] and a [[copper(I) chloride]] [[co-catalyst]].<ref>L. G. Wade, ''Organic Chemistry'', 5th edition, [[Prentice Hall]], [[Upper Saddle River, New Jersey]], United States, 2003.</ref> |
|||
:[[File:AlCl3 formylation.gif|300px]] |
|||
Pada tahun 1993 di AS, sekitar 21.000 ton {{chem2|AlCl|3}} diproduksi, tidak termasuk jumlah yang digunakan dalam produksi aluminium.<ref name=Ullmann>{{cite|author1=Otto Helmboldt|author2=L. Keith Hudson|author3=Chanakya Misra|author4=Karl Wefers|author5=Wolfgang Heck|author6=Hans Stark|author7=Max Danner|author8=Norbert Rösch|title=Aluminum Compounds, Inorganic|journal=Ullmann's Encyclopedia of Industrial Chemistry|year=2007|publisher=Wiley-VCH|location=Weinheim|DOI=10.1002/14356007.a01_527.pub2}}</ref> |
|||
Aluminium chloride finds a wide variety of other applications in [[organic chemistry]].<ref>P. Galatsis, in: ''Handbook of Reagents for Organic Synthesis: Acidic and Basic Reagents'', (H. J. Reich, J. H. Rigby, eds.), pp. 12–15, [[John Wiley & Sons|Wiley]], [[New York]], 1999.</ref> For example, it can catalyse the "[[ene reaction]]", such as the addition of [[3-buten-2-one]] (methyl vinyl ketone) to [[carvone]]:<ref>{{cite journal | author = B. B. Snider | title = Lewis-acid catalyzed ene reactions | journal = [[Acc. Chem. Res.]] | volume = 13 | page = 426 | year = 1980 | doi = 10.1021/ar50155a007 | issue = 11}}</ref> |
|||
:[[File:AlCl3 ene rxn.gif|400px]] |
|||
Aluminium triklorida hidrat dibuat dengan melarutkan aluminium oksida dalam [[asam klorida]]. Aluminium logam juga mudah larut dalam asam klorida ─ membebaskan gas hidrogen dan menghasilkan panas. Memanaskan padatan ini tidak menghasilkan aluminium triklorida anhidrat, karena senyawa heksahidratnya terdekomposisi menjadi [[aluminium oksida]] ketika dipanaskan hingga {{convert|300|C}}:<ref name=Ullmann/> |
|||
AlCl<sub>3</sub> is also widely used for [[polymerization]] and [[isomerization]] reactions of [[hydrocarbon]]s. Important examples include the manufacture of [[ethylbenzene]], which used to make [[styrene]] and thus [[polystyrene]], and also production of [[dodecylbenzene]], which is used for making [[detergent]]s.<ref name="Greenwood"/> |
|||
<center><math>2\text{ AlCl}_3 + 3\text{ H}_2\text{O} \longrightarrow \text{Al}_2\text{O}_3 + 6\text{ HCl}</math></center> |
|||
Aluminium chloride combined with aluminium in the presence of an arene can be used to synthesize bis(arene) metal complexes, e.g. [[bis(benzene)chromium]], from certain metal halides via the so-called [[Ernst Otto Fischer|Fischer]]-Hafner synthesis. |
|||
[[Aluminium]] juga membentuk [[klorida]] yang lebih rendah, [[aluminium(I) klorida]] (AlCl), tetapi ini sangat tidak stabil dan hanya dikenal dalam fase uapnya.<ref name="Greenwood"/> |
|||
===Hydrated aluminium chlorides=== |
|||
The hexahydrate has few applications, but [[aluminium chlorohydrate]] is a common component in [[antiperspirant]]s at low concentrations.<ref name=Ullmann>Otto Helmboldt, L. Keith Hudson, Chanakya Misra, Karl Wefers, Wolfgang Heck, Hans Stark, Max Danner, Norbert Rösch "Aluminum Compounds, Inorganic" in Ullmann's Encyclopedia of Industrial Chemistry 2007, Wiley-VCH, Weinheim.{{DOI|10.1002/14356007.a01_527.pub2}}</ref> [[Hyperhidrosis]] sufferers need a much higher concentration (12% or higher), sold under such brand names as Xeransis, Drysol, DryDerm, sunsola, Maxim, [[Odaban]], CertainDri, B+Drier, Chlorhydrol, Anhydrol Forte and [[Driclor]]. |
|||
== Penggunaan == |
|||
==Symmetry and Dipole moment== |
|||
=== Aluminium triklorida anhidrat === |
|||
Aluminium chloride belongs to the point group D<sub>3h</sub> in its monomeric form and D<sub>2h</sub> in its dimeric form. Both forms of aluminium chloride, however, do not possess a dipole moment because the bond dipole moments cancel each other out. |
|||
{{chem2|AlCl|3}} mungkin merupakan [[asam Lewis]] yang paling banyak digunakan dan juga salah satu yang paling kuat. Senyawa ini banyak ditemukan dalam aplikasi [[industri kimia]] sebagai [[katalis]] untuk [[reaksi Friedel–Crafts]], baik asilasi maupun alkilasi. Produk pentingnya adalah [[deterjen]] dan [[etilbenzena]]. Ia juga digunakan dalam reaksi [[polimerisasi]] dan [[isomerisasi]] [[hidrokarbon]]. |
|||
Reaksi Friedel–Crafts<ref name="Friedel"/> merupakan pengguna utama aluminium klorida, misalnya dalam preparasi [[antrakuinon]] (untuk bahan pewarna industri) dari [[benzena]] dan [[fosgen]].<ref name="Greenwood"/> Secara umum reaksi Friedel–Crafts, [[asil klorida]] atau [[alkil halida]] bereaksi dengan sistem [[aromatik]] sebagai berikut:<ref name="Friedel"/> |
|||
==Safety== |
|||
<center>[[Berkas:Benzene Friedel-Crafts alkylation-diagram.svg|330px]]</center> |
|||
Anhydrous AlCl<sub>3</sub> reacts vigorously with [[base (chemistry)|base]]s, so suitable precautions are required. |
|||
It can cause irritation to the eyes, skin, and the respiratory system if inhaled or on contact.<ref>http://www.solvaychemicals.us/static/wma/pdf/5/1/1/8/ALCL.pdf</ref> |
|||
Reaksi alkilasi lebih banyak digunakan daripada reaksi asilasi , meskipun praktiknya lebih menuntut perhatian teknis karena reaksi lebih lamban. Untuk kedua reaksi, aluminium klorida, bahan beserta peralatan lainnya harus kering, meskipun jejak kelembaban diperlukan agar reaksi dapat berlangsung. Masalah umum dengan reaksi Friedel–Crafts adalah bahwa [[katalis]] aluminium klorida kadang-kadang diperlukan dalam jumlah [[stoikiometri]]s penuh, karena membentuk [[Kompleks (kimia)|kompleks]] kuat dengan produk. Komplikasi ini kadang-kadang menghasilkan limbah korosif dalam jumlah besar. Untuk alasan ini dan sejenisnya, telah dicari katalis yang lebih dapat di[[daur ulang]] atau [[Kimia hijau|ramah lingkungan]]. Dengan demikian, penggunaan aluminium triklorida di beberapa aplikasi telah digantikan oleh [[zeolit]]. |
|||
Aluminum chloride has been established as a [[neurotoxin]].<ref name="Lankoff">{{cite journal |author=He BP, Strong MJ |title=A morphological analysis of the motor neuron degeneration and microglial reaction in acute and chronic in vivo aluminum chloride neurotoxicity |journal=J. Chem. Neuroanat. |volume=17 |issue=4 |pages=207–15 |date=January 2000 |pmid=10697247 |doi= 10.1016/S0891-0618(99)00038-1|url=}}</ref><ref>{{cite journal |author=Zubenko GS, Hanin I |title=Cholinergic and noradrenergic toxicity of intraventricular aluminum chloride in the rat hippocampus |journal=Brain Res. |volume=498 |issue=2 |pages=381–4 |date=October 1989 |pmid=2790490 |doi= 10.1016/0006-8993(89)91121-9|url=}}</ref><ref>{{cite journal |author=Peng JH, Xu ZC, Xu ZX |title=Aluminum-induced acute cholinergic neurotoxicity in rat |journal=Mol. Chem. Neuropathol. |volume=17 |issue=1 |pages=79–89 |date=August 1992 |pmid=1388451 |doi= 10.1007/BF03159983|url=|display-authors=etal}}</ref><ref>{{cite journal|author = Banks, W.A.|author2=Kastin, A.J.|year = 1989|title = Aluminum-induced neurotoxicity: alterations in membrane function at the blood–brain barrier|journal = Neurosci Biobehav Rev|volume = 13|issue = 1|pages = 47–53|doi = 10.1016/S0149-7634(89)80051-X|pmid = 2671833}}</ref> |
|||
--> |
|||
Aluminium klorida dapat juga digunakan untuk memasukkan gugus [[aldehida]] ke dalam cincin [[aromatik]], contohnya dalam [[reaksi Gattermann-Koch]] yang menggunakan [[karbon monoksida]], [[hidrogen klorida]] dan [[ko-katalis]] [[tembaga(I) klorida]].<ref>{{cite|author=Wade, L.G.|title=Organic Chemistry|edition=5th|publisher=[[Prentice Hall]]|location=[[Upper Saddle River, New Jersey]], United States|year=2003}}</ref> |
|||
==Referensi== |
|||
<center>[[Berkas:AlCl3 formylation.gif|300px]]</center> |
|||
Aluminium klorida banyak digunakan dalam berbagai macam aplikasi [[kimia organik]] lainnya.<ref>{{cite|author=Galatsis, P.|title=Handbook of Reagents for Organic Synthesis: Acidic and Basic Reagents|editor=H.J. Reich, J.H. Rigby|pages=12–15|publisher=[[John Wiley & Sons|Wiley]]|location=[[New York]]|year=1999}}</ref> Misalnya, ia dapat mengkatalisis "[[reaksi ena]]", seperti adisi [[3-buten-2-on]] (metil vinil keton) menjadi [[karvona]]:<ref>{{cite journal | author = Snider, B.B. | title = Lewis-acid catalyzed ene reactions | journal = [[Acc. Chem. Res.]] | volume = 13 | page = 426 | year = 1980 | doi = 10.1021/ar50155a007 | issue = 11}}</ref> |
|||
<center>[[Berkas:AlCl3 ene rxn.gif|400px]]</center> |
|||
AlCl<sub>3</sub> juga banyak digunakan untuk reaksi [[polimerisasi]] dan [[isomerisasi]] [[hidrokarbon]]. Contoh penting antara lain pembuatan [[etilbenzena]], yang digunakan untuk membuat [[stirena]] sebagai bahan baku [[polistirena]], dan juga produksi [[dodesilbenzena]], yang digunakan untuk pembuatan [[deterjen]].<ref name="Greenwood"/> |
|||
Aluminium klorida yang dikombinasikan dengan aluminium dan dengan adanya suatu arena dapat digunakan untuk mensintesis kompleks logam bis(arena), misalnya [[bis(benzena)kromium]], dari halida logam tertentu melalui apa yang disebut sintesis [[Ernst Otto Fischer|Fischer]]-Hafner. |
|||
=== Aluminium klorida hidrat === |
|||
Heksahidratnya memiliki sedikit aplikasi, tetapi [[aluminium klorohidrat]] pada konsentrasi rendah adalah komponen umum dalam [[antiperspiran]].<ref name=Ullmann /> Penderita [[Hiperhidrosis]] memerlukan konsentrasi yang lebih tinggi (12% atau lebih tinggi), dijual dengan merek seperti Xeransis, Drysol, DryDerm, sunsola, Maxim, [[Odaban]], CertainDri, B+Drier, Chlorhydrol, Anhydrol Forte dan [[Driclor]]. |
|||
== Simetri dan momen dipol == |
|||
Aluminium klorida berada dalam kelompok D<sub>3h</sub> dalam bentuk monomernya dan D<sub>2h</sub> dalam bentuk dimernya. Bagaimanapun, kedua bentuk aluminium klorida, tidak memiliki momen dipol karena momen dipol ikatan meniadakan satu sama lain. |
|||
== Keselamatan == |
|||
AlCl<sub>3</sub> anhidrat bereaksi hebat dengan [[Basa (kimia)|basa]], sehingga diperlukan tindakan pencegahan yang sesuai. Hal ini dapat menyebabkan iritasi pada mata, kulit, dan sistem pernapasan jika terhirup atau saat kontak.<!--<ref>http://www.solvaychemicals.us/static/wma/pdf/5/1/1/8/ALCL.pdf</ref>--> |
|||
Aluminium klorida telah ditetapkan sebagai [[neurotoksin]].<ref name="Lankoff">{{cite journal |author=He BP, Strong MJ |title=A morphological analysis of the motor neuron degeneration and microglial reaction in acute and chronic in vivo aluminum chloride neurotoxicity |journal=J. Chem. Neuroanat. |volume=17 |issue=4 |pages=207–15 |date=January 2000 |pmid=10697247 |doi= 10.1016/S0891-0618(99)00038-1|url=}}</ref><ref>{{cite journal |author=Zubenko GS, Hanin I |title=Cholinergic and noradrenergic toxicity of intraventricular aluminum chloride in the rat hippocampus |journal=Brain Res. |volume=498 |issue=2 |pages=381–4 |date=October 1989 |pmid=2790490 |doi= 10.1016/0006-8993(89)91121-9|url=}}</ref><ref>{{cite journal |author=Peng JH, Xu ZC, Xu ZX |title=Aluminum-induced acute cholinergic neurotoxicity in rat |journal=Mol. Chem. Neuropathol. |volume=17 |issue=1 |pages=79–89 |date=August 1992 |pmid=1388451 |doi= 10.1007/BF03159983|url=|display-authors=etal}}</ref><ref>{{cite journal|author = Banks, W.A.|author2=Kastin, A.J.|year = 1989|title = Aluminum-induced neurotoxicity: alterations in membrane function at the blood–brain barrier|journal = Neurosci Biobehav Rev|volume = 13|issue = 1|pages = 47–53|doi = 10.1016/S0149-7634(89)80051-X|pmid = 2671833}}</ref> |
|||
== Referensi == |
|||
<!--This article uses the Cite.php citation mechanism. If you would like more information on how to add references to this article, please see http://meta.wikimedia.org/wiki/Cite/Cite.php --> |
<!--This article uses the Cite.php citation mechanism. If you would like more information on how to add references to this article, please see http://meta.wikimedia.org/wiki/Cite/Cite.php --> |
||
{{reflist}} |
{{reflist}} |
||
<!-- |
|||
== Pranala luar == |
|||
==External links== |
|||
{{Commons category|Aluminium chloride}} |
{{Commons category|Aluminium chloride}} |
||
* [http://www.inchem.org/documents/icsc/icsc/eics1125.htm International Chemical Safety Card 1125] |
* [http://www.inchem.org/documents/icsc/icsc/eics1125.htm International Chemical Safety Card 1125] |
||
* [http://www.orgsyn.org/orgsyn/chemname.asp?nameID=33169 Index of Organic Synthesis procedures that utilize AlCl<sub>3</sub>] |
* [http://www.orgsyn.org/orgsyn/chemname.asp?nameID=33169 Index of Organic Synthesis procedures that utilize AlCl<sub>3</sub>] |
||
* [http://www.chemguide.co.uk/inorganic/period3/chlorides.html The period 3 chlorides] |
* [http://www.chemguide.co.uk/inorganic/period3/chlorides.html The period 3 chlorides] |
||
* [http://www.chemicalsubstanceschimiques.gc.ca/fact-fait/alum-salts-sels-eng.php Government of Canada Fact Sheets and Frequently Asked Questions: Aluminum Salts] |
|||
* [http://www.solvaychemicals.us/static/wma/pdf/5/1/1/8/ALCL.pdf MSDS] |
|||
* [http://www.chemicalsubstanceschimiques.gc.ca/fact-fait/alum-salts-sels-eng.php Government of Canada Fact Sheets and Frequently Asked Questions: Aluminum Salts] |
|||
--> |
|||
{{Senyawa aluminium}} |
{{Senyawa aluminium}} |
||
{{Authority control}} |
{{Authority control}} |
||
<!--[[Category:Deliquescent substances]]--> |
|||
[[Kategori:Klorida]] |
[[Kategori:Klorida]] |
||
[[Kategori:Halida logam]] |
[[Kategori:Halida logam]] |
||
[[Kategori:Senyawa aluminium]] |
|||
[[Kategori:Senyawa anorganik]] |
[[Kategori:Senyawa anorganik]] |
||
[[Kategori:Pereaksi untuk kimia organik]] |
[[Kategori:Pereaksi untuk kimia organik]] |
||
<!--[[Category:Deliquescent substances]]--> |
|||
Revisi terkini sejak 11 Desember 2023 04.03

| |
| |
| Nama | |
|---|---|
| Nama IUPAC
aluminium klorida
| |
| Nama lain
aluminium(III) klorida
aluminum triklorida | |
| Penanda | |
| |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| AlCl3 | |
| Massa molar | 133,34 g/mol (anhidrat) 241,43 g/mol (heksahidrat) |
| Penampilan | padatan putih atau kuning pucat, higroskopis |
| Densitas | 2,48 g/cm3 (anhidrat) 1,3 g/cm3 (heksahidrat) |
| Titik lebur | 1.924 °C (3.495 °F; 2.197 K) (anhidrat) 100 °C (212 °F; 373 K) (heksahidrat) 180 °C (356 °F; 453 K) (menyublim) |
| Titik didih | 120 °C (248 °F; 393 K) (heksahidrat) |
| 43,9 g/100 ml (0 °C) 44,9 g/100 ml (10 °C) 45,8 g/100 ml (20 °C) 46,6 g/100 ml (30 °C) 47,3 g/100 ml (40 °C) 48,1 g/100 ml (60 °C) 48,6 g/100 ml (80 °C) 49 g/100 ml (100 °C) | |
| Kelarutan | larut dalam hidrogen klorida, etanol, kloroform, karbon tetraklorida sedikit larut dalam benzena |
| Tekanan uap | 133,3 Pa (99 °C) 13,3 kPa (151 °C)[1] |
| Viskositas | 0,35 cP (197 °C) 0,26 cP (237 °C)[1] |
| Struktur | |
| Monoklinik, mS16 | |
| C12/m1, No. 12 | |
| Oktahedral (padat) Tetrahedral (cair) | |
| Trigonal planar (uap monomerik) | |
| Termokimia | |
| Kapasitas kalor (C) | 91 J/mol·K[1] |
| Entropi molar standar (S |
111 J/mol·K[2] |
| Entalpi pembentukan standar (ΔfH |
−704,2 kJ/mol[1][2] |
| Energi bebas Gibbs (ΔfG) | −628,6 kJ/mol[1] |
| Farmakologi | |
| Kode ATC | D10 |
| Bahaya | |
| Piktogram GHS |  [3] [3]
|
| Keterangan bahaya GHS | {{{value}}} |
| H314[3] | |
| P280, P310, P305+351+338[3] | |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
anhidrat: 380 mg/kg, mencit (oral) heksahidrat: 3311 mg/kg, mencit (oral) |
| Batas imbas kesehatan AS (NIOSH): | |
PEL (yang diperbolehkan)
|
none[4] |
REL (yang direkomendasikan)
|
2 mg/m3[4] |
IDLH (langsung berbahaya)
|
N.D.[4] |
| Senyawa terkait | |
Anion lain
|
Aluminium fluorida Aluminium bromida Aluminium iodida |
Kation lainnya
|
Boron triklorida Galium triklorida Indium(III) klorida Magnesium klorida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Aluminium klorida (AlCl3) adalah senyawa kimia utama dari aluminium dan klorin. Senyawa ini berwarna putih, tetapi sampelnya sering terkontaminasi dengan besi triklorida, yang memberikan pewarnaan kuning. Padatannya mempunyai titik leleh dan titik didih rendah. Senyawa ini terutama diproduksi dan dikonsumsi dalam produksi logam aluminium, tetapi sejumlah besar juga digunakan dalam bidang industri kimia. Senyawa ini sering digolongkan sebagai asam Lewis. Ini merupakan contoh senyawa anorganik yang retak pada temperatur rendah, berubah bolak-balik dari polimer menjadi monomer.
Struktur
[sunting | sunting sumber]AlCl memiliki tiga struktur yang berbeda, bergantung pada temperatur dan fasenya (padat, cair, gas). AlCl padat berbentuk seperti lembaran dengan kisi kristal closed packed cubic. Dalam bentuk ini, pusat Al menunjukkan geometri koordinasi oktahedral.[5] Dalam lelehannya, aluminium triklorida berada sebagai dimer Al, dengan aluminium tetrakoordinasi. Perubahan struktur ini terkait dengan rendahnya massa jenis fasa cairnya (1,78 g/cm3) vs aluminium triklorida padat (2,48 g/cm3). Dimer Al2Cl6 juga dijumpai dalam fasa uap. Pada temperatur yang lebih tinggi, dimer Al2Cl6 terdisosiasi menjadi AlCl trigonal planar, yang secara struktur analog dengan BF. Lelehannya memiliki daya hantar listrik rendah,[6] tidak seperti halida ionik lainnya misalnya natrium klorida.
Reaksi
[sunting | sunting sumber]Aluminium klorida anhidrat adalah asam Lewis kuat, mampu membentuk adisi asam-basa Lewis dengan basa Lewis seperti benzofenon dan mesitilena.[7] Ia membentuk tetrakloroaluminat AlCl dengan adanya ion klorida.
Aluminium klorida bereaksi dengan kalsium dan magnesium hidrida dalam tetrahidrofuran membentuk tetrahidroaluminat.
Reaksi dengan air
[sunting | sunting sumber]Aluminium klorida bersifat higroskopis, mempunyai afinitas yang kuat terhadap air. Ini menguap di udara lembap dan mendesis ketika dicampur dengan air karena ion Cl− digantikan dengan molekul H2O dalam kisi-kisinya untuk membentuk heksahidrate AlCl3·6H2O (juga berwarna putih kekuningan). Fase anhidrat tidak dapat diperoleh kembali pada pemanasan karena HCl hilang menyisakan aluminium hidroksida dan alumina (aluminium oksida):
Pada pemanasan kuat (~400 °C), aluminium oksida terbentuk dari aluminium hidroksida melalui:
Larutan akuatik AlCl adalah ionik sehingga menghantarkan listrik dengan baik. Larutan semacam ini dijumpai bersifat asam, menandakan hidrolisis parsial ion Al. Reaksinya dapat dijelaskan secara sederhana sebagai:
Larutan akuatik berperlaku sama seperti garam aluminium lainnya yang mengandung ion Al terhidrasi, membentuk endapan gelatin aluminium hidroksida pada saat direaksikan dengan natrium hidroksida encer:
Sintesis
[sunting | sunting sumber]Aluminium klorida diproduksi dalam skala besar dengan cara reaksi eksotermik logam aluminium dengan klorin atau hidrogen klorida pada temperatur antara 650 hingga 750 °C (1.202 hingga 1.382 °F).[6]
Aluminium klorida dapat terbentuk melalui reaksi pengusiran tunggal antara tembaga klorida dan logam aluminium.
Pada tahun 1993 di AS, sekitar 21.000 ton AlCl diproduksi, tidak termasuk jumlah yang digunakan dalam produksi aluminium.[8]
Aluminium triklorida hidrat dibuat dengan melarutkan aluminium oksida dalam asam klorida. Aluminium logam juga mudah larut dalam asam klorida ─ membebaskan gas hidrogen dan menghasilkan panas. Memanaskan padatan ini tidak menghasilkan aluminium triklorida anhidrat, karena senyawa heksahidratnya terdekomposisi menjadi aluminium oksida ketika dipanaskan hingga 300 °C (572 °F):[8]
Aluminium juga membentuk klorida yang lebih rendah, aluminium(I) klorida (AlCl), tetapi ini sangat tidak stabil dan hanya dikenal dalam fase uapnya.[6]
Penggunaan
[sunting | sunting sumber]Aluminium triklorida anhidrat
[sunting | sunting sumber]AlCl mungkin merupakan asam Lewis yang paling banyak digunakan dan juga salah satu yang paling kuat. Senyawa ini banyak ditemukan dalam aplikasi industri kimia sebagai katalis untuk reaksi Friedel–Crafts, baik asilasi maupun alkilasi. Produk pentingnya adalah deterjen dan etilbenzena. Ia juga digunakan dalam reaksi polimerisasi dan isomerisasi hidrokarbon.
Reaksi Friedel–Crafts[7] merupakan pengguna utama aluminium klorida, misalnya dalam preparasi antrakuinon (untuk bahan pewarna industri) dari benzena dan fosgen.[6] Secara umum reaksi Friedel–Crafts, asil klorida atau alkil halida bereaksi dengan sistem aromatik sebagai berikut:[7]

Reaksi alkilasi lebih banyak digunakan daripada reaksi asilasi , meskipun praktiknya lebih menuntut perhatian teknis karena reaksi lebih lamban. Untuk kedua reaksi, aluminium klorida, bahan beserta peralatan lainnya harus kering, meskipun jejak kelembaban diperlukan agar reaksi dapat berlangsung. Masalah umum dengan reaksi Friedel–Crafts adalah bahwa katalis aluminium klorida kadang-kadang diperlukan dalam jumlah stoikiometris penuh, karena membentuk kompleks kuat dengan produk. Komplikasi ini kadang-kadang menghasilkan limbah korosif dalam jumlah besar. Untuk alasan ini dan sejenisnya, telah dicari katalis yang lebih dapat didaur ulang atau ramah lingkungan. Dengan demikian, penggunaan aluminium triklorida di beberapa aplikasi telah digantikan oleh zeolit.
Aluminium klorida dapat juga digunakan untuk memasukkan gugus aldehida ke dalam cincin aromatik, contohnya dalam reaksi Gattermann-Koch yang menggunakan karbon monoksida, hidrogen klorida dan ko-katalis tembaga(I) klorida.[9]
Aluminium klorida banyak digunakan dalam berbagai macam aplikasi kimia organik lainnya.[10] Misalnya, ia dapat mengkatalisis "reaksi ena", seperti adisi 3-buten-2-on (metil vinil keton) menjadi karvona:[11]

AlCl3 juga banyak digunakan untuk reaksi polimerisasi dan isomerisasi hidrokarbon. Contoh penting antara lain pembuatan etilbenzena, yang digunakan untuk membuat stirena sebagai bahan baku polistirena, dan juga produksi dodesilbenzena, yang digunakan untuk pembuatan deterjen.[6]
Aluminium klorida yang dikombinasikan dengan aluminium dan dengan adanya suatu arena dapat digunakan untuk mensintesis kompleks logam bis(arena), misalnya bis(benzena)kromium, dari halida logam tertentu melalui apa yang disebut sintesis Fischer-Hafner.
Aluminium klorida hidrat
[sunting | sunting sumber]Heksahidratnya memiliki sedikit aplikasi, tetapi aluminium klorohidrat pada konsentrasi rendah adalah komponen umum dalam antiperspiran.[8] Penderita Hiperhidrosis memerlukan konsentrasi yang lebih tinggi (12% atau lebih tinggi), dijual dengan merek seperti Xeransis, Drysol, DryDerm, sunsola, Maxim, Odaban, CertainDri, B+Drier, Chlorhydrol, Anhydrol Forte dan Driclor.
Simetri dan momen dipol
[sunting | sunting sumber]Aluminium klorida berada dalam kelompok D3h dalam bentuk monomernya dan D2h dalam bentuk dimernya. Bagaimanapun, kedua bentuk aluminium klorida, tidak memiliki momen dipol karena momen dipol ikatan meniadakan satu sama lain.
Keselamatan
[sunting | sunting sumber]AlCl3 anhidrat bereaksi hebat dengan basa, sehingga diperlukan tindakan pencegahan yang sesuai. Hal ini dapat menyebabkan iritasi pada mata, kulit, dan sistem pernapasan jika terhirup atau saat kontak.
Aluminium klorida telah ditetapkan sebagai neurotoksin.[12][13][14][15]
Referensi
[sunting | sunting sumber]- ^ a b c d e "Properties of substance: aluminium chloride", chemister.ru
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles (edisi ke-6th). Houghton Mifflin Company. ISBN 0-618-94690-X.
- ^ a b c Sigma-Aldrich Co., Aluminum chloride. Diakses tanggal 2014-05-05.
- ^ a b c "NIOSH Pocket Guide to Chemical Hazards #0024". National Institute for Occupational Safety and Health (NIOSH).
- ^ Sebaliknya, AlBr3 memiliki lebih banyak struktur molekul, dengan pusat Al3+ berada pada lubang tetrahedral dari kisi closed-packed ion Br−: A.F. Wells (1984), Structural Inorganic Chemistry, Oxford, United Kingdom: Oxford Press
- ^ a b c d e N.N. Greenwood; A. Earnshaw (1984), Chemistry of the Elements, Oxford, United Kingdom: Pergamon Press
- ^ a b c G.A. Olah, ed. (1963), Friedel-Crafts and Related Reactions, 1, New York: Interscience
- ^ a b c Otto Helmboldt; L. Keith Hudson; Chanakya Misra; Karl Wefers; Wolfgang Heck; Hans Stark; Max Danner; Norbert Rösch (2007), "Aluminum Compounds, Inorganic", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a01_527.pub2
- ^ Wade, L.G. (2003), Organic Chemistry (edisi ke-5th), Upper Saddle River, New Jersey, United States: Prentice Hall
- ^ Galatsis, P. (1999), H.J. Reich, J.H. Rigby, ed., Handbook of Reagents for Organic Synthesis: Acidic and Basic Reagents, New York: Wiley, hlm. 12–15
- ^ Snider, B.B. (1980). "Lewis-acid catalyzed ene reactions". Acc. Chem. Res. 13 (11): 426. doi:10.1021/ar50155a007.
- ^ He BP, Strong MJ (January 2000). "A morphological analysis of the motor neuron degeneration and microglial reaction in acute and chronic in vivo aluminum chloride neurotoxicity". J. Chem. Neuroanat. 17 (4): 207–15. doi:10.1016/S0891-0618(99)00038-1. PMID 10697247.
- ^ Zubenko GS, Hanin I (October 1989). "Cholinergic and noradrenergic toxicity of intraventricular aluminum chloride in the rat hippocampus". Brain Res. 498 (2): 381–4. doi:10.1016/0006-8993(89)91121-9. PMID 2790490.
- ^ Peng JH, Xu ZC, Xu ZX; et al. (August 1992). "Aluminum-induced acute cholinergic neurotoxicity in rat". Mol. Chem. Neuropathol. 17 (1): 79–89. doi:10.1007/BF03159983. PMID 1388451.
- ^ Banks, W.A.; Kastin, A.J. (1989). "Aluminum-induced neurotoxicity: alterations in membrane function at the blood–brain barrier". Neurosci Biobehav Rev. 13 (1): 47–53. doi:10.1016/S0149-7634(89)80051-X. PMID 2671833.



![{\displaystyle \left[{\text{Al(H}}_{2}{\text{O)}}_{6}\right]^{3+}\rightleftharpoons \left[{\text{Al(OH)(H}}_{2}{\text{O)}}_{5}\right]^{2+}+{\text{H}}^{+}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/77b4756fe534ee8c6606fb5036724dcae6f7f731)




