Molekul: Perbedaan antara revisi
k r2.7.3) (Robot: Mengubah mk:Молекула menjadi mk:Молекул |
Badak Jawa (bicara | kontrib) k Mengembalikan suntingan oleh 182.0.198.163 (bicara) ke revisi terakhir oleh Hysocc Tag: Pengembalian Suntingan perangkat seluler Suntingan peramban seluler Suntingan seluler lanjutan |
||
| (37 revisi perantara oleh 30 pengguna tidak ditampilkan) | |||
| Baris 1: | Baris 1: | ||
{{Use dmy dates|date=September 2017}} |
|||
[[Berkas:Atisane3.png|thumb|350px|Penggambaran tiga dimensi (kiri dan tengah) berserta dua dimensi (kanan) molekul [[terpenoid]] atisana.]] |
|||
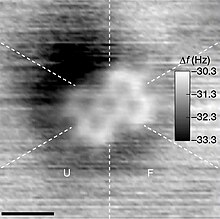
[[Berkas:PTCDA AFM.jpg|jmpl|Citra [[mikroskop gaya atom]] (AFM) molekul [[perilenatetrakarboksilat dianhidrida]] (PTCDA), yang mengandung gugus karbon cincin lima.<ref>{{cite journal|doi=10.1038/ncomms8766|pmid=26178193|pmc=4518281|title=Chemical structure imaging of a single molecule by atomic force microscopy at room temperature|journal=Nature Communications|volume=6|page=7766|year=2015|last1=Iwata|first1=Kota|last2=Yamazaki|first2=Shiro|last3=Mutombo|first3=Pingo|last4=Hapala|first4=Prokop|last5=Ondráček|first5=Martin|last6=Jelínek|first6=Pavel|last7=Sugimoto|first7=Yoshiaki|bibcode= 2015NatCo...6E7766I}}</ref>]] |
|||
[[Berkas:Pentacene on Ni(111) STM.jpg|jmpl|Citra [[mikroskop penerowongan payaran]] molekul [[pentasena]], yang mengandung rantai lurus dari karbon cincin lima.<ref>{{cite journal|doi=10.1039/C4NR07057G|pmid=25619890|title=Pentacene on Ni(111): Room-temperature molecular packing and temperature-activated conversion to graphene|journal=Nanoscale|volume=7|issue=7|pages=3263–9|year=2015|last1=Dinca|first1=L. E.|last2=De Marchi|first2=F.|last3=MacLeod|first3=J. M.|last4=Lipton-Duffin|first4=J.|last5=Gatti|first5=R.|last6=Ma|first6=D.|last7=Perepichka|first7=D. F.|last8=Rosei|first8=F.|bibcode= 2015Nanos...7.3263D}}</ref>]] |
|||
[[Berkas:TOAT AFM.png|jmpl|Citra AFM 1,5,9-triokso-13-azatriangulena beserta struktur kimianya.<ref>{{cite journal|doi=10.1038/ncomms11560|pmid=27230940|pmc=4894979|title=Mapping the electrostatic force field of single molecules from high-resolution scanning probe images|journal=Nature Communications|volume=7|pages=11560|year=2016|last1=Hapala|first1=Prokop|last2=Švec|first2=Martin|last3=Stetsovych|first3=Oleksandr|last4=Van Der Heijden|first4=Nadine J.|last5=Ondráček|first5=Martin|last6=Van Der Lit|first6=Joost|last7=Mutombo|first7=Pingo|last8=Swart|first8=Ingmar|last9=Jelínek|first9=Pavel|bibcode=2016NatCo...711560H}}</ref>]] |
|||
'''Molekul''' |
'''Molekul''' sederhananya adalah dua atau lebih [[atom]] yang saling terikat bersama dan diikat oleh [[ikatan kimia]]. Mereka merupakan [[wikt:gugusan|gugusan]] yang secara [[Listrik|elektris]] netral.<ref name="iupac">{{GoldBookRef| title=Molecule|file=M04002|accessdate=23 February 2016}}</ref><ref>{{cite book| author= Ebbin, Darrell D.| title= General Chemistry |edition=3rd| date= 1990| publisher= Houghton Mifflin Co.| location= Boston| isbn= 0-395-43302-9}}</ref><ref>{{cite book| author= Brown, T.L. |author2=Kenneth C. Kemp |author3=Theodore L. Brown |author4=Harold Eugene LeMay |author5=Bruce Edward Bursten |title= Chemistry–the Central Science | url= https://archive.org/details/studentlectureno00theo |edition=9th| date= 2003| publisher= Prentice Hall| location= New Jersey| isbn= 0-13-066997-0}}</ref><ref>{{cite book| last= Chang| first= Raymond| title= Chemistry | url= https://archive.org/details/chemistry0006chan|edition=6th| date= 1998| publisher= McGraw Hill| location= New York| isbn= 0-07-115221-0}}</ref><ref>{{cite book| author= Zumdahl, Steven S.| title= Chemistry | url= https://archive.org/details/chemistry0004zumd|edition=4th| date= 1997| publisher= Houghton Mifflin| location= Boston| isbn= 0-669-41794-7}}</ref> Molekul dibedakan dari ion berdasarkan ketiadaan [[muatan listrik]]. Namun, dalam [[fisika kuantum]], [[kimia organik]], dan [[biokimia]], istilah ''molekul'' sering digunakan dengan agak longgar, juga digunakan untuk [[ion poliatomik]]. |
||
Dalam teori |
Dalam [[teori kinetika gas]], istilah ''molekul'' sering digunakan untuk [[partikel]] gas apapun tanpa memperdulikan komposisinya. Menurut definisi ini, atom [[gas mulia]] dianggap sebagai molekul sebagai molekul monoatomik.<ref>{{cite book| last= Chandra| first= Sulekh| title= Comprehensive Inorganic Chemistry| date= 2005| publisher= New Age Publishers| isbn= 81-224-1512-1}}</ref> |
||
| title=Comprehensive Inorganic Chemistry |
|||
| last=Chandra | first=Sulekh |
|||
| publisher=New Age Publishers | isbn=8122415121 }}</ref> |
|||
Suatu molekul dapat [[homonuklir]], yaitu, mengandung atom-atom dari satu [[unsur kimia]], misalnya [[oksigen]] (O<sub>2</sub>); atau dapat pula berupa [[heteronuklir]], suatu [[senyawa kimia]] yang tersusun dari lebih dari satu unsur, misalnya [[air]] (H<sub>2</sub>O). Atom dan kompleks yang terhubung melalui [[ikatan non kovalen]], seperti [[ikatan hidrogen]] atau [[ikatan ionik]], umumnya dianggap sebagai molekul tunggal.<ref>{{cite encyclopedia|title= Molecule|encyclopedia=[[Encyclopædia Britannica]]|date =22 January 2016|url=http://global.britannica.com/science/molecule|access-date=23 February 2016}}</ref> |
|||
Molekul sebagai komponen materi jamak terdapat dalam zat organik (dan biokimia tentunya). Mereka menyusun sebagian besar samudera dan atmosfer. Namun, mayoritas zat padat yang kita kenal di Bumi, termasuk sebagian besar mineral yang membentuk [[Kerak bumi|kerak]], [[Mantel bumi|mantel]], dan [[Struktur bumi|inti bumi]], mengandung banyak ikatan kimia, tetapi ''tidak'' tersusun dari molekul yang dapat diidentifikasi. Selain itu, tidak ada molekul yang khas yang dapat didefinisikan sebagai [[kristal ionik]] ([[garam]]) dan kristal kovalen ([[padatan jaringan kovalen]], ''network solid''), meskipun ini sering tersusun dari [[sel unit]] yang berulang sehingga membentuk [[Bidang (geometri)|bidang]] (seperti dalam [[grafena]]) atau tiga dimensi (seperti [[intan]], [[kuarsa]], atau [[natrium klorida]]). Tema struktur sel unit yang berulang juga berlaku untuk sebagian besar fase paling padat dengan [[ikatan logam]], yang artinya bahwa logam padat juga tidak terbuat dari molekul. Dalam [[kaca]] (zat padat yang berada dalam keadaan vitreous tak teratur), atom-atom juga dapat disatukan oleh ikatan kimia tanpa adanya molekul definitif apapun, maupun tanpa adanya keterulangan unit yang teratur seperti pada kristal. |
|||
== Ilmu molekuler == |
|||
Ilmu yang mempelajari molekul disebut ''kimia molekuler'' ataupun ''fisika molekuler'' bergantung pada fokus kajiannya. Kimia molekuler berkutat pada hukum-hukum yang mengatur interaksi antara molekul, manakala fisika molekuler berkutat pada hukum-hukum yang mengatur struktur dan sifat-sifat molekul. Dalam prakteknya, perbedaan kedua ilmu tersebut tidaklah jelas dan saling bertumpang tindih. Dalam ilmu molekuler, sebuah molekul terdiri dari suatu sistem stabil yang terdiri dari dua atau lebih molekul. [[Ion poliatomik]] dapat pula kadang-kadang dianggap sebagai molekul yang bermuatan. Istilah ''molekul tak stabil'' digunakan untuk merujuk pada spesi-spesi kimia yang sangat reaktif. |
|||
lebih lanjut tentang molekul |
|||
== |
== Sains molekular == |
||
Walaupun keberadaan molekul telah diterima oleh banyak kimiawan sejak awal abad ke-19, terdapat beberapa pertentangan di antara para fisikawan seperti [[Ernst Mach|Mach]], [[Ludwig Boltzmann|Boltzmann]], [[James Clerk Maxwell|Maxwell]], dan [[Willard Gibbs|Gibbs]], yang memandang molekul hanyalah sebagai sebuah konsepsi matematis. Karya [[Jean Perrin|Perrin]] pada gerak Brown (1911) dianggap sebagai bukti akhir yang meyakinkan para ilmuwan akan keberadaan molekul. |
|||
Sains molekul disebut ''kimia molekular'' atau ''[[fisika molekular]]'', tergantung fokusnya apakah fokus pada kimia atau fisika. Kimia molekular berurusan dengan hukum-hukum yang mengatur interaksi antara molekul yang menghasilkan pembentukan dan pemecahan [[ikatan kimia]], sementara fisika molekular berurusan dengan hukum-hukum yang mengatur struktur dan sifat-sifatnya. Namun pada prakteknya, perbedaan ini tidak tegas. Dalam sains molekular, suatu molekul terdiri dari suatu sistem stabil ({{Ill|keadaan ikatan|en|bound state}} yang tersusun dari dua atau lebih [[atom]]. [[Ion poliatomik]] kadang-kadang dapat dianggap sebagai molekul bermuatan listrik. Istilah ''molekul tak stabil'' digunakan untuk molekul yang sangat [[Deret reaktivitas|reaktif]], yaitu pemasangan jangka pendek ([[Resonansi (kimia)|resonansi]]) elektron dan [[inti atom]], seperti [[Radikal bebas|radikal]], [[Ion|ion-ion]] molekul, [[molekul Rydberg]], [[keadaan transisi]], [[Gaya van der Waals|kompleks van der Waals]], atau sistem dari tumbukan atom seperti [[kondensat Bose–Einstein]]. |
|||
Definisi molekul pula telah berubah seiring dengan berkembangnya pengetahuan atas struktur molekul. Definisi paling awal mendefinisikan molekul sebagai [[partikel]] terkecil [[bahan kimia|bahan-bahan kimia]] yang masih mempertahankan komposisi dan sifat-sifat kimiawinya.<ref>[http://antoine.frostburg.edu/chem/senese/101/glossary/m.shtml#molecule Molecule Definition] (Frostburg State University)</ref> Definisi ini sering kali tidak dapat diterapkan karena banyak bahan materi seperti [[bebatuan]], [[garam (kimia)|garam]], dan [[logam]] tersusun atas jaringan-jaringan atom dan [[ion]] yang terikat secara kimiawi dan tidak tersusun atas molekul-molekul diskret. |
|||
== Sejarah dan etimologi == |
|||
{{Main|Sejarah teori molekul}} |
|||
Menurut [[Merriam-Webster]] dan [[Online Etymology Dictionary]], istilah "''molecule''" diturunkan dari the [[bahasa Latin]] "[[mol]]es" atau unit kecil massa. |
|||
* '''Molecule''' (1794) – "partikel yang teramat halus", dari bahasa Prancis ''{{linktext-en|molécule}}'' (1678), dari bahasa [[Neo-Latin]] ''{{linktext-en|molecula}}'', kecil dari bahasa Latin ''{{linktext-en|moles}}'' "massa, penghalang". Awal maknanya samar-samar; mode kata (digunakan sampai akhir abad 18 hanya dalam bentuk Latin) dapat ditelusuri ke filsafat [[René Descartes|Descartes]].<ref>{{OEtymD|molecule|accessdate=2016-02-22}}</ref><ref>{{cite web|title=molecule|url=http://www.merriam-webster.com/dictionary/molecule|publisher=Merriam-Webster|accessdate=22 February 2016|archive-date=2021-02-24|archive-url=https://web.archive.org/web/20210224223305/https://www.merriam-webster.com/dictionary/molecule|dead-url=no}}</ref> |
|||
Definisi molekul telah berkembang seiring peningkatan pengetahuan tentang struktur molekul. Definisi sebelumnya kurang tepat, mendefinisikan molekul sebagai "[[Daftar partikel|partikel]] terkecil dari [[zat kimia]] murni yang masih mempertahankan [[Senyawa kimia|komposisi]] dan sifat kimianya".<ref>[http://antoine.frostburg.edu/chem/senese/101/glossary/m.shtml#molecule Molecule Definition] {{Webarchive|url=https://web.archive.org/web/20141013143129/http://antoine.frostburg.edu/chem/senese/101/glossary/m.shtml#molecule |date=2014-10-13 }} ([[Frostburg State University]])</ref> Definisi ini sering terpatahkan karena banyak zat dalam kehidupan sehari-hari, seperti [[batu]]an, [[Garam (kimia)|garam]], dan [[logam]], terdiri dari jaringan kristal besar dari atom atau ion yang [[Ikatan kimia|berikatan secara kimia]], tetapi tidak terbuat dari molekul diskrit. |
|||
{{clear}} |
|||
== Ikatan == |
|||
Molekul disatukan oleh [[ikatan kovalen]] atau [[Ikatan ionik|ikatan ion]]. Beberapa jenis unsur nonlogam hanya ada sebagai molekul di lingkungan. Sebagai contoh, hidrogen hanya ada sebagai molekul hidrogen. Sebuah molekul senyawa terbuat dari dua unsur atau lebih.<ref>{{cite web|title=The Hutchinson unabridged encyclopedia with atlas and weather guide|url=http://worldcat.org/title/hutchinson-unabridged-encyclopedia-with-atlas-and-weather-guide/oclc/696918830|website=worldcat.org|publisher=Oxford, England|accessdate=28 February 2016|archive-date=2020-01-26|archive-url=https://web.archive.org/web/20200126124400/https://www.worldcat.org/title/hutchinson-unabridged-encyclopedia-with-atlas-and-weather-guide/oclc/696918830|dead-url=no}}</ref> |
|||
=== Kovalen === |
|||
{{main|Ikatan kovalen}} |
|||
[[Berkas:Covalent bond hydrogen.svg|jmpl|ka|Pembentukan ikatan kovalen H<sub>2</sub> (kanan) di mana dua [[atom hidrogen]] berbagi dua elektron.]] |
|||
Ikatan kovalen adalah [[ikatan kimia]] yang melibatkan pembagian [[pasangan elektron]] di antara [[atom]]. Pasangan elektron ini disebut ''pasangan bersama'' atau ''pasangan ikatan'', dan keseimbangan stabil dari gaya tarik dan tolak antar atom, ketika mereka berbagi elektron hal itu disebut ''ikatan kovalen''.<ref>{{cite book| author2= Brad Williamson; Robin J. Heyden| last= Campbell| first= Neil A.| title= Biology: Exploring Life| url= http://www.phschool.com/el_marketing.html| accessdate= 2012-02-05| year= 2006| publisher= Pearson Prentice Hall| location= Boston, Massachusetts| isbn= 0-13-250882-6| archive-date= 2014-11-02| archive-url= https://web.archive.org/web/20141102041816/http://www.phschool.com/el_marketing.html| dead-url= no}}</ref> |
|||
=== Ionik === |
|||
{{main|Ikatan ionik}} |
|||
[[Berkas:NaF.gif|jmpl|kiri|[[Natrium]] dan [[fluor]] yang sedang mengalami reaksi redoks membentuk [[natrium fluorida]]. Natrium kehilangan [[elektron]] terluarnya untuk memperoleh [[konfigurasi elektron]] stabilnya, dan elektron ini memasuki atom fluor secara [[Eksotermik|eksotermal]].]] |
|||
Ikatan ionik adalah sejenis [[ikatan kimia]] yang melibatkan daya tarik [[elektrostatik]] antara ion dengan muatan berlawanan, dan merupakan interaksi utama yang terjadi pada [[senyawa ionik]]. Ion adalah atom yang telah kehilangan satu atau lebih [[elektron]] (disebut [[kation]]) dan atom yang telah mendapatkan satu atau lebih elektron (disebut [[anion]]).<ref>{{Cite book|url=https://books.google.com/books?id=6VdROgeQ5M8C&pg=PA7&dq=ionic+bonding+-wikipedia&hl=en&sa=X&ved=0ahUKEwi34bOG_6nTAhVnl1QKHRLZBeoQ6AEILTAC#v=onepage&q=ionic%20bonding%20-wikipedia&f=false|title=Elements of Metallurgy and Engineering Alloys|last=Campbell|first=Flake C.|date=2008-01-01|publisher=ASM International|isbn=9781615030583|language=en}}</ref> Transfer elektron ini disebut ''elektrovalensi'' yang merupakan lawan dari [[Ikatan kovalen|kovalensi]]. Dalam kasus yang paling sederhana, kation adalah atom [[logam]] dan anion adalah atom [[nonlogam]], tetapi ion ini bisa menjadi lebih rumit, misalnya, ion molekuler seperti {{Chem|NH|4|+}} atau {{Chem|SO|4|2−}}. Sederhananya, ikatan ionik adalah transfer elektron dari logam ke nonlogam agar kedua atom mendapatkan kelopak valensi yang terisi penuh. |
|||
== Ukuran molekul == |
== Ukuran molekul == |
||
Kebanyakan molekul |
Kebanyakan molekul terlalu kecil untuk dilihat dengan mata telanjang, tapi terdapat pengecualian. [[DNA]], sebuah [[makromolekul]], dapat mencapai ukuran [[skala makroskopis|makroskopis]], seperti kebanyakan molekul [[polimer]]. Molekul yang biasa digunakan sebagai blok pembangun untuk sintesis organik memiliki dimensi beberapa [[angstrom]] (Å) sampai beberapa ratus Å, atau sekitar seper satu miliar meter. Molekul tunggal biasanya tidak dapat diamati oleh [[cahaya]] (seperti disebutkan di atas), tetapi molekul kecil dan bahkan kerangka atom dapat ditelusuri dalam beberapa keadaan dengan menggunakan [[mikroskop gaya atom]]. Beberapa molekul terbesar adalah [[makromolekul]] atau [[supermolekul]]. |
||
''Jari-jari molekul efektif'' merupakan ukuran molekul yang terpantau dalam larutan.<ref>{{cite journal |
|||
Molekul terkecil adalah hidrogen [[Molekul diatomik|diatomik]] (H<sub>2</sub>), dengan panjang ikatan 0,74 Å.<ref>{{cite book| author= Roger L. DeKock |author2=Harry B. Gray|author3=Harry B. Gray| title= Chemical structure and bonding| url= https://books.google.com/?id=q77rPHP5fWMC&pg=PA199| date= 1989| publisher= University Science Books| isbn= 0-935702-61-X| page= 199}}</ref> |
|||
|author=Chang RL, Deen WM, Robertson CR, Brenner BM. |
|||
Jari-jari molekul yang efektif adalah ukuran yang ditunjukkan molekul dalam larutan.<ref>{{cite journal |
|||
|author=Chang RL |author2=Deen WM |author3=Robertson CR |author4=Brenner BM. |
|||
|title=Permselectivity of the glomerular capillary wall: III. Restricted transport of polyanions |
|title=Permselectivity of the glomerular capillary wall: III. Restricted transport of polyanions |
||
|journal=Kidney Int. |
|journal=Kidney Int. |
||
|volume=8 |
|volume=8 |
||
|issue=4 |
|issue=4 |
||
|pages= |
|pages=212–218 |
||
|year=1975 |
|year=1975 |
||
|month=Oct |
|||
|pmid=1202253 |
|pmid=1202253 |
||
|doi= |
|doi=10.1038/ki.1975.104 |
||
}}</ref><ref>{{cite journal |
|||
|url= |
|||
|author=Chang RL |author2=Ueki IF |author3=Troy JL |author4=Deen WM |author5=Robertson CR |author6=Brenner BM. |
|||
}}</ref><ref>{{cite journal |
|||
|author=Chang RL, Ueki IF, Troy JL, Deen WM, Robertson CR, Brenner BM. |
|||
|title=Permselectivity of the glomerular capillary wall to macromolecules. II. Experimental studies in rats using neutral dextran |
|title=Permselectivity of the glomerular capillary wall to macromolecules. II. Experimental studies in rats using neutral dextran |
||
|journal=Biophys J. |
|journal=Biophys J. |
||
|volume=15 |
|volume=15 |
||
|issue=9 |
|issue=9 |
||
|pages= |
|pages=887–906 |
||
|year=1975 |
|year=1975 |
||
|month=Sept |
|||
|pmid=1182263 |
|pmid=1182263 |
||
|doi=10.1016/S0006-3495(75)85863-2 |
|||
|doi= |
|||
|pmc=1334749 |
|||
|url= |
|||
|bibcode= 1975BpJ....15..887C}}</ref> {{Ill|Tabel permselektivitas berbagai zat|en|Table of permselectivity for different substances}} berisi contoh-contoh ini. |
|||
}}</ref> |
|||
== Rumus molekul == |
== Rumus molekul == |
||
[[Rumus empiris]] sebuah senyawa menunjukkan nilai perbandingan paling sederhana [[unsur|unsur-unsur]] penyusun senyawa tersebut. Sebagai contohnya, [[air]] selalu memiliki nilai perbandingan atom [[hidrogen]] berbanding [[oksigen]] 2:1. [[Etanol]] pula selalu memiliki nilai perbandingan antara [[karbon]], [[hidrogen]], dan [[oksigen]] 2:6:1. Namun, rumus ini tidak menunjukkan bentuk ataupun susunan atom dalam molekul tersebut. Contohnya, dimetil eter juga memiliki nilai perbandingan yang sama dengan etanol. Molekul dengan jumlah [[atom]] penyusun yang sama namun berbeda susunannya disebut sebagai [[isomer]]. |
|||
=== Jenis rumus kimia === |
|||
Perlu diperhatikan bahwa rumus empiris hanya memberikan nilai perbandingan atom-atom penyusun suatu molekul dan tidak memberikan nilai jumlah atom yang sebenarnya. [[Rumus molekul]] menggambarkan jumlah atom penyusun molekul secara tepat. Contohnya, [[asetilena]] memiliki rumus molekuler C<sub>2</sub>H<sub>2</sub>, namun rumus empirisnya adalah CH. |
|||
{{Main|Rumus kimia}} |
|||
[[Rumus kimia]] untuk molekul menggunakan satu baris simbol [[unsur kimia]], angka, dan terkadang juga simbol lainnya, seperti tanda kurung, tanda hubung (''dash''), tanda kurung siku, dan tanda ''plus'' (+) dan ''minus'' (−). Ini terbatas pada satu baris tipografi simbol, yang mungkin mencakup subskrip dan superskrip. |
|||
Massa suatu molekul dapat dihitung dari rumus kimianya. Sering kali massa molekul diekspresikan dalam [[satuan massa atom]] yang setara dengan 1/12 massa atom karbon-12. |
|||
[[Rumus empiris]] senyawa adalah jenis rumus kimia yang sangat sederhana.<ref>{{Cite book|url=https://books.google.com/books?id=6wUmteTIc18C&pg=PA288&dq=empirical+formula&hl=en&sa=X&ved=0ahUKEwiv64bBh6rTAhUSwmMKHb3vB0IQ6AEIOjAF#v=onepage&q=empirical%20formula&f=false|title=The Practice of Chemistry|last=Wink|first=Donald J.|last2=Fetzer-Gislason|first2=Sharon|last3=McNicholas|first3=Sheila|date=2003-03-01|publisher=Macmillan|isbn=9780716748717|language=en}}</ref> Ini adalah [[Perbandingan|rasio]] [[bilangan bulat]] paling sederhana dari [[unsur kimia]] pembentuknya.<ref>{{Cite web|url=http://www.chemteam.info/Mole/EmpiricalFormula.html|title=ChemTeam: Empirical Formula|website=www.chemteam.info|access-date=2017-04-16|archive-date=2021-01-19|archive-url=https://web.archive.org/web/20210119114516/https://www.chemteam.info/Mole/EmpiricalFormula.html|dead-url=no}}</ref> Sebagai contoh, air selalu terdiri dari rasio 2:1 atom [[hidrogen]] terhadap atom [[oksigen]], dan etil [[alkohol]] atau [[etanol]] selalu terdiri dari [[karbon]], [[hidrogen]], dan [[oksigen]] dalam rasio 2:6:1. Namun, ini tidak menentukan jenis molekul secara unik–[[dimetil eter]] memiliki rasio yang sama seperti etanol, misalnya. Molekul dengan atom yang sama dalam susunan yang berbeda disebut [[isomer]]. Juga karbohidrat, misalnya, memiliki rasio yang sama (karbon:hidrogen:oksigen = 1:2:1) (dan dengan demikian rumus empiris yang sama) namun jumlah atom dalam molekulnya berbeda. |
|||
[[Rumus molekul]] mencerminkan jumlah atom yang tepat yang membentuk molekul dan mengkarakterisasi molekul yang berbeda. Namun isomer yang berbeda dapat memiliki komposisi atom yang sama saat menjadi molekul yang berbeda. |
|||
Rumus empiris sering kali sama dengan rumus molekul tapi tidak selalu. Sebagai contoh, molekul [[asetilena]] memiliki rumus molekul C<sub>2</sub>H<sub>2</sub>, tetapi rasio unsur yang paling sederhana adalah CH. |
|||
[[Massa Molekul Relatif|Massa molekul]] dapat dihitung dari [[rumus kimia]] dan dinyatakan dalam [[satuan massa atom]] konvensional sama dengan 1/12 massa atom karbon-12 ([[isotop]] <sup>12</sup>[[Karbon|C]]) netral. Untuk [[padatan jaringan]], istilah [[unit rumus]] digunakan dalam perhitungan [[stoikiometri]].{{clear}} |
|||
=== Rumus struktur === |
|||
{{Main|Rumus struktur}} |
|||
[[Berkas:Atisane3.png|jmpl|ka|400px|Representasi [[3 dimensi|3D]] (kiri dan tengah) dan [[Model geomertri 2D|2D]] (kanan) dari molekul [[terpenoid]] atisana.]] |
|||
Untuk molekul dengan struktur 3 dimensi yang rumit, terutama yang melibatkan atom yang terikat pada empat substituen yang berbeda, formula molekul sederhana atau bahkan [[rumus kimia]] semi-struktural mungkin tidak cukup untuk menentukan molekul secara lengkap. Dalam kasus ini, mungkin diperlukan jenis formula grafis yang disebut [[rumus struktur]]. Rumus struktur pada gilirannya dapat diwakili dengan nama kimia satu dimensi, tetapi [[tata nama kimia]] semacam itu membutuhkan banyak kata dan istilah yang bukan merupakan bagian dari rumus kimia. |
|||
== Geometri molekul == |
== Geometri molekul == |
||
{{Main|Geometri molekul}} |
|||
[[Berkas:Cyanostar STM.png|jmpl|kiri|lurus|Struktur dan citra [[Mikroskop penerowongan payaran|STM]] molekul [[dendrimer]] "sianostar".<ref>{{cite journal|doi=10.1039/C4CC03725A|pmid=25080328|title=Anion-induced dimerization of 5-fold symmetric cyanostars in 3D crystalline solids and 2D self-assembled crystals|journal=Chemical Communications|volume=50|issue=69|pages=9827–30|year=2014|last1=Hirsch|first1=Brandon E.|last2=Lee|first2=Semin|last3=Qiao|first3=Bo|last4=Chen|first4=Chun-Hsing|last5=McDonald|first5=Kevin P.|last6=Tait|first6=Steven L.|last7=Flood|first7=Amar H.}}</ref>]] |
|||
Molekul memiliki geometri yang berbentuk tetap dalam keadaan kesetimbangan. Panjang ikat dan sudut ikatan akan terus bergetar melalui gerak vibrasi dan rotasi. Rumus kimia dan struktur molekul merupakan dua faktor penting yang menentukan sifat-sifat suatu senyawa. Senyawa isomer memiliki rumus kimia yang sama, namun sifat-sifat yang berbeda oleh karena strukturnya yang berbeda. Stereoisomer adalah salah satu jenis isomer yang memiliki sifat fisika dan kimia yang sangat mirip namun aktivitas [[biokimia]] yang berbeda. |
|||
Molekul memiliki [[Kesetimbangan mekanika|kesetimbangan]] geometri—panjang dan sudut ikatan—tetap yang dengannya mereka terus berosilasi melalui gerak vibrasi dan rotasi. Bahan murni terdiri dari molekul dengan struktur geometris rata-rata yang sama. Rumus kimia dan struktur molekul adalah dua faktor penting yang menentukan sifat-sifatnya, terutama [[Deret reaktivitas|reaktivitasnya]]. [[Isomer]] berbagi rumus kimia tapi biasanya memiliki sifat yang sangat berbeda karena strukturnya yang berbeda. [[Stereoisomerisme|Stereoisomer]], jenis isomer tertentu, memiliki sifat fisiko-kimia yang sangat mirip dan pada saat bersamaan berbeda aktivitas [[biokimia]]nya. |
|||
== Lihat pula == |
|||
{{portalkimia}} |
|||
{{commonscat|Molecules}} |
|||
== Spektroskopi molekuler == |
|||
{{Main|Spektroskopi}} |
|||
[[Berkas:Dehydrogenation of H2TPP by STM.jpg|jmpl|upright=1.3|Hidrogen dapat dibebaskan dari molekul [[Tetrafenilporfirin|H<sub>2</sub>TPP]] dengan menerapkan tegangan berlebih ke ujung [[mikroskop penerowongan payaran]] (STM, a); penghilangan ini mengubah kurva arus-voltase (I-V) dari molekul TPP, yang diukur dengan menggunakan ujung STM yang sama, dari seperti [[dioda]] (kurva merah di b) menjadi seperti [[resistor]] (kurva hijau). Gambar (c) menunjukkan deretan molekul TPP, H<sub>2</sub>TPP dan TPP. Saat memindai gambar (d), kelebihan voltase diterapkan pada H<sub>2</sub>TPP pada titik hitam, yang secara langsung menghilangkan hidrogen, seperti yang ditunjukkan pada bagian bawah (d) dan gambar hasil pemindaian ulang (e). Manipulasi semacam itu bisa digunakan dalam [[Elektronika skala molekuler|elektronika molekul tunggal]].<ref>{{cite journal|doi=10.1038/srep08350|pmid=25666850|pmc=4322354|title=N and p type character of single molecule diodes|journal=Scientific Reports|volume=5|page=8350|year=2015|bibcode= 2015NatSR...5E8350Z|author1=Zoldan|first1=V. C.|last2=Faccio|first2=R|last3=Pasa|first3=A. A.}}</ref>]] |
|||
'''Spektroskopi molekuler''' berhubungan dengan respon ([[Spektrum frekuensi|spektrum]]) molekul yang berinteraksi dengan sinyal probing [[energi]] yang diketahui (atau [[frekuensi]], sesuai dengan [[Konstanta Planck|rumus Planck]]). Molekul memiliki tingkat energi terkuantisasi yang dapat dianalisis dengan mendeteksi pertukaran energi molekul melalui [[absorbansi]] atau [[Spektrum emisi|emisi]].<ref name="iupac2">{{GoldBookRef|title=Spectroscopy|file=S05848|accessdate=23 February 2016}}</ref> Spektroskopi umumnya tidak mengacu pada studi [[difraksi]] di mana partikel seperti [[neutron]], [[elektron]], atau [[sinar-X]] energi tinggi yang berinteraksi dengan susunan molekul reguler (seperti dalam kristal). |
|||
[[Spektroskopi rotasional|Spektroskopi gelombang mikro]] biasanya mengukur perubahan rotasi molekul, dan dapat digunakan untuk mengidentifikasi molekul di luar angkasa. [[Spektroskopi inframerah]] mengukur perubahan vibrasi molekul, termasuk ''stretching'', ''bending'' atau ''twisting''. Ini biasanya digunakan untuk mengidentifikasi jenis ikatan atau [[Gugus fungsional|gugus fungsi]] dalam molekul. Perubahan pengaturan elektron menghasilkan jalur penyerapan atau emisi pada sinar ultraviolet, sinar tampak atau [[inframerah dekat]], dan menghasilkan warna. Spektroskopi resonansi inti sebenarnya mengukur lingkungan inti tertentu dalam molekul, dan dapat digunakan untuk mengkarakterisasi jumlah atom dalam posisi yang berbeda dalam molekul. |
|||
== Aspek teoretis == |
|||
Studi tentang molekul melalui [[Fisika molekular|fisika molekuler]] dan [[Kimia teori|kimia teoretis]] sebagian besar didasarkan pada [[mekanika kuantum]] dan sangat penting untuk memahami [[ikatan kimia]]. Molekul yang paling sederhana adalah [[Kation dihidrogen|ion-molekul hidrogen]], {{Chem|H|2|+}}, dan yang paling sederhana dari semua ikatan kimia adalah [[Ikatan kovalen|ikatan satu elektron]]. {{Chem|H|2|+}} terdiri dari dua [[proton]] bermuatan positif dan satu [[elektron]] bermuatan negatif, yang berarti bahwa [[persamaan Schrödinger]] untuk sistem tersebut dapat dipecahkan lebih mudah karena kurangnya tolakan elektron–elektron. Seiring dengan kepesatan perkembangan komputer digital, solusi pendekatan untuk molekul yang lebih rumit menjadi mungkin dan merupakan salah satu aspek utama dari [[kimia komputasi]]. |
|||
Ketika mencoba untuk menentukan secara ketat apakah susunan atom ''cukup stabil'' untuk dianggap sebagai molekul, IUPAC menyarankan agar "sesuai dengan depresi pada [[permukaan energi potensial]] yang cukup dalam untuk membatasi setidaknya satu keadaan vibrasi".<ref name="iupac" /> Definisi ini tidak bergantung pada sifat interaksi antara atom, tetapi hanya pada kekuatan interaksi. Sebenarnya, ini termasuk spesies yang terikat lemah yang secara tradisional tidak dianggap sebagai molekul, seperti [[helium]] [[dimer]], [[Helium dimer|He<sub>2</sub>]], yang memiliki satu [[keadaan ikatan]] vibrasi<ref>{{cite journal |author=Anderson JB |title=Comment on "An exact quantum Monte Carlo calculation of the helium-helium intermolecular potential" [J. Chem. Phys. 115, 4546 (2001)] |journal=J Chem Phys |volume=120 |issue=20 |pages=9886–7 |date=May 2004 |pmid=15268005 |doi=10.1063/1.1704638 |bibcode= 2004JChPh.120.9886A}}</ref> dan terikat secara longgar sehingga hanya dapat diamati pada suhu yang sangat rendah. |
|||
''Stabil-tidaknya'' susunan atom untuk dianggap sebagai molekul secara inheren merupakan definisi operasional. Secara filosofis, oleh karena itu, sebuah molekul bukanlah entitas fundamental (sebaliknya, misalnya, terhadap [[partikel dasar]]); sebaliknya, konsep molekul adalah cara kimiawan untuk membuat pernyataan yang berguna tentang kekuatan interaksi skala atom di dunia yang kita amati.{{clear}} |
|||
== Lihat juga == |
|||
{{div col|colwidth=23em}} |
|||
* [[Atom]] |
* [[Atom]] |
||
* [[Polaritas (kimia)|Polaritas kimia]] |
|||
* [[Molekul diatomik]] |
|||
* [[Ikatan kovalen]] |
* [[Ikatan kovalen]] |
||
* [[Molekul diatomik]] |
|||
* [[Daftar senyawa kimia]] |
|||
* {{ill|Daftar molekul interstelar dan sirkumstelar|en|List of interstellar and circumstellar molecules}} |
|||
* {{ill|Perangkat lunak perancang molekul|en|Molecular design software}} |
|||
* [[Rekayasa molekul]] |
|||
* [[Geometri molekul]] |
|||
* {{ill|Hamiltonan molekul|en|Molecular Hamiltonian}} |
|||
* [[Ion poliatomik]] |
|||
* {{ill|Pemodelan molekul|en|Molecular modelling}} |
|||
* [[Orbital molekul]] |
|||
* [[Ikatan non kovalen]] |
|||
* {{ill|Sistem periodik molekul kecil|en|Periodic systems of small molecules}} |
|||
* [[Molekul kecil]] |
|||
* {{ill|Perbandingan perangkat lunak untuk pemodelan mekanika molekul|en|Comparison of software for molecular mechanics modeling}} |
|||
* [[Molekul van der Waals]] |
|||
* [[World Wide Molecular Matrix]] |
|||
{{div col end}} |
|||
{{Portal bar|Kimia|Fisika}} |
|||
== Referensi == |
== Referensi == |
||
{{ |
{{Reflist|30em}} |
||
== Pranala luar == |
== Pranala luar == |
||
<!--{{wikimedia|collapsible=true|c=Category:Molecules|voy=no|wikt=molecule|v=no|n=no|q=Molecule|s=no|b=no|species=no|d=Q11369}}--> |
|||
* [http://www.chm.bris.ac.uk/motm/motm.htm Molecule of the Month] - School of Chemistry, University of Bristol |
|||
* [http://www.chm.bris.ac.uk/motm/motm.htm Molecule of the Month{{snds}}School of Chemistry, University of Bristol] |
|||
[[Kategori:Molekul| ]] |
|||
[[Kategori:Kimia]] |
|||
{{Molecules detected in outer space}} |
|||
{{Link FA|lmo}} |
|||
{{Partikel}} |
|||
{{authority control}} |
|||
[[ |
[[Kategori:Molekul| ]] |
||
[[Kategori:Fisika molekuler| ]] |
|||
[[als:Molekül]] |
|||
[[ |
[[Kategori:Kimia]] |
||
[[ |
[[Kategori:Materi]] |
||
[[as:অণু]] |
|||
[[ast:Molécula]] |
|||
[[az:Molekul]] |
|||
[[bar:Molekui]] |
|||
[[bat-smg:Muolekolė]] |
|||
[[be:Малекула]] |
|||
[[be-x-old:Малекула]] |
|||
[[bg:Молекула]] |
|||
[[bn:অণু]] |
|||
[[br:Molekulenn]] |
|||
[[bs:Molekula]] |
|||
[[ca:Molècula]] |
|||
[[ceb:Molekula]] |
|||
[[ckb:گەرد]] |
|||
[[cs:Molekula]] |
|||
[[cy:Moleciwl]] |
|||
[[da:Molekyle]] |
|||
[[de:Molekül]] |
|||
[[dsb:Molekul]] |
|||
[[el:Μόριο]] |
|||
[[en:Molecule]] |
|||
[[eo:Molekulo]] |
|||
[[es:Molécula]] |
|||
[[et:Molekul]] |
|||
[[eu:Molekula]] |
|||
[[fa:مولکول]] |
|||
[[fi:Molekyyli]] |
|||
[[fiu-vro:Molõkul]] |
|||
[[fo:Mýl]] |
|||
[[fr:Molécule]] |
|||
[[fy:Molekule]] |
|||
[[ga:Móilín]] |
|||
[[gl:Molécula]] |
|||
[[he:מולקולה]] |
|||
[[hi:अणु]] |
|||
[[hr:Molekula]] |
|||
[[hsb:Molekul]] |
|||
[[hu:Molekula]] |
|||
[[ia:Molecula]] |
|||
[[io:Molekulo]] |
|||
[[is:Sameind]] |
|||
[[it:Molecola]] |
|||
[[ja:分子]] |
|||
[[jbo:xumsle]] |
|||
[[jv:Molekul]] |
|||
[[ka:მოლეკულა]] |
|||
[[kk:Молекула]] |
|||
[[kn:ಅಣು]] |
|||
[[ko:분자]] |
|||
[[ku:Molekul]] |
|||
[[la:Molecula]] |
|||
[[lmo:Mulecula]] |
|||
[[lt:Molekulė]] |
|||
[[lv:Molekula]] |
|||
[[mk:Молекул]] |
|||
[[ml:തന്മാത്ര (രസതന്ത്രം)]] |
|||
[[mn:Молекул]] |
|||
[[mr:रेणू]] |
|||
[[ms:Molekul]] |
|||
[[my:မော်လီကျူး]] |
|||
[[nds:Molekül]] |
|||
[[nl:Molecuul]] |
|||
[[nn:Molekyl]] |
|||
[[no:Molekyl]] |
|||
[[nov:Molekule]] |
|||
[[nrm:Molétchule]] |
|||
[[oc:Molecula]] |
|||
[[os:Молекулæ]] |
|||
[[pam:Molecule]] |
|||
[[pl:Cząsteczka]] |
|||
[[pms:Molécola]] |
|||
[[pnb:مالیکیول]] |
|||
[[pt:Molécula]] |
|||
[[qu:Iñuwa]] |
|||
[[ro:Moleculă]] |
|||
[[ru:Молекула]] |
|||
[[rue:Молекула]] |
|||
[[sh:Molekula]] |
|||
[[simple:Molecule]] |
|||
[[sk:Molekula]] |
|||
[[sl:Molekula]] |
|||
[[sq:Molekula]] |
|||
[[sr:Молекул]] |
|||
[[su:Molekul]] |
|||
[[sv:Molekyl]] |
|||
[[sw:Molekuli]] |
|||
[[ta:மூலக்கூறு]] |
|||
[[th:โมเลกุล]] |
|||
[[tk:Molekula]] |
|||
[[tl:Mulapik]] |
|||
[[tr:Molekül]] |
|||
[[tt:Молекула]] |
|||
[[ug:مولېكۇلا]] |
|||
[[uk:Молекула]] |
|||
[[ur:سالمہ]] |
|||
[[uz:Molekula]] |
|||
[[vi:Phân tử]] |
|||
[[war:Molekula]] |
|||
[[xal:Молекул]] |
|||
[[yi:מאלעקול]] |
|||
[[zh:分子]] |
|||
[[zh-classical:分子]] |
|||
[[zh-min-nan:Hun-chú]] |
|||
[[zh-yue:分子]] |
|||
Revisi terkini sejak 26 Agustus 2024 06.04


Molekul sederhananya adalah dua atau lebih atom yang saling terikat bersama dan diikat oleh ikatan kimia. Mereka merupakan gugusan yang secara elektris netral.[4][5][6][7][8] Molekul dibedakan dari ion berdasarkan ketiadaan muatan listrik. Namun, dalam fisika kuantum, kimia organik, dan biokimia, istilah molekul sering digunakan dengan agak longgar, juga digunakan untuk ion poliatomik.
Dalam teori kinetika gas, istilah molekul sering digunakan untuk partikel gas apapun tanpa memperdulikan komposisinya. Menurut definisi ini, atom gas mulia dianggap sebagai molekul sebagai molekul monoatomik.[9]
Suatu molekul dapat homonuklir, yaitu, mengandung atom-atom dari satu unsur kimia, misalnya oksigen (O2); atau dapat pula berupa heteronuklir, suatu senyawa kimia yang tersusun dari lebih dari satu unsur, misalnya air (H2O). Atom dan kompleks yang terhubung melalui ikatan non kovalen, seperti ikatan hidrogen atau ikatan ionik, umumnya dianggap sebagai molekul tunggal.[10]
Molekul sebagai komponen materi jamak terdapat dalam zat organik (dan biokimia tentunya). Mereka menyusun sebagian besar samudera dan atmosfer. Namun, mayoritas zat padat yang kita kenal di Bumi, termasuk sebagian besar mineral yang membentuk kerak, mantel, dan inti bumi, mengandung banyak ikatan kimia, tetapi tidak tersusun dari molekul yang dapat diidentifikasi. Selain itu, tidak ada molekul yang khas yang dapat didefinisikan sebagai kristal ionik (garam) dan kristal kovalen (padatan jaringan kovalen, network solid), meskipun ini sering tersusun dari sel unit yang berulang sehingga membentuk bidang (seperti dalam grafena) atau tiga dimensi (seperti intan, kuarsa, atau natrium klorida). Tema struktur sel unit yang berulang juga berlaku untuk sebagian besar fase paling padat dengan ikatan logam, yang artinya bahwa logam padat juga tidak terbuat dari molekul. Dalam kaca (zat padat yang berada dalam keadaan vitreous tak teratur), atom-atom juga dapat disatukan oleh ikatan kimia tanpa adanya molekul definitif apapun, maupun tanpa adanya keterulangan unit yang teratur seperti pada kristal.
Sains molekular
[sunting | sunting sumber]Sains molekul disebut kimia molekular atau fisika molekular, tergantung fokusnya apakah fokus pada kimia atau fisika. Kimia molekular berurusan dengan hukum-hukum yang mengatur interaksi antara molekul yang menghasilkan pembentukan dan pemecahan ikatan kimia, sementara fisika molekular berurusan dengan hukum-hukum yang mengatur struktur dan sifat-sifatnya. Namun pada prakteknya, perbedaan ini tidak tegas. Dalam sains molekular, suatu molekul terdiri dari suatu sistem stabil (keadaan ikatan yang tersusun dari dua atau lebih atom. Ion poliatomik kadang-kadang dapat dianggap sebagai molekul bermuatan listrik. Istilah molekul tak stabil digunakan untuk molekul yang sangat reaktif, yaitu pemasangan jangka pendek (resonansi) elektron dan inti atom, seperti radikal, ion-ion molekul, molekul Rydberg, keadaan transisi, kompleks van der Waals, atau sistem dari tumbukan atom seperti kondensat Bose–Einstein.
Sejarah dan etimologi
[sunting | sunting sumber]Menurut Merriam-Webster dan Online Etymology Dictionary, istilah "molecule" diturunkan dari the bahasa Latin "moles" atau unit kecil massa.
- Molecule (1794) – "partikel yang teramat halus", dari bahasa Prancis molécule (1678), dari bahasa Neo-Latin molecula, kecil dari bahasa Latin moles "massa, penghalang". Awal maknanya samar-samar; mode kata (digunakan sampai akhir abad 18 hanya dalam bentuk Latin) dapat ditelusuri ke filsafat Descartes.[11][12]
Definisi molekul telah berkembang seiring peningkatan pengetahuan tentang struktur molekul. Definisi sebelumnya kurang tepat, mendefinisikan molekul sebagai "partikel terkecil dari zat kimia murni yang masih mempertahankan komposisi dan sifat kimianya".[13] Definisi ini sering terpatahkan karena banyak zat dalam kehidupan sehari-hari, seperti batuan, garam, dan logam, terdiri dari jaringan kristal besar dari atom atau ion yang berikatan secara kimia, tetapi tidak terbuat dari molekul diskrit.
Ikatan
[sunting | sunting sumber]Molekul disatukan oleh ikatan kovalen atau ikatan ion. Beberapa jenis unsur nonlogam hanya ada sebagai molekul di lingkungan. Sebagai contoh, hidrogen hanya ada sebagai molekul hidrogen. Sebuah molekul senyawa terbuat dari dua unsur atau lebih.[14]
Kovalen
[sunting | sunting sumber]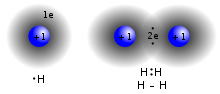
Ikatan kovalen adalah ikatan kimia yang melibatkan pembagian pasangan elektron di antara atom. Pasangan elektron ini disebut pasangan bersama atau pasangan ikatan, dan keseimbangan stabil dari gaya tarik dan tolak antar atom, ketika mereka berbagi elektron hal itu disebut ikatan kovalen.[15]
Ionik
[sunting | sunting sumber]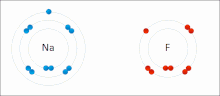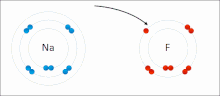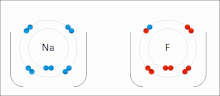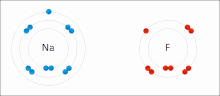
Ikatan ionik adalah sejenis ikatan kimia yang melibatkan daya tarik elektrostatik antara ion dengan muatan berlawanan, dan merupakan interaksi utama yang terjadi pada senyawa ionik. Ion adalah atom yang telah kehilangan satu atau lebih elektron (disebut kation) dan atom yang telah mendapatkan satu atau lebih elektron (disebut anion).[16] Transfer elektron ini disebut elektrovalensi yang merupakan lawan dari kovalensi. Dalam kasus yang paling sederhana, kation adalah atom logam dan anion adalah atom nonlogam, tetapi ion ini bisa menjadi lebih rumit, misalnya, ion molekuler seperti NH+4 atau SO2−4. Sederhananya, ikatan ionik adalah transfer elektron dari logam ke nonlogam agar kedua atom mendapatkan kelopak valensi yang terisi penuh.
Ukuran molekul
[sunting | sunting sumber]Kebanyakan molekul terlalu kecil untuk dilihat dengan mata telanjang, tapi terdapat pengecualian. DNA, sebuah makromolekul, dapat mencapai ukuran makroskopis, seperti kebanyakan molekul polimer. Molekul yang biasa digunakan sebagai blok pembangun untuk sintesis organik memiliki dimensi beberapa angstrom (Å) sampai beberapa ratus Å, atau sekitar seper satu miliar meter. Molekul tunggal biasanya tidak dapat diamati oleh cahaya (seperti disebutkan di atas), tetapi molekul kecil dan bahkan kerangka atom dapat ditelusuri dalam beberapa keadaan dengan menggunakan mikroskop gaya atom. Beberapa molekul terbesar adalah makromolekul atau supermolekul.
Molekul terkecil adalah hidrogen diatomik (H2), dengan panjang ikatan 0,74 Å.[17]
Jari-jari molekul yang efektif adalah ukuran yang ditunjukkan molekul dalam larutan.[18][19] Tabel permselektivitas berbagai zat berisi contoh-contoh ini.
Rumus molekul
[sunting | sunting sumber]Jenis rumus kimia
[sunting | sunting sumber]Rumus kimia untuk molekul menggunakan satu baris simbol unsur kimia, angka, dan terkadang juga simbol lainnya, seperti tanda kurung, tanda hubung (dash), tanda kurung siku, dan tanda plus (+) dan minus (−). Ini terbatas pada satu baris tipografi simbol, yang mungkin mencakup subskrip dan superskrip.
Rumus empiris senyawa adalah jenis rumus kimia yang sangat sederhana.[20] Ini adalah rasio bilangan bulat paling sederhana dari unsur kimia pembentuknya.[21] Sebagai contoh, air selalu terdiri dari rasio 2:1 atom hidrogen terhadap atom oksigen, dan etil alkohol atau etanol selalu terdiri dari karbon, hidrogen, dan oksigen dalam rasio 2:6:1. Namun, ini tidak menentukan jenis molekul secara unik–dimetil eter memiliki rasio yang sama seperti etanol, misalnya. Molekul dengan atom yang sama dalam susunan yang berbeda disebut isomer. Juga karbohidrat, misalnya, memiliki rasio yang sama (karbon:hidrogen:oksigen = 1:2:1) (dan dengan demikian rumus empiris yang sama) namun jumlah atom dalam molekulnya berbeda.
Rumus molekul mencerminkan jumlah atom yang tepat yang membentuk molekul dan mengkarakterisasi molekul yang berbeda. Namun isomer yang berbeda dapat memiliki komposisi atom yang sama saat menjadi molekul yang berbeda.
Rumus empiris sering kali sama dengan rumus molekul tapi tidak selalu. Sebagai contoh, molekul asetilena memiliki rumus molekul C2H2, tetapi rasio unsur yang paling sederhana adalah CH.
Massa molekul dapat dihitung dari rumus kimia dan dinyatakan dalam satuan massa atom konvensional sama dengan 1/12 massa atom karbon-12 (isotop 12C) netral. Untuk padatan jaringan, istilah unit rumus digunakan dalam perhitungan stoikiometri.
Rumus struktur
[sunting | sunting sumber]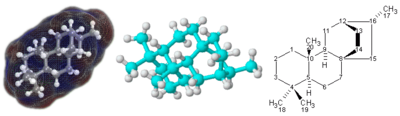
Untuk molekul dengan struktur 3 dimensi yang rumit, terutama yang melibatkan atom yang terikat pada empat substituen yang berbeda, formula molekul sederhana atau bahkan rumus kimia semi-struktural mungkin tidak cukup untuk menentukan molekul secara lengkap. Dalam kasus ini, mungkin diperlukan jenis formula grafis yang disebut rumus struktur. Rumus struktur pada gilirannya dapat diwakili dengan nama kimia satu dimensi, tetapi tata nama kimia semacam itu membutuhkan banyak kata dan istilah yang bukan merupakan bagian dari rumus kimia.
Geometri molekul
[sunting | sunting sumber]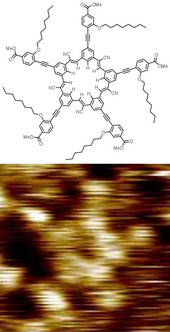
Molekul memiliki kesetimbangan geometri—panjang dan sudut ikatan—tetap yang dengannya mereka terus berosilasi melalui gerak vibrasi dan rotasi. Bahan murni terdiri dari molekul dengan struktur geometris rata-rata yang sama. Rumus kimia dan struktur molekul adalah dua faktor penting yang menentukan sifat-sifatnya, terutama reaktivitasnya. Isomer berbagi rumus kimia tapi biasanya memiliki sifat yang sangat berbeda karena strukturnya yang berbeda. Stereoisomer, jenis isomer tertentu, memiliki sifat fisiko-kimia yang sangat mirip dan pada saat bersamaan berbeda aktivitas biokimianya.
Spektroskopi molekuler
[sunting | sunting sumber]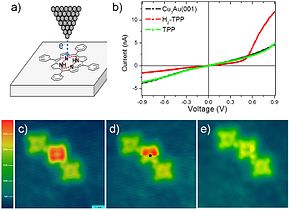
Spektroskopi molekuler berhubungan dengan respon (spektrum) molekul yang berinteraksi dengan sinyal probing energi yang diketahui (atau frekuensi, sesuai dengan rumus Planck). Molekul memiliki tingkat energi terkuantisasi yang dapat dianalisis dengan mendeteksi pertukaran energi molekul melalui absorbansi atau emisi.[24] Spektroskopi umumnya tidak mengacu pada studi difraksi di mana partikel seperti neutron, elektron, atau sinar-X energi tinggi yang berinteraksi dengan susunan molekul reguler (seperti dalam kristal).
Spektroskopi gelombang mikro biasanya mengukur perubahan rotasi molekul, dan dapat digunakan untuk mengidentifikasi molekul di luar angkasa. Spektroskopi inframerah mengukur perubahan vibrasi molekul, termasuk stretching, bending atau twisting. Ini biasanya digunakan untuk mengidentifikasi jenis ikatan atau gugus fungsi dalam molekul. Perubahan pengaturan elektron menghasilkan jalur penyerapan atau emisi pada sinar ultraviolet, sinar tampak atau inframerah dekat, dan menghasilkan warna. Spektroskopi resonansi inti sebenarnya mengukur lingkungan inti tertentu dalam molekul, dan dapat digunakan untuk mengkarakterisasi jumlah atom dalam posisi yang berbeda dalam molekul.
Aspek teoretis
[sunting | sunting sumber]Studi tentang molekul melalui fisika molekuler dan kimia teoretis sebagian besar didasarkan pada mekanika kuantum dan sangat penting untuk memahami ikatan kimia. Molekul yang paling sederhana adalah ion-molekul hidrogen, H+2, dan yang paling sederhana dari semua ikatan kimia adalah ikatan satu elektron. H+2 terdiri dari dua proton bermuatan positif dan satu elektron bermuatan negatif, yang berarti bahwa persamaan Schrödinger untuk sistem tersebut dapat dipecahkan lebih mudah karena kurangnya tolakan elektron–elektron. Seiring dengan kepesatan perkembangan komputer digital, solusi pendekatan untuk molekul yang lebih rumit menjadi mungkin dan merupakan salah satu aspek utama dari kimia komputasi.
Ketika mencoba untuk menentukan secara ketat apakah susunan atom cukup stabil untuk dianggap sebagai molekul, IUPAC menyarankan agar "sesuai dengan depresi pada permukaan energi potensial yang cukup dalam untuk membatasi setidaknya satu keadaan vibrasi".[4] Definisi ini tidak bergantung pada sifat interaksi antara atom, tetapi hanya pada kekuatan interaksi. Sebenarnya, ini termasuk spesies yang terikat lemah yang secara tradisional tidak dianggap sebagai molekul, seperti helium dimer, He2, yang memiliki satu keadaan ikatan vibrasi[25] dan terikat secara longgar sehingga hanya dapat diamati pada suhu yang sangat rendah.
Stabil-tidaknya susunan atom untuk dianggap sebagai molekul secara inheren merupakan definisi operasional. Secara filosofis, oleh karena itu, sebuah molekul bukanlah entitas fundamental (sebaliknya, misalnya, terhadap partikel dasar); sebaliknya, konsep molekul adalah cara kimiawan untuk membuat pernyataan yang berguna tentang kekuatan interaksi skala atom di dunia yang kita amati.
Lihat juga
[sunting | sunting sumber]- Atom
- Polaritas kimia
- Ikatan kovalen
- Molekul diatomik
- Daftar senyawa kimia
- Daftar molekul interstelar dan sirkumstelar
- Perangkat lunak perancang molekul
- Rekayasa molekul
- Geometri molekul
- Hamiltonan molekul
- Ion poliatomik
- Pemodelan molekul
- Orbital molekul
- Ikatan non kovalen
- Sistem periodik molekul kecil
- Molekul kecil
- Perbandingan perangkat lunak untuk pemodelan mekanika molekul
- Molekul van der Waals
- World Wide Molecular Matrix
Referensi
[sunting | sunting sumber]- ^ Iwata, Kota; Yamazaki, Shiro; Mutombo, Pingo; Hapala, Prokop; Ondráček, Martin; Jelínek, Pavel; Sugimoto, Yoshiaki (2015). "Chemical structure imaging of a single molecule by atomic force microscopy at room temperature". Nature Communications. 6: 7766. Bibcode:2015NatCo...6E7766I. doi:10.1038/ncomms8766. PMC 4518281
 . PMID 26178193.
. PMID 26178193.
- ^ Dinca, L. E.; De Marchi, F.; MacLeod, J. M.; Lipton-Duffin, J.; Gatti, R.; Ma, D.; Perepichka, D. F.; Rosei, F. (2015). "Pentacene on Ni(111): Room-temperature molecular packing and temperature-activated conversion to graphene". Nanoscale. 7 (7): 3263–9. Bibcode:2015Nanos...7.3263D. doi:10.1039/C4NR07057G. PMID 25619890.
- ^ Hapala, Prokop; Švec, Martin; Stetsovych, Oleksandr; Van Der Heijden, Nadine J.; Ondráček, Martin; Van Der Lit, Joost; Mutombo, Pingo; Swart, Ingmar; Jelínek, Pavel (2016). "Mapping the electrostatic force field of single molecules from high-resolution scanning probe images". Nature Communications. 7: 11560. Bibcode:2016NatCo...711560H. doi:10.1038/ncomms11560. PMC 4894979
 . PMID 27230940.
. PMID 27230940.
- ^ a b IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (2006–) "Molecule".
- ^ Ebbin, Darrell D. (1990). General Chemistry (edisi ke-3rd). Boston: Houghton Mifflin Co. ISBN 0-395-43302-9.
- ^ Brown, T.L.; Kenneth C. Kemp; Theodore L. Brown; Harold Eugene LeMay; Bruce Edward Bursten (2003). Chemistry–the Central Science (edisi ke-9th). New Jersey: Prentice Hall. ISBN 0-13-066997-0.
- ^ Chang, Raymond (1998). Chemistry (edisi ke-6th). New York: McGraw Hill. ISBN 0-07-115221-0.
- ^ Zumdahl, Steven S. (1997). Chemistry (edisi ke-4th). Boston: Houghton Mifflin. ISBN 0-669-41794-7.
- ^ Chandra, Sulekh (2005). Comprehensive Inorganic Chemistry. New Age Publishers. ISBN 81-224-1512-1.
- ^ "Molecule". Encyclopædia Britannica. 22 January 2016. Diakses tanggal 23 February 2016.
- ^ Harper, Douglas. "molecule". Online Etymology Dictionary. Diakses tanggal 2016-02-22.
- ^ "molecule". Merriam-Webster. Diarsipkan dari versi asli tanggal 2021-02-24. Diakses tanggal 22 February 2016.
- ^ Molecule Definition Diarsipkan 2014-10-13 di Wayback Machine. (Frostburg State University)
- ^ "The Hutchinson unabridged encyclopedia with atlas and weather guide". worldcat.org. Oxford, England. Diarsipkan dari versi asli tanggal 2020-01-26. Diakses tanggal 28 February 2016.
- ^ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 0-13-250882-6. Diarsipkan dari versi asli tanggal 2014-11-02. Diakses tanggal 2012-02-05.
- ^ Campbell, Flake C. (2008-01-01). Elements of Metallurgy and Engineering Alloys (dalam bahasa Inggris). ASM International. ISBN 9781615030583.
- ^ Roger L. DeKock; Harry B. Gray; Harry B. Gray (1989). Chemical structure and bonding. University Science Books. hlm. 199. ISBN 0-935702-61-X.
- ^ Chang RL; Deen WM; Robertson CR; Brenner BM. (1975). "Permselectivity of the glomerular capillary wall: III. Restricted transport of polyanions". Kidney Int. 8 (4): 212–218. doi:10.1038/ki.1975.104. PMID 1202253.
- ^ Chang RL; Ueki IF; Troy JL; Deen WM; Robertson CR; Brenner BM. (1975). "Permselectivity of the glomerular capillary wall to macromolecules. II. Experimental studies in rats using neutral dextran". Biophys J. 15 (9): 887–906. Bibcode:1975BpJ....15..887C. doi:10.1016/S0006-3495(75)85863-2. PMC 1334749
 . PMID 1182263.
. PMID 1182263.
- ^ Wink, Donald J.; Fetzer-Gislason, Sharon; McNicholas, Sheila (2003-03-01). The Practice of Chemistry (dalam bahasa Inggris). Macmillan. ISBN 9780716748717.
- ^ "ChemTeam: Empirical Formula". www.chemteam.info. Diarsipkan dari versi asli tanggal 2021-01-19. Diakses tanggal 2017-04-16.
- ^ Hirsch, Brandon E.; Lee, Semin; Qiao, Bo; Chen, Chun-Hsing; McDonald, Kevin P.; Tait, Steven L.; Flood, Amar H. (2014). "Anion-induced dimerization of 5-fold symmetric cyanostars in 3D crystalline solids and 2D self-assembled crystals". Chemical Communications. 50 (69): 9827–30. doi:10.1039/C4CC03725A. PMID 25080328.
- ^ Zoldan, V. C.; Faccio, R; Pasa, A. A. (2015). "N and p type character of single molecule diodes". Scientific Reports. 5: 8350. Bibcode:2015NatSR...5E8350Z. doi:10.1038/srep08350. PMC 4322354
 . PMID 25666850.
. PMID 25666850.
- ^ IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (2006–) "Spectroscopy".
- ^ Anderson JB (May 2004). "Comment on "An exact quantum Monte Carlo calculation of the helium-helium intermolecular potential" [J. Chem. Phys. 115, 4546 (2001)]". J Chem Phys. 120 (20): 9886–7. Bibcode:2004JChPh.120.9886A. doi:10.1063/1.1704638. PMID 15268005.

