Uranium: Perbedaan antara revisi
Mengubah tnda kutung supya bisa mndpt info lbh😆 Tag: Suntingan perangkat seluler Suntingan peramban seluler |
Reformat 1 URL (Wayback Medic 2.5)) #IABot (v2.0.9.5) (GreenC bot |
||
| (22 revisi perantara oleh 10 pengguna tidak ditampilkan) | |||
| Baris 1: | Baris 1: | ||
{{Tentang|unsur kimia}} |
|||
{{Kotak info uranium}} |
{{Kotak info uranium}} |
||
'''Uranium''' adalah sebuah [[unsur kimia]] dengan [[Lambang unsur|lambang]] '''U''' dan [[nomor atom]] 92. Ia merupakan [[logam]] berwarna abu-abu keperakan dalam [[aktinida|deret aktinida]] [[tabel periodik]]. Sebuah atom uranium memiliki 92 [[proton]] dan 92 [[elektron]], dimana 6 di antaranya adalah [[elektron valensi]]. Uranium [[peluruhan radioaktif|meluruh secara radioaktif]] dengan memancarkan sebuah [[partikel alfa]]. [[Waktu paruh]] peluruhan ini bervariasi antara 159.200 dan 4,5 miliar tahun untuk [[isotop uranium|isotop]] yang berbeda, menjadikannya berguna untuk menentukan [[usia Bumi]]. Isotop paling umum dalam [[uranium alam]]i adalah [[uranium-238]] (yang memiliki 146 [[neutron]] dan menyumbang lebih dari 99% uranium di Bumi) dan [[uranium-235]] (yang memiliki 143 neutron). Uranium memiliki [[Massa atom relatif|berat atom]] tertinggi dari unsur-unsur yang terjadi [[nuklida primordial|secara primordial]]. [[Massa jenis|Kepadatan]]nya sekitar 70% lebih tinggi dari [[timbal]], dan sedikit lebih rendah dari [[emas]] atau [[wolfram]]. Ia terjadi secara alami dalam konsentrasi rendah, yaitu beberapa [[Notasi bagian per#Bagian per juta|bagian per juta]] di tanah, batu dan air, dan ia [[penambangan uranium|diekstraksi]] secara komersial dari [[mineral]] yang mengandung uranium seperti [[uraninit]].<ref>{{cite web|title=Uranium |url=https://www.britannica.com/science/uranium |website=Encyclopaedia Britannica|access-date=12 Juni 2023}}</ref> |
|||
Banyak penggunaan uranium kontemporer mengeksploitasi sifat [[inti atom|nuklir]]nya yang unik. Uranium-235 adalah satu-satunya [[isotop]] [[bahan fisil|fisil]] alami, yang membuatnya banyak digunakan pada [[pembangkit listrik tenaga nuklir]] dan [[senjata nuklir]]. Namun, karena konsentrasi kecil yang ditemukan di alam, uranium perlu mengalami [[Pengayaan uranium|pengayaan]] agar uranium-235 dapat cukup. Uranium-238 dapat difisi oleh [[Suhu neutron#Cepat|neutron cepat]], dan ia bersifat [[bahan subur|subur]], artinya ia dapat [[transmutasi|ditransmutasikan]] menjadi [[plutonium-239]] yang fisil dalam [[reaktor nuklir]]. Isotop fisil lainnya, [[uranium-233]], dapat diproduksi dari [[torium]] alami dan dipelajari untuk penggunaan industri di masa depan dalam teknologi nuklir. Uranium-238 memiliki kemungkinan kecil untuk mengalami [[pembelahan spontan|fisi spontan]] atau bahkan fisi terinduksi dengan neutron cepat; uranium-235, dan pada tingkat yang lebih rendah uranium-233, memiliki penampang lintang fisi yang jauh lebih tinggi untuk [[Suhu neutron#Lambat|neutron lambat]]. Dalam konsentrasi yang cukup, isotop-isotop ini mempertahankan [[reaksi rantai nuklir]] yang berkelanjutan. Hal ini menghasilkan panas dalam reaktor tenaga nuklir, dan menghasilkan bahan fisil untuk senjata nuklir. [[Uranium terdeplesi]] (<sup>238</sup>U) digunakan dalam [[penetrator energi kinetik]] dan [[Perisai kendaraan|pelapisan pelindung]].{{sfn|Emsley|2001|p=479}}<ref name=Fink/> |
|||
Uranium yang dapat dijumpai secara alami adalah uranium-238 (99,2739–99,2752%), uranium-235 (0,7198–0,7202%), dan sekelumit [[uranium-234]] (0,0050–0,0059%). Uranium meluruh secara lambat dengan memancarkan [[partikel alfa]]. [[Umur paruh]] uranium-238 adalah sekitar 4,47 [[milyar]] tahun, sedangkan untuk uranium-235 adalah 704 [[juta]] tahun.<ref>{{cite web|url=http://ie.lbl.gov/toi/nucSearch.asp|title=WWW Table of Radioactive Isotopes}}</ref> Oleh sebab itu, uranium dapat digunakan untuk penentuan [[umur Bumi]]. |
|||
[[Penemuan unsur kimia|Penemuan]] uranium pada tahun 1789 dalam mineral [[uraninit]] dikreditkan pada [[Martin Heinrich Klaproth]], yang menamai unsur baru tersebut dengan nama planet [[Uranus]] yang saat itu baru ditemukan. [[Eugène-Melchior Péligot]] adalah orang pertama yang mengisolasi logam tersebut dan sifat radioaktifnya ditemukan pada tahun 1896 oleh [[Henri Becquerel]]. Penelitian yang dilakukan oleh [[Otto Hahn]], [[Lise Meitner]], [[Enrico Fermi]] dan lainnya, seperti [[Julius Robert Oppenheimer|J. Robert Oppenheimer]] mulai tahun 1934 menyebabkan penggunaannya mulai meningkat, seperti sebagai bahan bakar dalam industri [[tenaga nuklir]] dan ''[[Little Boy]]'', [[Serangan bom atom Hiroshima dan Nagasaki|senjata nuklir pertama yang digunakan dalam perang]]. [[Perlombaan senjata]] berikutnya selama [[Perang Dingin]] antara [[Amerika Serikat]] dan [[Uni Soviet]] menghasilkan puluhan ribu senjata nuklir yang menggunakan logam uranium dan [[plutonium-239]] yang diturunkan dari uranium. Pembongkaran senjata ini dan fasilitas nuklir terkait dilakukan dalam berbagai program [[pelucutan senjata nuklir]] dan menelan biaya miliaran dolar. Uranium tingkat senjata yang diperoleh dari senjata nuklir kemudian diencerkan dengan uranium-238 dan digunakan kembali sebagai bahan bakar reaktor nuklir. Pengembangan dan penyebaran [[reaktor nuklir]] ini berlanjut di basis global karena merupakan sumber energi bebas CO<sub>2</sub> yang kuat. [[Bahan bakar nuklir bekas]] membentuk [[limbah radioaktif]], yang sebagian besar terdiri dari uranium-238 dan menimbulkan ancaman kesehatan dan [[Uranium di lingkungan|dampak lingkungan]] yang signifikan. |
|||
[[Berkas:Little_boy.jpg|thumb|left|[[Little Boy]], bom atom yang dijatuhkan oleh [[Amerika Serikat]] di [[Hiroshima]], [[Jepang]] berhulu ledak uranium]] |
|||
==Karakteristik== |
|||
Uranium-235 merupakan satu-satunya isotop unsur kimia alami yang bersifat [[fisil]] (yakni dapat mempertahankan reaksi berantai pada fisi nuklir), sedangkan uranium-238 dapat dijadikan fisil menggunakan neutron cepat. Selain itu, uranium-238 juga dapat ditransmutasikan menjadi [[plutonium-239]] yang bersifat fisil dalam [[reaktor nuklir]]. Isotop uranium lainnya yang juga bersifat fisil adalah [[uranium-233]], yang dapat dihasilkan dari [[torium]]. |
|||
[[Berkas:Nuclear fission.svg|thumb|left|upright=0.7|Peristiwa fisi nuklir yang diinduksi oleh neutron yang melibatkan uranium-235|alt=Diagram yang menunjukkan transformasi rantai uranium-235 menjadi uranium-236 menjadi barium-141 dan kripton-92]] |
|||
Uranium adalah [[logam]] [[peluruhan radioaktif|radioaktif]] lemah berwarna putih keperakan. Ia memiliki [[Kekerasan unsur kimia (halaman data)|kekerasan Mohs]] sebesar 6, cukup untuk menggores kaca dan kira-kira setara dengan [[titanium]], [[rodium]], [[mangan]], dan [[niobium]]. Ia bersifat [[Keuletan (fisika)|lunak]], [[Keuletan (fisika)|ulet]], sedikit [[paramagnetisme|paramagnetik]], [[elektronegativitas|elektropositif]] kuat, dan merupakan [[resistivitas dan konduktivitas listrik|konduktor listrik]] yang buruk.<ref name="SciTechEncy" /><ref name="LANL">{{cite book |author=Hammond, C. R. |title=The Elements, in Handbook of Chemistry and Physics |edition=81 |publisher=CRC press |date=2000 |isbn=978-0-8493-0481-1 |url=http://www-d0.fnal.gov/hardware/cal/lvps_info/engineering/elements.pdf}}</ref> Logam uranium memiliki [[massa jenis|kepadatan]] yang sangat tinggi, yaitu 19,1 g/cm<sup>3</sup>,<ref>{{cite web|url=http://www.rsc.org/periodic-table/element/92/uranium|title=Uranium|publisher=Royal Society of Chemistry}}</ref> lebih padat dari [[timbal]] (11,3 g/cm<sup>3</sup>),<ref>{{cite web|url=http://www.rsc.org/periodic-table/element/82/lead|title=Lead|publisher=Royal Society of Chemistry}}</ref> tetapi sedikit kurang padat dibandingkan [[wolfram]] dan [[emas]] (19,3 g/cm<sup>3</sup>).<ref>{{cite web|url=http://www.rsc.org/periodic-table/element/74/tungsten|title=Tungsten|publisher=Royal Society of Chemistry}}</ref><ref>{{cite web|url=http://www.rsc.org/periodic-table/element/79/gold|title=Gold|publisher=Royal Society of Chemistry}}</ref> |
|||
Logam uranium bereaksi dengan hampir semua unsur nonlogam (kecuali [[gas mulia]]) dan [[senyawa kimia|senyawa]]nya, dengan reaktivitas yang meningkat seiring peningkatan suhu.<ref name="ColumbiaEncy">{{cite encyclopedia |title=uranium |encyclopedia=Columbia Electronic Encyclopedia|url=http://www.answers.com/uranium |publisher=Columbia University Press |edition=6 |access-date=12 Juni 2023|archive-date=27 Juli 2011|archive-url=https://web.archive.org/web/20110727194715/http://www.answers.com/uranium|url-status=dead}}</ref> [[Asam klorida]] dan [[asam nitrat|nitrat]] melarutkan uranium, tetapi asam nonoksidator selain asam klorida menyerang unsur tersebut dengan sangat lambat.<ref name="SciTechEncy" /> Saat dibelah halus, ia dapat bereaksi dengan air dingin; di udara, logam uranium akan terlapisi dengan lapisan gelap [[uranium oksida]].<ref name="LANL" /> Uranium dalam bijih diekstraksi secara kimiawi dan diubah menjadi [[uranium dioksida]] atau bentuk kimia lain yang dapat digunakan dalam industri. |
|||
== Lihat pula == |
|||
* [[Depleted uranium]] |
|||
* [[Teknik nuklir]] |
|||
* [[Putaran bahan bakar nuklir]] |
|||
* [[Fisika nuklir]] |
|||
* [[Reaktor nuklir]] |
|||
* [[Senjata nuklir]] |
|||
Uranium-235 adalah isotop pertama yang ditemukan bersifat [[bahan fisil|fisil]]. Isotop alami lainnya dapat difisi, tetapi tidak fisil. Saat dibombardir dengan neutron lambat, [[isotop]] uranium-235-nya sebagian besar akan terbagi menjadi dua [[inti atom|inti]] yang lebih kecil, melepaskan [[energi pengikatan]] inti dan lebih banyak neutron. Jika terlalu banyak neutron ini diserap oleh inti uranium-235 lainnya, [[reaksi rantai nuklir]] akan terjadi yang menghasilkan semburan panas atau (dalam keadaan khusus) ledakan. Dalam reaktor nuklir, reaksi rantai seperti itu diperlambat dan dikendalikan oleh [[racun neutron]], menyerap beberapa neutron bebas. Bahan penyerap neutron tersebut sering menjadi bagian dari [[Batang kendali (reaktor nuklir)|batang kendali]] reaktor (lihat [[fisika reaktor nuklir]] untuk penjelasan proses kendali reaktor ini). |
|||
== Referensi == |
|||
{{reflist}} |
|||
Sesedikit {{cvt|15|lb}} uranium-235 dapat digunakan untuk membuat bom atom.<ref name="EncyIntel">{{cite encyclopedia |encyclopedia=Encyclopedia of Espionage, Intelligence, and Security|publisher=The Gale Group, Inc. |title=uranium |url=http://www.answers.com/uranium|access-date=12 Juni 202e|archive-date=27 Juli 2011|archive-url=https://web.archive.org/web/20110727194715/http://www.answers.com/uranium|url-status=dead}}</ref> Senjata nuklir yang diledakkan di [[Hiroshima, Hiroshima|Hiroshima]], disebut ''[[Little Boy]]'', mengandalkan fisi uranium. Namun, bom nuklir pertama (''Gadget'' yang digunakan pada [[Trinity (uji coba nuklir)|Trinity]]) dan bom yang diledakkan di [[Nagasaki]] (''[[Fat Man]]'') adalah bom plutonium. |
|||
== Bibliografi == |
|||
* ''World Uranium Resources'', by Kenneth S. Deffeyes and Ian D. MacGregor, Scientific American, January, 1980, page 66. |
|||
Logam uranium memiliki tiga bentuk [[alotropi]]k:<ref>{{cite book |url=https://books.google.com/books?id=KWGu-LYMYjMC&pg=PA108 |page=108 |title=Applications of Texture Analysis |author=Rollett, A. D. |publisher=John Wiley and Sons |date=2008 |isbn=978-0-470-40835-3}}</ref> |
|||
== Pranala luar == |
|||
* α ([[sistem kristal ortorombus|ortorombus]]) stabil hingga suhu {{convert|668|C}}. Ortorombus, [[grup ruang]] No. 63, ''Cmcm'', [[Konstanta kisi|parameter kisi]] ''a'' = 285,4 pm, ''b'' = 587 pm, ''c'' = 495,5 pm.<ref name="Grenthe">{{cite book|last1=Grenthe |first1=Ingmar |first2=Janusz |last2=Drożdżyński |first3=Takeo |last3=Fujino |first4=Edgar C. |last4=Buck |author-link5=Thomas Albrecht-Schönzart |first5=Thomas E. |last5=Albrecht-Schmitt |first6=Stephen F. |last6=Wolf |contribution=Uranium |title=The Chemistry of the Actinide and Transactinide Elements |editor1-first=Lester R. |editor1-last=Morss |editor2-first=Norman M. |editor2-last=Edelstein |editor3-first=Jean |editor3-last=Fuger |edition=3 |date=2006 |volume=5 |publisher=Springer |location=Dordrecht, Belanda |pages=52–160 |url=http://radchem.nevada.edu/classes/rdch710/files/thorium.pdf |doi=10.1007/1-4020-3598-5_5 |url-status=dead |archive-url=https://web.archive.org/web/20160307160941/http://radchem.nevada.edu/classes/rdch710/files/Thorium.pdf |archive-date=7 Maret 2016 |isbn=978-1-4020-3555-5 }}</ref> |
|||
* [http://www.webelements.com/webelements/elements/text/U/index.html WebElements.com - Uranium] (also used as a reference) |
|||
* β ([[sistem kristal tetragon|tetragon]]) stabil dari {{convert|668|to|775|C}}. Tetragon, grup ruang ''P''4<sub>2</sub>/''mnm'', ''P''4<sub>2</sub>''nm'', atau ''P''4''n''2, parameter kisi ''a'' = 565,6 pm, ''b'' = ''c'' = 1075,9 pm.<ref name="Grenthe" /> |
|||
* [http://environmentalchemistry.com/yogi/periodic/U.html EnvironmentalChemistry.com - Uranium] (also used as a reference) |
|||
* γ ([[sistem kristal kubik|kubus berpusat-badan]]) dari {{convert|775|C}} hingga titik lebur—ini adalah keadaan yang paling lunak dan ulet. Kubus berpusat-badan, parameter kisi ''a'' = 352,4 pm.<ref name="Grenthe" /> |
|||
* [http://education.jlab.org/itselemental/ele092.html It's Elemental - Uranium] |
|||
==Aplikasi== |
|||
* [http://www.eia.doe.gov/fuelnuclear.html The US government provides lots of statistics and information relevant to the energy industry at ] |
|||
===Militer=== |
|||
* [http://www.neis.org/literature/Brochures/weapcon.htm Nuclear Power and Nuclear Weapons: Making the Connections] |
|||
[[Berkas:30mm DU slug.jpg|thumb|left|Berbagai militer menggunakan [[uranium terdeplesi]] sebagai penetrator kepadatan tinggi.|alt=Silinder logam mengilap dengan ujung runcing. Panjang keseluruhannya 9 cm dan diameternya sekitar 2 cm.]] |
|||
* [http://www.uic.com.au The Uranium Information Centre also has lots of information on uranium] |
|||
* [http://pearl1.lanl.gov/periodic/elements/92.html Los Alamos National Laboratory's Chemistry Division: Periodic Table - Uranium] |
|||
* [http://www.epa.gov/radiation/radionuclides/uranium.htm U.S. EPA: Radiation Information for Uranium] |
|||
Aplikasi utama uranium di sektor militer adalah penetrator kepadatan tinggi. Amunisi ini terdiri dari [[uranium terdeplesi]] (DU) yang dipadukan dengan 1–2% unsur lain, seperti [[titanium]] atau [[molibdenum]].<ref>{{cite web |url=http://www.gulflink.osd.mil/du_ii/du_ii_tabe.htm#TAB_E_Development_of_DU_Munitions|title=Development of DU Munitions |year=2000|work=Depleted Uranium in the Gulf (II)|publisher=Gulflink, official website of Force Health Protection & Readiness}}</ref> Pada kecepatan tumbukan tinggi, kerapatan, kekerasan, dan [[piroforik|piroforisitas]] proyektil memungkinkan penghancuran target lapis baja berat. Perisai tank dan [[perisai kendaraan]] yang bisa dilepas lainnya juga bisa dikeraskan dengan pelat uranium terdeplesi. Penggunaan uranium terdeplesi menjadi perdebatan politik dan lingkungan setelah penggunaan amunisi tersebut oleh AS, Inggris dan negara-negara lain selama perang di Teluk Persia dan Balkan menimbulkan pertanyaan mengenai senyawa uranium yang tersisa di tanah<ref name=Fink>Fink, Margit (11 Agustus 2005) [https://idw-online.de/de/news124118 "Metal of Dishonor" – munitions from depleted Uranium (DU) contaminates soils in crisis areas]. Bundesforschungsanstalt für Landwirtschaft</ref><ref>Schnug, E. dan Haneklaus, S. (2008) [https://kipdf.com/uran-umwelt-unbehagen-ewald-schnug-silvia-haneklaus_5aca4aa81723dd5ea58e6de9.html Uran – Umwelt – Unbehagen]. Institut für Pflanzenernährung und Bodenkunde</ref><ref>Fink, M. (2004) [https://idw-online.de/de/news84961 Uran – Umwelt – Unbehagen]. Bundesforschungsanstalt für Landwirtschaft</ref><ref>{{cite journal |vauthors=Brand RA, Schnug E |title=Depleted Uranium: a New Environmental Radiotoxological Pollutant |journal=FAL – Agric. Res. |volume=55 |issue=4 |pages=211–218 |year=2005 |url=https://www.researchgate.net/publication/279544142}}</ref> (lihat [[sindrom Perang Teluk]]).<ref name="EncyIntel" /> |
|||
{{clr}} |
|||
Uranium terdeplesi juga digunakan sebagai bahan pelindung pada beberapa wadah yang digunakan untuk menyimpan dan mengangkut bahan radioaktif. Meskipun logam itu sendiri bersifat radioaktif, kepadatannya yang tinggi membuatnya lebih efektif daripada [[timbal]] dalam menghentikan radiasi dari sumber yang kuat seperti [[radium]].<ref name="SciTechEncy" /> Kegunaan lain dari uranium terdeplesi meliputi penyeimbang untuk permukaan kontrol pesawat, sebagai pemberat untuk [[Proses penetrasi atmosfer|kendaraan ''re-entry'']] rudal, dan sebagai bahan pelindung.<ref name="LANL" /> Karena kepadatannya yang tinggi, bahan ini ditemukan dalam [[Sistem Navigasi Inersia|sistem navigasi inersia]] dan [[kompas]] [[giroskop]]is.<ref name="LANL" /> Uranium terdeplesi lebih disukai daripada logam padat serupa karena kemampuannya untuk mudah dikerjakan dan dicor serta biayanya yang relatif rendah.{{sfn|Emsley|2001|p=480}} Risiko utama paparan uranium terdeplesi adalah keracunan kimia dari [[uranium oksida]] dan bukan radioaktivitasnya (uranium hanya merupakan [[peluruhan alfa|pemancar alfa]] yang lemah). |
|||
{{Compact periodic table}} |
|||
{{kimia-stub}} |
|||
Selama tahap akhir [[Perang Dunia II]], seluruh [[Perang Dingin]], dan pada tingkat yang lebih rendah sesudahnya, uranium-235 telah digunakan sebagai bahan peledak fisil untuk memproduksi senjata nuklir. Awalnya, dua jenis bom fisi utama dibangun: perangkat yang relatif sederhana yang menggunakan uranium-235 dan mekanisme yang lebih rumit yang menggunakan [[plutonium-239]] yang berasal dari uranium-238. Kemudian, jenis bom fisi/fusi yang jauh lebih rumit dan jauh lebih kuat ([[senjata termonuklir]]) dibangun, yang menggunakan perangkat berbasis plutonium untuk menyebabkan campuran [[tritium]] dan [[deuterium]] mengalami [[fusi nuklir]]. Bom semacam itu dibungkus dalam kotak uranium nonfisil (tak diperkaya), dan mereka memperoleh lebih dari setengah kekuatan mereka dari fisi bahan ini oleh [[Suhu neutron#Cepat|neutron cepat]] dari proses fusi nuklir.<ref>{{cite web |
|||
|url=https://fas.org/nuke/intro/nuke/design.htm |
|||
|title=Nuclear Weapon Design |
|||
|publisher=Federation of American Scientists |
|||
|date=1998 |
|||
|access-date=12 Juni 2023 |
|||
|url-status=dead |
|||
|archive-url=https://web.archive.org/web/20081226091803/https://fas.org/nuke/intro/nuke/design.htm |
|||
|archive-date=26 Desember 2008 |
|||
}}</ref> |
|||
===Sipil=== |
|||
Penggunaan utama uranium di sektor sipil adalah sebagai bahan bakar [[pembangkit listrik tenaga nuklir]]. Satu kilogram uranium-235 secara teoretis dapat menghasilkan sekitar 20 [[Joule#Terajoule|terajoule]] energi (2{{e|13}} [[joule]]), dengan asumsi fisi sempurna; [[energi]] sebanyak 1,5 juta kilogram (1,500 [[ton metrik|ton]]) [[batu bara]].{{sfn|Emsley|2001|p=479}} |
|||
Pembangkit listrik [[tenaga nuklir]] komersial menggunakan bahan bakar yang biasanya diperkaya sekitar 3% uranium-235.{{sfn|Emsley|2001|p=479}} Desain [[Reaktor CANDU|CANDU]] dan [[Reaktor Magnox|Magnox]] adalah satu-satunya reaktor komersial yang mampu menggunakan bahan bakar uranium yang tak diperkaya. Bahan bakar yang digunakan untuk reaktor [[Angkatan Laut Amerika Serikat]] biasanya sangat diperkaya dengan [[uranium-235]] (nilai pastinya [[informasi rahasia|dirahasiakan]]). Dalam [[reaktor pembiak]], uranium-238 juga dapat diubah menjadi [[plutonium]] melalui reaksi berikut:<ref name="LANL" /> |
|||
:{{nuclide|link=yes|uranium|238}} + n {{Bigmath|→}} {{nuclide|link=yes|uranium|239}} + γ {{overunderset|{{Bigmath|→}}|β<sup>−</sup>| }} {{nuclide|link=yes|neptunium|239}} {{overunderset|{{Bigmath|→}}|β<sup>−</sup>| }} {{nuclide|link=yes|plutonium|239}} |
|||
[[Berkas:U glass with black light.jpg|thumb|right|Kaca uranium bersinar di bawah [[ultraungu|sinar UV]]|alt=Tempat kaca di atas dudukan kaca. Piringnya menyala hijau sementara dudukannya nirwarna.]] |
|||
Sebelum (dan, kadang-kadang, sesudah) penemuan radioaktivitas, uranium digunakan terutama dalam jumlah kecil untuk kaca kuning dan glasir tembikar, seperti [[kaca uranium]] dan di [[Fiesta (peralatan makan)|Fiestaware]].<ref>[http://www.hlchina.com/gmastatement.html "Statement regarding the ''Good Morning America'' broadcast," The Homer Laughlin China Co.] {{webarchive|url=https://web.archive.org/web/20120401000958/http://www.hlchina.com/gmastatement.html |date=1 April 2012 }}, 16 Maret 2011, Diakses tanggal 12 Juni 2023.</ref> |
|||
Penemuan dan isolasi [[radium]] dalam bijih uranium ([[uraninit]]) oleh [[Marie Curie]] memicu pengembangan penambangan uranium untuk mengekstraksi radium, yang digunakan untuk membuat cat berpendar dalam gelap untuk jam dan dial pesawat.<ref>{{cite web |url=https://www.newscientist.com/article/mg15520902.900-dial-r-for-radioactive.html |title=Dial R for radioactive – 12 July 1997 – New Scientist |publisher=Newscientist.com |access-date=12 Juni 2023}}</ref><ref>{{cite web |title=Uranium Mining |url=https://www.atomicheritage.org/history/uranium-mining |website=Atomic Heritage Foundation |publisher=Atomic Heritage Foundation |access-date=12 Juni 2023}}</ref> Pengekstrasian ini meninggalkan jumlah uranium yang luar biasa sebagai produk limbah, karena dibutuhkan tiga ton uranium untuk mengekstraksi satu gram radium. Produk limbah ini dialihkan ke industri kaca, membuat kaca uranium sangat murah dan melimpah. Selain glasir tembikar, glasir [[ubin uranium]] menyumbang sebagian besar penggunaan, termasuk ubin kamar mandi dan dapur umum yang dapat diproduksi dalam warna hijau, kuning, [[Senduduk (warna)|ungu pucat]], hitam, biru, merah, dan warna lainnya. |
|||
[[Berkas:Uranium ceramic - Flickr - Sencer Sarı.jpg|thumb|Glasir uranium pada keramik [[Sencer Sarı]] bersinar di bawah [[Ultraungu|sinar UV]].]] |
|||
[[Berkas:Vacuum capacitor with uranium glass.jpg|thumb|Kaca uranium digunakan sebagai segel timbal dalam [[kondensator|kapasitor]] vakum|alt=Sebuah silinder kaca ditutup pada kedua ujungnya dengan elektroda logam. Di dalam bola kaca terdapat silinder logam yang terhubung ke elektroda.]] |
|||
Uranium juga digunakan dalam bahan kimia [[fotografi]] (khususnya [[uranil nitrat|uranium nitrat]] sebagai [[tinta bubuk|toner]]),<ref name="LANL" /> dalam filamen lampu untuk lampu [[penerangan panggung]],<ref name="epa">{{cite web|url=http://www.epa.gov/superfund/health/contaminants/radiation/pdfs/Uranium%20Fact%20Sheet%20final.pdf|access-date=12 Juni 2023|title=EPA Facts about Uranium|publisher=U.S. Environmental Protection Agency|archive-date=2014-11-29|archive-url=https://web.archive.org/web/20141129061718/http://www.epa.gov/superfund/health/contaminants/radiation/pdfs/Uranium%20Fact%20Sheet%20final.pdf|dead-url=unfit}}</ref> untuk memperbaiki penampilan [[gigi palsu]],<ref>{{cite web |url=https://orau.org/health-physics-museum/collection/consumer/ceramics/uranium-containing-dentures.html |title=Uranium Containing Dentures (ca. 1960s, 1970s) |publisher=[[Oak Ridge Associated Universities]] |website=ORAU Museum of Radiation and Radioactivity |date=1999 |access-date=12 Juni 2023}}</ref> dan dalam industri kulit dan kayu untuk noda dan pewarna. Garam uranium adalah [[mordan]] dari sutra atau wol. Uranil asetat dan uranil format digunakan sebagai "noda" padat-elektron dalam [[mikroskop transmisi elektron]], untuk meningkatkan kontras spesimen biologis pada bagian ultratipis dan [[noda negatif|penodaan negatif]] [[virus]], [[organel|organel sel]] terisolasi, dan [[makromolekul]]. |
|||
Penemuan radioaktivitas uranium mengantarnya pada penggunaan ilmiah dan praktis tambahan. [[Waktu paruh]] yang panjang dari isotop uranium-238 (4,47{{e|9}} tahun) membuatnya sangat cocok untuk digunakan dalam memperkirakan usia [[batuan beku]] paling awal dan untuk jenis [[penanggalan radiometrik]] lainnya, meliputi [[penanggalan uranium–torium]], [[penanggalan uranium–timbal]], dan [[penanggalan uranium–uranium]]. Logam uranium dapat digunakan untuk target [[sinar-X]] dalam pembuatan sinar-X berenergi tinggi.<ref name="LANL" /> |
|||
==Sejarah== |
|||
===Penggunaan pra-penemuan=== |
|||
Penggunaan uranium dalam bentuk [[oksida]] alaminya dimulai setidaknya pada tahun 79 [[Era Umum|CE]], ketika ia digunakan di [[Kekaisaran Romawi]] untuk menambah warna kuning pada lapisan [[keramik]].<ref name="LANL" /> Kaca kuning dengan 1% uranium oksida ditemukan di sebuah vila Romawi di Tanjung [[Posillipo]] di [[Teluk Napoli]], Italia, oleh R. T. Gunther dari [[Universitas Oxford]] pada tahun 1912.{{sfn|Emsley|2001|p=482}} Dimulai pada akhir [[Abad Pertengahan]], bijih-bijih uranium diekstrak dari tambang perak [[Wangsa Habsburg|Habsburg]] di [[Jáchymov|Joachimsthal]], [[Bohemia]] (sekarang Jáchymov di [[Ceko|Republik Ceko]]), dan digunakan sebagai zat pewarna dalam industri pembuatan [[kaca]] lokal.{{sfn|Emsley|2001|p=477}} Pada awal abad ke-19, satu-satunya sumber bijih uranium yang diketahui di dunia adalah tambang ini. Penambangan uranium di [[Erzgebirge|Pegunungan Erz]] dihentikan di sisi [[Jerman]] setelah Perang Dingin berakhir dan [[Wismut (perusahaan)|SDAG Wismut]] ditutup. Di sisi Ceko ada upaya selama gelembung harga uranium tahun 2007 untuk memulai kembali penambangan, tetapi upaya itu dengan cepat ditinggalkan menyusul jatuhnya harga uranium.<ref>{{Cite web|url=https://www.praguepost.com/articles/2008/05/07/uran-stumbles-in-wooing-towns.php|title = Uran stumbles in wooing towns|date = 7 Mei 2008 |work=Prague Post |access-date=12 Juni 2023 |first=Victor |last=Velek}}</ref><ref>{{Cite web|url=https://www.praguepost.com/business/the-history-of-ore-uranium-mining-in-czechia|title = The History of Ore & Uranium Mining in Czechia|date = November 2017}}</ref> |
|||
===Penemuan=== |
|||
[[Berkas:Uranus as seen by NASA's Voyager 2.tif|thumb|left|upright|Planet [[Uranus]], asal nama uranium]] |
|||
[[Penemuan unsur kimia|Penemuan]] unsur ini dikreditkan pada ahli kimia Jerman [[Martin Heinrich Klaproth]]. Saat dia bekerja di laboratorium eksperimentalnya di [[Berlin]] pada tahun 1789, Klaproth mampu mengendapkan senyawa kuning (kemungkinan [[natrium diuranat]]) dengan melarutkan [[uraninit]] dalam [[asam nitrat]] dan menetralkan larutan itu dengan [[natrium hidroksida]].{{sfn|Emsley|2001|p=477}} Klaproth menganggap bahwa zat kuning itu adalah oksida dari unsur yang belum ditemukan dan memanaskannya dengan [[arang]] untuk mendapatkan bubuk hitam, yang menurutnya adalah logam yang baru ditemukan itu sendiri (sebenarnya, bubuk itu adalah sebuah oksida uranium).{{sfn|Emsley|2001|p=477}}<ref>{{cite journal |
|||
| title = Chemische Untersuchung des Uranits, einer neuentdeckten metallischen Substanz |
|||
| author = Klaproth, M. H. |
|||
| journal = Chemische Annalen |
|||
| volume = 2 |
|||
| date = 1789 |
|||
| pages = 387–403 |
|||
| author-link = Martin Heinrich Klaproth}}</ref> Dia menamai unsur yang baru ditemukan itu dari nama planet [[Uranus]] (dinamai dari [[Uranus (mitologi)|dewa langit Yunani]] purba), yang telah ditemukan delapan tahun sebelumnya oleh [[William Herschel]].<ref>{{cite encyclopedia|edition=4|title=Uranium|encyclopedia=The American Heritage Dictionary of the English Language |publisher=Houghton Mifflin Company|url=http://www.answers.com/uranium|access-date=12 Juni 2023|archive-date=27 Juli 2011 |archive-url=https://web.archive.org/web/20110727194715/http://www.answers.com/uranium|url-status=dead}}</ref> |
|||
Pada tahun 1841, [[Eugène-Melchior Péligot]], Profesor Kimia Analitik di [[Conservatoire national des arts et métiers|Conservatoire National des Arts et Métiers]] (Sekolah Pusat Seni dan Manufaktur) di [[Paris]], mengisolasi sampel pertama logam uranium dengan memanaskan [[Uranium(IV) klorida|uranium tetraklorida]] dengan [[kalium]].{{sfn|Emsley|2001|p=477}}<ref>{{cite journal| title=Recherches Sur L'Uranium |
|||
| author=Péligot, E.-M. |journal=[[Annales de chimie et de physique]] |
|||
| volume=5 |issue=5 |date=1842 |
|||
| pages=5–47 |url=http://gallica.bnf.fr/ark:/12148/bpt6k34746s/f4.table}}</ref> |
|||
[[Berkas:Becquerel plate.jpg|thumb|[[Henri Becquerel|Antoine Henri Becquerel]] menemukan fenomena [[peluruhan radioaktif|radioactivity]] radioaktivitas dengan memaparkan [[pelat fotografi]] ke uranium pada tahun 1896.|alt=Dua fitur hitam kabur pada latar belakang seperti kertas putih kabur. Terdapat tulisan tangan di bagian atas gambar.]] |
|||
[[Henri Becquerel]] menemukan [[peluruhan radioaktif|radioaktivitas]] dengan menggunakan uranium pada tahun 1896.<ref name="ColumbiaEncy" /> Becquerel membuat penemuan ini di Paris dengan meninggalkan sampel garam uranium, K<sub>2</sub>UO<sub>2</sub>(SO<Sub>4</sub>)<sub>2</sub> (kalium uranil sulfat), di atas [[pelat fotografi]] yang tidak terpapar di dalam laci dan mencatat bahwa pelat telah menjadi "berkabut".{{sfn|Emsley|2001|p=478}} Dia menentukan bahwa suatu bentuk cahaya atau sinar tak terlihat yang dipancarkan oleh uranium telah memapari pelat tersebut. |
|||
Selama Perang Dunia I ketika [[Blok Sentral]] kekurangan [[molibdenum]] untuk membuat laras senapan artileri dan baja perkakas berkecepatan tinggi, mereka secara rutin menggantinya dengan paduan [[ferouranium]] yang menghadirkan banyak karakteristik fisik yang sama. Ketika praktik ini dikenal pada tahun 1916, pemerintah A.S. meminta beberapa universitas terkemuka untuk meneliti penggunaan uranium ini dan alat yang dibuat menggunakan formula ini tetap digunakan selama beberapa dekade.<ref>{{cite web|url=https://books.google.com/books?id=-5c7AQAAMAAJ&q=ferrouranium+artillery&pg=PA367|title=The Electric Journal|date=10 April 1920|publisher=Westinghouse Club |via=Google Books}}</ref><ref>{{cite book |url=https://books.google.com/books?id=kfvBmuFOAiEC&pg=PA8 |title=Preparation of ferro-uranium |first1=Horace Wadsworth |last1=Gillett |first2=Edward Lawrence |last2=Mack |date=10 April 1917 |series=Techinical Paper 177 – U.S. Bureau of Mines |publisher=U.S. Govt. print. off. |via=Google Books}}</ref> Praktik ini berakhir ketika [[Proyek Manhattan]] dan [[Perang Dingin]] menempatkan permintaan besar pada uranium untuk penelitian fisi dan pengembangan senjata. |
|||
===Penelitian fisi=== |
|||
[[Berkas:UraniumCubesLarge.jpg|thumb|Kubus dan balok uranium yang diproduksi selama proyek Manhattan]] |
|||
Sebuah tim yang dipimpin oleh [[Enrico Fermi]] pada tahun 1934 mengamati bahwa pembombardiran uranium dengan neutron akan menghasilkan pancaran [[peluruhan beta|sinar beta]] ([[elektron]] atau [[positron]] dari unsur yang dihasilkan; lihat [[partikel beta]]).{{sfn|Seaborg|1968|p=773}} Produk fisi pada awalnya disalahartikan sebagai unsur baru dengan nomor atom 93 dan 94, yang oleh Dekan Fakultas Roma, Orso Mario Corbino, masing-masing diberi nama ''[[ausonium]]'' dan ''[[Hesperium (kimia)|hesperium]]''.<ref>{{cite web |
|||
|url = https://www.nobelprize.org/nobel_prizes/physics/laureates/1938/fermi-lecture.pdf |
|||
|last = Fermi |
|||
|first = Enrico |
|||
|date = 12 Desember 1938 |
|||
|title = Artificial radioactivity produced by neutron bombardment: Nobel Lecture |
|||
|publisher = Royal Swedish Academy of Sciences |
|||
|access-date = 13 Juni 2023 |
|||
|archive-url = https://web.archive.org/web/20180809111423/https://www.nobelprize.org/nobel_prizes/physics/laureates/1938/fermi-lecture.pdf |
|||
|archive-date = 9 Agustus 2018 |
|||
|url-status = dead |
|||
}}</ref><ref>{{cite journal |author=De Gregorio, A. |title=A Historical Note About How the Property was Discovered that Hydrogenated Substances Increase the Radioactivity Induced by Neutrons |date=2003 |pages=41–47 |volume=19 |journal=Nuovo Saggiatore |arxiv=physics/0309046 |bibcode=2003physics...9046D}}</ref><ref>{{cite web |author=Nigro, M. |title=Hahn, Meitner e la teoria della fissione |url=http://www.brera.unimi.it/SISFA/atti/2003/312-321NigroBari.pdf |date=2004 |access-date=13 Juni 2023 |archive-date=25 Maret 2009 |archive-url=https://web.archive.org/web/20090325120427/http://www.brera.unimi.it/SISFA/atti/2003/312-321NigroBari.pdf |url-status=dead}}</ref><ref>{{cite web| author=van der Krogt, Peter |url=http://elements.vanderkrogt.net/element.php?sym=Pu |title=Elementymology & Elements Multidict |access-date=13 Juni 2023}}</ref> Eksperimen yang mengarah pada penemuan kemampuan uranium untuk memfisi (membelah) menjadi unsur yang lebih ringan dan melepaskan [[energi pengikatan]] dilakukan oleh [[Otto Hahn]] dan [[Fritz Strassmann]]{{sfn|Seaborg|1968|p=773}} di laboratorium milik Hahn di Berlin. Pada Februari 1939, [[Lise Meitner]] dan keponakannya, fisikawan [[Otto Frisch|Otto Robert Frisch]], menerbitkan penjelasan fisika dan menamakan proses itu sebagai "[[fisi nuklir]]".<ref>{{cite journal |
|||
| title = Disintegration of Uranium by Neutrons: a New Type of Nuclear Reaction |
|||
| author1 = [[Lise Meitner|Meitner, L.]] |
|||
| author2 = [[Otto Frisch|Frisch, O.]] |
|||
| journal = [[Nature]] |
|||
| volume = 143 |
|||
| date = 1939 |
|||
| pages = 239–240 |
|||
| doi = 10.1038/224466a0 |
|||
| url = http://www.atomicarchive.com/Docs/Begin/Nature_Meitner.shtml |bibcode = 1969Natur.224..466M |
|||
| issue=5218| s2cid = 4188874 |
|||
}}</ref> Segera setelah itu, Fermi berhipotesis bahwa fisi uranium mungkin melepaskan cukup banyak neutron untuk mempertahankan reaksi fisi. Konfirmasi hipotesis ini datang pada tahun 1939, dan penelitian selanjutnya menemukan bahwa rata-rata sekitar 2,5 neutron dilepaskan oleh setiap fisi isotop uranium-235 yang langka.{{sfn|Seaborg|1968|p=773}} Fermi mendesak [[Alfred O. C. Nier]] untuk memisahkan isotop uranium untuk penentuan komponen fisil, dan pada 29 Februari 1940, Nier menggunakan instrumen yang dibuatnya di [[Universitas Minnesota]] untuk memisahkan sampel [[uranium-235]] pertama di dunia di Laboratorium Tate. Setelah dikirimkan ke [[siklotron]] [[Pupin Hall|Universitas Columbia]], [[John Ray Dunning|John Dunning]] memastikan bahwa sampel tersebut adalah bahan fisil yang diisolasi pada 1 Maret.<ref>{{cite web|title=Alfred O. C. Nier |url=https://www.aps.org/programs/outreach/history/historicsites/nier.cfm |website=www.aps.org|access-date=13 Juni 2023}}</ref> Pekerjaan lebih lanjut menemukan bahwa isotop uranium-238 yang jauh lebih umum dapat di[[transmutasi]]kan menjadi plutonium, yang, seperti uranium-235, juga dapat difisi oleh neutron termal. Penemuan ini menyebabkan banyak negara mulai mengerjakan pengembangan senjata nuklir dan [[tenaga nuklir]]. Meskipun fisi telah ditemukan di Jerman, ''[[Proyek senjata nuklir Jerman|Uranverein]]'' ("klub uranium") proyek masa perang Jerman untuk meneliti tenaga nuklir dan/atau senjata terhambat oleh sumber daya yang terbatas, pertikaian, pengasingan atau tidak terlibatnya beberapa ilmuwan terkemuka di lapangan dan beberapa kesalahan krusial seperti gagal memperhitungkan ketidakmurnian dalam sampel grafit yang tersedia yang membuatnya tampak kurang cocok sebagai [[moderator neutron]] daripada kenyataannya. Upaya Jerman untuk membangun reaktor [[air berat]]/[[uranium alam]]i belum mencapai titik kritis pada saat Amerika mencapai [[Haigerloch]], tempat percobaan reaktor perang terakhir Jerman.<ref>{{cite web|author=Manfred Popp |url=https://www.spektrum.de/news/hitlers-atombombe-warum-es-sie-nicht-gab/1423529 |title=Wissenschaftsgeschichte: Hitlers Atombombe – warum es sie nicht gab – Spektrum der Wissenschaft |publisher=Spektrum.de |date=21 September 2016 |accessdate=13 Juni 2023}}</ref> |
|||
Pada tanggal 2 Desember 1942, sebagai bagian dari [[Proyek Manhattan]], tim lain yang dipimpin oleh Enrico Fermi dapat memulai [[reaksi rantai nuklir]] swadaya buatan pertama, [[Chicago Pile-1]]. Rencana awal menggunakan uranium-235 yang diperkaya ditinggalkan karena ia belum tersedia dalam jumlah yang cukup.<ref>{{cite web |url=http://large.stanford.edu/courses/2013/ph241/masters1/ |title=Chicago Pile One|website=large.stanford.edu|access-date=13 Juni 2023}}</ref> Bekerja di laboratorium di bawah [[Lapangan Stagg]] di [[Universitas Chicago]], tim itu menciptakan kondisi yang diperlukan untuk reaksi semacam itu dengan menumpuk bersama 360 ton [[grafit]], 53 ton [[uranium oksida]], dan 5,5 ton logam uranium, yang mayoritas dipasok oleh [[Pabrik Lampu Westinghouse]] dalam proses produksi darurat.{{sfn|Seaborg|1968|p=773}}<ref>{{cite journal |last=Walsh |first=John |title=A Manhattan Project Postscript |journal=Science |date=19 Juni 1981 |volume=212 |pages=1369–1371 |bibcode=1981Sci...212.1369W |pmid=17746246 |url=http://pbadupws.nrc.gov/docs/ML0533/ML053340429.pdf |access-date=13 Juni 2023 |publisher=AAAS |doi=10.1126/science.212.4501.1369 |issue=4501}}</ref> |
|||
===Persenjataan nuklir=== |
|||
[[Berkas:Atomic cloud over Hiroshima - NARA 542192 - Edit.jpg|thumb|upright|[[Awan jamur]] di atas [[Hiroshima, Hiroshima|Hiroshima]] setelah dijatuhkannya bom atom berbasis uranium yang dijuluki '[[Little Boy]]'|alt=Pecahan putih awan asap seperti jamur merah yang berevolusi dari tanah.]] |
|||
Dua jenis bom atom utama dikembangkan oleh Amerika Serikat selama [[Perang Dunia II]]: perangkat berbasis uranium (nama kode "[[Little Boy]]") yang bahan fisilnya adalah [[uranium yang diperkaya]] tinggi, dan perangkat berbasis plutonium (lihat [[Trinity (uji coba nuklir)|uji Trinity]] dan "[[Fat Man]]") yang plutoniumnya berasal dari uranium-238. Perangkat Little Boy berbasis uranium menjadi senjata nuklir pertama yang digunakan dalam perang ketika ia diledakkan di atas kota [[Hiroshima, Hiroshima|Hiroshima]] di [[Jepang]] pada 6 Agustus 1945. Meledak dengan hasil setara dengan 12.500 ton [[trinitrotoluena|TNT]], ledakan dan gelombang termal dari bom tersebut menghancurkan hampir 50.000 bangunan dan menewaskan sekitar 75.000 orang (lihat [[Serangan bom atom Hiroshima dan Nagasaki]]).{{sfn|Emsley|2001|p=478}} Awalnya diyakini bahwa uranium relatif langka, dan [[proliferasi nuklir]] dapat dihindari hanya dengan membeli semua stok uranium yang diketahui, tetapi dalam satu dekade, deposit uranium besar ditemukan di banyak tempat di seluruh dunia.<ref>Helmreich, J.E. ''Gathering Rare Ores: The Diplomacy of Uranium Acquisition, 1943–1954'', Princeton UP, 1986: ch. 10 {{ISBN|0-7837-9349-9}}</ref><ref>{{cite book |last=Schnug |first=Ewald |title=Uranium – Past and Future Challenges |chapter=Where has all the uranium gone? Or what feeds Dimona – circumstantial evidence for an illicit fate of uranium from rock phosphate processing |publisher=Springer |date=2014 |isbn=978-3-319-11058-5 |doi=10.1007/978-3-319-11059-2_84 |pages=731–738}}</ref> |
|||
===Reaktor=== |
|||
[[Berkas:First four nuclear lit bulbs.jpeg|thumb|Empat bola lampu dinyalakan dengan listrik yang dihasilkan dari reaktor nuklir penghasil listrik buatan pertama, [[Reaktor Pembiak Eksperimental I|EBR-I]] (1951)|alt=Ruang industri dengan empat bola lampu besar yang menyala tergantung dari sebuah batang.]] |
|||
[[Reaktor Grafit X-10]] di [[Laboratorium Nasional Oak Ridge]] (ORNL) di Oak Ridge, [[Tennessee]], sebelumnya dikenal sebagai Clinton Pile dan X-10 Pile, adalah reaktor nuklir buatan kedua di dunia (setelah Chicago Pile milik Enrico Fermi) dan merupakan reaktor pertama yang dirancang dan dibangun untuk operasi berkelanjutan. [[Reaktor Pembiak Eksperimental I]] milik [[Laboratorium Nasional Argonne]], terletak di Stasiun Pengujian Reaktor Nasional milik [[Komisi Energi Atom Amerika Serikat|Komisi Energi Atom]] dekat [[Arco, Idaho]], menjadi reaktor nuklir pertama yang menghasilkan listrik pada 20 Desember 1951.<ref>{{cite web |url=http://www.ne.anl.gov/About/reactors/frt.shtml |title=Reactors Designed by Argonne National Laboratory: Fast Reactor Technology |publisher=[[Departemen Energi Amerika Serikat|Departemen Energi A.S.]], [[Laboratorium Nasional Argonne]] |date=2012 |access-date=13 Juni 2023}}</ref> Awalnya, empat bola lampu 150 watt dinyalakan oleh reaktor tersebut, tetapi perbaikan akhirnya memungkinkannya untuk menyalakan seluruh fasilitas (kemudian, kota Arco menjadi yang pertama di dunia dimana semua [[listrik]]nya berasal dari tenaga nuklir yang dihasilkan oleh [[Eksperimen BORAX|BORAX-III]], reaktor lain yang dirancang dan dioperasikan oleh Laboratorium Nasional Argonne).<ref>{{cite web |url=http://web.em.doe.gov/tie/history.html |title=History and Success of Argonne National Laboratory: Part 1 |publisher=Departemen Energi A.S., Laboratorium Nasional Argonne |date=1998 |access-date=13 Juni 2023 |archive-url=https://web.archive.org/web/20060926155637/http://web.em.doe.gov/tie/history.html |archive-date=26 September 2006 |url-status=dead}}</ref><ref>{{cite web |title=Reactors Designed by Argonne National Laboratory: Light Water Reactor Technology Development |publisher=Departemen Energi A.S., Laboratorium Nasional Argonne |date=2012 |url=http://www.ne.anl.gov/About/reactors/lwr3.shtml#fragment-5 |access-date=13 Juni 2023}}</ref> Pembangkit listrik tenaga nuklir skala komersial pertama di dunia, [[Pembangkit Listrik Tenaga Nuklir Obninsk|Obninsk]] di [[Uni Soviet]], memulai pembangkitan dengan reaktor AM-1 pada 27 Juni 1954. Pembangkit listrik tenaga nuklir awal lainnya adalah [[Pembangkit listrik tenaga nuklir Calder Hall|Calder Hall]] di Inggris, yang memulai pembangkitan pada 17 Oktober 1956,<ref>{{cite news |title=1956:Queen switches on nuclear power |date=17 Oktober 1956 |work=[[BBC News]] |url=http://news.bbc.co.uk/onthisday/hi/dates/stories/october/17/newsid_3147000/3147145.stm |access-date=13 Juni 2023}}</ref> dan [[Pembangkit Listrik Tenaga Atom Shippingport]] di [[Pennsylvania]], yang dimulai pada 26 Mei 1958. Tenaga nuklir pertama kali digunakan untuk tenaga penggerak [[kapal selam]], [[USS Nautilus (SSN-571)|USS ''Nautilus'']], pada tahun 1954.{{sfn|Seaborg|1968|p=773}}<ref>{{cite web |title=STR (Submarine Thermal Reactor) in "Reactors Designed by Argonne National Laboratory: Light Water Reactor Technology Development" |publisher=Departemen Energi A.S., Laboratorium Nasional Argonne |url=http://www.ne.anl.gov/About/reactors/lwr3.shtml#fragment-2 |date=2012 |access-date=13 Juni 2023}}</ref> |
|||
===Fisi prasejarah yang terjadi secara alami=== |
|||
{{Utama|Reaktor nuklir alam}} |
|||
Pada tahun 1972, fisikawan Prancis [[Francis Perrin (fisikawan)|Francis Perrin]] menemukan lima belas reaktor fisi nuklir alami kuno dan tidak lagi aktif di tiga endapan bijih terpisah di [[tambang Oklo]] di [[Gabon]], [[Afrika Barat]], yang secara kolektif dikenal sebagai [[Reaktor nuklir alam|Reaktor Fosil Oklo]]. Deposit bijih itu berumur 1,7 miliar tahun; kemudian, uranium-235 merupakan sekitar 3% dari total uranium di Bumi.<ref name="OCRWM">{{cite web |title=Oklo: Natural Nuclear Reactors |work=Office of Civilian Radioactive Waste Management |url=http://www.ocrwm.doe.gov/factsheets/doeymp0010.shtml |archive-url=https://web.archive.org/web/20040603085718/http://www.ocrwm.doe.gov/factsheets/doeymp0010.shtml |archive-date=3 Juni 2004 |access-date=13 Juni 2023}}</ref> Nilai ini cukup tinggi untuk memungkinkan terjadinya reaksi rantai fisi nuklir yang berkelanjutan, asalkan ada kondisi pendukung lainnya. Kapasitas sedimen sekitarnya untuk mengandung produk [[limbah radioaktif|limbah nuklir]] yang mengancam kesehatan telah dikutip oleh pemerintah federal A.S. sebagai bukti pendukung kelayakan untuk menyimpan bahan bakar nuklir bekas di [[repositori limbah nuklir Gunung Yucca]].<ref name="OCRWM" /> |
|||
===Kontaminasi dan warisan Perang Dingin=== |
|||
[[Berkas:US and USSR nuclear stockpiles.svg|thumb|Cadangan senjata nuklir A.S. dan Uni Soviet/Rusia, 1945–2005|alt=Grafik yang menunjukkan evolusi jumlah senjata nuklir di A.S. dan Uni Soviet dan pada periode 1945–2005. A.S mendominasi tahun-tahun awal dan Uni Soviet kemudian dengan dan saling silang sekitar tahun 1978.]] |
|||
[[Uji coba nuklir]] di atas tanah oleh Uni Soviet dan Amerika Serikat pada 1950-an dan awal 1960-an dan oleh [[Prancis]] pada 1970-an dan 1980-an{{sfn|Emsley|2001|p=480}} telah menyebabkan tersebarnya sejumlah besar [[luruhan nuklir|luruhan]] dari [[produk peluruhan|isotop anak]] uranium di seluruh dunia.<ref>{{cite journal |author=Warneke, T. |author2=Croudace, I. W. |author3=Warwick, P. E. |author4=Taylor, R. N. |name-list-style=amp |title=A new ground-level fallout record of uranium and plutonium isotopes for northern temperate latitudes |journal=Earth and Planetary Science Letters| date=2002 |volume=203 |issue=3–4 |pages=1047–1057 |doi=10.1016/S0012-821X(02)00930-5 |bibcode=2002E&PSL.203.1047W}}</ref> Luruhan dan polusi tambahan terjadi dari beberapa [[Kecelakaan dan insiden nuklir|kecelakaan nuklir]].<ref>{{cite news |url=http://www.time.com/time/photogallery/0,29307,1887705,00.html |archive-url=https://web.archive.org/web/20090328130544/http://www.time.com/time/photogallery/0,29307,1887705,00.html |url-status=dead |archive-date=28 Maret 2009 |title=The Worst Nuclear Disasters |publisher=Time.com |date=25 Maret 2009 |access-date=13 Juni 2023}}</ref> |
|||
Penambang uranium memiliki insiden [[kanker]] yang lebih tinggi. Kelebihan risiko kanker paru-paru di antara penambang uranium [[Suku Navajo|Navajo]], misalnya, telah didokumentasikan dan dikaitkan dengan pekerjaan mereka.<ref name="Gilliland et al 2000">{{cite journal |journal=Journal of Occupational and Environmental Medicine |author=Gilliland, Frank D. |author2=Hunt, William C. |author3=Pardilla, Marla |author4=Key, Charles R. |title=Uranium Mining and Lung Cancer Among Navajo Men in New Mexico and Arizona, 1969 to 1993 |url=https://archive.org/details/sim_journal-of-occupational-and-environmental-medicine_2000-03_42_3/page/n65 |date=Maret 2000 |volume=42 |issue=3 |pages=278–283 |pmid=10738707 |doi=10.1097/00043764-200003000-00008}}</ref> [[Undang-undang Kompensasi Paparan Radiasi|UU Kompensasi Paparan Radiasi]], undang-undang tahun 1990 di A.S., mewajibkan pembayaran sebesar [[Dolar Amerika Serikat|AS$]]100.000 sebagai "bentuk balas budi" kepada penambang uranium yang didiagnosis menderita kanker atau penyakit pernapasan lainnya.<ref name="ajph.org">{{cite journal |title=The History of Uranium Mining and the Navajo People |doi=10.2105/AJPH.92.9.1410 |publisher=Ajph.org |pmid=12197966 |date=2002 |last1=Brugge |first1=Doug |last2=Goble |first2=Rob |journal=American Journal of Public Health |volume=92 |issue=9 |pages=1410–9 |pmc=3222290}}</ref> |
|||
Selama [[Perang Dingin]] antara Uni Soviet dan Amerika Serikat, persediaan uranium yang sangat besar dikumpulkan dan puluhan ribu senjata nuklir dibuat menggunakan uranium yang diperkaya dan plutonium yang terbuat dari uranium. Setelah [[Sejarah Uni Soviet (1985–1991)#Pembubaran Uni Soviet|pecahnya Uni Soviet]] pada tahun 1991, diperkirakan 600 ton pendek (540 ton metrik) uranium tingkat senjata yang diperkaya tinggi (cukup untuk membuat 40.000 hulu ledak nuklir) telah disimpan di fasilitas yang seringkali tidak dijaga dengan baik di [[Rusia|Federasi Rusia]] dan beberapa negara bekas Soviet lainnya.<ref name="EncyIntel" /> Dari tahun 1993 hingga 2005, polisi di [[Asia]], [[Eropa]], dan [[Amerika Selatan]] telah [[spionase nuklir|mencegat pengiriman]] uranium atau plutonium tingkat bom selundupan setidaknya 16 kali, yang sebagian besar berasal dari sumber bekas Soviet.<ref name="EncyIntel" /> Dari tahun 1993 hingga 2005, Program Perlindungan, Kontrol, dan Akuntansi Material, yang dioperasikan oleh [[pemerintah federal Amerika Serikat]], menghabiskan sekitar AS$550 juta untuk membantu mengamankan cadangan uranium dan plutonium di Rusia. Uang ini digunakan untuk perbaikan dan peningkatan keamanan di fasilitas penelitian dan penyimpanan.<ref name="EncyIntel" /> |
|||
Keamanan fasilitas nuklir di Rusia telah meningkat secara signifikan sejak stabilisasi gejolak politik dan ekonomi pada awal 1990-an. Sebagai contoh, pada tahun 1993 terdapat 29 insiden dengan peringkat di atas level 1 pada [[Skala Kejadian Nuklir Internasional]], dan jumlah ini turun di bawah empat per tahun pada tahun 1995–2003. Jumlah pekerja yang menerima dosis radiasi tahunan di atas 20 m[[Sievert|Sv]], yang setara dengan satu [[Tomografi terkomputasi|pemindaian CT]] seluruh tubuh,<ref>{{cite journal |pmid=9166072 |year=1997 |last1=Van Unnik |first1=J. G. |last2=Broerse |first2=J. J. |last3=Geleijns |first3=J. |last4=Jansen |first4=J. T. |last5=Zoetelief |first5=J. |last6=Zweers |first6=D. |title=Survey of CT techniques and absorbed dose in various Dutch hospitals |url=https://archive.org/details/sim_british-journal-of-radiology_1997-04_70_832/page/367 |volume=70 |issue=832 |pages=367–71 |journal=The British Journal of Radiology|doi=10.1259/bjr.70.832.9166072 }} (3000 pemeriksaan dari 18 rumah sakit)</ref> mengalami penurunan tajam sekitar tahun 2000. Pada November 2015, pemerintah Rusia menyetujui program federal untuk keselamatan nuklir dan radiasi untuk tahun 2016 hingga 2030 dengan anggaran [[Rubel Rusia|₽]]562 miliar (sekitar AS$8 miliar). Masalah utamanya adalah "kewajiban yang ditangguhkan yang terakumulasi selama 70 tahun industri nuklir, terutama pada masa Uni Soviet". Sekitar 73% dari anggaran akan dihabiskan untuk penonaktifan reaktor nuklir dan fasilitas nuklir yang sudah tua dan usang, terutama yang terlibat dalam program pertahanan negara; 20% akan digunakan untuk pemrosesan dan pembuangan bahan bakar nuklir dan limbah radioaktif, dan 5% akan digunakan untuk memantau dan memastikan keselamatan nuklir dan radiasi.<ref>[https://world-nuclear.org/information-library/country-profiles/countries-o-s/russia-nuclear-fuel-cycle.aspx Russia's Nuclear Fuel Cycle]. World Nuclear Association. Diperbarui Desember 2021.</ref> |
|||
==Keterjadian== |
|||
===Asal=== |
|||
Bersama dengan semua unsur yang memiliki [[massa atom relatif|berat atom]] lebih tinggi dari [[besi]], uranium hanya secara alami dibentuk oleh [[proses r|proses-r]] (penangkapan neutron cepat) dalam [[supernova]] dan [[tabrakan bintang neutron]].<ref>{{cite web |url=http://herschel.jpl.nasa.gov/chemicalOrigins.shtml |title=History/Origin of Chemicals |publisher=NASA |access-date=13 Juni 2023}}</ref> Torium dan uranium primordial hanya diproduksi dalam proses-r, karena [[proses s|proses-s]] (penangkapan neutron lambat) dinilai terlalu lambat dan tidak dapat melewati celah ketidakstabilan setelah bismut.<ref name="B2FH">{{cite journal | author1=Burbidge, E. M. | author2=Burbidge, G. R. | author3=Fowler, W. A. | author4=Hoyle, F. | year=1957 | title=Synthesis of the Elements in Stars | journal=[[Reviews of Modern Physics]] | volume=29 | issue=4 | page=547 | bibcode=1957RvMP...29..547B | doi=10.1103/RevModPhys.29.547 | doi-access=free }}</ref><ref>{{cite book|last=Clayton|first=Donald D.|author-link=Donald D. Clayton|title=Principles of Stellar Evolution and Nucleosynthesis|url=https://archive.org/details/principlesofstel00clay|publisher=Mc-Graw-Hill|location=New York |date=1968|pages=[https://archive.org/details/principlesofstel00clay/page/577 577]–91|isbn=978-0226109534}}</ref> Selain dua isotop uranium primordial yang masih ada, <sup>235</sup>U dan <sup>238</sup>U, proses-r juga menghasilkan [[uranium-236|<sup>236</sup>U]] dalam jumlah yang signifikan, yang memiliki waktu paruh lebih pendek dan juga merupakan sebuah [[radionuklida punah]], yang telah lama meluruh sepenuhnya menjadi <sup>232</sup>Th. Uranium-236 itu sendiri diperkaya oleh peluruhan [[plutonium-244|<sup>244</sup>Pu]], terhitung untuk kelimpahan torium yang diamati lebih tinggi dari perkiraan dan kelimpahan uranium lebih rendah dari perkiraan.<ref name="thoruranium">{{cite journal |last1=Trenn |first1=Thaddeus J. |date=1978 |title=Thoruranium (U-236) as the extinct natural parent of thorium: The premature falsification of an essentially correct theory |journal=Annals of Science |volume=35 |issue=6 |pages=581–97 |doi=10.1080/00033797800200441}}</ref> Meskipun kelimpahan alami uranium telah dilengkapi dengan peluruhan [[plutonium-242|<sup>242</sup>Pu]] yang telah punah (waktu paruh 0,375 juta tahun) dan <sup>247</sup>Cm (waktu paruh 16 juta tahun), masing-masing menghasilkan <sup>238</sup>U dan <sup>235</sup>U, hal ini terjadi hampir dapat diabaikan karena waktu paruh kedua induk ini lebih pendek dan produksinya lebih rendah daripada <sup>236</sup>U dan <sup>244</sup>Pu, kedua induk torium: rasio <sup>247</sup>Cm:<sup>235</sup>U pada pembentukan Tata Surya adalah {{val|7.0e-5|1.6}}.<ref> |
|||
{{cite journal |last1=Tissot |first1=François L. H. |last2=Dauphas |first2=Nicolas |last3=Grossmann |first3=Lawrence |date=4 Maret 2016 |title=Origin of uranium isotope variations in early solar nebula condensates |journal=Science Advances |volume=2 |issue=3 |doi=10.1126/sciadv.1501400|pmid=26973874 |pmc=4783122 |arxiv=1603.01780 |bibcode=2016SciA....2E1400T |page=e1501400}}</ref> |
|||
===Biotik dan abiotik=== |
|||
{{Utama|Uranium di lingkungan}} |
|||
[[Berkas:Pichblende.jpg|thumb|Uraninit adalah bijih yang paling umum ditambang untuk mengekstraksi uranium.|alt=Sepotong batu abu-abu mengkilap berukuran 5 sentimeter dengan permukaan kasar.]] |
|||
[[Berkas:Evolution of Earth's radiogenic heat.svg|thumb|right|Evolusi aliran [[Nuklida radiogenik#Pemanasan radiogenik|panas radiogenik]] Bumi dari waktu ke waktu: kontribusi dari <sup>235</sup>U berwarna merah dan dari <sup>238</sup>U berwarna hijau]] |
|||
Uranium adalah unsur [[kelimpahan alami unsur|yang terjadi secara alami]] yang dapat ditemukan dalam kadar rendah di semua batuan, tanah, dan air. Uranium adalah unsur ke-51 dalam urutan [[Kelimpahan unsur di kerak Bumi|kelimpahan]] di kerak Bumi. Uranium juga merupakan unsur dengan jumlah tertinggi yang ditemukan secara alami dalam jumlah yang signifikan di Bumi dan hampir selalu ditemukan berkombinasi dengan unsur lain.<ref name="LANL" /> Peluruhan uranium, [[torium]], dan [[kalium-40]] di [[mantel (geologi)|mantel]] Bumi dianggap sebagai sumber utama panas<ref>{{cite magazine |url=https://www.newscientist.com/article/mg18725103-700-first-measurements-of-earths-core-radioactivity/ |title=First measurements of Earth's core radioactivity |magazine=New Scientist |last=Biever |first=Celeste |date=27 Juli 2005 |access-date=13 Juni 2023 }}</ref><ref>{{cite web |url=https://physicsworld.com/a/potassium-40-heats-up-earths-core/ |title=Potassium-40 heats up Earth's core |work=physicsworld.com |date=7 Mei 2003 |access-date=13 Juni 2023}}</ref> yang menjaga [[Struktur internal Bumi|inti luar]] Bumi dalam keadaan cair dan mendorong [[konveksi mantel]], yang pada gilirannya mendorong [[tektonika lempeng|lempeng tektonik]]. |
|||
Konsentrasi rata-rata uranium di [[kerak Bumi]] adalah (tergantung referensi) 2 hingga 4 [[Notasi bagian per#Bagian per juta|bagian per juta]],<ref name="SciTechEncy">{{cite encyclopedia |edition=5 |title=Uranium |encyclopedia=The McGraw-Hill Science and Technology Encyclopedia |publisher=The McGraw-Hill Companies, Inc. |isbn=978-0-07-142957-3 |year=2005 |url-access=registration |url=https://archive.org/details/mcgrawhillconcis00newy}}</ref>{{sfn|Emsley|2001|p=480}} atau sekitar 40 kali lebih melimpah daripada [[perak]].<ref name="ColumbiaEncy" /> Kerak Bumi dari permukaan hingga 25 km (15 mi) ke bawah diperkirakan mengandung 10<sup>17</sup> kg (2{{e|17}} lb) uranium sedangkan [[samudra]] mungkin mengandung 10<sup>13</sup> kg (2{{e|13}} lb).<ref name="SciTechEncy" /> Konsentrasi uranium dalam tanah berkisar antara 0,7 hingga 11 bagian per juta (hingga 15 bagian per juta di tanah pertanian karena penggunaan [[pupuk]] fosfat),<ref>Schnug, E., Sun, Y., Zhang, L., Windmann, H., Lottermoser, B.G., Ulrich, A. E., Bol, R., Makeawa, M., and Haneklaus, S.H. (2023) "Elemental loads with phosphate fertilizers – a constraint for soil productivity?" In: Bolan, N.S. and Kirkham, M.B. (eds.) ''Managing Soil Constraints for Sustaining Productivity''. CRC Press.</ref> dan konsentrasinya dalam air laut adalah [[Notasi bagian per#Bagian per miliar|3 bagian per miliar]].{{sfn|Emsley|2001|p=480}} |
|||
Uranium lebih banyak daripada [[antimon]], [[timah]], [[kadmium]], [[raksa]], atau perak, dan jumlahnya sama melimpahnya dengan [[arsen]] atau [[molibdenum]].<ref name="LANL" />{{sfn|Emsley|2001|p=480}} ditemukan dalam ratusan mineral, meliputi uraninit ([[bijih]] uranium yang paling umum), [[karnotit]], [[autunit]], [[uranofan]], [[torbernit]], dan [[kofinit]].<ref name="LANL" /> Konsentrasi uranium yang signifikan terjadi pada beberapa zat seperti endapan batuan [[fosfat]], dan mineral seperti [[lignit]], dan pasir [[monasit]] dalam bijih yang kaya uranium<ref name="LANL" /> (ia diperoleh secara komersial dari sumber dengan uranium sesedikit 0,1%<ref name="ColumbiaEncy" />). |
|||
Beberapa bakteri, seperti ''[[Shewanella putrefaciens]]'', ''[[Geobacter metallireducens]]'', dan beberapa galur ''[[Paraburkholderia fungorum|Burkholderia fungorum]]'', menggunakan uranium untuk pertumbuhannya dan mengubah U(VI) menjadi U(IV).<ref>{{cite journal |doi=10.1016/j.oregeorev.2004.10.003 |title=Evidence of uranium biomineralization in sandstone-hosted roll-front uranium deposits, northwestern China |date=2005 |last1=Min |first1=M. |last2=Xu |first2=H. |last3=Chen |first3=J. |last4=Fayek |first4=M. |journal=Ore Geology Reviews |volume=26 |page=198 |issue=3–4}}</ref><ref>{{cite journal|doi=10.1371/journal.pone.0123378|pmid=25874721|pmc=4395306|year=2015|last1=Koribanics|first1=N. M.|title=Spatial Distribution of an Uranium-Respiring Betaproteobacterium at the Rifle, CO Field Research Site|journal=PLOS ONE|volume=10|issue=4|pages=e0123378|last2=Tuorto|first2=S. J.|last3=Lopez-Chiaffarelli|first3=N.|last4=McGuinness|first4=L. R.|last5=Häggblom|first5=M. M.|last6=Williams|first6=K. H.|last7=Long|first7=P. E.|last8=Kerkhof|first8=L. J.|bibcode=2015PLoSO..1023378K|doi-access=free}}</ref> Penelitian terbaru menunjukkan bahwa jalur ini mencakup reduksi U(VI) terlarut melalui keadaan pentavalen U(V) perantara.<ref name="Renshaw">{{cite journal |last1=Renshaw |first1=J. C. |last2=Butchins |first2=L. J. C. |last3=Livens |first3=F. R. |last4=May |first4=I.|display-authors=3 |title=Bioreduction of uranium: environmental implications of a pentavalent intermediate |journal=Environmental Science & Technology |date=June 2005 |volume=39 |issue=15 |pages=5657–5660 |doi=10.1021/es048232b |pmid=16124300|bibcode=2005EnST...39.5657R }}</ref><ref name="Vitesse">{{cite journal |last1=Vitesse |first1=GF |last2=Morris |first2=K |last3=Natrajan |first3=LS |last4=Shaw |first4=S |title=Multiple Lines of Evidence Identify U(V) as a Key Intermediate during U(VI) Reduction by Shewanella oneidensis MR1 |journal=Environmental Science & Technology |date=Januari 2020 <!--|volume=preprint--> |volume=54 |issue=4 |pages=2268–2276 |doi=10.1021/acs.est.9b05285 |pmid=31934763 |bibcode=2020EnST...54.2268V |doi-access=free }}</ref> |
|||
<!-- BUTUH RUJUKAN |
|||
Beberapa penelitian terbaru di [[Manchester]] telah menunjukkan bahwa [[bakteri]] dapat mengurangi dan memperbaiki uranium di dalam [[tanah]]. Penelitian ini dilanjutkan di [[Universitas Plymouth]] oleh Dr. Keith Roach dan S. Handley. |
|||
/BUTUH RUJUKAN --> |
|||
Organisme lain, seperti lumut ''Trapelia involuta'' atau [[mikroorganisme]] seperti [[bakteri]] ''[[Citrobacter]]'', dapat menyerap konsentrasi uranium hingga 300 kali lipat dari lingkungannya.{{sfn|Emsley|2001|pp=476 and 482}} Spesies ''Citrobacter'' menyerap ion [[uranil]] ketika diberi [[gliserol fosfat]] (atau fosfat organik serupa lainnya). Setelah satu hari, satu gram bakteri dapat mengerakkan diri dengan sembilan gram kristal uranil fosfat; ini menciptakan kemungkinan bahwa organisme ini dapat digunakan dalam [[bioremediasi]] untuk [[pencemaran radioaktif|mendekontaminasi]] air yang tercemar uranium.{{sfn|Emsley|2001|p=477}}<ref>{{cite journal |
|||
| title = Uranium bioaccumulation by a ''Citrobacter'' sp. as a result of enzymically mediated growth of polycrystalline {{chem|HUO|2|PO|4}} |
|||
| author = Macaskie, L. E. |
|||
| author2 = Empson, R. M. |
|||
| author3 = Cheetham, A. K. |
|||
| author4 = Grey, C. P. |
|||
| author5 = Skarnulis, A. J. |
|||
| name-list-style = amp |
|||
| journal = Science |
|||
| volume = 257 |
|||
| issue = 5071 |
|||
| date = 1992 |
|||
| pages = 782–784 |
|||
| doi = 10.1126/science.1496397 |
|||
| pmid = 1496397 |bibcode = 1992Sci...257..782M}}</ref> |
|||
Proteobacterium ''[[Geobacter]]'' juga telah terbukti melakukan bioremediasi uranium dalam air tanah.<ref name="AndersonVrionis2003">{{cite journal |last1=Anderson |first1=R. T. |last2=Vrionis |first2=H. A. |last3=Ortiz-Bernad |first3=I. |last4=Resch |first4=C. T. |last5=Long |first5=P. E. |last6=Dayvault |first6=R. |last7=Karp |first7=K. |last8=Marutzky |first8=S. |last9=Metzler |first9=D. R. |last10=Peacock |first10=A. |last11=White |first11=D. C. |last12=Lowe |first12=M. |last13=Lovley |first13=D. R. |title=Stimulating the ''in situ'' activity of ''Geobacter'' species to remove uranium from the groundwater of a uranium-contaminated aquifer |url=https://archive.org/details/sim_applied-and-environmental-microbiology_2003-10_69_10/page/5884 |journal=Applied and Environmental Microbiology |volume=69 |issue=10 |date=2003 |pages=5884–5891 |doi=10.1128/AEM.69.10.5884-5891.2003 |pmc=201226 |pmid=14532040|bibcode=2003ApEnM..69.5884A }}</ref> Jamur mikoriza ''[[Rhizophagus irregularis|Glomus intraradices]]'' meningkatkan kandungan uranium di akar tanaman simbiotiknya.<ref>{{Cite journal |title=Metals, minerals and microbes: geomicrobiology and bioremediation |journal=Microbiology |author=Gadd, G. M. |volume=156 |issue=Pt 3 |date=March 2010 |pages=609–643|pmid=20019082 |doi=10.1099/mic.0.037143-0 |doi-access=free }}</ref> |
|||
Di alam, uranium(VI) membentuk kompleks karbonat yang sangat larut pada pH basa. Hal ini menyebabkan peningkatan mobilitas dan ketersediaan uranium ke air tanah dan tanah dari limbah nuklir yang menyebabkan bahaya kesehatan. Namun, sulit untuk mengendapkan uranium sebagai fosfat dengan adanya kelebihan karbonat pada pH basa. Galur ''[[Sphingomonas]]'' sp. BSAR-1 telah ditemukan dapat mengekspresikan fosfatase alkali (PhoK) aktivitas tinggi yang telah diterapkan untuk biopresipitasi uranium sebagai spesies uranil fosfat dari larutan alkalin. Kemampuan pengendapannya ditingkatkan dengan mengekspresikan protein PhoK secara berlebihan dalam ''[[Escherichia coli|E. coli]]''.<ref> |
|||
{{cite journal |
|||
|author=Nilgiriwala, K.S. |
|||
|author2=Alahari, A. |
|||
|author3=Rao, A. S. |
|||
|author4=Apte, S.K. |
|||
|name-list-style=amp |
|||
|date=2008 |
|||
|title=Cloning and Overexpression of Alkaline Phosphatase PhoK from ''Sphingomonas'' sp. Strain BSAR-1 for Bioprecipitation of Uranium from Alkaline Solutions |
|||
|url=https://archive.org/details/sim_applied-and-environmental-microbiology_2008-09_74_17/page/5516 |
|||
|journal=Applied and Environmental Microbiology |
|||
|volume=74 |
|||
|issue=17 |
|||
|pages=5516–5523 |
|||
|doi=10.1128/AEM.00107-08 |
|||
|pmid=18641147 |
|||
|pmc=2546639 |
|||
|bibcode=2008ApEnM..74.5516N |
|||
}}</ref> |
|||
[[Tumbuhan]] menyerap beberapa uranium dari tanah. Konsentrasi berat kering uranium dalam tumbuhan berkisar antara 5 hingga 60 bagian per miliar, dan abu dari kayu yang terbakar dapat memiliki konsentrasi hingga 4 bagian per juta.{{sfn|Emsley|2001|p=477}} Konsentrasi uranium dalam berat kering pada tumbuhan [[makanan|pangan]] biasanya lebih rendah dengan satu hingga dua mikrogram per hari tertelan melalui makanan yang dimakan manusia.{{sfn|Emsley|2001|p=477}} |
|||
===Produksi dan penambangan=== |
|||
{{Utama|Penambangan uranium}} |
|||
Produksi uranium di seluruh dunia pada tahun 2021 berjumlah 48.332 [[ton metrik|ton]], dimana 21.819 t (45%) ditambang di [[Kazakhstan]]. Negara penambangan uranium penting lainnya adalah [[Namibia]] (5.753 t), [[Kanada]] (4.693 t), [[Australia]] (4.192 t), [[Uzbekistan]] (3.500 t), dan [[Rusia]] (2.635 t).<ref name="WNA-WUM">{{cite web |url=https://world-nuclear.org/information-library/nuclear-fuel-cycle/mining-of-uranium/world-uranium-mining-production.aspx |title=World Uranium Mining |publisher=World Nuclear Association |access-date=13 Juni 2023 }}</ref> |
|||
Bijih uranium ditambang dengan beberapa cara: dengan [[penambangan lubang terbuka]], [[Penambangan batu lunak bawah tanah|bawah tanah]], [[pelindian in-situ|pelindian ''in-situ'']], dan [[Penambangan lubang bor|lubang bor]] (lihat [[penambangan uranium]]).{{sfn|Emsley|2001|p=479}} Bijih uranium tingkat rendah yang ditambang biasanya mengandung 0,01 hingga 0,25% uranium oksida. Langkah-langkah ekstensif harus dilakukan untuk mengekstraksi logam dari bijihnya.{{sfn|Seaborg|1968|p=774}} Bijih bermutu tinggi yang ditemukan di deposit [[Cekungan Athabasca]] di [[Saskatchewan]], Kanada rata-rata dapat mengandung hingga 23% uranium oksida.<ref>{{cite web |url=http://www.investcom.com/moneyshow/uranium_athabasca.htm |title=Athabasca Basin, Saskatchewan |access-date=13 Juni 2023}}</ref> Bijih uranium dihancurkan dan dibuat menjadi bubuk halus dan kemudian dilindi dengan [[asam]] atau [[alkali]]. [[Air lindi]] mengalami salah satu dari beberapa urutan presipitasi, ekstraksi pelarut, dan pertukaran ion. Campuran yang dihasilkan, disebut ''[[yellowcake]]'', mengandung sedikitnya 75% uranium oksida U<sub>3</sub>O<sub>8</sub>. ''Yellowcake'' kemudian di[[kalsinasi]] untuk menghilangkan kotoran dari proses penggilingan sebelum pemurnian dan konversi.<ref>{{cite book |url=https://books.google.com/books?id=F7p7W1rykpwC&pg=PA75 |pages=74–75 |title=Hydrometallurgy in extraction processes |volume=1 |author=Gupta, C. K. |author2=Mukherjee, T. K. |name-list-style=amp |publisher=CRC Press |date=1990 |isbn=978-0-8493-6804-2}}</ref> |
|||
Uranium tingkat komersial dapat diproduksi melalui [[redoks|reduksi]] uranium [[halida]] dengan [[logam alkali]] atau [[logam alkali tanah|alkali tanah]].<ref name="LANL" /> Logam uranium juga dapat dibuat melalui [[elektrolisis]] {{chem|KUF|5}} atau |
|||
[[Uranium tetrafluorida|{{chem|UF|4}}]], dilarutkan dalam larutan [[kalsium klorida]] ({{chem|Ca[[klorida|Cl]]|2}}) dan [[natrium klorida]] ([[natrium|Na]]Cl) cair.<ref name="LANL" /> Uranium yang sangat murni diproduksi melalui [[dekomposisi termal]] uranium halida pada filamen panas.<ref name="LANL" /> |
|||
<gallery mode=packed heights=200px> |
|||
U production-demand.png|Produksi (tambang) dan permintaan uranium dunia<ref name="WNA-WUM" /> |
|||
Yellowcake.jpg|alt=Massa belah ketupat seperti pasir kuning dengan latar belakang hitam.|''[[Yellowcake]]'' adalah campuran oksida uranium pekat yang disempurnakan lebih lanjut untuk mengekstrak uranium murni. |
|||
Uranium production, OWID.svg|Produksi uranium tahun 2015, dalam ton<ref>{{cite web |title=Uranium production |url=https://ourworldindata.org/grapher/uranium-production |website=Our World in Data |access-date=13 Juni 2023}}</ref> |
|||
</gallery> |
|||
===Sumber daya dan cadangan=== |
|||
[[Berkas:Uranium prices.webp|thumb|upright=2|Harga uranium 1990–2022.]] |
|||
Diperkirakan ada 6,1 juta ton uranium dalam cadangan bijih yang layak secara ekonomi dengan harga AS$130 per kg uranium,<ref name=res/> sementara 35 juta ton digolongkan sebagai sumber daya mineral (prospek yang masuk akal untuk ekstraksi ekonomi pada akhirnya).<ref name="IAEAResourcesDemand" /> |
|||
Australia memiliki 28% dari cadangan bijih uranium dunia yang diketahui<ref name=res>{{cite web |url=https://www.world-nuclear.org/information-library/nuclear-fuel-cycle/uranium-resources/supply-of-uranium.aspx |title=Uranium Supplies: Supply of Uranium – World Nuclear Association |website=www.world-nuclear.org}}</ref> dan deposit uranium tunggal terbesar di dunia terletak di Tambang [[Tambang Olympic Dam|Olympic Dam]] di [[Australia Selatan]].<ref>{{cite web|title=Uranium Mining and Processing in South Australia |publisher=South Australian Chamber of Mines and Energy |date=2002 |url=http://www.uraniumsa.org/processing/processing.htm |access-date=13 Juni 2023 |url-status=dead |archive-url=https://web.archive.org/web/20120106005859/http://www.uraniumsa.org/processing/processing.htm |archive-date=6 Januari 2012 }}</ref> Terdapat pula cadangan uranium yang signifikan di [[Bakouma]], sebuah [[subprefektur]] di [[prefektur]] [[Mbomou]] di [[Afrika Tengah|Republik Afrika Tengah]].<ref>{{cite news |date=2011 |url=https://www.reuters.com/article/idAFL5E7M34T920111103 |title=Areva suspends CAR uranium mine project |last1=Ngoupana |first1=P.-M. |last2=Felix |first2=B. |editor-last=Barker |editor-first=A. |work=Central African Republic News |access-date=13 Juni 2023}}</ref> |
|||
Beberapa uranium juga berasal dari senjata nuklir yang dibongkar.<ref>{{cite web |url=https://world-nuclear.org/information-library/nuclear-fuel-cycle/uranium-resources/military-warheads-as-a-source-of-nuclear-fuel.aspx |title=Military Warheads as a Source of Nuclear Fuel |work=World-nuclear.org |access-date=13 Juni 2023}}</ref> Misalnya, pada tahun 1993–2013 Rusia memasok Amerika Serikat dengan 15.000 ton uranium yang diperkaya rendah dalam [[Program Megatons to Megawatts]].<ref>{{cite web |url=http://www.usec.com/megatonstomegawatts.htm |title=Megatons to Megawatts|publisher=U.S. Enrichment Corp.|url-status=dead|archive-url=https://web.archive.org/web/20080716044207/http://www.usec.com/megatonstomegawatts.htm|archive-date=16 Juli 2008}}</ref> |
|||
Tambahan 4,6 miliar ton uranium diperkirakan terlarut dalam [[air laut]] (ilmuwan [[Jepang]] pada 1980-an menunjukkan bahwa ekstraksi uranium dari air laut menggunakan [[pertukaran ion|penukar ion]] secara teknis layak dilakukan).<ref name="UseaWater">{{cite web |title=Uranium recovery from Seawater |url=http://www.jaea.go.jp/jaeri/english/ff/ff43/topics.html |access-date=13 Juni 2023 |publisher=Japan Atomic Energy Research Institute |date=23 Agustus 1999 |archive-url=https://web.archive.org/web/20091017081215/http://www.jaea.go.jp/jaeri/english/ff/ff43/topics.html |archive-date=17 Oktober 2009 |url-status=dead}}</ref><ref name="stanfordCohen">{{cite web |title=How long will nuclear energy last? |url=http://www-formal.stanford.edu/jmc/progress/cohen.html |access-date=13 Juni 2023 |date=12 Februari 1996 |url-status=dead |archive-url=https://web.archive.org/web/20070410165316/http://www-formal.stanford.edu/jmc/progress/cohen.html |archive-date=10 April 2007 }}</ref> Terdapat percobaan untuk mengekstraksi uranium dari air laut,<ref>{{Cite journal |doi=10.1002/cjce.5450620416 |title=Extraction of uranium from sea water using biological origin adsorbents |url=https://archive.org/details/sim_canadian-journal-of-chemical-engineering_1984-08_62_4/page/559 |year=1984 |last1=Tsezos |first1=M. |last2=Noh |first2=S. H. |journal=The Canadian Journal of Chemical Engineering |volume=62 |issue=4| pages=559–561}}</ref> tetapi hasilnya rendah karena kandungan karbonat di dalam air. Pada tahun 2012, peneliti [[Laboratorium Nasional Oak Ridge|ORNL]] mengumumkan keberhasilan pengembangan bahan penyerap baru yang dijuluki HiCap yang melakukan retensi permukaan molekul padat atau gas, atom atau ion dan juga secara efektif menghilangkan logam beracun dari air, menurut hasil yang diverifikasi oleh para peneliti di Laboratorium Nasional Pacific Northwest.<ref>{{cite web |url=http://www.ornl.gov/info/press_releases/get_press_release.cfm?ReleaseNumber=mr20120821-00 |title=ORNL technology moves scientists closer to extracting uranium from seawater |publisher=[[Laboratorium Nasional Oak Ridge|Oak Ridge National Laboratory]], United States |date=21 Agustus 2012 |access-date=13 Juni 2023 |archive-url=https://web.archive.org/web/20120825192521/http://www.ornl.gov/info/press_releases/get_press_release.cfm?ReleaseNumber=mr20120821-00 |archive-date=25 Agustus 2012 |url-status=dead}}</ref><ref>{{cite web |title=Fueling nuclear power with seawater |publisher=Pnnl.gov |date=21 Agustus 2012 |url=http://www.pnnl.gov/news/release.aspx?id=938 |access-date=13 Juni 2023}}</ref> |
|||
===Persediaan=== |
|||
{{Utama|Pasar uranium}} |
|||
[[Berkas:MonthlyUraniumSpot.png|thumb|right|Harga spot uranium bulanan dalam AS$ per pon. [[Gelembung uranium 2007|Puncak harga 2007]] terlihat jelas.<ref name="uraniumingo">{{cite web |url=http://www.uranium.info/prices/monthly.html |archive-url=https://web.archive.org/web/20071212170510/http://www.uranium.info/prices/monthly.html |archive-date=12 Desember 2007 |title=NUEXCO Exchange Value (Monthly Uranium Spot)}}</ref>]] |
|||
Pada tahun 2005, sepuluh negara menyumbang mayoritas oksida uranium terkonsentrasi di dunia: [[Kanada]] (27,9%), [[Australia]] (22,8%), [[Kazakhstan]] (10,5%), [[Rusia]] (8,0%), [[Namibia]] (7,5%), [[Niger]] (7,4%), [[Uzbekistan]] (5,5%), [[Amerika Serikat]] (2,5%), [[Argentina]] (2,1%), dan [[Ukraina]] (1,9%).<ref>{{cite web |url=http://www.uxc.com/fuelcycle/uranium/production-uranium.html |title=World Uranium Production |publisher=UxC Consulting Company, LLC |access-date=13 Juni 2023 |archive-date=27 Februari 2007 |archive-url=https://web.archive.org/web/20070227140531/http://www.uxc.com/fuelcycle/uranium/production-uranium.html |url-status=dead}}</ref> Pada tahun 2008, Kazakhstan diperkirakan akan meningkatkan produksi dan menjadi pemasok uranium terbesar di dunia pada tahun 2009.<ref>{{cite web |author=Mithridates |url=http://www.pagef30.com/2008/07/kazakhstan-to-surpass-canada-as-worlds.html |title=Page F30: Kazakhstan to surpass Canada as the world's largest producer of uranium by last year (2009) |website=Mithridates.blogspot.com |date=24 Juli 2008 |access-date=13 Juni 2023}}</ref><ref>{{cite web |url=http://www.zaman.com.tr/haber.do?haberno=717292 |title=Kazakistan uranyum üretimini artıracak|publisher=Zaman Gazetesi |work=Zaman.com.tr |language=tr|access-date=13 Juni 2023|date=28 Juli 2008|url-status=dead|archive-url=https://web.archive.org/web/20090113013838/http://www.zaman.com.tr/haber.do?haberno=717292|archive-date=13 Januari 2009}}</ref> Prediksi tersebut menjadi kenyataan, dan Kazakhstan memang mendominasi pasar uranium dunia sejak tahun 2010. Pada tahun 2021, pangsanya mencapai 45,1%, diikuti oleh Namibia (11,9%), Kanada (9,7%), Australia (8,7%), Uzbekistan (7,2%), Niger (4,7%), Rusia (5,5%), [[Tiongkok]] (3,9%), [[India]] (1,3%), Ukraina (0,9%), dan [[Afrika Selatan]] (0,8%), dengan total produksi dunia sebesar 48.332 ton.<ref name="WNA-WUM"/> Sebagian besar uranium diproduksi bukan melalui penambangan bijih bawah tanah konvensional (29% dari produksi), tetapi melalui [[pelindian in-situ|pelindian ''in-situ'']] (66%).<ref name="WNA-WUM"/><ref>{{cite web|title=In Situ Leach Mining (ISL) of Uranium – World Nuclear Association |website=www.world-nuclear.org |url=https://www.world-nuclear.org/information-library/nuclear-fuel-cycle/mining-of-uranium/in-situ-leach-mining-of-uranium.aspx|access-date=13 Juni 2023}}</ref> |
|||
Pada akhir 1960-an, ahli geologi PBB juga menemukan endapan uranium utama dan cadangan mineral langka lainnya di [[Somalia]]. Penemuan itu adalah yang terbesar dari jenisnya, dengan pakar industri memperkirakan simpanan itu memiliki lebih dari 25% dari cadangan uranium dunia yang diketahui saat itu sebanyak 800.000 ton.<ref name="Bufais">{{cite news|title=Big Uranium Find Announced in Somalia|url=https://news.google.com/newspapers?id=hbVWAAAAIBAJ&pg=7276%2C235261|access-date=13 Juni 2023|newspaper=The New York Times|date=16 Maret 1968}}</ref> |
|||
Pasokan akhir yang tersedia diyakini cukup untuk setidaknya 85 tahun ke depan,<ref name="IAEAResourcesDemand">{{cite web| title=Global Uranium Resources to Meet Projected Demand |url=http://www.iaea.org/newscenter/news/2006/uranium_resources.html |access-date=13 Juni 2023 |publisher=International Atomic Energy Agency |date=2006}}</ref> meskipun beberapa penelitian menunjukkan kurangnya investasi di akhir abad ke-20 dapat menimbulkan masalah pasokan di abad ke-21.<ref name="MITfuelSupply">{{cite web| title=Lack of fuel may limit U.S. nuclear power expansion |url=https://news.mit.edu/2007/fuel-supply |access-date=13 Juni 2023 |work=Massachusetts Institute of Technology |date=21 Maret 2007}}</ref> Endapan uranium tampaknya berdistribusi log-normal. Ada peningkatan 300 kali lipat dalam jumlah uranium yang dapat diperoleh kembali untuk setiap penurunan sepuluh kali lipat kadar bijih.<ref>{{cite journal |
|||
| title = World Uranium Resources |
|||
| url = https://archive.org/details/sim_scientific-american_1980-01_242_1/page/66 |
|||
|journal = Scientific American |volume = 242|issue = 1| author = Deffeyes, Kenneth S. |
|||
| author2 = MacGregor, Ian D. |
|||
| name-list-style = amp |
|||
| date = Januari 1980 |
|||
| page = 66 |
|||
|osti = 6665051|bibcode = 1980SciAm.242a..66D|doi = 10.1038/scientificamerican0180-66}}</ref> Dengan kata lain, terdapat sedikit bijih berkadar tinggi dan secara proporsional jauh lebih banyak bijih berkadar rendah yang tersedia. |
|||
==Senyawa== |
|||
[[Berkas:Uranium reactions.svg|thumb|upright=1.5|right|Reaksi logam uranium]] |
|||
===Keadaan oksidasi dan oksida=== |
|||
====Oksida==== |
|||
{{multiple image |
|||
| align = right |
|||
| total_width = 330 |
|||
| image1 = U3O8lattice.jpg |
|||
| alt1 = Model bola dan tongkat dari struktur kristal berlapis yang mengandung dua jenis atom. |
|||
| caption1 = |
|||
| image2 = UO2lattice.jpg |
|||
| alt2 = Model bola dan tongkat dari struktur kristal mirip kubus yang mengandung dua jenis atom. |
|||
| caption2 = |
|||
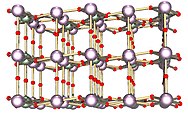
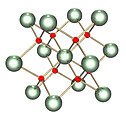
| footer = [[Triuranium oktoksida]] (kiri) dan [[uranium dioksida]] (kanan) adalah dua uranium oksida yang paling umum. |
|||
}} |
|||
''[[Yellowcake]]'' uranium yang dikalsinasi, seperti yang diproduksi di banyak pabrik besar, berisi distribusi spesies oksidasi uranium dalam berbagai bentuk mulai dari yang paling teroksidasi hingga yang paling tidak teroksidasi. Partikel dengan waktu tinggal yang singkat dalam pengalsinasi umumnya akan kurang teroksidasi dibandingkan dengan waktu retensi yang lama atau partikel yang diperoleh kembali dalam ''stack scrubber''. Kandungan uranium biasanya mengacu pada {{chem|U|3|O|8}}, yang berasal dari masa [[Proyek Manhattan]] ketika {{chem|U|3|O|8}} digunakan sebagai standar pelaporan kimia analitik.<ref>{{Cite book |last=Kloprogge |first=J. Theo |last2=Ponce |first2=Concepcion P. |last3=Loomis |first3=Tom A. |title=The periodic table : nature's building blocks : an introduction to the naturally occurring elements, their origins and their uses |date=2021 |publisher=Elsevier |isbn=978-0-12-821538-8 |location=Amsterdam |pages=861–862 |oclc=1223058470}}</ref> |
|||
[[Fase benda|Hubungan fase]] dalam sistem uranium-oksigen sangat kompleks. [[Bilangan oksidasi|Keadaan oksidasi]] uranium yang paling penting adalah uranium(IV) dan uranium(VI), dan dua oksida yang bersesuaian adalah [[uranium dioksida]] ({{chem|UO|2}}) dan [[uranium trioksida]] ({{chem|UO|3}}).{{sfn|Seaborg|1968|p=779}} [[Uranium oksida]] lainnya seperti uranium monoksida (UO), diuranium pentoksida ({{chem|U|2|O|5}}), dan uranium peroksida ({{chem|UO|4|·2H|2|O}}) juga eksis. |
|||
Bentuk uranium oksida yang paling umum adalah [[triuranium oktoksida]] ({{chem|U|3|O|8}}) dan {{chem|UO|2}}.<ref name="ANL-Chem">{{cite web |title=Chemical Forms of Uranium |publisher=Laboratorium Nasional Argonne |url=http://web.ead.anl.gov/uranium/guide/ucompound/forms/index.cfm |access-date=13 Juni 2023 |archive-url=https://web.archive.org/web/20060922180607/http://web.ead.anl.gov/uranium/guide/ucompound/forms/index.cfm |archive-date=22 September 2006 |url-status=dead}}</ref> Kedua bentuk oksida tersebut adalah padatan yang memiliki kelarutan rendah dalam air dan relatif stabil pada berbagai kondisi lingkungan. Triuranium oktoksida adalah (tergantung kondisi) senyawa uranium yang paling stabil dan merupakan bentuk yang paling banyak ditemukan di alam. Uranium dioksida adalah bentuk uranium yang paling umum digunakan sebagai bahan bakar reaktor nuklir.<ref name="ANL-Chem"/> Pada suhu sekitar, {{chem|UO|2}} secara bertahap akan berubah menjadi {{chem|U|3|O|8}}. Karena kestabilannya, uranium oksida umumnya dianggap sebagai bentuk kimia yang disukai untuk penyimpanan atau pembuangan.<ref name="ANL-Chem"/> |
|||
====Kimia berair==== |
|||
[[Berkas:U Oxstufen.jpg|thumb|left|upright|Uranium dalam keadaan oksidasi III, IV, V, VI]] |
|||
Garam uranium dari banyak [[bilangan oksidasi|keadaan oksidasi]] bersifat [[kelarutan|larut]] dalam air dan dapat dipelajari dalam [[larutan berair]]. Bentuk ionik yang paling umum adalah {{chem|U|3+}} (coklat kemerahan), {{chem|U|4+}} (hijau), {{chem|UO|2|+}} (tak stabil), dan {{chem|UO|2|2+}} (kuning), untuk U(III), U(IV), U(V), dan U(VI), masing-masing.{{sfn|Seaborg|1968|p=778}} Beberapa senyawa padat dan semilogam seperti UO dan US terdapat pada keadaan oksidasi formal uranium(II), tetapi tidak ada ion sederhana yang diketahui eksis dalam larutan untuk keadaan tersebut. Ion {{chem|U|3+}} membebaskan [[hidrogen]] dari [[air]] dan karena itu dianggap sangat tidak stabil. Ion {{chem|UO|2|2+}} mewakili keadaan uranium(VI) dan diketahui membentuk senyawa seperti [[uranil karbonat]], [[uranil klorida]], dan [[uranil sulfat]]. {{chem|UO|2|2+}} juga membentuk [[kompleks koordinasi|kompleks]] dengan berbagai bahan [[pengelatan|pengelat]] [[senyawa organik|organik]], yang paling sering dijumpai adalah [[uranil asetat]].{{sfn|Seaborg|1968|p=778}} |
|||
Tidak seperti garam uranil dari uranium dan bentuk kationik uranium-oksida [[ion poliatomik]], [[uranat]], garam yang mengandung anion poliatomik uranium-oksida, umumnya tidak larut dalam air. |
|||
====Karbonat==== |
|||
Interaksi anion karbonat dengan uranium(VI) menyebabkan [[diagram Pourbaix]] berubah sangat besar ketika medium diubah dari air menjadi larutan yang mengandung karbonat. Walaupun sebagian besar karbonat tidak larut dalam air (siswa sering diajari bahwa semua karbonat selain logam alkali tidak larut dalam air), uranium karbonat sering larut dalam air. Hal ini dikarenakan kation U(VI) mampu mengikat dua oksida terminal dan tiga atau lebih karbonat untuk membentuk kompleks anionik. |
|||
{|class="wikitable" style="text-align:center; float:center" |
|||
|+[[Diagram Pourbaix]]<ref name="medusa">Puigdomenech, Ignasi (2004) [https://www.kth.se/che/medusa/chemeq-1.369367 ''Hydra/Medusa Chemical Equilibrium Database and Plotting Software'']. KTH Royal Institute of Technology</ref> |
|||
|[[Berkas:Uranium pourdaix diagram in water.png|center|190x180px|alt=Grafik potensial vs. pH yang menunjukkan daerah stabilitas berbagai senyawa uranium]] |
|||
|[[Berkas:Uranium pourdiax diagram in carbonate media.png|center|190x180px|alt=Grafik potensial vs. pH yang menunjukkan daerah stabilitas berbagai senyawa uranium]] |
|||
|- |
|||
|Uranium dalam media berair yang tidak membentuk kompleks (misalnya [[asam perklorat]]/natrium hidroksida).<ref name="medusa" /> |
|||
|Uranium dalam larutan karbonat |
|||
|- |
|||
|[[Berkas:Uranium fraction diagram with no carbonate.png|center|250x180px|alt=Grafik potensial vs. pH yang menunjukkan daerah stabilitas berbagai senyawa uranium]] |
|||
|[[Berkas:Uranium fraction diagram with carbonate present.png|center|250x180px|alt=Grafik potensial vs. pH yang menunjukkan daerah stabilitas berbagai senyawa uranium]] |
|||
|- |
|||
|Konsentrasi relatif dari berbagai bentuk kimia uranium dalam media berair yang tidak membentuk kompleks (misalnya asam perklorat/[[natrium hidroksida]]).<ref name="medusa" /> |
|||
|Konsentrasi relatif dari berbagai bentuk kimia uranium dalam larutan karbonat berair.<ref name="medusa" /> |
|||
|} |
|||
====Pengaruh pH==== |
|||
Diagram fraksi uranium dengan adanya karbonat mengilustrasikan hal ini lebih lanjut: ketika pH larutan uranium(VI) meningkat, uranium diubah menjadi uranium oksida hidroksida terhidrasi dan pada pH tinggi menjadi kompleks hidroksida anionik. |
|||
Ketika karbonat ditambahkan, uranium diubah menjadi serangkaian kompleks karbonat jika pH dinaikkan. Salah satu efek dari reaksi ini adalah peningkatan kelarutan uranium dalam kisaran pH 6 hingga 8, sebuah fakta yang memiliki pengaruh langsung pada stabilitas jangka panjang bahan bakar nuklir uranium dioksida bekas. |
|||
===Hidrida, karbida, dan nitrida=== |
|||
Logam uranium yang dipanaskan hingga suhu {{convert|250|to|300|C|F}} bereaksi dengan [[hidrogen]] untuk membentuk [[uranium hidrida]]. Bahkan, suhu yang lebih tinggi akan menghilangkan hidrogen secara reversibel. Sifat ini membuat uranium hidrida menjadi bahan awal yang nyaman untuk membuat bubuk uranium reaktif bersama dengan berbagai senyawa uranium [[karbida]], [[nitrida]], dan [[halida]].{{sfn|Seaborg|1968|p=782}} Ada dua modifikasi kristal uranium hidrida: bentuk α yang diperoleh pada suhu rendah dan bentuk β yang dibuat ketika suhu formasi berada di atas 250 °C.{{sfn|Seaborg|1968|p=782}} |
|||
[[Uranium karbida]] dan [[uranium nitrida|nitrida]] merupakan senyawa [[semilogam]] yang relatif [[lengai]] yang sedikit larut dalam [[asam]], bereaksi dengan air, dan dapat menyala di [[udara]] untuk membentuk {{chem|U|3|O|8}}.{{sfn|Seaborg|1968|p=782}} Karbida uranium meliputi uranium monokarbida (U[[carbon|C]]), uranium dikarbida ({{chem|UC|2}}), dan diuranium trikarbida ({{chem|U|2|C|3}}). Baik UC maupun {{chem|UC|2}} dibentuk dengan menambahkan karbon pada uranium cair atau dengan memaparkan logam uranium pada karbon monoksida pada suhu tinggi. Stabil di bawah suhu 1800 °C, {{chem|U|2|C|3}} dibuat dengan menggunakan campuran UC dan {{chem|UC|2}} yang dipanaskan pada tekanan mekanis.{{sfn|Seaborg|1968|p=780}} Uranium nitrida diperoleh dengan pemaparan langsung logam uranium pada [[nitrogen]], meliputi uranium mononitrida (UN), uranium dinitrida ({{chem|UN|2}}), dan diuranium trinitrida ({{chem|U|2|N|3}}).{{sfn|Seaborg|1968|p=780}} |
|||
===Halida=== |
|||
[[Berkas:Uranium hexafluoride crystals sealed in an ampoule.jpg|thumb|upright=1.05|[[Uranium heksafluorida]] adalah bahan baku yang digunakan untuk memisahkan uranium-235 dari uranium alami.|alt=Zat seperti salju dalam ampul kaca tertutup.]] |
|||
<!--[[Berkas:Uranium-hexafluoride-2D-V2.svg|thumb|upright|[[Uranium heksafluorida]] adalah bahan baku yang digunakan untuk memisahkan uranium-235 dari uranium alami.|alt=Diagram kerangka senyawa kimia yang memiliki atom uranium di tengahnya yang terikat pada 6 atom fluorin.]]--> |
|||
Semua uranium fluorida dibuat menggunakan [[uranium tetrafluorida]] ({{chem|UF|4}}); {{chem|UF|4}} sendiri dibuat melalui hidrofluorinasi uranium dioksida.{{sfn|Seaborg|1968|p=782}} Reduksi {{chem|UF|4}} dengan hidrogen pada suhu 1000 °C menghasilkan uranium trifluorida ({{chem|UF|3}}). Di bawah kondisi suhu dan tekanan yang tepat, reaksi {{chem|UF|4}} dengan gas [[uranium heksafluorida]] ({{chem|UF|6}}) dapat membentuk fluorida intermediat {{chem|U|2|F|9}}, {{chem|U|4|F|17}}, dan {{chem|UF|5}}.{{sfn|Seaborg|1968|p=782}} |
|||
Pada suhu kamar, {{chem|UF|6}} memiliki [[tekanan uap]] yang tinggi, membuatnya berguna dalam proses [[difusi gas]] untuk memisahkan uranium-235 yang langka dari isotop uranium-238 yang umum. Senyawa ini dapat dibuat dari uranium dioksida dan uranium hidrida dengan proses berikut:{{sfn|Seaborg|1968|p=782}} |
|||
:{{chem|UO|2}} + 4 HF → {{chem|UF|4}} + 2 {{chem|H|2|O}} (500 °C, endotermik) |
|||
:{{chem|UF|4}} + {{chem|F|2}} → {{chem|UF|6}} (350 °C, endotermik) |
|||
{{chem|UF|6}} yang dihasilkan, berupa padatan putih, bersifat sangat [[reaksi kimia|reaktif]] (melalui fluorinasi), mudah [[Sublimasi (perubahan wujud zat)|menyublim]] (memancarkan uap yang berperilaku seperti [[gas ideal|gas hampir ideal]]), dan merupakan senyawa uranium yang paling volatil yang pernah ada.{{sfn|Seaborg|1968|p=782}} |
|||
Salah satu metode pembuatan [[uranium tetraklorida]] ({{chem|UCl|4}}) adalah dengan langsung menggabungkan [[klorin]] dengan logam uranium atau uranium hidrida. Reduksi {{chem|UCl|4}} oleh hidrogen akan menghasilkan uranium triklorida ({{chem|UCl|3}}) sedangkan klorida uranium yang lebih tinggi dibuat melalui reaksi dengan klorin tambahan.{{sfn|Seaborg|1968|p=782}} Semua uranium klorida bereaksi dengan air dan udara. |
|||
[[Bromida]] dan [[iodida]] uranium dibentuk melalui reaksi langsung, masing-masing, antara [[bromin]] dan [[iodin]] dengan uranium atau dengan menambahkan {{chem|UH|3}} ke dalam asam unsur tersebut.{{sfn|Seaborg|1968|p=782}} Contoh yang dikenal meliputi: {{chem|UBr|3}}, {{chem|UBr|4}}, {{chem|UI|3}}, dan {{chem|UI|4}}. {{chem|UI|5}} belum pernah disiapkan. Uranium oksihalida bersifat larut dalam air dan meliputi {{chem|UO|2|F|2}}, {{chem|UOCl|2}}, {{chem|UO|2|Cl|2}}, dan {{chem|UO|2|Br|2}}. Stabilitas oksihalida menurun dengan meningkatnya [[massa atom relatif|berat atom]] komponen halida.{{sfn|Seaborg|1968|p=782}} |
|||
==Isotop== |
|||
{{Utama|Isotop uranium}} |
|||
<!--[[Berkas:Uranium enrichment proportions.svg|thumb|upright=0.55|Grafik pai menunjukkan proporsi relatif uranium-238 (biru) dan uranium-235 (merah) pada berbagai tingkat pengayaan]]--> |
|||
Uranium, seperti semua unsur dengan [[nomor atom]] lebih besar dari 82, tidak memiliki [[Nuklida stabil|isotop stabil]]. Semua isotop uranium bersifat [[peluruhan radioaktif|radioaktif]] karena [[gaya nuklir kuat]] tidak mengalahkan [[Elektromagnetisme#Tolakan|tolakan elektromagnetik]] dalam nuklida yang mengandung lebih dari 82 proton.<ref name="beiser">{{cite book|title=Concepts of Modern Physics|chapter-url=http://phy240.ahepl.org/Concepts_of_Modern_Physics_by_Beiser.pdf |year=2003|publisher=[[McGraw Hill Education|McGraw-Hill Education]]|isbn=978-0-07-244848-1|chapter=Nuclear Transformations|pages=432–434 |edition=6 |first=A. |last=Beiser |access-date=13 Juni 2023|archive-date=4 Oktober 2016|archive-url=https://web.archive.org/web/20161004204701/http://phy240.ahepl.org/Concepts_of_Modern_Physics_by_Beiser.pdf|url-status=dead}}</ref> Namun demikian, dua isotop yang paling stabil, uranium-238 dan uranium-235, memiliki [[waktu paruh]] yang cukup lama untuk terjadi di alam sebagai [[Nuklida primordial#Nuklida primordial radioaktif|radionuklida primordial]], dengan jumlah terukur yang bertahan sejak pembentukan Bumi.<ref name=primU>{{cite journal |first1= I. U. |last1= Roederer |first2=K. |last2=Kratz |first3=A. |last3=Frebel |first4=N. |last4=Christlieb |first5=B. |last5=Pfeiffer |first6=J. J. |last6=Cowan |first7=C. |last7=Sneden |title=The end of nucleosynthesis: Production of lead and thorium in the early galaxy |date=2009 |journal=The Astrophysical Journal |volume=698 |number=2 |pages= 1963–1980 |doi=10.1088/0004-637X/698/2/1963|arxiv= 0904.3105 |bibcode= 2009ApJ...698.1963R |hdl= 2152/35050 |s2cid= 14814446 }}</ref> Kedua [[nuklida]] ini, bersama dengan [[torium-232]], adalah nuklida primordial yang dikonfirmasi lebih berat daripada [[bismut-209]] yang hampir stabil.{{NUBASE2020|ref}}{{refn|name=pu244}} |
|||
[[Uranium alam]]i terdiri dari tiga isotop utama: uranium-238 (99,28% kelimpahan alami), uranium-235 (0,71%), dan uranium-234 (0,0054%). Ada juga empat isotop renik lainnya: uranium-239, yang terbentuk ketika <sup>238</sup>U mengalami fisi spontan, melepaskan neutron yang ditangkap oleh atom <sup>238</sup>U; uranium-237, yang terbentuk ketika <sup>238</sup>U menangkap sebuah neutron tetapi memancarkan dua lagi, yang kemudian meluruh menjadi [[Isotop neptunium#Neptunium-237|neptunium-237]]; [[uranium-236]], yang terjadi dalam jumlah kecil akibat penangkapan neutron pada <sup>235</sup>U dan sebagai produk peluruhan [[plutonium-244]];{{refn|name=pu244|Terjadinya plutonium-244 sebagai nuklida primordial masih diperdebatkan, meskipun beberapa laporan pendeteksiannya juga dikaitkan dengan penggabungan dari [[medium antarbintang]].<ref name="PRC">{{cite journal|last=Lachner|first=J. |display-authors=etal|date=2012|title=Attempt to detect primordial <sup>244</sup>Pu on Earth|journal=Physical Review C|volume=85|issue=1|page=015801| doi=10.1103/PhysRevC.85.015801|bibcode=2012PhRvC..85a5801L}}</ref><ref name="WallnerFaestermann2015">{{cite journal |last1=Wallner |first1=A. |last2=Faestermann |first2=T. |last3=Feige |first3=J. |last4=Feldstein |first4=C. |last5=Knie |first5=K. |last6=Korschinek |first6=G. |last7=Kutschera |first7=W. |last8=Ofan |first8=A. |last9=Paul |first9=M. |last10=Quinto |first10=F. |last11=Rugel |first11=G. |last12=Steier |first12=P. |title=Abundance of live 244Pu in deep-sea reservoirs on Earth points to rarity of actinide nucleosynthesis |journal=Nature Communications |volume=6 |year=2015 |page=5956 |issn=2041-1723 |doi=10.1038/ncomms6956 |pmid=25601158 |pmc=4309418 |arxiv=1509.08054 |bibcode=2015NatCo...6.5956W}}</ref>}} dan terakhir, [[uranium-233]], yang terbentuk dalam [[deret radioaktif|rantai peluruhan]] neptunium-237. |
|||
Uranium-238 adalah isotop uranium yang paling stabil, dengan waktu paruh sekitar {{val|4.463|e=9}} tahun,{{NUBASE2020|ref}} kira-kira se[[usia Bumi]]. Uranium-238 sebagian besar merupakan pemancar alfa, meluruh menjadi torium-234. Ia akhirnya meluruh melalui [[Deret radioaktif#Deret uranium (atau deret radium)|deret uranium]], yang memiliki 18 anggota, menjadi [[Isotop timbal#Timbal-206|timbal-206]].<ref name="ColumbiaEncy" /> Uranium-238 bukan merupakan isotop [[bahan fisil|fisil]], tetapi [[bahan subur|subur]], karena setelah [[pengaktifan neutron|aktivasi neutron]], ia dapat diubah menjadi plutonium-239, isotop fisil lainnya. Memang, inti <sup>238</sup>U dapat menyerap satu neutron untuk menghasilkan isotop radioaktif [[Isotop uranium#Uranium-239|uranium-239]]. <sup>239</sup>U meluruh melalui [[Peluruhan beta|emisi beta]] menjadi [[neptunium]]-239, juga merupakan pemancar beta, yang pada gilirannya meluruh, dalam beberapa hari menjadi plutonium-239. <sup>239</sup>Pu digunakan sebagai bahan fisil dalam [[senjata nuklir|bom atom]] pertama yang diledakkan dalam "uji Trinity" pada 15 Juli 1945 di [[New Mexico]].{{sfn|Seaborg|1968|p=773}} |
|||
Uranium-235 memiliki waktu paruh sekitar {{val|7.04|e=8}} tahun; ia adalah isotop uranium paling stabil berikutnya setelah <sup>238</sup>U dan juga sebagian besar merupakan pemancar alfa, meluruh menjadi torium-231.{{NUBASE2020|ref}} Uranium-235 merupakan isotop yang penting untuk [[reaktor nuklir]] dan [[senjata nuklir]], karena ia merupakan satu-satunya isotop uranium yang ada di alam dalam jumlah signifikan yang bersifat fisil. Ini berarti ia dapat dipecah menjadi dua atau tiga fragmen ([[produk pembelahan atom|produk fisi]]) oleh [[Suhu neutron#Termal|neutron termal]].<ref name="ColumbiaEncy" /> Rantai peluruhan <sup>235</sup>U, yang disebut [[Deret radioaktif#Deret aktinium|deret aktinium]], memiliki 15 anggota dan akhirnya meluruh menjadi timbal-207.<ref name="ColumbiaEncy" /> Laju peluruhan yang konstan dalam deret peluruhan ini membuat perbandingan rasio unsur induk dan [[produk peluruhan|unsur anak]] berguna dalam [[penanggalan radiometrik]]. |
|||
Uranium-236 memiliki waktu paruh {{val|2.342|e=7}} tahun{{NUBASE2020|ref}} dan tidak ditemukan dalam jumlah yang signifikan di alam. Waktu paruh uranium-236 terlalu pendek untuk disebut primordial, meskipun ia telah diidentifikasi sebagai nenek moyang yang telah [[radionuklida punah|punah]] dari anak peluruhan alfanya, torium-232.<ref name="thoruranium"/> Uranium-236 terjadi pada [[bahan bakar nuklir bekas]] ketika penangkapan neutron pada <sup>235</sup>U tidak menyebabkan fisi, atau sebagai produk peluruhan [[plutonium-240]]. Uranium-236 bersifat tidak subur, karena diperlukan tiga penangkapan neutron lagi untuk menghasilkan <sup>239</sup>Pu yang bersifat fisil, dan ia sendiri tidak bersifat fisil; dengan demikian, ia dianggap limbah radioaktif berumur panjang.<ref name=236U>{{cite journal |title = Alpha-particle emission probabilities of <sup>236</sup>U obtained by alpha spectrometry |journal = Applied Radiation and Isotopes |volume = 87 |pages = 292–296 |year = 2014 |issn = 0969-8043 |doi = 10.1016/j.apradiso.2013.11.020 |first1=M. |last1=Marouli |first2=S. |last2=Pommé |first3=V. |last3=Jobbágy |first4=R. |last4=Van Ammel |first5=J. |last5=Paepen |first6=H. |last6=Stroh |first7=L. |last7=Benedik|pmid = 24309010 }}</ref> |
|||
Uranium-234 adalah anggota deret uranium dan terjadi dalam kesetimbangan dengan nenek moyangnya, <sup>238</sup>U; ia mengalami peluruhan alfa dengan waktu paruh 245.500 tahun{{NUBASE2020|ref}} dan meluruh menjadi timbal-206 melalui serangkaian isotop yang berumur relatif pendek. |
|||
Uranium-233 mengalami peluruhan alfa dengan waktu paruh 160.000 tahun dan, seperti <sup>235</sup>U, bersifat fisil.<ref name="LANL" /> Ia dapat dibiakkan dari [[torium-232]] melalui pemborbardiran neutron, biasanya dalam reaktor nuklir; proses ini dikenal sebagai [[siklus bahan bakar torium]]. Karena fisilitas <sup>233</sup>U dan kelimpahan alami torium yang lebih besar (tiga kali lipat uranium),<ref name="iaea2022">{{cite report |title=Near Term and Promising Long Term Options for the Deployment of Thorium Based Nuclear Energy |publisher=International Atomic Energy Agency |date=2022 |location=Vienna |url=https://www-pub.iaea.org/MTCD/Publications/PDF/TE-2009web.pdf}}</ref> <sup>233</sup>U telah diselidiki untuk digunakan sebagai bahan bakar nuklir sebagai alternatif yang mungkin untuk <sup>235</sup>U dan <sup>239</sup>Pu,<ref name="Forsburg 1999">{{cite journal |author1=Forsburg, C. W. |author2=Lewis, L. C. |title=Uses For Uranium-233: What Should Be Kept for Future Needs? |publisher=Laboratorium Nasional Oak Ridge |journal=Ornl-6952 |date=24 September 1999 |url=http://moltensalt.org/references/static/downloads/pdf/ORNL-6952.pdf}}</ref> meskipun ia tidak digunakan secara luas {{as of|lc=y|2022}}.<ref name="iaea2022"/> Rantai peluruhan uranium-233 merupakan bagian dari [[Deret radioaktif#Deret neptunium|deret neptunium]] dan berakhir pada bismut-209 yang hampir stabil (waktu paruh {{val|2.01|e=19|}} tahun){{NUBASE2020|ref}} dan [[talium]]-205 yang stabil. |
|||
[[Uranium-232]] adalah sebuah pemancar alfa dengan waktu paruh 68,9 tahun.{{NUBASE2020|ref}} Isotop ini diproduksi sebagai produk sampingan dalam produksi <sup>233</sup>U dan dianggap sebagai gangguan, karena ia tidak bersifat fisil dan meluruh melalui pemancar alfa dan [[sinar gama|gama]] seperti [[Isotop talium#Daftar isotop|<sup>208</sup>Tl]].<ref name="Forsburg 1999"/> Torium-232 juga diperkirakan dapat mengalami [[peluruhan beta ganda]], yang akan menghasilkan uranium-232, tetapi hal ini belum diamati secara eksperimental.{{NUBASE2020|ref}} |
|||
Semua isotop dari <sup>232</sup>U hingga <sup>236</sup>U memiliki cabang [[peluruhan gugus]] minor (kurang dari {{val|e=-10}}%), dan semua bar <sup>233</sup>U ini, selain <sup>238</sup>U, memiliki cabang [[pembelahan spontan|fisi spontan]] minor;{{NUBASE2020|ref}} [[rasio percabangan]] terbesar untuk fisi spontan adalah sekitar {{val|5|e=-5}}% untuk <sup>238</sup>U, atau sekitar satu dari setiap dua juta peluruhan.<ref>{{cite book |last=Goffer |first=Zvi |year=2006 |title=Archaeological Chemistry |page=106 |publisher=[[John Wiley & Sons|Wiley]] |edition=2 |isbn=978-0-471-91515-7}}</ref> Isotop renik berumur pendek <sup>237</sup>U dan <sup>239</sup>U secara eksklusif mengalami [[peluruhan beta]], dengan waktu paruh masing-masing 6,752 hari dan 23,45 menit.{{NUBASE2020|ref}} |
|||
Secara total, 28 isotop uranium telah diidentifikasi, mulai dari [[nomor massa]] 214<ref>{{cite journal |title=New α -Emitting Isotope 214 U and Abnormal Enhancement of α -Particle Clustering in Lightest Uranium Isotopes |year=2021 |url=https://journals.aps.org/prl/abstract/10.1103/PhysRevLett.126.152502 |doi=10.1103/PhysRevLett.126.152502 |access-date=13 Juni 2023|last1=Zhang |first1=Z. Y. |last2=Yang |first2=H. B. |last3=Huang |first3=M. H. |last4=Gan |first4=Z. G. |last5=Yuan |first5=C. X. |last6=Qi |first6=C. |last7=Andreyev |first7=A. N. |last8=Liu |first8=M. L. |last9=Ma |first9=L. |last10=Zhang |first10=M. M. |last11=Tian |first11=Y. L. |last12=Wang |first12=Y. S. |last13=Wang |first13=J. G. |last14=Yang |first14=C. L. |last15=Li |first15=G. S. |last16=Qiang |first16=Y. H. |last17=Yang |first17=W. Q. |last18=Chen |first18=R. F. |last19=Zhang |first19=H. B. |last20=Lu |first20=Z. W. |last21=Xu |first21=X. X. |last22=Duan |first22=L. M. |last23=Yang |first23=H. R. |last24=Huang |first24=W. X. |last25=Liu |first25=Z. |last26=Zhou |first26=X. H. |last27=Zhang |first27=Y. H. |last28=Xu |first28=H. S. |last29=Wang |first29=N. |last30=Zhou |first30=H. B. |journal=Physical Review Letters |volume=126 |issue=15 |page=152502 |pmid=33929212 |arxiv=2101.06023 |bibcode=2021PhRvL.126o2502Z |s2cid=231627674 |display-authors=1 }}</ref> hingga 242, dengan pengecualian 220.{{NUBASE2020|ref}}<ref name=U241>{{cite journal |title = Discovery of New Isotope <sup>241</sup>U and Systematic High-Precision Atomic Mass Measurements of Neutron-Rich Pa-Pu Nuclei Produced via Multinucleon Transfer Reactions |author1= Niwase, T. |author2=Watanabe, Y. X. |author3=Hirayama, Y. |author4=Mukai, M. |author5=Schury, P. |author6=Andreyev, A. N. |author7=Hashimoto, T. |author8=Iimura, S. |author9=Ishiyama, H. |author10=Ito, Y. |author11=Jeong, S. C. |author12=Kaji, D. |author13=Kimura, S. |author14=Miyatake, H. |author15=Morimoto, K. |author16=Moon, J.-Y. |author17=Oyaizu, M. |author18=Rosenbusch, M. |author19=Taniguchi, A. |author20=Wada, M. |display-authors=3 |journal = Physical Review Letters |volume = 130 |issue = 13 |pages = 132502-1–132502-6 |year = 2023 |doi = 10.1103/PhysRevLett.130.132502}}</ref> Di antara isotop uranium yang tidak ditemukan dalam sampel alami atau bahan bakar nuklir, isotop uranium yang berumur paling panjang adalah <sup>230</sup>U, sebuah pemancar alfa dengan waktu paruh 20,23 hari.{{NUBASE2020|ref}} Isotop ini telah dipertimbangkan untuk digunakan dalam [[terapi partikel alfa bertarget]] (TAT).<ref name="230Pa">{{cite journal |last1=Mastren |first1=T. |last2=Stein |first2=B.W. |last3=Parker |first3=T.G. |last4=Radchenko |first4=V. |last5=Copping |first5=R. |last6=Owens |first6=A. |last7=Wyant |first7=L.E. |last8=Brugh |first8=M. |last9=Kozimor |first9=S.A. |last10=Noriter |first10=F.M. |last11=Birnbaum |first11=E.R. |last12=John |first12=K.D. |last13=Fassbender |first13=M.E. |title=Separation of protactinium employing sulfur-based extraction chromatographic resins |journal=Analytical Chemistry |date=2018 |volume=90 |issue=11 |pages=7012–7017 |doi=10.1021/acs.analchem.8b01380 |pmid=29757620 |osti=1440455 |url=https://www.researchgate.net/publication/325135604 |issn=0003-2700}}</ref> Semua isotop lainnya memiliki waktu paruh lebih pendek dari satu jam, kecuali <sup>231</sup>U (waktu paruh 4,2 hari) dan <sup>240</sup>U (waktu paruh 14,1 jam).{{NUBASE2020|ref}} Isotop berumur terpendek yang diketahui adalah <sup>221</sup>U, dengan waktu paruh 660 [[Nano-|nano]]detik, dan diperkirakan <sup>220</sup>U yang hingga sekarang tidak diketahui memiliki waktu paruh yang bahkan lebih pendek.<ref name=Khuyagbaatar>{{Cite journal|last=Khuyagbaatar|first=J.|display-authors=et al|date=11 Desember 2015|title=New Short-Lived Isotope <sup>221</sup>U and the Mass Surface Near ''N'' = 126.|journal=Physical Review Letters|volume=115|issue=24 |pages=242502|doi=10.1103/PhysRevLett.115.242502|pmid=26705628 |bibcode=2015PhRvL.115x2502K |url=https://lup.lub.lu.se/record/8311218 }}</ref> Isotop kaya proton yang lebih ringan dari <sup>232</sup>U utamanya mengalami peluruhan alfa, kecuali <sup>229</sup>U dan <sup>231</sup>U, yang masing-masing meluruh menjadi [[isotop protaktinium]] melalui [[emisi positron]] dan [[tangkapan elektron|penangkapan elektron]]; <sup>240</sup>U dan <sup>242</sup>U yang kaya neutron mengalami [[peluruhan beta]] untuk membentuk [[isotop neptunium]].{{NUBASE2020|ref}} |
|||
===Pengayaan=== |
|||
{{Utama|Uranium yang diperkaya}} |
|||
[[Berkas:Gas centrifuge cascade.jpg|thumb|Sekumpulan [[pemusing gas]] digunakan untuk memperkaya bijih uranium untuk memusatkan isotop fisilnya.|alt=Sebuah foto aula besar yang dipenuhi susunan silinder panjang berwarna putih.]] |
|||
Di alam, uranium ditemukan sebagai uranium-238 (99,2742%) dan uranium-235 (0,7204%). [[Pemisahan isotop]] memusatkan (memperkaya) uranium-235 yang fisil untuk senjata nuklir dan sebagian besar pembangkit listrik tenaga nuklir, kecuali untuk [[reaktor berpendingin gas]] dan [[reaktor air berat bertekanan]]. Sebagian besar neutron yang dilepaskan oleh pemfisian atom uranium-235 harus berdampak pada atom uranium-235 lainnya untuk mempertahankan [[reaksi rantai nuklir]]. Konsentrasi dan jumlah uranium-235 yang dibutuhkan untuk mencapai ini disebut '[[massa kritis]]'. |
|||
Untuk dianggap 'diperkaya', fraksi uranium-235 harus antara 3% dan 5%.<ref>{{cite web |url=http://web.ead.anl.gov/uranium/guide/depletedu/enrich/index.cfm |title=Uranium Enrichment |access-date=13 Juni 2023 |publisher=Laboratorium Nasional Argonne |archive-url=https://web.archive.org/web/20070124232415/http://web.ead.anl.gov/uranium/guide/depletedu/enrich/index.cfm |archive-date=24 Januari 2007 |url-status=dead}}</ref> Proses ini menghasilkan uranium dalam jumlah besar, yang merupakan uranium-235 terdeplesi dan dengan fraksi uranium-238 yang meningkat, yang disebut uranium terdeplesi atau 'DU'. Untuk dianggap 'terdeplesi', konsentrasi isotop uranium-235 tidak boleh lebih dari 0,3%.<ref name="paducah">{{cite news |url=http://www.wise-uranium.org/dhap991.html |title=Depleted Uranium: a by-product of the Nuclear Chain |access-date=13 Juni 2023 |publisher=Laka Foundation |author=Diehl, Peter |url-status=dead |archive-url=https://archive.today/20130113114319/http://www.wise-uranium.org/dhap991.html |archive-date=13 Januari 2013}}</ref> Harga uranium telah meningkat sejak tahun 2001, sehingga tailing pengayaan yang mengandung lebih dari 0,35% uranium-235 sedang dipertimbangkan untuk pengayaan ulang, mendorong harga [[uranium heksafluorida terdeplesi]] di atas AS$130 per kilogram pada Juli 2007 dari AS$5 pada tahun 2001.<ref name="paducah" /> |
|||
Proses [[pemusing gas|sentrifugasi gas]], di mana gas [[uranium heksafluorida]] ({{chem|UF|6}}) dipisahkan oleh perbedaan berat molekul antara <sup>235</sup>UF<sub>6</sub> dan <sup>238</sup>UF<sub>6</sub> menggunakan [[pemusing]] berkecepatan tinggi, merupakan proses pengayaan termurah dan terdepan.{{sfn|Emsley|2001|p=478}} Proses [[difusi gas]] telah menjadi metode utama untuk pengayaan dan digunakan dalam [[Proyek Manhattan]]. Dalam proses ini, uranium heksafluorida berulang kali ter[[difusi]] melalui membran [[perak]]-[[seng]], dan berbagai isotop uranium dipisahkan oleh laju difusi (karena uranium-238 lebih berat, ia berdifusi sedikit lebih lambat daripada uranium-235).{{sfn|Emsley|2001|p=478}} Metode [[pemisahan isotop laser molekuler]] (MLIS) menggunakan sinar [[laser]] berenergi tepat untuk memutuskan ikatan antara uranium-235 dan [[fluorin]]. Ini membuat uranium-238 terikat pada fluorin dan memungkinkan logam uranium-235 mengendap dari larutan.{{sfn|Emsley|2001|p=479}} Metode pengayaan laser alternatif dikenal sebagai [[pemisahan isotop laser uap atom]] (AVLIS) dan menggunakan [[laser yang dapat diatur]] yang dapat terlihat seperti [[laser pewarna]].<ref>{{cite book |editor=[[F. J. Duarte|Duarte, F. J.]] |editor2=Hillman, L. W. |title=Dye Laser Principles |publisher=Academic |date=1990 |page=413 |isbn=978-0-12-222700-4 |url=http://www.opticsjournal.com/dlp.htm |url-status=dead |archive-url=https://web.archive.org/web/20100917020215/http://www.opticsjournal.com/dlp.htm |archive-date=17 September 2010}}</ref> Metode lain yang digunakan adalah difusi termal cair.<ref name="SciTechEncy" /> |
|||
Satu-satunya penyimpangan yang signifikan dari rasio <sup>235</sup>U terhadap <sup>238</sup>U dalam sampel alami yang diketahui terjadi di [[Oklo]], [[Gabon]], di mana [[reaktor nuklir alam|reaktor fisi nuklir alami]] mengonsumsi sebagian dari <sup>235</sup>U sekitar dua miliar tahun yang lalu ketika rasio <sup>235</sup>U terhadap <sup>238</sup>U lebih mirip dengan [[uranium yang diperkaya|uranium yang diperkaya rendah]] yang memungkinkan air biasa ("ringan") untuk bertindak sebagai [[moderator neutron]] mirip dengan proses dalam [[reaktor air ringan]] buatan manusia. Adanya reaktor fisi alami yang telah diprediksi secara teoretis sebelumnya terbukti dengan ditemukannya sedikit penyimpangan konsentrasi <sup>235</sup>U dari nilai yang diperkirakan selama [[pengayaan uranium]] di Prancis. Investigasi selanjutnya untuk mengesampingkan tindakan jahat manusia (seperti pencurian <sup>235</sup>U) mengkonfirmasi teori itu dengan menemukan rasio isotop [[produk pembelahan atom|produk fisi]] umum (atau lebih tepatnya nuklida anak stabil mereka) sejalan dengan nilai yang diperkirakan untuk fisi tetapi menyimpang dari nilai yang diharapkan untuk sampel turunan non-fisi dari unsur-unsur tersebut. |
|||
==Paparan manusia== |
|||
Seseorang dapat terpapar uranium (atau [[produk peluruhan|anak radioaktif]]nya, seperti [[radon]]) dengan menghirup debu di udara atau dengan menelan air dan makanan yang terkontaminasi. Jumlah uranium di udara biasanya sangat kecil; namun, orang-orang yang bekerja di pabrik yang memproses [[pupuk]] [[fosfat]], tinggal di dekat fasilitas pemerintah yang membuat atau menguji senjata nuklir, tinggal atau bekerja di dekat medan perang modern di mana [[senjata]] uranium terdeplesi telah digunakan,<ref name=Fink/> atau tinggal atau bekerja di dekat pembangkit listrik tenaga [[batu bara]], fasilitas yang menambang atau memproses bijih uranium, atau pengayaan uranium untuk bahan bakar reaktor, mungkin mengalami peningkatan paparan uranium.<ref name="EPA-Rad">{{cite web |date=16 Februari 2023 |title=Radionuclide Basics: Uranium |publisher=U.S. Environmental Protection Agency |url=https://www.epa.gov/radiation/radionuclide-basics-uranium |access-date=13 Juni 2023}}</ref><ref name="ATSDR-ToxFAQ">{{cite web |title=ToxFAQ for Uranium |url=https://wwwn.cdc.gov/TSP/ToxFAQs/ToxFAQsDetails.aspx?faqid=439&toxid=77 |access-date=13 Juni 2023 |publisher=Agency for Toxic Substances and Disease Registry |date=18 Maret 2014}}</ref> Rumah atau bangunan yang berada di atas deposit uranium (endapan terak alami atau buatan manusia) mungkin memiliki peningkatan paparan gas radon. [[Administrasi Keselamatan dan Kesehatan Kerja]] (OSHA) telah menetapkan [[Batas paparan diizinkan|batas paparan yang diizinkan]] untuk paparan uranium di tempat kerja sebesar 0,25 mg/m<sup>3</sup> selama 8 jam hari kerja. [[Institut Nasional untuk Keselamatan dan Kesehatan Kerja]] (NIOSH) telah menetapkan [[Batas paparan rekomendasi|batas paparan yang direkomendasikan]] (REL) sebesar 0,2 mg/m<sup>3</sup> selama 8 jam hari kerja dan batas jangka pendek sebesar 0,6 mg/m<sup>3</sup>. Pada kadar 10 mg/m<sup>3</sup>, uranium [[IDLH|langsung berbahaya bagi kehidupan dan kesehatan]].<ref>{{cite web |date=30 Oktober 2019 |title=CDC – NIOSH Pocket Guide to Chemical Hazards – Uranium (insoluble compounds, as U) |url=https://www.cdc.gov/niosh/npg/npgd0650.html |access-date=13 Juni 2023 |website=Institut Nasional untuk Keselamatan dan Kesehatan Kerja}}</ref> |
|||
Sebagian besar uranium yang tertelan dikeluarkan selama proses [[pencernaan]]. Hanya 0,5% yang diserap ketika bentuk uranium yang tidak larut, seperti oksidanya, dicerna, sedangkan penyerapan ion [[uranil]] yang lebih larut dapat mencapai 5%.{{sfn|Emsley|2001|p=477}} Namun, senyawa uranium yang larut cenderung cepat melewati tubuh, sedangkan senyawa uranium yang tidak larut, terutama ketika terhirup melalui debu ke dalam [[paru-paru]], menimbulkan bahaya yang lebih serius. Setelah memasuki aliran darah, uranium yang diserap cenderung ter[[bioakumulasi]] dan tinggal selama bertahun-tahun di jaringan [[tulang]] karena afinitas uranium terhadap fosfat.{{sfn|Emsley|2001|p=477}} Uranium yang masuk akan menjadi ion uranil, yang menumpuk di tulang, hati, ginjal, dan jaringan reproduksi.<ref>{{cite book |last=Permyakov |first=Eugene |title=Metalloproteomics |publisher=John Wiley & Sons |place=Hoboken |date=2009 |isbn=978-0-470-44774-1 |oclc=609844907 |page=564}}</ref> |
|||
Toksisitas radiologis dan kimiawi uranium digabungkan oleh fakta bahwa unsur-unsur dengan nomor atom tinggi seperti uranium menunjukkan radiotoksisitas sekunder meskipun penyerapan gama latar belakang dan sinar-X alami serta emisi ulang fotoelektron, yang dikombinasikan dengan afinitas tinggi uranium ke gugus fosfat DNA menyebabkan peningkatan jumlah pemutusan DNA untai tunggal dan ganda.<ref>Busby, C. and Schnug, E. (2008). "Advanced biochemical and biophysical aspects of uranium contamination". In: De Kok, L.J. and Schnug, E. (Eds) ''Loads and Fate of Fertilizer Derived Uranium''. Backhuys Publishers, Leiden, Belanda. {{ISBN| 978-90-5782-193-6}}</ref> |
|||
Uranium tidak diserap melalui kulit, dan [[partikel alfa]] yang dikeluarkan oleh uranium tidak dapat menembus kulit.<ref name="epa" /> |
|||
Uranium dapat didekontaminasi dari permukaan baja dan<ref name="Francis">{{cite journal |pmid=16053105 |date=2005 |last1=Francis |first1=A. J. |last2=Dodge |first2=C. J. |last3=McDonald |first3=J. A. |last4=Halada |first4=G. P. |title=Decontamination of uranium-contaminated steel surfaces by hydroxycarboxylic acid with uranium recovery |volume=39 |issue=13 |pages=5015–21 |journal=Environmental Science & Technology |doi=10.1021/es048887c |bibcode=2005EnST...39.5015F}}</ref> dan [[akuifer]].<ref>{{Cite journal |last=Gandhi |first=T. Pushparaj |last2=Sampath |first2=Prasanna Venkatesh |last3=Maliyekkal |first3=Shihabudheen M. |date=15 Juni 2022 |title=A critical review of uranium contamination in groundwater: Treatment and sludge disposal |journal=The Science of the Total Environment |volume=825 |pages=153947 |pmid=35189244 |doi=10.1016/j.scitotenv.2022.153947 |issn=1879-1026}}</ref><ref>{{Cite journal |last=Prusty |first=Sourav |last2=Somu |first2=Prathap |last3=Sahoo |first3=Jitendra Kumar |last4=Panda |first4=Debasish |last5=Sahoo |first5=Sunil Kumar |last6=Sahoo |first6=Shraban Kumar |last7=Lee |first7=Yong Rok |last8=Jarin |first8=T. |last9=Sundar |first9=L. Syam |last10=Rao |first10=Koppula Srinivas |date=Desember 2022 |title=Adsorptive sequestration of noxious uranium (VI) from water resources: A comprehensive review |journal=Chemosphere |volume=308 |issue=Pt 1 |pages=136278 |doi=10.1016/j.chemosphere.2022.136278 |issn=1879-1298 |pmid=36057349}}</ref> |
|||
===Efek dan pencegahan=== |
|||
Fungsi normal [[ginjal]], [[otak]], [[hati]], [[jantung]], dan sistem lain dapat dipengaruhi oleh paparan uranium, karena, selain bersifat radioaktif lemah, uranium adalah [[toksisitas logam|logam beracun]].{{sfn|Emsley|2001|p=477}}<ref name="Craft04">{{cite journal |
|||
| title = Depleted and natural uranium: chemistry and toxicological effects |
|||
| author = Craft, E. S. |
|||
| author2 = Abu-Qare, A. W. |
|||
| author3 = Flaherty, M. M. |
|||
| author4 = Garofolo, M. C. |
|||
| author5 = Rincavage, H. L. |
|||
| author6 = Abou-Donia, M. B. |
|||
| name-list-style = amp |
|||
| journal = Journal of Toxicology and Environmental Health Part B: Critical Reviews |
|||
| date = 2004 |
|||
| volume = 7 |
|||
| issue = 4 |
|||
| pmid = 15205046 |
|||
| pages = 297–317 |
|||
| doi = 10.1080/10937400490452714| url = http://www.dmzhawaii.org/wp-content/uploads/2009/02/health-overview-04.pdf |
|||
| citeseerx = 10.1.1.535.5247 |
|||
| s2cid = 9357795 |
|||
}}</ref><ref name="ATSDR">{{cite report |title=Toxicological Profile for Uranium |chapter=2. Relevance to Public Health |pages=11–38 |chapter-url=http://www.atsdr.cdc.gov/toxprofiles/tp150-c2.pdf |url=https://wwwn.cdc.gov/TSP/ToxProfiles/ToxProfiles.aspx?id=440&tid=77 |author=Agency for Toxic Substances and Disease Registry (ATSDR) |location=Atlanta, GA| publisher=U.S. Department of Health and Human Services, Public Health Service| id=CAS# 7440-61-1 |date=Februari 2013}}</ref> Uranium juga merupakan [[Toksisitas reproduktif|racun reproduktif]].<ref name="Hindin2005">{{cite journal |doi=10.1186/1476-069X-4-17 |last1=Hindin |first1=Rita|last2=Brugge |date=2005 |first2=D. |last3=Panikkar |first3=B. |title=Teratogenicity of depleted uranium aerosols: A review from an epidemiological perspective |journal=Environ Health |volume=4 |page=17 |pmid=16124873|pmc=1242351}}</ref><ref>{{cite journal |
|||
| author = Arfsten, D.P. |
|||
| author2 = K.R. Still |
|||
| author3 = G.D. Ritchie |
|||
| date = 2001 |
|||
| title = A review of the effects of uranium and depleted uranium exposure on reproduction and fetal development |
|||
| journal = Toxicology and Industrial Health |
|||
| volume = 17 |
|||
| pages = 180–91 |
|||
| doi = 10.1191/0748233701th111oa |
|||
| issue = 5–10 |
|||
| pmid = 12539863| s2cid = 25310165 |
|||
}}</ref> Efek radiologi umumnya bersifat lokal karena radiasi alfa, bentuk utama peluruhan <sup>238</sup>U, memiliki jangkauan yang sangat pendek, dan tidak akan menembus kulit. Radiasi alfa dari uranium yang dihirup telah terbukti menyebabkan [[kanker]] paru-paru pada pekerja nuklir yang terpapar.<ref>{{cite journal |last1= Grellier |first1= James |
|||
|last2= Atkinson|first2= Will |
|||
|last3= Bérard|first3= Philippe |
|||
|last4= Bingham|first4= Derek |
|||
|last5= Birchall|first5= Alan |
|||
|last6= Blanchardon|first6= Eric |
|||
|last7= Bull|first7= Richard |
|||
|last8= Guseva Canu|first8= Irina |
|||
|last9= Challeton-de Vathaire|first9= Cécile |
|||
|last10= Cockerill|first10=Rupert |
|||
|last11= Do|first11=Minh T |
|||
|last12= Engels|first12= Hilde |
|||
|last13= Figuerola|first13= Jordi |
|||
|last14= Foster|first14= Adrian |
|||
|last15= Holmstock|first15= Luc |
|||
|last16= Hurtgen|first16= Christian |
|||
|last17= Laurier|first17= Dominique |
|||
|last18= Puncher|first18= Matthew |
|||
|last19= Riddell |first19= Tony |
|||
|last20= Samson |first20= Eric |
|||
|last21= Thierry-Chef |first21= Isabelle |
|||
|last22= Tirmarche |first22= Margot |
|||
|last23= Vrijheid |first23= Martine |
|||
|last24= Cardis |first24= Elisabeth|date= 2017|title= Risk of lung cancer mortality in nuclear workers from internal exposure to alpha particle-emitting radionuclides.|journal= Epidemiology|volume= 28|issue= 5|pages= 675–684|doi= 10.1097/EDE.0000000000000684|pmc= 5540354 |pmid=28520643}}</ref> Walaupun CDC telah menerbitkan satu penelitian bahwa tidak ada kanker pada manusia yang terlihat akibat paparan uranium alami atau terdeplesi,<ref name="ATSDR-PHS">{{cite web |url=https://www.atsdr.cdc.gov/ToxProfiles/tp150-c1-b.pdf |title=Public Health Statement for Uranium |publisher=CDC |access-date=13 Juni 2023}}</ref> paparan uranium dan produk peluruhannya, terutama [[radon]], merupakan ancaman kesehatan yang signifikan.<ref>[https://www.cdc.gov/niosh/pgms/worknotify/fernald.html Radon Exposures to Workers at the Fernald Feed Materials Production Center]. Halaman diulas: 8 April 2020. U.S. National Institute for Occupational Safety and Health (NIOSH)</ref> Paparan terhadap [[stronsium-90]], [[iodin-131]], dan produk fisi lainnya tidak terkait dengan paparan uranium, tetapi dapat terjadi akibat prosedur medis atau paparan bahan bakar reaktor bekas atau luruhan dari senjata nuklir.<ref>Chart of the Nuclides, US Atomic Energy Commission 1968</ref> |
|||
Meskipun paparan penghirupan yang tidak disengaja terhadap [[uranium heksafluorida]] konsentrasi tinggi telah mengakibatkan kematian manusia, kematian tersebut dikaitkan dengan pembentukan asam fluorida dan [[uranil fluorida]] yang sangat beracun daripada dengan uranium itu sendiri.<ref>{{cite book |url=https://books.google.com/books?id=qDf3AO8nILoC&pg=PA1468 |page=1468 |title=Medical Toxicology |author=Dart, Richard C.|publisher=Lippincott Williams & Wilkins |date=2004 |isbn=978-0-7817-2845-4}}</ref> Logam uranium yang terbelah halus menimbulkan bahaya kebakaran karena uranium bersifat [[piroforik]]; butiran kecilnya akan menyala secara spontan di udara pada suhu kamar.<ref name="LANL" /> |
|||
Logam uranium biasanya ditangani dengan sarung tangan sebagai tindakan pencegahan yang memadai.<ref name="DOH.WA">{{cite web |publisher=Washington State Department of Health, Office of Radiation Protection |url=http://www.doh.wa.gov/ehp/rp/factsheets/factsheets-htm/fs27uran.htm |title=Radiation Fact Sheets #27, Uranium (U) |date=2010 |access-date=13 Juni 2023 |archive-url=https://web.archive.org/web/20110928164044/http://www.doh.wa.gov/ehp/rp/factsheets/factsheets-htm/fs27uran.htm |archive-date=28 September 2011 |url-status=dead}}</ref> Konsentrat uranium ditangani dan disimpan untuk memastikan bahwa orang tidak menghirup atau menelannya.<ref name="DOH.WA" /> |
|||
==Lihat pula== |
|||
{{div col}} |
|||
* [[Daftar kecelakaan dan insiden nuklir]] |
|||
* [[Daftar negara menurut cadangan uranium]] |
|||
* [[Daftar negara menurut produksi uranium]] |
|||
* [[Daftar proyek uranium]] |
|||
* [[Fisika nuklir]] |
|||
* [[Ikatan rangkap lima]] (sebelumnya dianggap sebagai [[ikatan Phi]]), dalam molekul U<sub>2</sub> |
|||
* [[Kecelakaan dan insiden nuklir]] |
|||
* [[Residu K-65]] |
|||
* [[Siklus bahan bakar nuklir]] |
|||
* [[Siklus bahan bakar torium]] |
|||
* [[Teknik nuklir]] |
|||
* [[World Uranium Hearing]] |
|||
{{div col end}} |
|||
==Catatan== |
|||
{{reflist}} |
|||
==Referensi== |
|||
* {{Cite book |date=2001 |chapter=Uranium |chapter-url=https://books.google.com/books?id=j-Xu07p3cKwC |title=Nature's Building Blocks: An A to Z Guide to the Elements |publisher=[[Oxford University Press]] |location=[[Oxford]] |isbn=978-0-19-850340-8 |author-link=John Emsley |first=John |last=Emsley |pages=[https://archive.org/details/naturesbuildingb0000emsl/page/476 476–482]|url=https://archive.org/details/naturesbuildingb0000emsl/page/476 }} |
|||
* {{Cite book |title=The Encyclopedia of the Chemical Elements |chapter=Uranium |date=1968 |author-link=Glenn Seaborg |first=Glenn T. |last=Seaborg |publisher=Reinhold Book Corporation |location=Skokie, Illinois |pages=773–786 |lccn=68029938}} |
|||
==Pranala luar== |
|||
{{Commons|Uranium}} |
|||
{{Wiktionary|uranium}} |
|||
* {{en}} [http://www.eia.gov/nuclear/ Data dan analisis bahan bakar nuklir] dari [[Administrasi Informasi Energi|Administrasi Informasi Energi A.S.]] |
|||
* {{en}} [http://www.uxc.com Harga pasar uranium saat ini] |
|||
* {{en}} [http://www.wise-uranium.org/umaps.html Peta deposit uranium dunia] |
|||
* {{en}} [https://web.archive.org/web/20051214080409/http://alsos.wlu.edu/qsearch.aspx?browse=science%2FUranium Bibliografi beranotasi untuk uranium dari Perpustakaan Digital Alsos] |
|||
* {{en}} [http://toxnet.nlm.nih.gov/cgi-bin/sis/search/r?dbs+hsdb:@term+@na+@rel+uranium,+radioactive Bank Data Zat Berbahaya NLM—Uranium, Radioaktif] |
|||
* {{en}} [https://www.cdc.gov/niosh/npg/npgd0650.html CDC – Panduan Saku NIOSH untuk Bahaya Kimia] |
|||
* {{en}} [http://www.infomine.com/library/publications/docs/Mining.com/Feb2008e.pdf Penambangan Uranium di Tambang Langer Heinrich, Namibia] |
|||
* {{en}} [http://www.world-nuclear-news.org/ Berita Nuklir Dunia] |
|||
* {{en}} [http://www.atsdr.cdc.gov/csem/uranium/ Studi Kasus ATSDR dalam Pengobatan Lingkungan: Toksisitas Uranium] [[Departemen Kesehatan dan Layanan Masyarakat Amerika Serikat|Departemen Kesehatan dan Layanan Masyarakat A.S.]] |
|||
* {{en}} [http://www.periodicvideos.com/videos/092.htm Uranium] di ''[[The Periodic Table of Videos]]'' (Universitas Nottingham) |
|||
{{Tabel periodik unsur kimia}} |
|||
{{Senyawa uranium}} |
|||
{{Proyek Manhattan}} |
|||
{{Authority control}} |
|||
[[Kategori:Uranium| ]] |
|||
[[Kategori:Unsur kimia]] |
[[Kategori:Unsur kimia]] |
||
[[Kategori:Aktinida]] |
[[Kategori:Aktinida]] |
||
[[Kategori:Bahan |
[[Kategori:Bahan nuklir]] |
||
[[Kategori: |
[[Kategori:Bahan bakar nuklir]] |
||
[[Kategori:Proyek Manhattan]] |
|||
Revisi terkini sejak 16 September 2023 12.13
92U Uranium | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Uranium yang diperkaya tinggi | ||||||||||||||||||||||||||||||||||||||||||||||||||
Garis spektrum uranium | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat umum | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengucapan | /uranium/[1] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Penampilan | metalik abu-abu keperakan; teroksidasi menjadi hitam ketika terpapar dengan udara | |||||||||||||||||||||||||||||||||||||||||||||||||
| Uranium dalam tabel periodik | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor atom (Z) | 92 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Golongan | golongan n/a | |||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | periode 7 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | blok-f | |||||||||||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | aktinida | |||||||||||||||||||||||||||||||||||||||||||||||||
| Berat atom standar (Ar) |
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Rn] 5f3 6d1 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 32, 21, 9, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat fisik | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | |||||||||||||||||||||||||||||||||||||||||||||||||
| Titik lebur | 1405,3 K (1132,2 °C, 2070 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Titik didih | 4404 K (4131 °C, 7468 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Kepadatan mendekati s.k. | 19,1 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||
| saat cair, pada t.l. | 17,3 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor peleburan | 9,14 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor penguapan | 417,1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||
| Kapasitas kalor molar | 27,665 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||
Tekanan uap
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat atom | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | +1, +2, +3,[2] +4, +5, +6 (oksida amfoter) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 1,38 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 597,6 kJ/mol ke-2: 1420 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari atom | empiris: 156 pm | |||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari kovalen | 196±7 pm | |||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari van der Waals | 186 pm | |||||||||||||||||||||||||||||||||||||||||||||||||
| Lain-lain | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | primordial | |||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | ortorombus | |||||||||||||||||||||||||||||||||||||||||||||||||
| Kecepatan suara batang ringan | 3155 m/s (suhu 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Ekspansi kalor | 13,9 µm/(m·K) (suhu 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Konduktivitas termal | 27,5 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitas listrik | 0,280 µΩ·m (suhu 0 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Arah magnet | paramagnetik | |||||||||||||||||||||||||||||||||||||||||||||||||
| Modulus Young | 208 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Modulus Shear | 111 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Modulus curah | 100 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Rasio Poisson | 0,23 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Skala Vickers | 1960–2500 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Skala Brinell | 2350–3850 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 7440-61-1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Sejarah | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Penamaan | dari planet Uranus, ia sendiri dinamai dari dewa langit Yunani Uranus | |||||||||||||||||||||||||||||||||||||||||||||||||
| Penemuan | Martin H. Klaproth (1789) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Isolasi pertama | E. Péligot (1841) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Isotop uranium yang utama | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
Uranium adalah sebuah unsur kimia dengan lambang U dan nomor atom 92. Ia merupakan logam berwarna abu-abu keperakan dalam deret aktinida tabel periodik. Sebuah atom uranium memiliki 92 proton dan 92 elektron, dimana 6 di antaranya adalah elektron valensi. Uranium meluruh secara radioaktif dengan memancarkan sebuah partikel alfa. Waktu paruh peluruhan ini bervariasi antara 159.200 dan 4,5 miliar tahun untuk isotop yang berbeda, menjadikannya berguna untuk menentukan usia Bumi. Isotop paling umum dalam uranium alami adalah uranium-238 (yang memiliki 146 neutron dan menyumbang lebih dari 99% uranium di Bumi) dan uranium-235 (yang memiliki 143 neutron). Uranium memiliki berat atom tertinggi dari unsur-unsur yang terjadi secara primordial. Kepadatannya sekitar 70% lebih tinggi dari timbal, dan sedikit lebih rendah dari emas atau wolfram. Ia terjadi secara alami dalam konsentrasi rendah, yaitu beberapa bagian per juta di tanah, batu dan air, dan ia diekstraksi secara komersial dari mineral yang mengandung uranium seperti uraninit.[3]
Banyak penggunaan uranium kontemporer mengeksploitasi sifat nuklirnya yang unik. Uranium-235 adalah satu-satunya isotop fisil alami, yang membuatnya banyak digunakan pada pembangkit listrik tenaga nuklir dan senjata nuklir. Namun, karena konsentrasi kecil yang ditemukan di alam, uranium perlu mengalami pengayaan agar uranium-235 dapat cukup. Uranium-238 dapat difisi oleh neutron cepat, dan ia bersifat subur, artinya ia dapat ditransmutasikan menjadi plutonium-239 yang fisil dalam reaktor nuklir. Isotop fisil lainnya, uranium-233, dapat diproduksi dari torium alami dan dipelajari untuk penggunaan industri di masa depan dalam teknologi nuklir. Uranium-238 memiliki kemungkinan kecil untuk mengalami fisi spontan atau bahkan fisi terinduksi dengan neutron cepat; uranium-235, dan pada tingkat yang lebih rendah uranium-233, memiliki penampang lintang fisi yang jauh lebih tinggi untuk neutron lambat. Dalam konsentrasi yang cukup, isotop-isotop ini mempertahankan reaksi rantai nuklir yang berkelanjutan. Hal ini menghasilkan panas dalam reaktor tenaga nuklir, dan menghasilkan bahan fisil untuk senjata nuklir. Uranium terdeplesi (238U) digunakan dalam penetrator energi kinetik dan pelapisan pelindung.[4][5]
Penemuan uranium pada tahun 1789 dalam mineral uraninit dikreditkan pada Martin Heinrich Klaproth, yang menamai unsur baru tersebut dengan nama planet Uranus yang saat itu baru ditemukan. Eugène-Melchior Péligot adalah orang pertama yang mengisolasi logam tersebut dan sifat radioaktifnya ditemukan pada tahun 1896 oleh Henri Becquerel. Penelitian yang dilakukan oleh Otto Hahn, Lise Meitner, Enrico Fermi dan lainnya, seperti J. Robert Oppenheimer mulai tahun 1934 menyebabkan penggunaannya mulai meningkat, seperti sebagai bahan bakar dalam industri tenaga nuklir dan Little Boy, senjata nuklir pertama yang digunakan dalam perang. Perlombaan senjata berikutnya selama Perang Dingin antara Amerika Serikat dan Uni Soviet menghasilkan puluhan ribu senjata nuklir yang menggunakan logam uranium dan plutonium-239 yang diturunkan dari uranium. Pembongkaran senjata ini dan fasilitas nuklir terkait dilakukan dalam berbagai program pelucutan senjata nuklir dan menelan biaya miliaran dolar. Uranium tingkat senjata yang diperoleh dari senjata nuklir kemudian diencerkan dengan uranium-238 dan digunakan kembali sebagai bahan bakar reaktor nuklir. Pengembangan dan penyebaran reaktor nuklir ini berlanjut di basis global karena merupakan sumber energi bebas CO2 yang kuat. Bahan bakar nuklir bekas membentuk limbah radioaktif, yang sebagian besar terdiri dari uranium-238 dan menimbulkan ancaman kesehatan dan dampak lingkungan yang signifikan.
Karakteristik[sunting | sunting sumber]

Uranium adalah logam radioaktif lemah berwarna putih keperakan. Ia memiliki kekerasan Mohs sebesar 6, cukup untuk menggores kaca dan kira-kira setara dengan titanium, rodium, mangan, dan niobium. Ia bersifat lunak, ulet, sedikit paramagnetik, elektropositif kuat, dan merupakan konduktor listrik yang buruk.[6][7] Logam uranium memiliki kepadatan yang sangat tinggi, yaitu 19,1 g/cm3,[8] lebih padat dari timbal (11,3 g/cm3),[9] tetapi sedikit kurang padat dibandingkan wolfram dan emas (19,3 g/cm3).[10][11]
Logam uranium bereaksi dengan hampir semua unsur nonlogam (kecuali gas mulia) dan senyawanya, dengan reaktivitas yang meningkat seiring peningkatan suhu.[12] Asam klorida dan nitrat melarutkan uranium, tetapi asam nonoksidator selain asam klorida menyerang unsur tersebut dengan sangat lambat.[6] Saat dibelah halus, ia dapat bereaksi dengan air dingin; di udara, logam uranium akan terlapisi dengan lapisan gelap uranium oksida.[7] Uranium dalam bijih diekstraksi secara kimiawi dan diubah menjadi uranium dioksida atau bentuk kimia lain yang dapat digunakan dalam industri.
Uranium-235 adalah isotop pertama yang ditemukan bersifat fisil. Isotop alami lainnya dapat difisi, tetapi tidak fisil. Saat dibombardir dengan neutron lambat, isotop uranium-235-nya sebagian besar akan terbagi menjadi dua inti yang lebih kecil, melepaskan energi pengikatan inti dan lebih banyak neutron. Jika terlalu banyak neutron ini diserap oleh inti uranium-235 lainnya, reaksi rantai nuklir akan terjadi yang menghasilkan semburan panas atau (dalam keadaan khusus) ledakan. Dalam reaktor nuklir, reaksi rantai seperti itu diperlambat dan dikendalikan oleh racun neutron, menyerap beberapa neutron bebas. Bahan penyerap neutron tersebut sering menjadi bagian dari batang kendali reaktor (lihat fisika reaktor nuklir untuk penjelasan proses kendali reaktor ini).
Sesedikit 15 pon (6,8 kg) uranium-235 dapat digunakan untuk membuat bom atom.[13] Senjata nuklir yang diledakkan di Hiroshima, disebut Little Boy, mengandalkan fisi uranium. Namun, bom nuklir pertama (Gadget yang digunakan pada Trinity) dan bom yang diledakkan di Nagasaki (Fat Man) adalah bom plutonium.
Logam uranium memiliki tiga bentuk alotropik:[14]
- α (ortorombus) stabil hingga suhu 668 °C (1.234 °F). Ortorombus, grup ruang No. 63, Cmcm, parameter kisi a = 285,4 pm, b = 587 pm, c = 495,5 pm.[15]
- β (tetragon) stabil dari 668 hingga 775 °C (1.234 hingga 1.427 °F). Tetragon, grup ruang P42/mnm, P42nm, atau P4n2, parameter kisi a = 565,6 pm, b = c = 1075,9 pm.[15]
- γ (kubus berpusat-badan) dari 775 °C (1.427 °F) hingga titik lebur—ini adalah keadaan yang paling lunak dan ulet. Kubus berpusat-badan, parameter kisi a = 352,4 pm.[15]
Aplikasi[sunting | sunting sumber]
Militer[sunting | sunting sumber]

Aplikasi utama uranium di sektor militer adalah penetrator kepadatan tinggi. Amunisi ini terdiri dari uranium terdeplesi (DU) yang dipadukan dengan 1–2% unsur lain, seperti titanium atau molibdenum.[16] Pada kecepatan tumbukan tinggi, kerapatan, kekerasan, dan piroforisitas proyektil memungkinkan penghancuran target lapis baja berat. Perisai tank dan perisai kendaraan yang bisa dilepas lainnya juga bisa dikeraskan dengan pelat uranium terdeplesi. Penggunaan uranium terdeplesi menjadi perdebatan politik dan lingkungan setelah penggunaan amunisi tersebut oleh AS, Inggris dan negara-negara lain selama perang di Teluk Persia dan Balkan menimbulkan pertanyaan mengenai senyawa uranium yang tersisa di tanah[5][17][18][19] (lihat sindrom Perang Teluk).[13]
Uranium terdeplesi juga digunakan sebagai bahan pelindung pada beberapa wadah yang digunakan untuk menyimpan dan mengangkut bahan radioaktif. Meskipun logam itu sendiri bersifat radioaktif, kepadatannya yang tinggi membuatnya lebih efektif daripada timbal dalam menghentikan radiasi dari sumber yang kuat seperti radium.[6] Kegunaan lain dari uranium terdeplesi meliputi penyeimbang untuk permukaan kontrol pesawat, sebagai pemberat untuk kendaraan re-entry rudal, dan sebagai bahan pelindung.[7] Karena kepadatannya yang tinggi, bahan ini ditemukan dalam sistem navigasi inersia dan kompas giroskopis.[7] Uranium terdeplesi lebih disukai daripada logam padat serupa karena kemampuannya untuk mudah dikerjakan dan dicor serta biayanya yang relatif rendah.[20] Risiko utama paparan uranium terdeplesi adalah keracunan kimia dari uranium oksida dan bukan radioaktivitasnya (uranium hanya merupakan pemancar alfa yang lemah).
Selama tahap akhir Perang Dunia II, seluruh Perang Dingin, dan pada tingkat yang lebih rendah sesudahnya, uranium-235 telah digunakan sebagai bahan peledak fisil untuk memproduksi senjata nuklir. Awalnya, dua jenis bom fisi utama dibangun: perangkat yang relatif sederhana yang menggunakan uranium-235 dan mekanisme yang lebih rumit yang menggunakan plutonium-239 yang berasal dari uranium-238. Kemudian, jenis bom fisi/fusi yang jauh lebih rumit dan jauh lebih kuat (senjata termonuklir) dibangun, yang menggunakan perangkat berbasis plutonium untuk menyebabkan campuran tritium dan deuterium mengalami fusi nuklir. Bom semacam itu dibungkus dalam kotak uranium nonfisil (tak diperkaya), dan mereka memperoleh lebih dari setengah kekuatan mereka dari fisi bahan ini oleh neutron cepat dari proses fusi nuklir.[21]
Sipil[sunting | sunting sumber]
Penggunaan utama uranium di sektor sipil adalah sebagai bahan bakar pembangkit listrik tenaga nuklir. Satu kilogram uranium-235 secara teoretis dapat menghasilkan sekitar 20 terajoule energi (2×1013 joule), dengan asumsi fisi sempurna; energi sebanyak 1,5 juta kilogram (1,500 ton) batu bara.[4]
Pembangkit listrik tenaga nuklir komersial menggunakan bahan bakar yang biasanya diperkaya sekitar 3% uranium-235.[4] Desain CANDU dan Magnox adalah satu-satunya reaktor komersial yang mampu menggunakan bahan bakar uranium yang tak diperkaya. Bahan bakar yang digunakan untuk reaktor Angkatan Laut Amerika Serikat biasanya sangat diperkaya dengan uranium-235 (nilai pastinya dirahasiakan). Dalam reaktor pembiak, uranium-238 juga dapat diubah menjadi plutonium melalui reaksi berikut:[7]

Sebelum (dan, kadang-kadang, sesudah) penemuan radioaktivitas, uranium digunakan terutama dalam jumlah kecil untuk kaca kuning dan glasir tembikar, seperti kaca uranium dan di Fiestaware.[22]
Penemuan dan isolasi radium dalam bijih uranium (uraninit) oleh Marie Curie memicu pengembangan penambangan uranium untuk mengekstraksi radium, yang digunakan untuk membuat cat berpendar dalam gelap untuk jam dan dial pesawat.[23][24] Pengekstrasian ini meninggalkan jumlah uranium yang luar biasa sebagai produk limbah, karena dibutuhkan tiga ton uranium untuk mengekstraksi satu gram radium. Produk limbah ini dialihkan ke industri kaca, membuat kaca uranium sangat murah dan melimpah. Selain glasir tembikar, glasir ubin uranium menyumbang sebagian besar penggunaan, termasuk ubin kamar mandi dan dapur umum yang dapat diproduksi dalam warna hijau, kuning, ungu pucat, hitam, biru, merah, dan warna lainnya.


Uranium juga digunakan dalam bahan kimia fotografi (khususnya uranium nitrat sebagai toner),[7] dalam filamen lampu untuk lampu penerangan panggung,[25] untuk memperbaiki penampilan gigi palsu,[26] dan dalam industri kulit dan kayu untuk noda dan pewarna. Garam uranium adalah mordan dari sutra atau wol. Uranil asetat dan uranil format digunakan sebagai "noda" padat-elektron dalam mikroskop transmisi elektron, untuk meningkatkan kontras spesimen biologis pada bagian ultratipis dan penodaan negatif virus, organel sel terisolasi, dan makromolekul.
Penemuan radioaktivitas uranium mengantarnya pada penggunaan ilmiah dan praktis tambahan. Waktu paruh yang panjang dari isotop uranium-238 (4,47×109 tahun) membuatnya sangat cocok untuk digunakan dalam memperkirakan usia batuan beku paling awal dan untuk jenis penanggalan radiometrik lainnya, meliputi penanggalan uranium–torium, penanggalan uranium–timbal, dan penanggalan uranium–uranium. Logam uranium dapat digunakan untuk target sinar-X dalam pembuatan sinar-X berenergi tinggi.[7]
Sejarah[sunting | sunting sumber]
Penggunaan pra-penemuan[sunting | sunting sumber]
Penggunaan uranium dalam bentuk oksida alaminya dimulai setidaknya pada tahun 79 CE, ketika ia digunakan di Kekaisaran Romawi untuk menambah warna kuning pada lapisan keramik.[7] Kaca kuning dengan 1% uranium oksida ditemukan di sebuah vila Romawi di Tanjung Posillipo di Teluk Napoli, Italia, oleh R. T. Gunther dari Universitas Oxford pada tahun 1912.[27] Dimulai pada akhir Abad Pertengahan, bijih-bijih uranium diekstrak dari tambang perak Habsburg di Joachimsthal, Bohemia (sekarang Jáchymov di Republik Ceko), dan digunakan sebagai zat pewarna dalam industri pembuatan kaca lokal.[28] Pada awal abad ke-19, satu-satunya sumber bijih uranium yang diketahui di dunia adalah tambang ini. Penambangan uranium di Pegunungan Erz dihentikan di sisi Jerman setelah Perang Dingin berakhir dan SDAG Wismut ditutup. Di sisi Ceko ada upaya selama gelembung harga uranium tahun 2007 untuk memulai kembali penambangan, tetapi upaya itu dengan cepat ditinggalkan menyusul jatuhnya harga uranium.[29][30]
Penemuan[sunting | sunting sumber]

Penemuan unsur ini dikreditkan pada ahli kimia Jerman Martin Heinrich Klaproth. Saat dia bekerja di laboratorium eksperimentalnya di Berlin pada tahun 1789, Klaproth mampu mengendapkan senyawa kuning (kemungkinan natrium diuranat) dengan melarutkan uraninit dalam asam nitrat dan menetralkan larutan itu dengan natrium hidroksida.[28] Klaproth menganggap bahwa zat kuning itu adalah oksida dari unsur yang belum ditemukan dan memanaskannya dengan arang untuk mendapatkan bubuk hitam, yang menurutnya adalah logam yang baru ditemukan itu sendiri (sebenarnya, bubuk itu adalah sebuah oksida uranium).[28][31] Dia menamai unsur yang baru ditemukan itu dari nama planet Uranus (dinamai dari dewa langit Yunani purba), yang telah ditemukan delapan tahun sebelumnya oleh William Herschel.[32]
Pada tahun 1841, Eugène-Melchior Péligot, Profesor Kimia Analitik di Conservatoire National des Arts et Métiers (Sekolah Pusat Seni dan Manufaktur) di Paris, mengisolasi sampel pertama logam uranium dengan memanaskan uranium tetraklorida dengan kalium.[28][33]

Henri Becquerel menemukan radioaktivitas dengan menggunakan uranium pada tahun 1896.[12] Becquerel membuat penemuan ini di Paris dengan meninggalkan sampel garam uranium, K2UO2(SO4)2 (kalium uranil sulfat), di atas pelat fotografi yang tidak terpapar di dalam laci dan mencatat bahwa pelat telah menjadi "berkabut".[34] Dia menentukan bahwa suatu bentuk cahaya atau sinar tak terlihat yang dipancarkan oleh uranium telah memapari pelat tersebut.
Selama Perang Dunia I ketika Blok Sentral kekurangan molibdenum untuk membuat laras senapan artileri dan baja perkakas berkecepatan tinggi, mereka secara rutin menggantinya dengan paduan ferouranium yang menghadirkan banyak karakteristik fisik yang sama. Ketika praktik ini dikenal pada tahun 1916, pemerintah A.S. meminta beberapa universitas terkemuka untuk meneliti penggunaan uranium ini dan alat yang dibuat menggunakan formula ini tetap digunakan selama beberapa dekade.[35][36] Praktik ini berakhir ketika Proyek Manhattan dan Perang Dingin menempatkan permintaan besar pada uranium untuk penelitian fisi dan pengembangan senjata.
Penelitian fisi[sunting | sunting sumber]

Sebuah tim yang dipimpin oleh Enrico Fermi pada tahun 1934 mengamati bahwa pembombardiran uranium dengan neutron akan menghasilkan pancaran sinar beta (elektron atau positron dari unsur yang dihasilkan; lihat partikel beta).[37] Produk fisi pada awalnya disalahartikan sebagai unsur baru dengan nomor atom 93 dan 94, yang oleh Dekan Fakultas Roma, Orso Mario Corbino, masing-masing diberi nama ausonium dan hesperium.[38][39][40][41] Eksperimen yang mengarah pada penemuan kemampuan uranium untuk memfisi (membelah) menjadi unsur yang lebih ringan dan melepaskan energi pengikatan dilakukan oleh Otto Hahn dan Fritz Strassmann[37] di laboratorium milik Hahn di Berlin. Pada Februari 1939, Lise Meitner dan keponakannya, fisikawan Otto Robert Frisch, menerbitkan penjelasan fisika dan menamakan proses itu sebagai "fisi nuklir".[42] Segera setelah itu, Fermi berhipotesis bahwa fisi uranium mungkin melepaskan cukup banyak neutron untuk mempertahankan reaksi fisi. Konfirmasi hipotesis ini datang pada tahun 1939, dan penelitian selanjutnya menemukan bahwa rata-rata sekitar 2,5 neutron dilepaskan oleh setiap fisi isotop uranium-235 yang langka.[37] Fermi mendesak Alfred O. C. Nier untuk memisahkan isotop uranium untuk penentuan komponen fisil, dan pada 29 Februari 1940, Nier menggunakan instrumen yang dibuatnya di Universitas Minnesota untuk memisahkan sampel uranium-235 pertama di dunia di Laboratorium Tate. Setelah dikirimkan ke siklotron Universitas Columbia, John Dunning memastikan bahwa sampel tersebut adalah bahan fisil yang diisolasi pada 1 Maret.[43] Pekerjaan lebih lanjut menemukan bahwa isotop uranium-238 yang jauh lebih umum dapat ditransmutasikan menjadi plutonium, yang, seperti uranium-235, juga dapat difisi oleh neutron termal. Penemuan ini menyebabkan banyak negara mulai mengerjakan pengembangan senjata nuklir dan tenaga nuklir. Meskipun fisi telah ditemukan di Jerman, Uranverein ("klub uranium") proyek masa perang Jerman untuk meneliti tenaga nuklir dan/atau senjata terhambat oleh sumber daya yang terbatas, pertikaian, pengasingan atau tidak terlibatnya beberapa ilmuwan terkemuka di lapangan dan beberapa kesalahan krusial seperti gagal memperhitungkan ketidakmurnian dalam sampel grafit yang tersedia yang membuatnya tampak kurang cocok sebagai moderator neutron daripada kenyataannya. Upaya Jerman untuk membangun reaktor air berat/uranium alami belum mencapai titik kritis pada saat Amerika mencapai Haigerloch, tempat percobaan reaktor perang terakhir Jerman.[44]
Pada tanggal 2 Desember 1942, sebagai bagian dari Proyek Manhattan, tim lain yang dipimpin oleh Enrico Fermi dapat memulai reaksi rantai nuklir swadaya buatan pertama, Chicago Pile-1. Rencana awal menggunakan uranium-235 yang diperkaya ditinggalkan karena ia belum tersedia dalam jumlah yang cukup.[45] Bekerja di laboratorium di bawah Lapangan Stagg di Universitas Chicago, tim itu menciptakan kondisi yang diperlukan untuk reaksi semacam itu dengan menumpuk bersama 360 ton grafit, 53 ton uranium oksida, dan 5,5 ton logam uranium, yang mayoritas dipasok oleh Pabrik Lampu Westinghouse dalam proses produksi darurat.[37][46]
Persenjataan nuklir[sunting | sunting sumber]

Dua jenis bom atom utama dikembangkan oleh Amerika Serikat selama Perang Dunia II: perangkat berbasis uranium (nama kode "Little Boy") yang bahan fisilnya adalah uranium yang diperkaya tinggi, dan perangkat berbasis plutonium (lihat uji Trinity dan "Fat Man") yang plutoniumnya berasal dari uranium-238. Perangkat Little Boy berbasis uranium menjadi senjata nuklir pertama yang digunakan dalam perang ketika ia diledakkan di atas kota Hiroshima di Jepang pada 6 Agustus 1945. Meledak dengan hasil setara dengan 12.500 ton TNT, ledakan dan gelombang termal dari bom tersebut menghancurkan hampir 50.000 bangunan dan menewaskan sekitar 75.000 orang (lihat Serangan bom atom Hiroshima dan Nagasaki).[34] Awalnya diyakini bahwa uranium relatif langka, dan proliferasi nuklir dapat dihindari hanya dengan membeli semua stok uranium yang diketahui, tetapi dalam satu dekade, deposit uranium besar ditemukan di banyak tempat di seluruh dunia.[47][48]
Reaktor[sunting | sunting sumber]

Reaktor Grafit X-10 di Laboratorium Nasional Oak Ridge (ORNL) di Oak Ridge, Tennessee, sebelumnya dikenal sebagai Clinton Pile dan X-10 Pile, adalah reaktor nuklir buatan kedua di dunia (setelah Chicago Pile milik Enrico Fermi) dan merupakan reaktor pertama yang dirancang dan dibangun untuk operasi berkelanjutan. Reaktor Pembiak Eksperimental I milik Laboratorium Nasional Argonne, terletak di Stasiun Pengujian Reaktor Nasional milik Komisi Energi Atom dekat Arco, Idaho, menjadi reaktor nuklir pertama yang menghasilkan listrik pada 20 Desember 1951.[49] Awalnya, empat bola lampu 150 watt dinyalakan oleh reaktor tersebut, tetapi perbaikan akhirnya memungkinkannya untuk menyalakan seluruh fasilitas (kemudian, kota Arco menjadi yang pertama di dunia dimana semua listriknya berasal dari tenaga nuklir yang dihasilkan oleh BORAX-III, reaktor lain yang dirancang dan dioperasikan oleh Laboratorium Nasional Argonne).[50][51] Pembangkit listrik tenaga nuklir skala komersial pertama di dunia, Obninsk di Uni Soviet, memulai pembangkitan dengan reaktor AM-1 pada 27 Juni 1954. Pembangkit listrik tenaga nuklir awal lainnya adalah Calder Hall di Inggris, yang memulai pembangkitan pada 17 Oktober 1956,[52] dan Pembangkit Listrik Tenaga Atom Shippingport di Pennsylvania, yang dimulai pada 26 Mei 1958. Tenaga nuklir pertama kali digunakan untuk tenaga penggerak kapal selam, USS Nautilus, pada tahun 1954.[37][53]
Fisi prasejarah yang terjadi secara alami[sunting | sunting sumber]
Pada tahun 1972, fisikawan Prancis Francis Perrin menemukan lima belas reaktor fisi nuklir alami kuno dan tidak lagi aktif di tiga endapan bijih terpisah di tambang Oklo di Gabon, Afrika Barat, yang secara kolektif dikenal sebagai Reaktor Fosil Oklo. Deposit bijih itu berumur 1,7 miliar tahun; kemudian, uranium-235 merupakan sekitar 3% dari total uranium di Bumi.[54] Nilai ini cukup tinggi untuk memungkinkan terjadinya reaksi rantai fisi nuklir yang berkelanjutan, asalkan ada kondisi pendukung lainnya. Kapasitas sedimen sekitarnya untuk mengandung produk limbah nuklir yang mengancam kesehatan telah dikutip oleh pemerintah federal A.S. sebagai bukti pendukung kelayakan untuk menyimpan bahan bakar nuklir bekas di repositori limbah nuklir Gunung Yucca.[54]
Kontaminasi dan warisan Perang Dingin[sunting | sunting sumber]
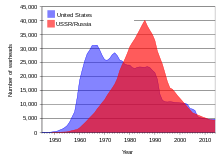
Uji coba nuklir di atas tanah oleh Uni Soviet dan Amerika Serikat pada 1950-an dan awal 1960-an dan oleh Prancis pada 1970-an dan 1980-an[20] telah menyebabkan tersebarnya sejumlah besar luruhan dari isotop anak uranium di seluruh dunia.[55] Luruhan dan polusi tambahan terjadi dari beberapa kecelakaan nuklir.[56]
Penambang uranium memiliki insiden kanker yang lebih tinggi. Kelebihan risiko kanker paru-paru di antara penambang uranium Navajo, misalnya, telah didokumentasikan dan dikaitkan dengan pekerjaan mereka.[57] UU Kompensasi Paparan Radiasi, undang-undang tahun 1990 di A.S., mewajibkan pembayaran sebesar AS$100.000 sebagai "bentuk balas budi" kepada penambang uranium yang didiagnosis menderita kanker atau penyakit pernapasan lainnya.[58]
Selama Perang Dingin antara Uni Soviet dan Amerika Serikat, persediaan uranium yang sangat besar dikumpulkan dan puluhan ribu senjata nuklir dibuat menggunakan uranium yang diperkaya dan plutonium yang terbuat dari uranium. Setelah pecahnya Uni Soviet pada tahun 1991, diperkirakan 600 ton pendek (540 ton metrik) uranium tingkat senjata yang diperkaya tinggi (cukup untuk membuat 40.000 hulu ledak nuklir) telah disimpan di fasilitas yang seringkali tidak dijaga dengan baik di Federasi Rusia dan beberapa negara bekas Soviet lainnya.[13] Dari tahun 1993 hingga 2005, polisi di Asia, Eropa, dan Amerika Selatan telah mencegat pengiriman uranium atau plutonium tingkat bom selundupan setidaknya 16 kali, yang sebagian besar berasal dari sumber bekas Soviet.[13] Dari tahun 1993 hingga 2005, Program Perlindungan, Kontrol, dan Akuntansi Material, yang dioperasikan oleh pemerintah federal Amerika Serikat, menghabiskan sekitar AS$550 juta untuk membantu mengamankan cadangan uranium dan plutonium di Rusia. Uang ini digunakan untuk perbaikan dan peningkatan keamanan di fasilitas penelitian dan penyimpanan.[13]
Keamanan fasilitas nuklir di Rusia telah meningkat secara signifikan sejak stabilisasi gejolak politik dan ekonomi pada awal 1990-an. Sebagai contoh, pada tahun 1993 terdapat 29 insiden dengan peringkat di atas level 1 pada Skala Kejadian Nuklir Internasional, dan jumlah ini turun di bawah empat per tahun pada tahun 1995–2003. Jumlah pekerja yang menerima dosis radiasi tahunan di atas 20 mSv, yang setara dengan satu pemindaian CT seluruh tubuh,[59] mengalami penurunan tajam sekitar tahun 2000. Pada November 2015, pemerintah Rusia menyetujui program federal untuk keselamatan nuklir dan radiasi untuk tahun 2016 hingga 2030 dengan anggaran ₽562 miliar (sekitar AS$8 miliar). Masalah utamanya adalah "kewajiban yang ditangguhkan yang terakumulasi selama 70 tahun industri nuklir, terutama pada masa Uni Soviet". Sekitar 73% dari anggaran akan dihabiskan untuk penonaktifan reaktor nuklir dan fasilitas nuklir yang sudah tua dan usang, terutama yang terlibat dalam program pertahanan negara; 20% akan digunakan untuk pemrosesan dan pembuangan bahan bakar nuklir dan limbah radioaktif, dan 5% akan digunakan untuk memantau dan memastikan keselamatan nuklir dan radiasi.[60]
Keterjadian[sunting | sunting sumber]
Asal[sunting | sunting sumber]
Bersama dengan semua unsur yang memiliki berat atom lebih tinggi dari besi, uranium hanya secara alami dibentuk oleh proses-r (penangkapan neutron cepat) dalam supernova dan tabrakan bintang neutron.[61] Torium dan uranium primordial hanya diproduksi dalam proses-r, karena proses-s (penangkapan neutron lambat) dinilai terlalu lambat dan tidak dapat melewati celah ketidakstabilan setelah bismut.[62][63] Selain dua isotop uranium primordial yang masih ada, 235U dan 238U, proses-r juga menghasilkan 236U dalam jumlah yang signifikan, yang memiliki waktu paruh lebih pendek dan juga merupakan sebuah radionuklida punah, yang telah lama meluruh sepenuhnya menjadi 232Th. Uranium-236 itu sendiri diperkaya oleh peluruhan 244Pu, terhitung untuk kelimpahan torium yang diamati lebih tinggi dari perkiraan dan kelimpahan uranium lebih rendah dari perkiraan.[64] Meskipun kelimpahan alami uranium telah dilengkapi dengan peluruhan 242Pu yang telah punah (waktu paruh 0,375 juta tahun) dan 247Cm (waktu paruh 16 juta tahun), masing-masing menghasilkan 238U dan 235U, hal ini terjadi hampir dapat diabaikan karena waktu paruh kedua induk ini lebih pendek dan produksinya lebih rendah daripada 236U dan 244Pu, kedua induk torium: rasio 247Cm:235U pada pembentukan Tata Surya adalah (7,0±1,6)×10−5.[65]
Biotik dan abiotik[sunting | sunting sumber]


Uranium adalah unsur yang terjadi secara alami yang dapat ditemukan dalam kadar rendah di semua batuan, tanah, dan air. Uranium adalah unsur ke-51 dalam urutan kelimpahan di kerak Bumi. Uranium juga merupakan unsur dengan jumlah tertinggi yang ditemukan secara alami dalam jumlah yang signifikan di Bumi dan hampir selalu ditemukan berkombinasi dengan unsur lain.[7] Peluruhan uranium, torium, dan kalium-40 di mantel Bumi dianggap sebagai sumber utama panas[66][67] yang menjaga inti luar Bumi dalam keadaan cair dan mendorong konveksi mantel, yang pada gilirannya mendorong lempeng tektonik.
Konsentrasi rata-rata uranium di kerak Bumi adalah (tergantung referensi) 2 hingga 4 bagian per juta,[6][20] atau sekitar 40 kali lebih melimpah daripada perak.[12] Kerak Bumi dari permukaan hingga 25 km (15 mi) ke bawah diperkirakan mengandung 1017 kg (2×1017 lb) uranium sedangkan samudra mungkin mengandung 1013 kg (2×1013 lb).[6] Konsentrasi uranium dalam tanah berkisar antara 0,7 hingga 11 bagian per juta (hingga 15 bagian per juta di tanah pertanian karena penggunaan pupuk fosfat),[68] dan konsentrasinya dalam air laut adalah 3 bagian per miliar.[20]
Uranium lebih banyak daripada antimon, timah, kadmium, raksa, atau perak, dan jumlahnya sama melimpahnya dengan arsen atau molibdenum.[7][20] ditemukan dalam ratusan mineral, meliputi uraninit (bijih uranium yang paling umum), karnotit, autunit, uranofan, torbernit, dan kofinit.[7] Konsentrasi uranium yang signifikan terjadi pada beberapa zat seperti endapan batuan fosfat, dan mineral seperti lignit, dan pasir monasit dalam bijih yang kaya uranium[7] (ia diperoleh secara komersial dari sumber dengan uranium sesedikit 0,1%[12]).
Beberapa bakteri, seperti Shewanella putrefaciens, Geobacter metallireducens, dan beberapa galur Burkholderia fungorum, menggunakan uranium untuk pertumbuhannya dan mengubah U(VI) menjadi U(IV).[69][70] Penelitian terbaru menunjukkan bahwa jalur ini mencakup reduksi U(VI) terlarut melalui keadaan pentavalen U(V) perantara.[71][72] Organisme lain, seperti lumut Trapelia involuta atau mikroorganisme seperti bakteri Citrobacter, dapat menyerap konsentrasi uranium hingga 300 kali lipat dari lingkungannya.[73] Spesies Citrobacter menyerap ion uranil ketika diberi gliserol fosfat (atau fosfat organik serupa lainnya). Setelah satu hari, satu gram bakteri dapat mengerakkan diri dengan sembilan gram kristal uranil fosfat; ini menciptakan kemungkinan bahwa organisme ini dapat digunakan dalam bioremediasi untuk mendekontaminasi air yang tercemar uranium.[28][74] Proteobacterium Geobacter juga telah terbukti melakukan bioremediasi uranium dalam air tanah.[75] Jamur mikoriza Glomus intraradices meningkatkan kandungan uranium di akar tanaman simbiotiknya.[76]
Di alam, uranium(VI) membentuk kompleks karbonat yang sangat larut pada pH basa. Hal ini menyebabkan peningkatan mobilitas dan ketersediaan uranium ke air tanah dan tanah dari limbah nuklir yang menyebabkan bahaya kesehatan. Namun, sulit untuk mengendapkan uranium sebagai fosfat dengan adanya kelebihan karbonat pada pH basa. Galur Sphingomonas sp. BSAR-1 telah ditemukan dapat mengekspresikan fosfatase alkali (PhoK) aktivitas tinggi yang telah diterapkan untuk biopresipitasi uranium sebagai spesies uranil fosfat dari larutan alkalin. Kemampuan pengendapannya ditingkatkan dengan mengekspresikan protein PhoK secara berlebihan dalam E. coli.[77]
Tumbuhan menyerap beberapa uranium dari tanah. Konsentrasi berat kering uranium dalam tumbuhan berkisar antara 5 hingga 60 bagian per miliar, dan abu dari kayu yang terbakar dapat memiliki konsentrasi hingga 4 bagian per juta.[28] Konsentrasi uranium dalam berat kering pada tumbuhan pangan biasanya lebih rendah dengan satu hingga dua mikrogram per hari tertelan melalui makanan yang dimakan manusia.[28]
Produksi dan penambangan[sunting | sunting sumber]
Produksi uranium di seluruh dunia pada tahun 2021 berjumlah 48.332 ton, dimana 21.819 t (45%) ditambang di Kazakhstan. Negara penambangan uranium penting lainnya adalah Namibia (5.753 t), Kanada (4.693 t), Australia (4.192 t), Uzbekistan (3.500 t), dan Rusia (2.635 t).[78]
Bijih uranium ditambang dengan beberapa cara: dengan penambangan lubang terbuka, bawah tanah, pelindian in-situ, dan lubang bor (lihat penambangan uranium).[4] Bijih uranium tingkat rendah yang ditambang biasanya mengandung 0,01 hingga 0,25% uranium oksida. Langkah-langkah ekstensif harus dilakukan untuk mengekstraksi logam dari bijihnya.[79] Bijih bermutu tinggi yang ditemukan di deposit Cekungan Athabasca di Saskatchewan, Kanada rata-rata dapat mengandung hingga 23% uranium oksida.[80] Bijih uranium dihancurkan dan dibuat menjadi bubuk halus dan kemudian dilindi dengan asam atau alkali. Air lindi mengalami salah satu dari beberapa urutan presipitasi, ekstraksi pelarut, dan pertukaran ion. Campuran yang dihasilkan, disebut yellowcake, mengandung sedikitnya 75% uranium oksida U3O8. Yellowcake kemudian dikalsinasi untuk menghilangkan kotoran dari proses penggilingan sebelum pemurnian dan konversi.[81]
Uranium tingkat komersial dapat diproduksi melalui reduksi uranium halida dengan logam alkali atau alkali tanah.[7] Logam uranium juga dapat dibuat melalui elektrolisis KUF5 atau UF4, dilarutkan dalam larutan kalsium klorida (CaCl2) dan natrium klorida (NaCl) cair.[7] Uranium yang sangat murni diproduksi melalui dekomposisi termal uranium halida pada filamen panas.[7]
-
Produksi (tambang) dan permintaan uranium dunia[78]
-
Yellowcake adalah campuran oksida uranium pekat yang disempurnakan lebih lanjut untuk mengekstrak uranium murni.
-
Produksi uranium tahun 2015, dalam ton[82]
Sumber daya dan cadangan[sunting | sunting sumber]

Diperkirakan ada 6,1 juta ton uranium dalam cadangan bijih yang layak secara ekonomi dengan harga AS$130 per kg uranium,[83] sementara 35 juta ton digolongkan sebagai sumber daya mineral (prospek yang masuk akal untuk ekstraksi ekonomi pada akhirnya).[84]
Australia memiliki 28% dari cadangan bijih uranium dunia yang diketahui[83] dan deposit uranium tunggal terbesar di dunia terletak di Tambang Olympic Dam di Australia Selatan.[85] Terdapat pula cadangan uranium yang signifikan di Bakouma, sebuah subprefektur di prefektur Mbomou di Republik Afrika Tengah.[86]
Beberapa uranium juga berasal dari senjata nuklir yang dibongkar.[87] Misalnya, pada tahun 1993–2013 Rusia memasok Amerika Serikat dengan 15.000 ton uranium yang diperkaya rendah dalam Program Megatons to Megawatts.[88]
Tambahan 4,6 miliar ton uranium diperkirakan terlarut dalam air laut (ilmuwan Jepang pada 1980-an menunjukkan bahwa ekstraksi uranium dari air laut menggunakan penukar ion secara teknis layak dilakukan).[89][90] Terdapat percobaan untuk mengekstraksi uranium dari air laut,[91] tetapi hasilnya rendah karena kandungan karbonat di dalam air. Pada tahun 2012, peneliti ORNL mengumumkan keberhasilan pengembangan bahan penyerap baru yang dijuluki HiCap yang melakukan retensi permukaan molekul padat atau gas, atom atau ion dan juga secara efektif menghilangkan logam beracun dari air, menurut hasil yang diverifikasi oleh para peneliti di Laboratorium Nasional Pacific Northwest.[92][93]
Persediaan[sunting | sunting sumber]

Pada tahun 2005, sepuluh negara menyumbang mayoritas oksida uranium terkonsentrasi di dunia: Kanada (27,9%), Australia (22,8%), Kazakhstan (10,5%), Rusia (8,0%), Namibia (7,5%), Niger (7,4%), Uzbekistan (5,5%), Amerika Serikat (2,5%), Argentina (2,1%), dan Ukraina (1,9%).[95] Pada tahun 2008, Kazakhstan diperkirakan akan meningkatkan produksi dan menjadi pemasok uranium terbesar di dunia pada tahun 2009.[96][97] Prediksi tersebut menjadi kenyataan, dan Kazakhstan memang mendominasi pasar uranium dunia sejak tahun 2010. Pada tahun 2021, pangsanya mencapai 45,1%, diikuti oleh Namibia (11,9%), Kanada (9,7%), Australia (8,7%), Uzbekistan (7,2%), Niger (4,7%), Rusia (5,5%), Tiongkok (3,9%), India (1,3%), Ukraina (0,9%), dan Afrika Selatan (0,8%), dengan total produksi dunia sebesar 48.332 ton.[78] Sebagian besar uranium diproduksi bukan melalui penambangan bijih bawah tanah konvensional (29% dari produksi), tetapi melalui pelindian in-situ (66%).[78][98]
Pada akhir 1960-an, ahli geologi PBB juga menemukan endapan uranium utama dan cadangan mineral langka lainnya di Somalia. Penemuan itu adalah yang terbesar dari jenisnya, dengan pakar industri memperkirakan simpanan itu memiliki lebih dari 25% dari cadangan uranium dunia yang diketahui saat itu sebanyak 800.000 ton.[99]
Pasokan akhir yang tersedia diyakini cukup untuk setidaknya 85 tahun ke depan,[84] meskipun beberapa penelitian menunjukkan kurangnya investasi di akhir abad ke-20 dapat menimbulkan masalah pasokan di abad ke-21.[100] Endapan uranium tampaknya berdistribusi log-normal. Ada peningkatan 300 kali lipat dalam jumlah uranium yang dapat diperoleh kembali untuk setiap penurunan sepuluh kali lipat kadar bijih.[101] Dengan kata lain, terdapat sedikit bijih berkadar tinggi dan secara proporsional jauh lebih banyak bijih berkadar rendah yang tersedia.
Senyawa[sunting | sunting sumber]
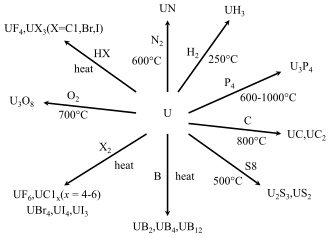
Keadaan oksidasi dan oksida[sunting | sunting sumber]
Oksida[sunting | sunting sumber]
Yellowcake uranium yang dikalsinasi, seperti yang diproduksi di banyak pabrik besar, berisi distribusi spesies oksidasi uranium dalam berbagai bentuk mulai dari yang paling teroksidasi hingga yang paling tidak teroksidasi. Partikel dengan waktu tinggal yang singkat dalam pengalsinasi umumnya akan kurang teroksidasi dibandingkan dengan waktu retensi yang lama atau partikel yang diperoleh kembali dalam stack scrubber. Kandungan uranium biasanya mengacu pada U3O8, yang berasal dari masa Proyek Manhattan ketika U3O8 digunakan sebagai standar pelaporan kimia analitik.[102]
Hubungan fase dalam sistem uranium-oksigen sangat kompleks. Keadaan oksidasi uranium yang paling penting adalah uranium(IV) dan uranium(VI), dan dua oksida yang bersesuaian adalah uranium dioksida (UO2) dan uranium trioksida (UO3).[103] Uranium oksida lainnya seperti uranium monoksida (UO), diuranium pentoksida (U2O5), dan uranium peroksida (UO4·2H2O) juga eksis.
Bentuk uranium oksida yang paling umum adalah triuranium oktoksida (U3O8) dan UO2.[104] Kedua bentuk oksida tersebut adalah padatan yang memiliki kelarutan rendah dalam air dan relatif stabil pada berbagai kondisi lingkungan. Triuranium oktoksida adalah (tergantung kondisi) senyawa uranium yang paling stabil dan merupakan bentuk yang paling banyak ditemukan di alam. Uranium dioksida adalah bentuk uranium yang paling umum digunakan sebagai bahan bakar reaktor nuklir.[104] Pada suhu sekitar, UO2 secara bertahap akan berubah menjadi U3O8. Karena kestabilannya, uranium oksida umumnya dianggap sebagai bentuk kimia yang disukai untuk penyimpanan atau pembuangan.[104]
Kimia berair[sunting | sunting sumber]

Garam uranium dari banyak keadaan oksidasi bersifat larut dalam air dan dapat dipelajari dalam larutan berair. Bentuk ionik yang paling umum adalah U3+ (coklat kemerahan), U4+ (hijau), UO+2 (tak stabil), dan UO2+2 (kuning), untuk U(III), U(IV), U(V), dan U(VI), masing-masing.[105] Beberapa senyawa padat dan semilogam seperti UO dan US terdapat pada keadaan oksidasi formal uranium(II), tetapi tidak ada ion sederhana yang diketahui eksis dalam larutan untuk keadaan tersebut. Ion U3+ membebaskan hidrogen dari air dan karena itu dianggap sangat tidak stabil. Ion UO2+2 mewakili keadaan uranium(VI) dan diketahui membentuk senyawa seperti uranil karbonat, uranil klorida, dan uranil sulfat. UO2+2 juga membentuk kompleks dengan berbagai bahan pengelat organik, yang paling sering dijumpai adalah uranil asetat.[105]
Tidak seperti garam uranil dari uranium dan bentuk kationik uranium-oksida ion poliatomik, uranat, garam yang mengandung anion poliatomik uranium-oksida, umumnya tidak larut dalam air.
Karbonat[sunting | sunting sumber]
Interaksi anion karbonat dengan uranium(VI) menyebabkan diagram Pourbaix berubah sangat besar ketika medium diubah dari air menjadi larutan yang mengandung karbonat. Walaupun sebagian besar karbonat tidak larut dalam air (siswa sering diajari bahwa semua karbonat selain logam alkali tidak larut dalam air), uranium karbonat sering larut dalam air. Hal ini dikarenakan kation U(VI) mampu mengikat dua oksida terminal dan tiga atau lebih karbonat untuk membentuk kompleks anionik.
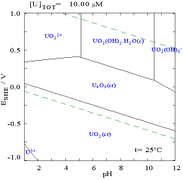 |
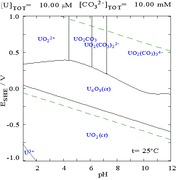 |
| Uranium dalam media berair yang tidak membentuk kompleks (misalnya asam perklorat/natrium hidroksida).[106] | Uranium dalam larutan karbonat |
 |
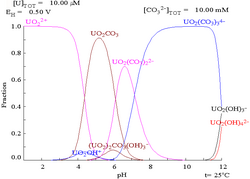 |
| Konsentrasi relatif dari berbagai bentuk kimia uranium dalam media berair yang tidak membentuk kompleks (misalnya asam perklorat/natrium hidroksida).[106] | Konsentrasi relatif dari berbagai bentuk kimia uranium dalam larutan karbonat berair.[106] |
Pengaruh pH[sunting | sunting sumber]
Diagram fraksi uranium dengan adanya karbonat mengilustrasikan hal ini lebih lanjut: ketika pH larutan uranium(VI) meningkat, uranium diubah menjadi uranium oksida hidroksida terhidrasi dan pada pH tinggi menjadi kompleks hidroksida anionik.
Ketika karbonat ditambahkan, uranium diubah menjadi serangkaian kompleks karbonat jika pH dinaikkan. Salah satu efek dari reaksi ini adalah peningkatan kelarutan uranium dalam kisaran pH 6 hingga 8, sebuah fakta yang memiliki pengaruh langsung pada stabilitas jangka panjang bahan bakar nuklir uranium dioksida bekas.
Hidrida, karbida, dan nitrida[sunting | sunting sumber]
Logam uranium yang dipanaskan hingga suhu 250 hingga 300 °C (482 hingga 572 °F) bereaksi dengan hidrogen untuk membentuk uranium hidrida. Bahkan, suhu yang lebih tinggi akan menghilangkan hidrogen secara reversibel. Sifat ini membuat uranium hidrida menjadi bahan awal yang nyaman untuk membuat bubuk uranium reaktif bersama dengan berbagai senyawa uranium karbida, nitrida, dan halida.[107] Ada dua modifikasi kristal uranium hidrida: bentuk α yang diperoleh pada suhu rendah dan bentuk β yang dibuat ketika suhu formasi berada di atas 250 °C.[107]
Uranium karbida dan nitrida merupakan senyawa semilogam yang relatif lengai yang sedikit larut dalam asam, bereaksi dengan air, dan dapat menyala di udara untuk membentuk U3O8.[107] Karbida uranium meliputi uranium monokarbida (UC), uranium dikarbida (UC2), dan diuranium trikarbida (U2C3). Baik UC maupun UC2 dibentuk dengan menambahkan karbon pada uranium cair atau dengan memaparkan logam uranium pada karbon monoksida pada suhu tinggi. Stabil di bawah suhu 1800 °C, U2C3 dibuat dengan menggunakan campuran UC dan UC2 yang dipanaskan pada tekanan mekanis.[108] Uranium nitrida diperoleh dengan pemaparan langsung logam uranium pada nitrogen, meliputi uranium mononitrida (UN), uranium dinitrida (UN2), dan diuranium trinitrida (U2N3).[108]
Halida[sunting | sunting sumber]

Semua uranium fluorida dibuat menggunakan uranium tetrafluorida (UF4); UF4 sendiri dibuat melalui hidrofluorinasi uranium dioksida.[107] Reduksi UF4 dengan hidrogen pada suhu 1000 °C menghasilkan uranium trifluorida (UF3). Di bawah kondisi suhu dan tekanan yang tepat, reaksi UF4 dengan gas uranium heksafluorida (UF6) dapat membentuk fluorida intermediat U2F9, U4F17, dan UF5.[107]
Pada suhu kamar, UF6 memiliki tekanan uap yang tinggi, membuatnya berguna dalam proses difusi gas untuk memisahkan uranium-235 yang langka dari isotop uranium-238 yang umum. Senyawa ini dapat dibuat dari uranium dioksida dan uranium hidrida dengan proses berikut:[107]
- UO2 + 4 HF → UF4 + 2 H2O (500 °C, endotermik)
- UF4 + F2 → UF6 (350 °C, endotermik)
UF6 yang dihasilkan, berupa padatan putih, bersifat sangat reaktif (melalui fluorinasi), mudah menyublim (memancarkan uap yang berperilaku seperti gas hampir ideal), dan merupakan senyawa uranium yang paling volatil yang pernah ada.[107]
Salah satu metode pembuatan uranium tetraklorida (UCl4) adalah dengan langsung menggabungkan klorin dengan logam uranium atau uranium hidrida. Reduksi UCl4 oleh hidrogen akan menghasilkan uranium triklorida (UCl3) sedangkan klorida uranium yang lebih tinggi dibuat melalui reaksi dengan klorin tambahan.[107] Semua uranium klorida bereaksi dengan air dan udara.
Bromida dan iodida uranium dibentuk melalui reaksi langsung, masing-masing, antara bromin dan iodin dengan uranium atau dengan menambahkan UH3 ke dalam asam unsur tersebut.[107] Contoh yang dikenal meliputi: UBr3, UBr4, UI3, dan UI4. UI5 belum pernah disiapkan. Uranium oksihalida bersifat larut dalam air dan meliputi UO2F2, UOCl2, UO2Cl2, dan UO2Br2. Stabilitas oksihalida menurun dengan meningkatnya berat atom komponen halida.[107]
Isotop[sunting | sunting sumber]
Uranium, seperti semua unsur dengan nomor atom lebih besar dari 82, tidak memiliki isotop stabil. Semua isotop uranium bersifat radioaktif karena gaya nuklir kuat tidak mengalahkan tolakan elektromagnetik dalam nuklida yang mengandung lebih dari 82 proton.[109] Namun demikian, dua isotop yang paling stabil, uranium-238 dan uranium-235, memiliki waktu paruh yang cukup lama untuk terjadi di alam sebagai radionuklida primordial, dengan jumlah terukur yang bertahan sejak pembentukan Bumi.[110] Kedua nuklida ini, bersama dengan torium-232, adalah nuklida primordial yang dikonfirmasi lebih berat daripada bismut-209 yang hampir stabil.[111][112]
Uranium alami terdiri dari tiga isotop utama: uranium-238 (99,28% kelimpahan alami), uranium-235 (0,71%), dan uranium-234 (0,0054%). Ada juga empat isotop renik lainnya: uranium-239, yang terbentuk ketika 238U mengalami fisi spontan, melepaskan neutron yang ditangkap oleh atom 238U; uranium-237, yang terbentuk ketika 238U menangkap sebuah neutron tetapi memancarkan dua lagi, yang kemudian meluruh menjadi neptunium-237; uranium-236, yang terjadi dalam jumlah kecil akibat penangkapan neutron pada 235U dan sebagai produk peluruhan plutonium-244;[112] dan terakhir, uranium-233, yang terbentuk dalam rantai peluruhan neptunium-237.
Uranium-238 adalah isotop uranium yang paling stabil, dengan waktu paruh sekitar 4,463×109 tahun,[111] kira-kira seusia Bumi. Uranium-238 sebagian besar merupakan pemancar alfa, meluruh menjadi torium-234. Ia akhirnya meluruh melalui deret uranium, yang memiliki 18 anggota, menjadi timbal-206.[12] Uranium-238 bukan merupakan isotop fisil, tetapi subur, karena setelah aktivasi neutron, ia dapat diubah menjadi plutonium-239, isotop fisil lainnya. Memang, inti 238U dapat menyerap satu neutron untuk menghasilkan isotop radioaktif uranium-239. 239U meluruh melalui emisi beta menjadi neptunium-239, juga merupakan pemancar beta, yang pada gilirannya meluruh, dalam beberapa hari menjadi plutonium-239. 239Pu digunakan sebagai bahan fisil dalam bom atom pertama yang diledakkan dalam "uji Trinity" pada 15 Juli 1945 di New Mexico.[37]
Uranium-235 memiliki waktu paruh sekitar 7,04×108 tahun; ia adalah isotop uranium paling stabil berikutnya setelah 238U dan juga sebagian besar merupakan pemancar alfa, meluruh menjadi torium-231.[111] Uranium-235 merupakan isotop yang penting untuk reaktor nuklir dan senjata nuklir, karena ia merupakan satu-satunya isotop uranium yang ada di alam dalam jumlah signifikan yang bersifat fisil. Ini berarti ia dapat dipecah menjadi dua atau tiga fragmen (produk fisi) oleh neutron termal.[12] Rantai peluruhan 235U, yang disebut deret aktinium, memiliki 15 anggota dan akhirnya meluruh menjadi timbal-207.[12] Laju peluruhan yang konstan dalam deret peluruhan ini membuat perbandingan rasio unsur induk dan unsur anak berguna dalam penanggalan radiometrik.
Uranium-236 memiliki waktu paruh 2,342×107 tahun[111] dan tidak ditemukan dalam jumlah yang signifikan di alam. Waktu paruh uranium-236 terlalu pendek untuk disebut primordial, meskipun ia telah diidentifikasi sebagai nenek moyang yang telah punah dari anak peluruhan alfanya, torium-232.[64] Uranium-236 terjadi pada bahan bakar nuklir bekas ketika penangkapan neutron pada 235U tidak menyebabkan fisi, atau sebagai produk peluruhan plutonium-240. Uranium-236 bersifat tidak subur, karena diperlukan tiga penangkapan neutron lagi untuk menghasilkan 239Pu yang bersifat fisil, dan ia sendiri tidak bersifat fisil; dengan demikian, ia dianggap limbah radioaktif berumur panjang.[115]
Uranium-234 adalah anggota deret uranium dan terjadi dalam kesetimbangan dengan nenek moyangnya, 238U; ia mengalami peluruhan alfa dengan waktu paruh 245.500 tahun[111] dan meluruh menjadi timbal-206 melalui serangkaian isotop yang berumur relatif pendek.
Uranium-233 mengalami peluruhan alfa dengan waktu paruh 160.000 tahun dan, seperti 235U, bersifat fisil.[7] Ia dapat dibiakkan dari torium-232 melalui pemborbardiran neutron, biasanya dalam reaktor nuklir; proses ini dikenal sebagai siklus bahan bakar torium. Karena fisilitas 233U dan kelimpahan alami torium yang lebih besar (tiga kali lipat uranium),[116] 233U telah diselidiki untuk digunakan sebagai bahan bakar nuklir sebagai alternatif yang mungkin untuk 235U dan 239Pu,[117] meskipun ia tidak digunakan secara luas hingga 2022[update].[116] Rantai peluruhan uranium-233 merupakan bagian dari deret neptunium dan berakhir pada bismut-209 yang hampir stabil (waktu paruh 2,01×1019 tahun)[111] dan talium-205 yang stabil.
Uranium-232 adalah sebuah pemancar alfa dengan waktu paruh 68,9 tahun.[111] Isotop ini diproduksi sebagai produk sampingan dalam produksi 233U dan dianggap sebagai gangguan, karena ia tidak bersifat fisil dan meluruh melalui pemancar alfa dan gama seperti 208Tl.[117] Torium-232 juga diperkirakan dapat mengalami peluruhan beta ganda, yang akan menghasilkan uranium-232, tetapi hal ini belum diamati secara eksperimental.[111]
Semua isotop dari 232U hingga 236U memiliki cabang peluruhan gugus minor (kurang dari 10−10%), dan semua bar 233U ini, selain 238U, memiliki cabang fisi spontan minor;[111] rasio percabangan terbesar untuk fisi spontan adalah sekitar 5×10−5% untuk 238U, atau sekitar satu dari setiap dua juta peluruhan.[118] Isotop renik berumur pendek 237U dan 239U secara eksklusif mengalami peluruhan beta, dengan waktu paruh masing-masing 6,752 hari dan 23,45 menit.[111]
Secara total, 28 isotop uranium telah diidentifikasi, mulai dari nomor massa 214[119] hingga 242, dengan pengecualian 220.[111][120] Di antara isotop uranium yang tidak ditemukan dalam sampel alami atau bahan bakar nuklir, isotop uranium yang berumur paling panjang adalah 230U, sebuah pemancar alfa dengan waktu paruh 20,23 hari.[111] Isotop ini telah dipertimbangkan untuk digunakan dalam terapi partikel alfa bertarget (TAT).[121] Semua isotop lainnya memiliki waktu paruh lebih pendek dari satu jam, kecuali 231U (waktu paruh 4,2 hari) dan 240U (waktu paruh 14,1 jam).[111] Isotop berumur terpendek yang diketahui adalah 221U, dengan waktu paruh 660 nanodetik, dan diperkirakan 220U yang hingga sekarang tidak diketahui memiliki waktu paruh yang bahkan lebih pendek.[122] Isotop kaya proton yang lebih ringan dari 232U utamanya mengalami peluruhan alfa, kecuali 229U dan 231U, yang masing-masing meluruh menjadi isotop protaktinium melalui emisi positron dan penangkapan elektron; 240U dan 242U yang kaya neutron mengalami peluruhan beta untuk membentuk isotop neptunium.[111]
Pengayaan[sunting | sunting sumber]

Di alam, uranium ditemukan sebagai uranium-238 (99,2742%) dan uranium-235 (0,7204%). Pemisahan isotop memusatkan (memperkaya) uranium-235 yang fisil untuk senjata nuklir dan sebagian besar pembangkit listrik tenaga nuklir, kecuali untuk reaktor berpendingin gas dan reaktor air berat bertekanan. Sebagian besar neutron yang dilepaskan oleh pemfisian atom uranium-235 harus berdampak pada atom uranium-235 lainnya untuk mempertahankan reaksi rantai nuklir. Konsentrasi dan jumlah uranium-235 yang dibutuhkan untuk mencapai ini disebut 'massa kritis'.
Untuk dianggap 'diperkaya', fraksi uranium-235 harus antara 3% dan 5%.[123] Proses ini menghasilkan uranium dalam jumlah besar, yang merupakan uranium-235 terdeplesi dan dengan fraksi uranium-238 yang meningkat, yang disebut uranium terdeplesi atau 'DU'. Untuk dianggap 'terdeplesi', konsentrasi isotop uranium-235 tidak boleh lebih dari 0,3%.[124] Harga uranium telah meningkat sejak tahun 2001, sehingga tailing pengayaan yang mengandung lebih dari 0,35% uranium-235 sedang dipertimbangkan untuk pengayaan ulang, mendorong harga uranium heksafluorida terdeplesi di atas AS$130 per kilogram pada Juli 2007 dari AS$5 pada tahun 2001.[124]
Proses sentrifugasi gas, di mana gas uranium heksafluorida (UF6) dipisahkan oleh perbedaan berat molekul antara 235UF6 dan 238UF6 menggunakan pemusing berkecepatan tinggi, merupakan proses pengayaan termurah dan terdepan.[34] Proses difusi gas telah menjadi metode utama untuk pengayaan dan digunakan dalam Proyek Manhattan. Dalam proses ini, uranium heksafluorida berulang kali terdifusi melalui membran perak-seng, dan berbagai isotop uranium dipisahkan oleh laju difusi (karena uranium-238 lebih berat, ia berdifusi sedikit lebih lambat daripada uranium-235).[34] Metode pemisahan isotop laser molekuler (MLIS) menggunakan sinar laser berenergi tepat untuk memutuskan ikatan antara uranium-235 dan fluorin. Ini membuat uranium-238 terikat pada fluorin dan memungkinkan logam uranium-235 mengendap dari larutan.[4] Metode pengayaan laser alternatif dikenal sebagai pemisahan isotop laser uap atom (AVLIS) dan menggunakan laser yang dapat diatur yang dapat terlihat seperti laser pewarna.[125] Metode lain yang digunakan adalah difusi termal cair.[6]
Satu-satunya penyimpangan yang signifikan dari rasio 235U terhadap 238U dalam sampel alami yang diketahui terjadi di Oklo, Gabon, di mana reaktor fisi nuklir alami mengonsumsi sebagian dari 235U sekitar dua miliar tahun yang lalu ketika rasio 235U terhadap 238U lebih mirip dengan uranium yang diperkaya rendah yang memungkinkan air biasa ("ringan") untuk bertindak sebagai moderator neutron mirip dengan proses dalam reaktor air ringan buatan manusia. Adanya reaktor fisi alami yang telah diprediksi secara teoretis sebelumnya terbukti dengan ditemukannya sedikit penyimpangan konsentrasi 235U dari nilai yang diperkirakan selama pengayaan uranium di Prancis. Investigasi selanjutnya untuk mengesampingkan tindakan jahat manusia (seperti pencurian 235U) mengkonfirmasi teori itu dengan menemukan rasio isotop produk fisi umum (atau lebih tepatnya nuklida anak stabil mereka) sejalan dengan nilai yang diperkirakan untuk fisi tetapi menyimpang dari nilai yang diharapkan untuk sampel turunan non-fisi dari unsur-unsur tersebut.
Paparan manusia[sunting | sunting sumber]
Seseorang dapat terpapar uranium (atau anak radioaktifnya, seperti radon) dengan menghirup debu di udara atau dengan menelan air dan makanan yang terkontaminasi. Jumlah uranium di udara biasanya sangat kecil; namun, orang-orang yang bekerja di pabrik yang memproses pupuk fosfat, tinggal di dekat fasilitas pemerintah yang membuat atau menguji senjata nuklir, tinggal atau bekerja di dekat medan perang modern di mana senjata uranium terdeplesi telah digunakan,[5] atau tinggal atau bekerja di dekat pembangkit listrik tenaga batu bara, fasilitas yang menambang atau memproses bijih uranium, atau pengayaan uranium untuk bahan bakar reaktor, mungkin mengalami peningkatan paparan uranium.[126][127] Rumah atau bangunan yang berada di atas deposit uranium (endapan terak alami atau buatan manusia) mungkin memiliki peningkatan paparan gas radon. Administrasi Keselamatan dan Kesehatan Kerja (OSHA) telah menetapkan batas paparan yang diizinkan untuk paparan uranium di tempat kerja sebesar 0,25 mg/m3 selama 8 jam hari kerja. Institut Nasional untuk Keselamatan dan Kesehatan Kerja (NIOSH) telah menetapkan batas paparan yang direkomendasikan (REL) sebesar 0,2 mg/m3 selama 8 jam hari kerja dan batas jangka pendek sebesar 0,6 mg/m3. Pada kadar 10 mg/m3, uranium langsung berbahaya bagi kehidupan dan kesehatan.[128]
Sebagian besar uranium yang tertelan dikeluarkan selama proses pencernaan. Hanya 0,5% yang diserap ketika bentuk uranium yang tidak larut, seperti oksidanya, dicerna, sedangkan penyerapan ion uranil yang lebih larut dapat mencapai 5%.[28] Namun, senyawa uranium yang larut cenderung cepat melewati tubuh, sedangkan senyawa uranium yang tidak larut, terutama ketika terhirup melalui debu ke dalam paru-paru, menimbulkan bahaya yang lebih serius. Setelah memasuki aliran darah, uranium yang diserap cenderung terbioakumulasi dan tinggal selama bertahun-tahun di jaringan tulang karena afinitas uranium terhadap fosfat.[28] Uranium yang masuk akan menjadi ion uranil, yang menumpuk di tulang, hati, ginjal, dan jaringan reproduksi.[129]
Toksisitas radiologis dan kimiawi uranium digabungkan oleh fakta bahwa unsur-unsur dengan nomor atom tinggi seperti uranium menunjukkan radiotoksisitas sekunder meskipun penyerapan gama latar belakang dan sinar-X alami serta emisi ulang fotoelektron, yang dikombinasikan dengan afinitas tinggi uranium ke gugus fosfat DNA menyebabkan peningkatan jumlah pemutusan DNA untai tunggal dan ganda.[130]
Uranium tidak diserap melalui kulit, dan partikel alfa yang dikeluarkan oleh uranium tidak dapat menembus kulit.[25]
Uranium dapat didekontaminasi dari permukaan baja dan[131] dan akuifer.[132][133]
Efek dan pencegahan[sunting | sunting sumber]
Fungsi normal ginjal, otak, hati, jantung, dan sistem lain dapat dipengaruhi oleh paparan uranium, karena, selain bersifat radioaktif lemah, uranium adalah logam beracun.[28][134][135] Uranium juga merupakan racun reproduktif.[136][137] Efek radiologi umumnya bersifat lokal karena radiasi alfa, bentuk utama peluruhan 238U, memiliki jangkauan yang sangat pendek, dan tidak akan menembus kulit. Radiasi alfa dari uranium yang dihirup telah terbukti menyebabkan kanker paru-paru pada pekerja nuklir yang terpapar.[138] Walaupun CDC telah menerbitkan satu penelitian bahwa tidak ada kanker pada manusia yang terlihat akibat paparan uranium alami atau terdeplesi,[139] paparan uranium dan produk peluruhannya, terutama radon, merupakan ancaman kesehatan yang signifikan.[140] Paparan terhadap stronsium-90, iodin-131, dan produk fisi lainnya tidak terkait dengan paparan uranium, tetapi dapat terjadi akibat prosedur medis atau paparan bahan bakar reaktor bekas atau luruhan dari senjata nuklir.[141]
Meskipun paparan penghirupan yang tidak disengaja terhadap uranium heksafluorida konsentrasi tinggi telah mengakibatkan kematian manusia, kematian tersebut dikaitkan dengan pembentukan asam fluorida dan uranil fluorida yang sangat beracun daripada dengan uranium itu sendiri.[142] Logam uranium yang terbelah halus menimbulkan bahaya kebakaran karena uranium bersifat piroforik; butiran kecilnya akan menyala secara spontan di udara pada suhu kamar.[7]
Logam uranium biasanya ditangani dengan sarung tangan sebagai tindakan pencegahan yang memadai.[143] Konsentrat uranium ditangani dan disimpan untuk memastikan bahwa orang tidak menghirup atau menelannya.[143]
Lihat pula[sunting | sunting sumber]
- Daftar kecelakaan dan insiden nuklir
- Daftar negara menurut cadangan uranium
- Daftar negara menurut produksi uranium
- Daftar proyek uranium
- Fisika nuklir
- Ikatan rangkap lima (sebelumnya dianggap sebagai ikatan Phi), dalam molekul U2
- Kecelakaan dan insiden nuklir
- Residu K-65
- Siklus bahan bakar nuklir
- Siklus bahan bakar torium
- Teknik nuklir
- World Uranium Hearing
Catatan[sunting | sunting sumber]
- ^ (Indonesia) "Uranium". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ Morss, L.R.; Edelstein, N.M.; Fuger, J., ed. (2006). The Chemistry of the Actinide and Transactinide Elements (edisi ke-3rd). Netherlands: Springer. ISBN 978-9048131464.
- ^ "Uranium". Encyclopaedia Britannica. Diakses tanggal 12 Juni 2023.
- ^ a b c d e Emsley 2001, hlm. 479.
- ^ a b c Fink, Margit (11 Agustus 2005) "Metal of Dishonor" – munitions from depleted Uranium (DU) contaminates soils in crisis areas. Bundesforschungsanstalt für Landwirtschaft
- ^ a b c d e f "Uranium"
 . The McGraw-Hill Science and Technology Encyclopedia (edisi ke-5). The McGraw-Hill Companies, Inc. 2005. ISBN 978-0-07-142957-3.
. The McGraw-Hill Science and Technology Encyclopedia (edisi ke-5). The McGraw-Hill Companies, Inc. 2005. ISBN 978-0-07-142957-3.
- ^ a b c d e f g h i j k l m n o p q Hammond, C. R. (2000). The Elements, in Handbook of Chemistry and Physics (PDF) (edisi ke-81). CRC press. ISBN 978-0-8493-0481-1.
- ^ "Uranium". Royal Society of Chemistry.
- ^ "Lead". Royal Society of Chemistry.
- ^ "Tungsten". Royal Society of Chemistry.
- ^ "Gold". Royal Society of Chemistry.
- ^ a b c d e f g "uranium". Columbia Electronic Encyclopedia (edisi ke-6). Columbia University Press. Diarsipkan dari versi asli tanggal 27 Juli 2011. Diakses tanggal 12 Juni 2023.
- ^ a b c d e "uranium". Encyclopedia of Espionage, Intelligence, and Security. The Gale Group, Inc. Diarsipkan dari versi asli tanggal 27 Juli 2011. Diakses tanggal 12 Juni 202e.
- ^ Rollett, A. D. (2008). Applications of Texture Analysis. John Wiley and Sons. hlm. 108. ISBN 978-0-470-40835-3.
- ^ a b c Grenthe, Ingmar; Drożdżyński, Janusz; Fujino, Takeo; Buck, Edgar C.; Albrecht-Schmitt, Thomas E.; Wolf, Stephen F. (2006). "Uranium". Dalam Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements (PDF). 5 (edisi ke-3). Dordrecht, Belanda: Springer. hlm. 52–160. doi:10.1007/1-4020-3598-5_5. ISBN 978-1-4020-3555-5. Diarsipkan dari versi asli (PDF) tanggal 7 Maret 2016.
- ^ "Development of DU Munitions". Depleted Uranium in the Gulf (II). Gulflink, official website of Force Health Protection & Readiness. 2000.
- ^ Schnug, E. dan Haneklaus, S. (2008) Uran – Umwelt – Unbehagen. Institut für Pflanzenernährung und Bodenkunde
- ^ Fink, M. (2004) Uran – Umwelt – Unbehagen. Bundesforschungsanstalt für Landwirtschaft
- ^ Brand RA, Schnug E (2005). "Depleted Uranium: a New Environmental Radiotoxological Pollutant". FAL – Agric. Res. 55 (4): 211–218.
- ^ a b c d e Emsley 2001, hlm. 480.
- ^ "Nuclear Weapon Design". Federation of American Scientists. 1998. Diarsipkan dari versi asli tanggal 26 Desember 2008. Diakses tanggal 12 Juni 2023.
- ^ "Statement regarding the Good Morning America broadcast," The Homer Laughlin China Co. Diarsipkan 1 April 2012 di Wayback Machine., 16 Maret 2011, Diakses tanggal 12 Juni 2023.
- ^ "Dial R for radioactive – 12 July 1997 – New Scientist". Newscientist.com. Diakses tanggal 12 Juni 2023.
- ^ "Uranium Mining". Atomic Heritage Foundation. Atomic Heritage Foundation. Diakses tanggal 12 Juni 2023.
- ^ a b "EPA Facts about Uranium" (PDF). U.S. Environmental Protection Agency. Archived from the original on 2014-11-29. Diakses tanggal 12 Juni 2023.
- ^ "Uranium Containing Dentures (ca. 1960s, 1970s)". ORAU Museum of Radiation and Radioactivity. Oak Ridge Associated Universities. 1999. Diakses tanggal 12 Juni 2023.
- ^ Emsley 2001, hlm. 482.
- ^ a b c d e f g h i j Emsley 2001, hlm. 477.
- ^ Velek, Victor (7 Mei 2008). "Uran stumbles in wooing towns". Prague Post. Diakses tanggal 12 Juni 2023.
- ^ "The History of Ore & Uranium Mining in Czechia". November 2017.
- ^ Klaproth, M. H. (1789). "Chemische Untersuchung des Uranits, einer neuentdeckten metallischen Substanz". Chemische Annalen. 2: 387–403.
- ^ "Uranium". The American Heritage Dictionary of the English Language (edisi ke-4). Houghton Mifflin Company. Diarsipkan dari versi asli tanggal 27 Juli 2011. Diakses tanggal 12 Juni 2023.
- ^ Péligot, E.-M. (1842). "Recherches Sur L'Uranium". Annales de chimie et de physique. 5 (5): 5–47.
- ^ a b c d Emsley 2001, hlm. 478.
- ^ "The Electric Journal". Westinghouse Club. 10 April 1920 – via Google Books.
- ^ Gillett, Horace Wadsworth; Mack, Edward Lawrence (10 April 1917). Preparation of ferro-uranium. Techinical Paper 177 – U.S. Bureau of Mines. U.S. Govt. print. off. – via Google Books.
- ^ a b c d e f Seaborg 1968, hlm. 773.
- ^ Fermi, Enrico (12 Desember 1938). "Artificial radioactivity produced by neutron bombardment: Nobel Lecture" (PDF). Royal Swedish Academy of Sciences. Diarsipkan dari versi asli (PDF) tanggal 9 Agustus 2018. Diakses tanggal 13 Juni 2023.
- ^ De Gregorio, A. (2003). "A Historical Note About How the Property was Discovered that Hydrogenated Substances Increase the Radioactivity Induced by Neutrons". Nuovo Saggiatore. 19: 41–47. arXiv:physics/0309046
 . Bibcode:2003physics...9046D.
. Bibcode:2003physics...9046D.
- ^ Nigro, M. (2004). "Hahn, Meitner e la teoria della fissione" (PDF). Diarsipkan dari versi asli (PDF) tanggal 25 Maret 2009. Diakses tanggal 13 Juni 2023.
- ^ van der Krogt, Peter. "Elementymology & Elements Multidict". Diakses tanggal 13 Juni 2023.
- ^ Meitner, L.; Frisch, O. (1939). "Disintegration of Uranium by Neutrons: a New Type of Nuclear Reaction". Nature. 143 (5218): 239–240. Bibcode:1969Natur.224..466M. doi:10.1038/224466a0.
- ^ "Alfred O. C. Nier". www.aps.org. Diakses tanggal 13 Juni 2023.
- ^ Manfred Popp (21 September 2016). "Wissenschaftsgeschichte: Hitlers Atombombe – warum es sie nicht gab – Spektrum der Wissenschaft". Spektrum.de. Diakses tanggal 13 Juni 2023.
- ^ "Chicago Pile One". large.stanford.edu. Diakses tanggal 13 Juni 2023.
- ^ Walsh, John (19 Juni 1981). "A Manhattan Project Postscript" (PDF). Science. AAAS. 212 (4501): 1369–1371. Bibcode:1981Sci...212.1369W. doi:10.1126/science.212.4501.1369. PMID 17746246. Diakses tanggal 13 Juni 2023.
- ^ Helmreich, J.E. Gathering Rare Ores: The Diplomacy of Uranium Acquisition, 1943–1954, Princeton UP, 1986: ch. 10 ISBN 0-7837-9349-9
- ^ Schnug, Ewald (2014). "Where has all the uranium gone? Or what feeds Dimona – circumstantial evidence for an illicit fate of uranium from rock phosphate processing". Uranium – Past and Future Challenges. Springer. hlm. 731–738. doi:10.1007/978-3-319-11059-2_84. ISBN 978-3-319-11058-5.
- ^ "Reactors Designed by Argonne National Laboratory: Fast Reactor Technology". Departemen Energi A.S., Laboratorium Nasional Argonne. 2012. Diakses tanggal 13 Juni 2023.
- ^ "History and Success of Argonne National Laboratory: Part 1". Departemen Energi A.S., Laboratorium Nasional Argonne. 1998. Diarsipkan dari versi asli tanggal 26 September 2006. Diakses tanggal 13 Juni 2023.
- ^ "Reactors Designed by Argonne National Laboratory: Light Water Reactor Technology Development". Departemen Energi A.S., Laboratorium Nasional Argonne. 2012. Diakses tanggal 13 Juni 2023.
- ^ "1956:Queen switches on nuclear power". BBC News. 17 Oktober 1956. Diakses tanggal 13 Juni 2023.
- ^ "STR (Submarine Thermal Reactor) in "Reactors Designed by Argonne National Laboratory: Light Water Reactor Technology Development"". Departemen Energi A.S., Laboratorium Nasional Argonne. 2012. Diakses tanggal 13 Juni 2023.
- ^ a b "Oklo: Natural Nuclear Reactors". Office of Civilian Radioactive Waste Management. Diarsipkan dari versi asli tanggal 3 Juni 2004. Diakses tanggal 13 Juni 2023.
- ^ Warneke, T.; Croudace, I. W.; Warwick, P. E.; Taylor, R. N. (2002). "A new ground-level fallout record of uranium and plutonium isotopes for northern temperate latitudes". Earth and Planetary Science Letters. 203 (3–4): 1047–1057. Bibcode:2002E&PSL.203.1047W. doi:10.1016/S0012-821X(02)00930-5.
- ^ "The Worst Nuclear Disasters". Time.com. 25 Maret 2009. Diarsipkan dari versi asli tanggal 28 Maret 2009. Diakses tanggal 13 Juni 2023.
- ^ Gilliland, Frank D.; Hunt, William C.; Pardilla, Marla; Key, Charles R. (Maret 2000). "Uranium Mining and Lung Cancer Among Navajo Men in New Mexico and Arizona, 1969 to 1993". Journal of Occupational and Environmental Medicine. 42 (3): 278–283. doi:10.1097/00043764-200003000-00008. PMID 10738707.
- ^ Brugge, Doug; Goble, Rob (2002). "The History of Uranium Mining and the Navajo People". American Journal of Public Health. Ajph.org. 92 (9): 1410–9. doi:10.2105/AJPH.92.9.1410. PMC 3222290
 . PMID 12197966.
. PMID 12197966.
- ^ Van Unnik, J. G.; Broerse, J. J.; Geleijns, J.; Jansen, J. T.; Zoetelief, J.; Zweers, D. (1997). "Survey of CT techniques and absorbed dose in various Dutch hospitals". The British Journal of Radiology. 70 (832): 367–71. doi:10.1259/bjr.70.832.9166072. PMID 9166072. (3000 pemeriksaan dari 18 rumah sakit)
- ^ Russia's Nuclear Fuel Cycle. World Nuclear Association. Diperbarui Desember 2021.
- ^ "History/Origin of Chemicals". NASA. Diakses tanggal 13 Juni 2023.
- ^ Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; Hoyle, F. (1957). "Synthesis of the Elements in Stars". Reviews of Modern Physics. 29 (4): 547. Bibcode:1957RvMP...29..547B. doi:10.1103/RevModPhys.29.547
 .
.
- ^ Clayton, Donald D. (1968). Principles of Stellar Evolution and Nucleosynthesis. New York: Mc-Graw-Hill. hlm. 577–91. ISBN 978-0226109534.
- ^ a b Trenn, Thaddeus J. (1978). "Thoruranium (U-236) as the extinct natural parent of thorium: The premature falsification of an essentially correct theory". Annals of Science. 35 (6): 581–97. doi:10.1080/00033797800200441.
- ^
Tissot, François L. H.; Dauphas, Nicolas; Grossmann, Lawrence (4 Maret 2016). "Origin of uranium isotope variations in early solar nebula condensates". Science Advances. 2 (3): e1501400. arXiv:1603.01780
 . Bibcode:2016SciA....2E1400T. doi:10.1126/sciadv.1501400. PMC 4783122
. Bibcode:2016SciA....2E1400T. doi:10.1126/sciadv.1501400. PMC 4783122  . PMID 26973874.
. PMID 26973874.
- ^ Biever, Celeste (27 Juli 2005). "First measurements of Earth's core radioactivity". New Scientist. Diakses tanggal 13 Juni 2023.
- ^ "Potassium-40 heats up Earth's core". physicsworld.com. 7 Mei 2003. Diakses tanggal 13 Juni 2023.
- ^ Schnug, E., Sun, Y., Zhang, L., Windmann, H., Lottermoser, B.G., Ulrich, A. E., Bol, R., Makeawa, M., and Haneklaus, S.H. (2023) "Elemental loads with phosphate fertilizers – a constraint for soil productivity?" In: Bolan, N.S. and Kirkham, M.B. (eds.) Managing Soil Constraints for Sustaining Productivity. CRC Press.
- ^ Min, M.; Xu, H.; Chen, J.; Fayek, M. (2005). "Evidence of uranium biomineralization in sandstone-hosted roll-front uranium deposits, northwestern China". Ore Geology Reviews. 26 (3–4): 198. doi:10.1016/j.oregeorev.2004.10.003.
- ^ Koribanics, N. M.; Tuorto, S. J.; Lopez-Chiaffarelli, N.; McGuinness, L. R.; Häggblom, M. M.; Williams, K. H.; Long, P. E.; Kerkhof, L. J. (2015). "Spatial Distribution of an Uranium-Respiring Betaproteobacterium at the Rifle, CO Field Research Site". PLOS ONE. 10 (4): e0123378. Bibcode:2015PLoSO..1023378K. doi:10.1371/journal.pone.0123378
 . PMC 4395306
. PMC 4395306  . PMID 25874721.
. PMID 25874721.
- ^ Renshaw, J. C.; Butchins, L. J. C.; Livens, F. R.; et al. (June 2005). "Bioreduction of uranium: environmental implications of a pentavalent intermediate". Environmental Science & Technology. 39 (15): 5657–5660. Bibcode:2005EnST...39.5657R. doi:10.1021/es048232b. PMID 16124300.
- ^ Vitesse, GF; Morris, K; Natrajan, LS; Shaw, S (Januari 2020). "Multiple Lines of Evidence Identify U(V) as a Key Intermediate during U(VI) Reduction by Shewanella oneidensis MR1". Environmental Science & Technology. 54 (4): 2268–2276. Bibcode:2020EnST...54.2268V. doi:10.1021/acs.est.9b05285
 . PMID 31934763.
. PMID 31934763.
- ^ Emsley 2001, hlm. 476 and 482.
- ^ Macaskie, L. E.; Empson, R. M.; Cheetham, A. K.; Grey, C. P.; Skarnulis, A. J. (1992). "Uranium bioaccumulation by a Citrobacter sp. as a result of enzymically mediated growth of polycrystalline HUO2PO4". Science. 257 (5071): 782–784. Bibcode:1992Sci...257..782M. doi:10.1126/science.1496397. PMID 1496397.
- ^ Anderson, R. T.; Vrionis, H. A.; Ortiz-Bernad, I.; Resch, C. T.; Long, P. E.; Dayvault, R.; Karp, K.; Marutzky, S.; Metzler, D. R.; Peacock, A.; White, D. C.; Lowe, M.; Lovley, D. R. (2003). "Stimulating the in situ activity of Geobacter species to remove uranium from the groundwater of a uranium-contaminated aquifer". Applied and Environmental Microbiology. 69 (10): 5884–5891. Bibcode:2003ApEnM..69.5884A. doi:10.1128/AEM.69.10.5884-5891.2003. PMC 201226
 . PMID 14532040.
. PMID 14532040.
- ^ Gadd, G. M. (March 2010). "Metals, minerals and microbes: geomicrobiology and bioremediation". Microbiology. 156 (Pt 3): 609–643. doi:10.1099/mic.0.037143-0
 . PMID 20019082.
. PMID 20019082.
- ^
Nilgiriwala, K.S.; Alahari, A.; Rao, A. S.; Apte, S.K. (2008). "Cloning and Overexpression of Alkaline Phosphatase PhoK from Sphingomonas sp. Strain BSAR-1 for Bioprecipitation of Uranium from Alkaline Solutions". Applied and Environmental Microbiology. 74 (17): 5516–5523. Bibcode:2008ApEnM..74.5516N. doi:10.1128/AEM.00107-08. PMC 2546639
 . PMID 18641147.
. PMID 18641147.
- ^ a b c d "World Uranium Mining". World Nuclear Association. Diakses tanggal 13 Juni 2023.
- ^ Seaborg 1968, hlm. 774.
- ^ "Athabasca Basin, Saskatchewan". Diakses tanggal 13 Juni 2023.
- ^ Gupta, C. K.; Mukherjee, T. K. (1990). Hydrometallurgy in extraction processes. 1. CRC Press. hlm. 74–75. ISBN 978-0-8493-6804-2.
- ^ "Uranium production". Our World in Data. Diakses tanggal 13 Juni 2023.
- ^ a b "Uranium Supplies: Supply of Uranium – World Nuclear Association". www.world-nuclear.org.
- ^ a b "Global Uranium Resources to Meet Projected Demand". International Atomic Energy Agency. 2006. Diakses tanggal 13 Juni 2023.
- ^ "Uranium Mining and Processing in South Australia". South Australian Chamber of Mines and Energy. 2002. Diarsipkan dari versi asli tanggal 6 Januari 2012. Diakses tanggal 13 Juni 2023.
- ^ Ngoupana, P.-M.; Felix, B. (2011). Barker, A., ed. "Areva suspends CAR uranium mine project". Central African Republic News. Diakses tanggal 13 Juni 2023.
- ^ "Military Warheads as a Source of Nuclear Fuel". World-nuclear.org. Diakses tanggal 13 Juni 2023.
- ^ "Megatons to Megawatts". U.S. Enrichment Corp. Diarsipkan dari versi asli tanggal 16 Juli 2008.
- ^ "Uranium recovery from Seawater". Japan Atomic Energy Research Institute. 23 Agustus 1999. Diarsipkan dari versi asli tanggal 17 Oktober 2009. Diakses tanggal 13 Juni 2023.
- ^ "How long will nuclear energy last?". 12 Februari 1996. Diarsipkan dari versi asli tanggal 10 April 2007. Diakses tanggal 13 Juni 2023.
- ^ Tsezos, M.; Noh, S. H. (1984). "Extraction of uranium from sea water using biological origin adsorbents". The Canadian Journal of Chemical Engineering. 62 (4): 559–561. doi:10.1002/cjce.5450620416.
- ^ "ORNL technology moves scientists closer to extracting uranium from seawater". Oak Ridge National Laboratory, United States. 21 Agustus 2012. Diarsipkan dari versi asli tanggal 25 Agustus 2012. Diakses tanggal 13 Juni 2023.
- ^ "Fueling nuclear power with seawater". Pnnl.gov. 21 Agustus 2012. Diakses tanggal 13 Juni 2023.
- ^ "NUEXCO Exchange Value (Monthly Uranium Spot)". Diarsipkan dari versi asli tanggal 12 Desember 2007.
- ^ "World Uranium Production". UxC Consulting Company, LLC. Diarsipkan dari versi asli tanggal 27 Februari 2007. Diakses tanggal 13 Juni 2023.
- ^ Mithridates (24 Juli 2008). "Page F30: Kazakhstan to surpass Canada as the world's largest producer of uranium by last year (2009)". Mithridates.blogspot.com. Diakses tanggal 13 Juni 2023.
- ^ "Kazakistan uranyum üretimini artıracak". Zaman.com.tr (dalam bahasa Turki). Zaman Gazetesi. 28 Juli 2008. Diarsipkan dari versi asli tanggal 13 Januari 2009. Diakses tanggal 13 Juni 2023.
- ^ "In Situ Leach Mining (ISL) of Uranium – World Nuclear Association". www.world-nuclear.org. Diakses tanggal 13 Juni 2023.
- ^ "Big Uranium Find Announced in Somalia". The New York Times. 16 Maret 1968. Diakses tanggal 13 Juni 2023.
- ^ "Lack of fuel may limit U.S. nuclear power expansion". Massachusetts Institute of Technology. 21 Maret 2007. Diakses tanggal 13 Juni 2023.
- ^ Deffeyes, Kenneth S.; MacGregor, Ian D. (Januari 1980). "World Uranium Resources". Scientific American. 242 (1): 66. Bibcode:1980SciAm.242a..66D. doi:10.1038/scientificamerican0180-66. OSTI 6665051.
- ^ Kloprogge, J. Theo; Ponce, Concepcion P.; Loomis, Tom A. (2021). The periodic table : nature's building blocks : an introduction to the naturally occurring elements, their origins and their uses. Amsterdam: Elsevier. hlm. 861–862. ISBN 978-0-12-821538-8. OCLC 1223058470.
- ^ Seaborg 1968, hlm. 779.
- ^ a b c "Chemical Forms of Uranium". Laboratorium Nasional Argonne. Diarsipkan dari versi asli tanggal 22 September 2006. Diakses tanggal 13 Juni 2023.
- ^ a b Seaborg 1968, hlm. 778.
- ^ a b c d Puigdomenech, Ignasi (2004) Hydra/Medusa Chemical Equilibrium Database and Plotting Software. KTH Royal Institute of Technology
- ^ a b c d e f g h i j Seaborg 1968, hlm. 782.
- ^ a b Seaborg 1968, hlm. 780.
- ^ Beiser, A. (2003). "Nuclear Transformations" (PDF). Concepts of Modern Physics (edisi ke-6). McGraw-Hill Education. hlm. 432–434. ISBN 978-0-07-244848-1. Diarsipkan dari versi asli (PDF) tanggal 4 Oktober 2016. Diakses tanggal 13 Juni 2023.
- ^ Roederer, I. U.; Kratz, K.; Frebel, A.; Christlieb, N.; Pfeiffer, B.; Cowan, J. J.; Sneden, C. (2009). "The end of nucleosynthesis: Production of lead and thorium in the early galaxy". The Astrophysical Journal. 698 (2): 1963–1980. arXiv:0904.3105
 . Bibcode:2009ApJ...698.1963R. doi:10.1088/0004-637X/698/2/1963. hdl:2152/35050.
. Bibcode:2009ApJ...698.1963R. doi:10.1088/0004-637X/698/2/1963. hdl:2152/35050.
- ^ a b c d e f g h i j k l m n Kondev, F.G.; Wang, M.; Huang, W.J.; Naimi, S.; Audi, G. (2021). "The NUBASE2020 evaluation of nuclear properties" (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ a b Terjadinya plutonium-244 sebagai nuklida primordial masih diperdebatkan, meskipun beberapa laporan pendeteksiannya juga dikaitkan dengan penggabungan dari medium antarbintang.[113][114]
- ^ Lachner, J.; et al. (2012). "Attempt to detect primordial 244Pu on Earth". Physical Review C. 85 (1): 015801. Bibcode:2012PhRvC..85a5801L. doi:10.1103/PhysRevC.85.015801.
- ^ Wallner, A.; Faestermann, T.; Feige, J.; Feldstein, C.; Knie, K.; Korschinek, G.; Kutschera, W.; Ofan, A.; Paul, M.; Quinto, F.; Rugel, G.; Steier, P. (2015). "Abundance of live 244Pu in deep-sea reservoirs on Earth points to rarity of actinide nucleosynthesis". Nature Communications. 6: 5956. arXiv:1509.08054
 . Bibcode:2015NatCo...6.5956W. doi:10.1038/ncomms6956. ISSN 2041-1723. PMC 4309418
. Bibcode:2015NatCo...6.5956W. doi:10.1038/ncomms6956. ISSN 2041-1723. PMC 4309418  . PMID 25601158.
. PMID 25601158.
- ^ Marouli, M.; Pommé, S.; Jobbágy, V.; Van Ammel, R.; Paepen, J.; Stroh, H.; Benedik, L. (2014). "Alpha-particle emission probabilities of 236U obtained by alpha spectrometry". Applied Radiation and Isotopes. 87: 292–296. doi:10.1016/j.apradiso.2013.11.020. ISSN 0969-8043. PMID 24309010.
- ^ a b Near Term and Promising Long Term Options for the Deployment of Thorium Based Nuclear Energy (PDF) (Laporan). Vienna: International Atomic Energy Agency. 2022.
- ^ a b Forsburg, C. W.; Lewis, L. C. (24 September 1999). "Uses For Uranium-233: What Should Be Kept for Future Needs?" (PDF). Ornl-6952. Laboratorium Nasional Oak Ridge.
- ^ Goffer, Zvi (2006). Archaeological Chemistry (edisi ke-2). Wiley. hlm. 106. ISBN 978-0-471-91515-7.
- ^ Zhang, Z. Y.; et al. (2021). "New α -Emitting Isotope 214 U and Abnormal Enhancement of α -Particle Clustering in Lightest Uranium Isotopes". Physical Review Letters. 126 (15): 152502. arXiv:2101.06023
 . Bibcode:2021PhRvL.126o2502Z. doi:10.1103/PhysRevLett.126.152502. PMID 33929212 Periksa nilai
. Bibcode:2021PhRvL.126o2502Z. doi:10.1103/PhysRevLett.126.152502. PMID 33929212 Periksa nilai |pmid=(bantuan). Diakses tanggal 13 Juni 2023. - ^ Niwase, T.; Watanabe, Y. X.; Hirayama, Y.; et al. (2023). "Discovery of New Isotope 241U and Systematic High-Precision Atomic Mass Measurements of Neutron-Rich Pa-Pu Nuclei Produced via Multinucleon Transfer Reactions". Physical Review Letters. 130 (13): 132502–1–132502–6. doi:10.1103/PhysRevLett.130.132502.
- ^ Mastren, T.; Stein, B.W.; Parker, T.G.; Radchenko, V.; Copping, R.; Owens, A.; Wyant, L.E.; Brugh, M.; Kozimor, S.A.; Noriter, F.M.; Birnbaum, E.R.; John, K.D.; Fassbender, M.E. (2018). "Separation of protactinium employing sulfur-based extraction chromatographic resins". Analytical Chemistry. 90 (11): 7012–7017. doi:10.1021/acs.analchem.8b01380. ISSN 0003-2700. OSTI 1440455. PMID 29757620.
- ^ Khuyagbaatar, J.; et al. (11 Desember 2015). "New Short-Lived Isotope 221U and the Mass Surface Near N = 126". Physical Review Letters. 115 (24): 242502. Bibcode:2015PhRvL.115x2502K. doi:10.1103/PhysRevLett.115.242502. PMID 26705628.
- ^ "Uranium Enrichment". Laboratorium Nasional Argonne. Diarsipkan dari versi asli tanggal 24 Januari 2007. Diakses tanggal 13 Juni 2023.
- ^ a b Diehl, Peter. "Depleted Uranium: a by-product of the Nuclear Chain". Laka Foundation. Diarsipkan dari versi asli tanggal 13 Januari 2013. Diakses tanggal 13 Juni 2023.
- ^ Duarte, F. J.; Hillman, L. W., ed. (1990). Dye Laser Principles. Academic. hlm. 413. ISBN 978-0-12-222700-4. Diarsipkan dari versi asli tanggal 17 September 2010.
- ^ "Radionuclide Basics: Uranium". U.S. Environmental Protection Agency. 16 Februari 2023. Diakses tanggal 13 Juni 2023.
- ^ "ToxFAQ for Uranium". Agency for Toxic Substances and Disease Registry. 18 Maret 2014. Diakses tanggal 13 Juni 2023.
- ^ "CDC – NIOSH Pocket Guide to Chemical Hazards – Uranium (insoluble compounds, as U)". Institut Nasional untuk Keselamatan dan Kesehatan Kerja. 30 Oktober 2019. Diakses tanggal 13 Juni 2023.
- ^ Permyakov, Eugene (2009). Metalloproteomics. Hoboken: John Wiley & Sons. hlm. 564. ISBN 978-0-470-44774-1. OCLC 609844907.
- ^ Busby, C. and Schnug, E. (2008). "Advanced biochemical and biophysical aspects of uranium contamination". In: De Kok, L.J. and Schnug, E. (Eds) Loads and Fate of Fertilizer Derived Uranium. Backhuys Publishers, Leiden, Belanda. ISBN 978-90-5782-193-6
- ^ Francis, A. J.; Dodge, C. J.; McDonald, J. A.; Halada, G. P. (2005). "Decontamination of uranium-contaminated steel surfaces by hydroxycarboxylic acid with uranium recovery". Environmental Science & Technology. 39 (13): 5015–21. Bibcode:2005EnST...39.5015F. doi:10.1021/es048887c. PMID 16053105.
- ^ Gandhi, T. Pushparaj; Sampath, Prasanna Venkatesh; Maliyekkal, Shihabudheen M. (15 Juni 2022). "A critical review of uranium contamination in groundwater: Treatment and sludge disposal". The Science of the Total Environment. 825: 153947. doi:10.1016/j.scitotenv.2022.153947. ISSN 1879-1026. PMID 35189244 Periksa nilai
|pmid=(bantuan). - ^ Prusty, Sourav; Somu, Prathap; Sahoo, Jitendra Kumar; Panda, Debasish; Sahoo, Sunil Kumar; Sahoo, Shraban Kumar; Lee, Yong Rok; Jarin, T.; Sundar, L. Syam; Rao, Koppula Srinivas (Desember 2022). "Adsorptive sequestration of noxious uranium (VI) from water resources: A comprehensive review". Chemosphere. 308 (Pt 1): 136278. doi:10.1016/j.chemosphere.2022.136278. ISSN 1879-1298. PMID 36057349 Periksa nilai
|pmid=(bantuan). - ^ Craft, E. S.; Abu-Qare, A. W.; Flaherty, M. M.; Garofolo, M. C.; Rincavage, H. L.; Abou-Donia, M. B. (2004). "Depleted and natural uranium: chemistry and toxicological effects" (PDF). Journal of Toxicology and Environmental Health Part B: Critical Reviews. 7 (4): 297–317. CiteSeerX 10.1.1.535.5247
 . doi:10.1080/10937400490452714. PMID 15205046.
. doi:10.1080/10937400490452714. PMID 15205046.
- ^ Agency for Toxic Substances and Disease Registry (ATSDR) (Februari 2013). "2. Relevance to Public Health" (PDF). Toxicological Profile for Uranium (Laporan). Atlanta, GA: U.S. Department of Health and Human Services, Public Health Service. hlm. 11–38. CAS# 7440-61-1.
- ^ Hindin, Rita; Brugge, D.; Panikkar, B. (2005). "Teratogenicity of depleted uranium aerosols: A review from an epidemiological perspective". Environ Health. 4: 17. doi:10.1186/1476-069X-4-17. PMC 1242351
 . PMID 16124873.
. PMID 16124873.
- ^ Arfsten, D.P.; K.R. Still; G.D. Ritchie (2001). "A review of the effects of uranium and depleted uranium exposure on reproduction and fetal development". Toxicology and Industrial Health. 17 (5–10): 180–91. doi:10.1191/0748233701th111oa. PMID 12539863.
- ^ Grellier, James; Atkinson, Will; Bérard, Philippe; Bingham, Derek; Birchall, Alan; Blanchardon, Eric; Bull, Richard; Guseva Canu, Irina; Challeton-de Vathaire, Cécile; Cockerill, Rupert; Do, Minh T; Engels, Hilde; Figuerola, Jordi; Foster, Adrian; Holmstock, Luc; Hurtgen, Christian; Laurier, Dominique; Puncher, Matthew; Riddell, Tony; Samson, Eric; Thierry-Chef, Isabelle; Tirmarche, Margot; Vrijheid, Martine; Cardis, Elisabeth (2017). "Risk of lung cancer mortality in nuclear workers from internal exposure to alpha particle-emitting radionuclides". Epidemiology. 28 (5): 675–684. doi:10.1097/EDE.0000000000000684. PMC 5540354
 . PMID 28520643.
. PMID 28520643.
- ^ "Public Health Statement for Uranium" (PDF). CDC. Diakses tanggal 13 Juni 2023.
- ^ Radon Exposures to Workers at the Fernald Feed Materials Production Center. Halaman diulas: 8 April 2020. U.S. National Institute for Occupational Safety and Health (NIOSH)
- ^ Chart of the Nuclides, US Atomic Energy Commission 1968
- ^ Dart, Richard C. (2004). Medical Toxicology. Lippincott Williams & Wilkins. hlm. 1468. ISBN 978-0-7817-2845-4.
- ^ a b "Radiation Fact Sheets #27, Uranium (U)". Washington State Department of Health, Office of Radiation Protection. 2010. Diarsipkan dari versi asli tanggal 28 September 2011. Diakses tanggal 13 Juni 2023.
Referensi[sunting | sunting sumber]
- Emsley, John (2001). "Uranium". Nature's Building Blocks: An A to Z Guide to the Elements. Oxford: Oxford University Press. hlm. 476–482. ISBN 978-0-19-850340-8.
- Seaborg, Glenn T. (1968). "Uranium". The Encyclopedia of the Chemical Elements. Skokie, Illinois: Reinhold Book Corporation. hlm. 773–786. LCCN 68029938.
Pranala luar[sunting | sunting sumber]
- (Inggris) Data dan analisis bahan bakar nuklir dari Administrasi Informasi Energi A.S.
- (Inggris) Harga pasar uranium saat ini
- (Inggris) Peta deposit uranium dunia
- (Inggris) Bibliografi beranotasi untuk uranium dari Perpustakaan Digital Alsos
- (Inggris) Bank Data Zat Berbahaya NLM—Uranium, Radioaktif
- (Inggris) CDC – Panduan Saku NIOSH untuk Bahaya Kimia
- (Inggris) Penambangan Uranium di Tambang Langer Heinrich, Namibia
- (Inggris) Berita Nuklir Dunia
- (Inggris) Studi Kasus ATSDR dalam Pengobatan Lingkungan: Toksisitas Uranium Departemen Kesehatan dan Layanan Masyarakat A.S.
- (Inggris) Uranium di The Periodic Table of Videos (Universitas Nottingham)
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||



![Produksi (tambang) dan permintaan uranium dunia[78]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/75/U_production-demand.png/431px-U_production-demand.png)

![Produksi uranium tahun 2015, dalam ton[82]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9a/Uranium_production%2C_OWID.svg/425px-Uranium_production%2C_OWID.svg.png)