Asam benzoat: Perbedaan antara revisi
Tidak ada ringkasan suntingan |
Add 1 book for Wikipedia:Pemastian (20231010)) #IABot (v2.0.9.5) (GreenC bot |
||
| (46 revisi perantara oleh 31 pengguna tidak ditampilkan) | |||
| Baris 1: | Baris 1: | ||
{{chembox |
|||
| ImageFileL1 = Benzoic acid.svg |
|||
| ImageSizeL1 = 120px |
|||
| ImageFileR1 = Benzoic-acid-3D-vdW.png |
|||
| ImageSizeR1 = 120px |
|||
| IUPACName = Asam benzoat |
|||
| OtherNames = Asam benzenakarboksilat,{{br}}Karboksibenzena,{{br}}E210, Asam drasiklik |
|||
| Section1 = {{Chembox Identifiers |
|||
| Abbreviations = |
|||
| CASNo = 65-85-0 |
|||
| CASNo_Ref = {{cascite}} |
|||
| EINECS = 200-618-2 |
|||
| PubChem = 243 |
|||
| ChemSpiderID= 238 |
|||
| SMILES = c1ccccc1C(=O)O |
|||
| InChI = 1/C7H6O2/c8-7(9)6-4-2-1-3-5-6/h1-5H,(H,8,9)/f/h8H |
|||
| RTECS = DG0875000 |
|||
| ChEBI = 30746 |
|||
| ATCCode_prefix = |
|||
| ATCCode_suffix = |
|||
| ATC_Supplemental = |
|||
}} |
|||
| Section2 = {{Chembox Properties |
|||
| Formula = C<sub>6</sub>H<sub>5</sub>COOH |
|||
| MolarMass = 122,12 g/mol |
|||
| Appearance = Padatan kristal tak berwarna |
|||
| Density = 1,32 g/cm<sup>3</sup>, padat |
|||
| MeltingPt = 122,4 °C (395 K) |
|||
| Melting_notes = |
|||
| BoilingPt = 249 °C (522 K) |
|||
| Boiling_notes = |
|||
| Solubility = Terlarutkan (air panas){{br}}3,4 g/l (25 °C) |
|||
| SolubleOther = THF 3,37 M, etanol 2,52 M, metanol 2,82 M<ref>[http://oru.edu/cccda/sl/solubility/allsolvents.php?solute=benzoic%20acid Solubility of benzoic acid in non-aqueous solvents]</ref> |
|||
| Solvent = [[THF]], [[etanol]], [[metanol]] |
|||
| pKa = 4,21 |
|||
| pKb = |
|||
| IsoelectricPt = |
|||
| LambdaMax = |
|||
| Absorbance = |
|||
| SpecRotation = |
|||
| RefractIndex = |
|||
| Viscosity = |
|||
| Dipole = |
|||
}} |
|||
| Section3 = {{Chembox Structure |
|||
| CrystalStruct = [[Monoklinik]] |
|||
| Coordination = |
|||
| MolShape = [[planar]] |
|||
| Dipole = 1,72 [[Debye|D]] dalam [[Dioksana]] |
|||
}} |
|||
| Section4 = {{Chembox Thermochemistry |
|||
| DeltaHf = |
|||
| DeltaHc = |
|||
| Entropy = |
|||
| HeatCapacity = |
|||
}} |
|||
| Section7 = {{Chembox Hazards |
|||
| ExternalMSDS = [http://sciencelab.com/msds.php?msdsId=9927096 ScienceLab.com] |
|||
| EUClass = |
|||
| EUIndex = not listed |
|||
| MainHazards = Menyebabkan iritasi |
|||
| NFPA-H = 2 |
|||
| NFPA-F = 1 |
|||
| NFPA-R = 0 |
|||
| NFPA-O = |
|||
| RPhrases = |
|||
| SPhrases = |
|||
| RSPhrases = |
|||
| FlashPt = 121 °C (394 K) |
|||
| Autoignition = |
|||
| ExploLimits = |
|||
| PEL = |
|||
}} |
|||
| Section8 = {{Chembox Related |
|||
| OtherAnions = |
|||
| OtherCations = |
|||
| OtherFunctn = [[asam fenilasetat]],{{br}}[[asam hipurat]],{{br}}[[asam salisilat]] |
|||
| Function = [[Asam karboksilat]] |
|||
| OtherCpds = [[benzena]],{{br}}[[benzaldehida]],{{br}}[[benzil alkohol]],{{br}}[[benzilamina]],{{br}}[[benzil benzoat]],{{br}}[[benzoil klorida]],{{br}}[[asam 3-nitrobenzoat]],{{br}}[[asam 3,5-dinitrobenzoat]] |
|||
}} |
|||
}} |
|||
[[Berkas:S-Sci-ArCOOH.jpg|ka|jmpl|300px|Kristal asam benzoat]] |
|||
'''Asam benzoat''', C<sub>7</sub>H<sub>6</sub>O<sub>2</sub> (atau C<sub>6</sub>H<sub>5</sub>COOH), adalah padatan kristal berwarna putih dan merupakan [[asam karboksilat]] [[aromatik]] yang paling sederhana. Nama asam ini berasal dari ''gum benzoin'' ([[getah kemenyan]]), yang dahulu merupakan satu-satunya sumber asam benzoat. Asam lemah ini beserta garam turunannya digunakan sebagai pengawet makanan. Asam benzoat adalah prekursor yang penting dalam sintesis banyak bahan-bahan kimia lainnya. |
|||
Asam benzoat adalah bahan pengawet yang sering dipakai dalam pembuatan makanan. Penggunaan bahan pengawet ini cukup banyak mendominasi produk makanan dan minuman untuk mempertahankan bahan pangan dari serangan [[mikroba]] pembusuk seperti [[bakteri]] dan [[jamur]], dengan cara mencegah atau menghentikan proses pembusukan. |
|||
== Penemuan == |
|||
Lalu bagaimana efek bahan pengawet tersebut bagi tubuh kita ? "Asal dipakai sesuai dengan dosis maksimal yang telah diatur, kita tak perlu khawatir karena tubuh kita memiliki sistem [[detoksifikasi ]]benzoat yang sangat efektif. Benzoat akan terbuang hingga 95 persen lewat [[urin]]". |
|||
Asam benzoat pertama kali ditemukan pada abad ke-16. [[Distilasi kering]] getah kemenyan pertama kali dideskripsikan oleh [[Nostradamus]] (1556), dan selanjutnya oleh [[Alexius Pedemontanus]] (1560) dan [[Blaise de Vigenère]] (1596).<ref>{{cite book|author= Neumüller O-A|year = 1988|title = Römpps Chemie-Lexikon|edition = 6|publisher = Frankh'sche Verlagshandlung|location = Stuttgart|isbn = 3-440-04516-1|oclc= 50969944 }}</ref> |
|||
[[Justus von Liebig]] dan [[Friedrich Wöhler]] berhasil menentukan struktur asam benzoat pada tahun 1832.<ref>{{cite journal |
|||
Di dalam tubuh, asam benzoat akan bergabung dengan [[glisin]] di dalam hati dan membentuk [[asam hippurat]] yang akan dikeluarkan lewat urin. Jika masih ada yang tertinggal, benzoat akan bergabung dengan [[asam glukuronat]] yang termetabolisme lewat urin. |
|||
| author= [[Justus von Liebig|Liebig J]], [[Friedrich Wöhler|Wöhler F]] |
|||
| title=Untersuchungen über das Radikal der Benzoesäure |
|||
| journal = [[Liebigs Annalen|Annalen der Chemie]] |
|||
| year = 1832 |
|||
| volume = 3 |
|||
| pages = 249–282 |
|||
| doi = 10.1002/jlac.18320030302}}</ref> Mereka juga meneliti bagaimana [[asam hipurat]] berhubungan dengan asam benzoat. |
|||
Pada tahun 1875, Salkowski menemukan bahwa asam benzoat memiliki aktivitas anti jamur.<ref>{{cite journal | author= Salkowski E| title= | journal=Berl Klin Wochenschr| year=1875 | volume=12 | pages=297–298}}</ref> |
|||
Benzoat sebenarnya bisa ditemukan secara natural pada buah dan rempah. [[Cengkeh]], [[cinnamon]] dan buah [[berry]] mengandung benzoat. |
|||
== Produksi == |
|||
[[Kategori:Asam organik]] |
|||
=== Pembuatan secara industri === |
|||
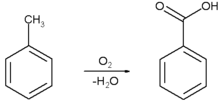
Asam benzoat diproduksi secara komersial dengan oksidasi parsial [[toluena]] dengan [[oksigen]]. Proses ini dikatalisis oleh [[kobalt]] ataupun [[mangan]] [[naftenat]]. Proses ini menggunakan bahan-bahan baku yang murah, menghasilkan rendemen yang tinggi, dan dianggap sebagai ramah lingkungan. |
|||
[[Berkas:Benzoic acid-chemical-synthesis-1.png|220px|Oksidasi toluena]] |
|||
[[bg:Бензоена киселина]] |
|||
[[de:Benzoesäure]] |
|||
=== Sintesis laboratorium === |
|||
[[en:Benzoic acid]] |
|||
Asam benzoat sangatlah murah dan tersedia secara meluas, sehingga sintesis laboratorium asam benzoat umumnya hanya dipraktikkan untuk tujuan pedagogi. Ia umumnya diajarkan kepada mahasiswa universitas. |
|||
[[es:Ácido benzoico]] |
|||
[[fr:Acide benzoïque]] |
|||
Untuk semua metode sintesis, asam benzoat dapat dimurnikan dengan rekristalisasi dari air, karena asam benzoat larut dengan baik dalam air panas namun buruk dalam air dingin. Penghindaran penggunaan pelarut organik untuk rekristalisasi membuat eksperimen ini aman. Pelarut lainnya yang memungkinkan meliputi [[asam asetat]], [[benzena]], eter petrolium, dan campuran etanol dan air.<ref>{{cite book|title = Purification of Laboratory Chemicals|edition = 3rd|author = D. D. Perrin; W. L. F. Armarego|publisher = Pergamon Press|pages = 94|year = 1988|isbn = 0-08-034715-0}}</ref> |
|||
[[ko:벤조산]] |
|||
[[it:Acido benzoico]] |
|||
==== Dengan hidrolisis ==== |
|||
[[lv:Benzoskābe]] |
|||
Sama seperti [[nitril]] ataupun [[amida]] lainnya, [[benzonitril]] dan [[benzoamida]] dapat dihidrolisis menjadi asam benzoat ataupun basa konjugatnya dalam keadaan asam maupun basa. |
|||
[[nl:Benzoëzuur]] |
|||
[[ja:安息香酸]] |
|||
==== Dari benzaldehida ==== |
|||
[[pl:Kwas benzoesowy]] |
|||
[[Disproporsionasi]] [[benzaldehida]] yang diinduksi oleh basa dalam [[reaksi Cannizzaro]] akan menghasilkan sejumlah asam benzoat dan [[benzil alkohol]] dalam jumlah yang sama banyak. Benzil alkohol kemudian dapat dipisahkan dari asam benzoat dengan [[distilasi]]. |
|||
[[pt:Ácido benzóico]] |
|||
[[ru:Бензойная кислота]] |
|||
[[Berkas:Benzaldehyde Cannizzaro reaction.png|400px]] |
|||
[[sk:Kyselina benzoová]] |
|||
[[fi:Bentsoehappo]] |
|||
==== Dari bromobenzena ==== |
|||
[[sv:Bensoesyra]] |
|||
[[Bromobenzena]] dapat diubah menjadi asam benzoat dengan "karbonasi" zat anatara [[fenilmagensium bromida]]:<ref>{{cite book|title = Introduction to Organic Laboratory Techniques: A Small Scale Approach|url = https://archive.org/details/introductiontoor0000unse_q6p2|author = Donald L. Pavia|year = 2004|publisher = Thomson Brooks/Cole|isbn = 0534408338|pages = [https://archive.org/details/introductiontoor0000unse_q6p2/page/312 312]–314}}</ref> |
|||
[[zh:苯甲酸]] |
|||
:C<sub>6</sub>H<sub>5</sub>MgBr + CO<sub>2</sub> → C<sub>6</sub>H<sub>5</sub>CO<sub>2</sub>MgBr |
|||
:C<sub>6</sub>H<sub>5</sub>CO<sub>2</sub>MgBr + HCl → C<sub>6</sub>H<sub>5</sub>CO<sub>2</sub>H + MgBrCl |
|||
==== Dari benzil alkohol ==== |
|||
[[Benzil alkohol]] dapat direfluks dengan kalium permanganat ataupun oksidator lainnya dalam air. Campuran ini kemudian disaring dalam keadaan panas untuk memisahkan mangan dioksida, dan kemudian didinginkan untuk mendapatkan asam benzoat. |
|||
=== Pembuatan secara historis === |
|||
Proses industri pertama melibatkan reaksi antara [[benzotriklorida]] (triklorometil benzena) dengan [[kalsium hidroksida]] dalam air, menggunakan [[besi]] sebagai [[katalis]]. [[Kalsium benzoat]] yang dihasilkan kemudian diubah menjadi asam benzoat dengan menggunakan [[asam klorida]]. Produk proses ini mengandung turunan asam benzoat yang terklorinasi dalam jumlah yang signifikan. Oleh karena itu, asam benzoat yang digunakan untuk konsumsi manusia didapatkan dari distilasi getah kemenyan. Pada zaman sekarang, asam benzoat yang digunakan untuk konsumsi diproduksi secara sintetik.<ref>{{cite web |url=http://www.columbian.com/lifeHome/whatsinmy/10102006news66192.cfm |title=What's in my... |accessdate=2007-09-08 |last=Killinger-Mann |first=Karen |coauthors= |date=2007-09-07 |work= |publisher=The Columbian |archive-date=2007-09-27 |archive-url=https://web.archive.org/web/20070927174515/http://www.columbian.com/lifeHome/whatsinmy/10102006news66192.cfm |dead-url=yes }}</ref> |
|||
== Referensi == |
|||
{{reflist}} |
|||
8. [http://toko-kimia.indogt.com/benzoat/benzoat/ penggunaan asam benzoat pada makanan] {{Webarchive|url=https://web.archive.org/web/20120415181718/http://toko-kimia.indogt.com/benzoat/benzoat/ |date=2012-04-15 }} |
|||
{{Authority control}} |
|||
[[Kategori:Asam organik]] |
|||
[[Kategori:Benzoat]] |
|||
[[Kategori:Senyawa aromatik]] |
|||
[[Kategori:Obat Esensial Nasional Indonesia]] |
|||
Revisi terkini sejak 11 Oktober 2023 17.23
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Asam benzoat
| |||
| Nama lain
Asam benzenakarboksilat,
Karboksibenzena, E210, Asam drasiklik | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C6H5COOH | |||
| Massa molar | 122,12 g/mol | ||
| Penampilan | Padatan kristal tak berwarna | ||
| Densitas | 1,32 g/cm3, padat | ||
| Titik lebur | 122,4 °C (395 K) | ||
| Titik didih | 249 °C (522 K) | ||
| Terlarutkan (air panas) 3,4 g/l (25 °C) | |||
| Kelarutan dalam THF, etanol, metanol | THF 3,37 M, etanol 2,52 M, metanol 2,82 M[1] | ||
| Keasaman (pKa) | 4,21 | ||
| Struktur | |||
| Monoklinik | |||
| planar | |||
| 1,72 D dalam Dioksana | |||
| Bahaya | |||
| Bahaya utama | Menyebabkan iritasi | ||
| Titik nyala | 121 °C (394 K) | ||
| Senyawa terkait | |||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||

Asam benzoat, C7H6O2 (atau C6H5COOH), adalah padatan kristal berwarna putih dan merupakan asam karboksilat aromatik yang paling sederhana. Nama asam ini berasal dari gum benzoin (getah kemenyan), yang dahulu merupakan satu-satunya sumber asam benzoat. Asam lemah ini beserta garam turunannya digunakan sebagai pengawet makanan. Asam benzoat adalah prekursor yang penting dalam sintesis banyak bahan-bahan kimia lainnya.
Penemuan
[sunting | sunting sumber]Asam benzoat pertama kali ditemukan pada abad ke-16. Distilasi kering getah kemenyan pertama kali dideskripsikan oleh Nostradamus (1556), dan selanjutnya oleh Alexius Pedemontanus (1560) dan Blaise de Vigenère (1596).[2]
Justus von Liebig dan Friedrich Wöhler berhasil menentukan struktur asam benzoat pada tahun 1832.[3] Mereka juga meneliti bagaimana asam hipurat berhubungan dengan asam benzoat.
Pada tahun 1875, Salkowski menemukan bahwa asam benzoat memiliki aktivitas anti jamur.[4]
Produksi
[sunting | sunting sumber]Pembuatan secara industri
[sunting | sunting sumber]Asam benzoat diproduksi secara komersial dengan oksidasi parsial toluena dengan oksigen. Proses ini dikatalisis oleh kobalt ataupun mangan naftenat. Proses ini menggunakan bahan-bahan baku yang murah, menghasilkan rendemen yang tinggi, dan dianggap sebagai ramah lingkungan.
Sintesis laboratorium
[sunting | sunting sumber]Asam benzoat sangatlah murah dan tersedia secara meluas, sehingga sintesis laboratorium asam benzoat umumnya hanya dipraktikkan untuk tujuan pedagogi. Ia umumnya diajarkan kepada mahasiswa universitas.
Untuk semua metode sintesis, asam benzoat dapat dimurnikan dengan rekristalisasi dari air, karena asam benzoat larut dengan baik dalam air panas namun buruk dalam air dingin. Penghindaran penggunaan pelarut organik untuk rekristalisasi membuat eksperimen ini aman. Pelarut lainnya yang memungkinkan meliputi asam asetat, benzena, eter petrolium, dan campuran etanol dan air.[5]
Dengan hidrolisis
[sunting | sunting sumber]Sama seperti nitril ataupun amida lainnya, benzonitril dan benzoamida dapat dihidrolisis menjadi asam benzoat ataupun basa konjugatnya dalam keadaan asam maupun basa.
Dari benzaldehida
[sunting | sunting sumber]Disproporsionasi benzaldehida yang diinduksi oleh basa dalam reaksi Cannizzaro akan menghasilkan sejumlah asam benzoat dan benzil alkohol dalam jumlah yang sama banyak. Benzil alkohol kemudian dapat dipisahkan dari asam benzoat dengan distilasi.
Dari bromobenzena
[sunting | sunting sumber]Bromobenzena dapat diubah menjadi asam benzoat dengan "karbonasi" zat anatara fenilmagensium bromida:[6]
- C6H5MgBr + CO2 → C6H5CO2MgBr
- C6H5CO2MgBr + HCl → C6H5CO2H + MgBrCl
Dari benzil alkohol
[sunting | sunting sumber]Benzil alkohol dapat direfluks dengan kalium permanganat ataupun oksidator lainnya dalam air. Campuran ini kemudian disaring dalam keadaan panas untuk memisahkan mangan dioksida, dan kemudian didinginkan untuk mendapatkan asam benzoat.
Pembuatan secara historis
[sunting | sunting sumber]Proses industri pertama melibatkan reaksi antara benzotriklorida (triklorometil benzena) dengan kalsium hidroksida dalam air, menggunakan besi sebagai katalis. Kalsium benzoat yang dihasilkan kemudian diubah menjadi asam benzoat dengan menggunakan asam klorida. Produk proses ini mengandung turunan asam benzoat yang terklorinasi dalam jumlah yang signifikan. Oleh karena itu, asam benzoat yang digunakan untuk konsumsi manusia didapatkan dari distilasi getah kemenyan. Pada zaman sekarang, asam benzoat yang digunakan untuk konsumsi diproduksi secara sintetik.[7]
Referensi
[sunting | sunting sumber]- ^ Solubility of benzoic acid in non-aqueous solvents
- ^ Neumüller O-A (1988). Römpps Chemie-Lexikon (edisi ke-6). Stuttgart: Frankh'sche Verlagshandlung. ISBN 3-440-04516-1. OCLC 50969944.
- ^ Liebig J, Wöhler F (1832). "Untersuchungen über das Radikal der Benzoesäure". Annalen der Chemie. 3: 249–282. doi:10.1002/jlac.18320030302.
- ^ Salkowski E (1875). Berl Klin Wochenschr. 12: 297–298. Tidak memiliki atau tanpa
|title=(bantuan) - ^ D. D. Perrin; W. L. F. Armarego (1988). Purification of Laboratory Chemicals (edisi ke-3rd). Pergamon Press. hlm. 94. ISBN 0-08-034715-0.
- ^ Donald L. Pavia (2004). Introduction to Organic Laboratory Techniques: A Small Scale Approach. Thomson Brooks/Cole. hlm. 312–314. ISBN 0534408338.
- ^ Killinger-Mann, Karen (2007-09-07). "What's in my..." The Columbian. Diarsipkan dari versi asli tanggal 2007-09-27. Diakses tanggal 2007-09-08.
8. penggunaan asam benzoat pada makanan Diarsipkan 2012-04-15 di Wayback Machine.