Oksidator


Dalam kimia, zat pengoksidasi, dalam bahasa Indonesia lebih dikenal sebagai oksidator, memiliki dua makna. Pengertian pertama, oksidator adalah spesies kimia yang menghilangkan elektron dari spesies lainnya. Ini adalah salah satu komponen dalam reaksi oksidasi-reduksi (redoks). Pengertian lainnya, oksidator adalah spesies kimia yang memindahkan atom elektronegatif, biasanya oksigen, ke dalam substrat. Pembakaran, ledakan pada umumnya, dan reaksi redoks organik melibatkan reaksi perpindahan atom.
Akseptor elektron
Akseptor (penerima) elektron berpartisipasi dalam reaksi transfer elektron. Dalam konteks ini, oksidator disebut sebagai akseptor elektron dan zat pereduksi (dalam bahasa Indonesia lebih dikenal sebagai reduktor) disebut sebagai donor (penyumbang) elektron. Oksidator klasik adalah ion ferosenium [Fe(C''";, yang menerima sebuah elektron untuk membentuk Fe(C''";.[1]
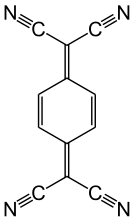
Tetrasianokuinodimetana adalah akseptor elektron organik.
Telah tersedia tabulasi pemeringkatan sifat akseptor elektron berbagai pereaksi (potensial redoks), lihat Potensial standar elektrode (laman data).
Mekanisme
Hal yang menarik bagi para kimiawan adalah detail kejadian transfer elektron, yang dapat dijelaskan sebagai sferis dalam atau sferis luar.
Pereaksi pemindah atom
Dalam penggunaan yang umum, oksidator memindahkan atom oksigen kepada substrat. Dalam konteks ini, oksidator dapat disebut sebagai pereaksi oksigenasi atau agen pemindah atom oksigen (oxygen-atom transfer (OAT) agent).[2] Contohnya antara lain [MnO''"; (permanganat), [CrO''"; (kromat), OsO (osmium tetroksida), dan terutama [ClO''"; (perklorat). Perlu diperhatikan bahwa spesies ini semuanya adalah oksida.
Dalam beberapa kasus, oksida-oksida ini juga bertindak selaku akseptor elektron, sebagaimana digambarkan dalam konversi [MnO''"; menjadi [MnO''"; manganat.
Oksidator yang umum (agen pemindah atom O)
- Oksigen (O)
- Ozon (O)
- Hidrogen peroksida (H) dan peroksida anorganik lainnya
- Fluorin (F), klorin (Cl), dan halogen lainnya
- Asam nitrat (HNO) dan senyawa nitrat
- Asam sulfat (H)
- Asam peroksidisulfat (H)
- Asam peroksimonosulfat (H)
- Klorit, klorat, perklorat, dan senyawa halogen sejenis lainnya
- Hipoklorit dan senyawa hipohalit lainnya, termasuk pemutih rumah tangga (NaClO)
- Senayawa krom heksavalen seperti asam kromat dan dikromat serta kromium trioksida, piridinium klorokromat (PCC), dan senyawa kromat/dikromat
- Senyawa permanganat seperti kalium permanganat
- Natrium perborat
- Dinitrogen monoksida (N)
- Kalium nitrat (KNO), oksidator dalam serbuk hitam
Definisi bahan berbahaya
Definisi bahan berbahaya oksidator adalah zat yang dapat menyebabkan, atau berkontribusi pada, pembakaran bahan lain.[3] Berdasarkan definisi ini, beberapa material yang dikelompokkan sebagai oksidator oleh praktisi dan akademisi kimia analitik tidak diklasifikasikan sebagai oksidator dalam cakupan bahan berbahaya. Sebagai contoh kalium dikromat, yang tidak lolos uji sebagai kelompok bahan berbahaya kelompok oksidator.
Departemen Transportasi Amerika Serikat (Department of Transport, DOT) mendefinisikan oksidator secara lebih spesifik. Terdapat dua definisi untuk oksidator yang diatur dalam regulasi DOT. Mereka adalah Kelas 5; Divisi 5.1 dan Kelas 5; Divisi 5.2. Divisi 5.1 "adalah material apapun, biasanya melepaskan oksigen, yang menyebabkan atau memperbesar pembakaran bahan lain." Divisi 5.1 DOT untuk oksidator padat "jika, ketika diuji sesuai dengan UN Manual of Tests and Criteria (IBR, lihat § 171.7 dalam sub-bab ini), berarti waktu pembakarannya kurang dari atau sama dengan waktu pembakaran campuran kalium bromat/selulosa." Divisi 5.1 DOT untuk oksidator cair "jika, ketika diuji sesuai dengan UN Manual of Tests and Criteria, ia menyala secara spontan atau waktu peningkatan tekanan dari 690 kPa menjadi 2070 kPa gauge kurang dari waktu peningkatan tekanan campuran asam nitrat (65%): selulosa (1:1)."[4]
Oksidator yang umum dan produk turunannya
| Oksidator | Produk |
|---|---|
| O oksigen | Bervariasi, termasuk oksida HO dan CO |
| O ozon | Bervariasi, termasuk keton, aldehida, dan H; lihat ozonolisis |
| F fluor | F |
| Cl klorin | Cl |
| Br bromin | Br |
| I iodin | I, I |
| ClO hipoklorit | Cl, H |
| ClO klorat | Cl, H |
| HNO asam nitrat | NO nitrogen monoksida NO nitrogen dioksida |
| Krom heksavalen CrO kromium trioksida CrO kromat Cr dikromat |
Cr, H |
| MnO permanganat MnO manganat |
Mn (suasana asam) atau MnO (suasana basa) |
| H, peroksida lainnya | Bervariasi, termasuk oksida dan H |
Lihat juga
Referensi
- ^ N. G. Connelly, W. E. Geiger (1996). "Chemical Redox Agents for Organometallic Chemistry". Chemical Reviews. 96 (2): 877–910. doi:10.1021/cr940053x. PMID 11848774.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (edisi ke-6), New York: Wiley-Interscience, ISBN 0-471-72091-7
- ^ Australian Dangerous Goods Code, 6th Edition
- ^ 49 CFR 172.127 General Requirements for Shipments and Packagings; Subpart D

