Timbal(II) nitrat

| |||

| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Lead(II) nitrate
| |||
| Nama lain
Lead nitrate
Plumbous nitrate Lead dinitrate Plumb dulcis | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| Nomor UN | 1469 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| Pb(NO3)2 | |||
| Massa molar | 331,2g/mol | ||
| Penampilan | Kristal putih tak berwarna | ||
| Densitas | 4,53 g/cm3 (20 °C) | ||
| Titik lebur | 270°C decomposes | ||
| 37,65 g/100 mL (0 °C) 52 g/100 mL (20 °C) 127 g/100 mL (100 °C) | |||
| Kelarutan dalam asam nitrat dalam etanol dalam metanol |
tak larut 0,04 g/100 mL 1,3 g/100 mL | ||
| Indeks bias (nD) | 1,782[1] | ||
| Struktur | |||
| Kubik pusat muka | |||
| kuboktahedral | |||
| Bahaya | |||
| Lembar data keselamatan | ICSC 1000, MallBaker MSDS | ||
Klasifikasi UE (DSD) (usang)
|
Repr. Cat. 1/3 Beracun (T) Berbahaya (Xn) Berbahaya bagi lingkungan (N) | ||
| Frasa-R | R61, R20/22, R33, R62, R50/53 | ||
| Frasa-S | S53, S45, S60, S61 | ||
| Titik nyala | Tidak terbakar | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LDLo (terendah tercatat)
|
500 mg/kg (marmot, oral)[2] | ||
| Senyawa terkait | |||
Anion lain
|
Timbal(II) sulfat Timbal(II) klorida Timbal(II) bromida | ||
Kation lainnya
|
Timah(II) nitrat | ||
Senyawa terkait
|
Talium(III) nitrat Bismut(III) nitrat | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Timbal(II) nitrat adalah suatu senyawa anorganik dengan rumus kimia Pb(NO3)2. Senyawa ini umumnya dijumpai sebagai kristal tak berwarna atau serbuk putih dan, tidak seperti kebanyakan garam timbal(II) lainnya, larut dalam air.
Senyawa ini telah dikenal sejak Abad Pertengahan dengan nama plumb dulcis, produksi timbal(II) nitrat baik dari logam timbal maupun timbal oksida dalam asam nitrat merupakan produksi skala kecil, untuk digunakan langsung dalam pembuatan senyawa timbal lainnya. Pada abad ke-19 timbal(II) nitrat mulai diproduksi secara komersial di Eropa dan Amerika Serikat. Menurut catatan sejarah, penggunaan utamanya adalah sebagai bahan baku produksi pigmen untuk cat timbal, tetapi cat sejenis ini sudah digantikan oleh cat yang lebih aman berbahan dasar titanium dioksida. Penggunaan industri lainnya mencakup penstabil panas dalam nilon dan poliester, dan sebagai pelapis kertas fototermografi. Sejak tahun 2000an, timal(II) nitrat mulai digunakan dalan sianidasi emas.
Timbal(II) nitrat bersifat toksik, suatu oksidator, dan digolongkan sebagai berpotensi karsinogenik pada manusia oleh Badan Internasional Penelitian Kanker (International Agency for Research on Cancer). Akibatnya, timbal(II) nitrat harus ditangani dan disimpan dengan tindakan pencegahan keselamatan yang memadai untuk mencegah terhirup, tertelan, dan terkena kulit. Oleh karena sifat alaminya yang berbahaya, aplikasi terbatas timbal (II) nitrat berada di bawah pengawasan ketat.
Sejarah
Sejak Abad Pertengahan, timbal(II) nitrat telah diproduksi sebagai bahan baku produksi pigmen berwarna dalam cat timbal, seperti krom kuning (timbal(II) kromat), krom jingga (timbal(II) hidroksida kromat) dan senyawa timbal sejenis. Pigmen-pigmen ini digunakan untuk pewarnaan dan pencetakan kaliko dan tekstil lainnya.[3]
Pada tahun 1597, alkimiawan Jerman Andreas Libavius adalah yang pertama menjelaskan senyawa ini, dengan merujuk pada nama abad pertengahan plumb dulcis dan calx plumb dulcis, yang berarti timbal manis, karena rasanya.[4] Meskipun awalnya tidak dipahami selama beberapa abad berikutnya, sifat dekrepitasi timbal(II) nitrat menjadikannya digunakan dalam korek api dan bahan peledak khusus seperti timbal azida.[5]
Proses produksi pernah dan masih mengikuti cara kimia sederhana, melarutkan timbal dalam aqua fortis (asam nitrat), dan secara berkala diambil endapannya. Namun, produksi tetap skala kecil selama berabad-abad, dan produksi komersial timbal(II) nitrat sebagai bahan baku untuk pembuatan senyawa timbal lainnya tidak dilaporkan sampai 1835.[6][7] Pada tahun 1974, A.S. mengkonsumsi senyawa timbal, tidak termasuk pigmen dan aditif bensin, adalah 642 ton.[8]
Struktur
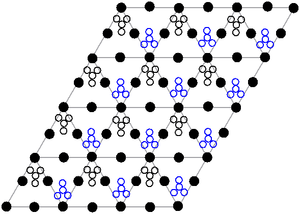
Struktur kristal timbal(II) nitrat padat telah ditentukan menggunakan difraksi neutron.[9][10] Senyawa mengkristal dalam sistem kubik dengan atom timbal dalam sistem kubik pusat muka. Golongan ruangnya adalah Pa3Z=4 (notasi kisi Bravais), yang masing-masing sisi kubus memiliki panjang 784 pikometer.
Noktah hitam menggambarkan atom timbal, noktah putih gugus nitrat 27 pikometer di atas bidang atom timbal. Pada konfigurasi ini, setiap atom timbal [[Ikatan kimia|terikat dengan duabelas atom oksigen (panjang ikatan:281 pikometer). Semua panjang atom N–O juga sama pada 127&nbs;pikometer.
Ketertarikan peneliti pada struktur kristal timbal(II) nitrat terutama didasarkan pada kemungkinan rotasi internal bebas gugus nitrat dalam kisi kristal pada kenaikan temperatur, tetapi ini hingga saat ini belum terbukti.[10]
Preparasi dan produksi
Timbal(II) nitrat dapat diperoleh dengan melarutkan logam timbal dalam larutan asam nitrat:[8][11]
Cara yang lebih lazim adalah dengan melarutkan timbal(II) oksida dalam asam nitrat:[8]
Dalam kasus lain, karena pelarutnya adalah asam nitrat pekat (sedangkan timbal(II) nitrat memiliki kelarutan yang sangat rendah) dan larutan yang dihasilkan mengandung ion nitrat, kristal timbal(II) nitrat anhidrat terbentuk secara spontan sebagai hasil dari efek ion sejenis:[11]
Memungkinkan juga untuk mengekstrak nitrat dari bahan organik seperti pupuk atau urin. Ekstraksi nitrat menggunakan metode ini tidak sekuat nitrat berderajat kemurnian industri, tetapi dapat digunakan untuk produksi serbuk mesiu.
Hampir semua timbal(II) nitrat yang tersedia secara komersial diproduksi sesuai dengan bahan skala laboratorium.[12] Dipasok dalam kemasan kantong 25 kg hingga kantong jumbo 1.000&nbps;kg, dan dalam kemasan laboratorium. Hal ini dilakukan baik oleh produsen umum bahan kimia laboratorium maupun produsen timbal dan senyawa timbal. Tidak ada produksi skala besar yang telah dilaporkan.
Dalam perlakuan limbah timbal menggunakan asam nitrat, misalnya, dalam pengolahan limbah timbal-bismut dari pengilangan timbal, larutan tak murni timbal(II) nitrat dibuat sebagai produk sampingan. Larutan ini dilaporkan untuk digunakan dalam proses sianidasi emas.[13]
Reaksi
Selain timbal(II) asetat, timbal(II) nitrat adalah satu-satunya senyawa timbal umum yang dapat larut. Timbal(II) nitrat mudah larut dalam air menghasilkan larutan jernih tak berwarna.[14] Sebagai senyawa ion, pelarutan timbal(II) nitrat melibatkan disosiasi menjadi ion-ion konstituennya.
Timbal(II) nitrat membentuk larutan yang sedikit asam, dengan pH antara 3,0 sampai 4,0 untuk larutan 20% dalam air.[15]
Ketika larutan natrium hidroksida pekat ditambahkan ke dalam larutan timbal(II) nitrat, terbentuk basa nitrat, meskipun sedikit melampaui titik ekivalen. Menuju setengah titik ekivalen, terbentuk senyawa Pb(NO3)2·Pb(OH)2, yang kemudian setelah titik ini akan terbentuk Pb(NO3)2·5Pb(OH)2. Tidak ada pembentukan Pb(OH) sederhana pada pH sekitar 12.[11][16]
Lihat juga
- Pigmen yang mengandung timbal, seperti Timbal putih, Kuning Napoli, dan Timbal merah
- Senyawa bersejarah, seperti Asam muriatat, Vitriol, gula timbal, dan Sal mirabilis
Referensi
- ^ Patnaik, Pradyot (2003). Handbook of Inorganic Chemical Compounds. McGraw-Hill. hlm. 475. ISBN 0-07-049439-8.
- ^ "Senyawa timbal (sebagai Pb)". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ Partington, James Riddick (1950). A Text-book of Inorganic Chemistry. MacMillan. hlm. 838.
- ^ Libavius, Andreas (1595). Alchemia Andreæ Libavii. Francofurti: Iohannes Saurius.
- ^ Barkley, J.B. (October 1978). "Lead nitrate as an oxidizer in blackpowder". Pyrotechnica. Post Falls, Idaho: Pyrotechnica Publications. 4: 16–18.
- ^ "Lead". Encyclopædia Britannica Eleventh Edition. Diakses tanggal 2006-10-11.
- ^ Macgregor, John (1847). Progress of America to year 1846. London: Whittaker & Co. ISBN 0-665-51791-2.
- ^ a b c Greenwood, Norman N.; Earnshaw, A. (1997). Chemistry of the Elements (edisi ke-2nd). Oxford: Butterworth-Heinemann. hlm. 388, 456. ISBN 0-7506-3365-4.
- ^ Hamilton, W.C. (1957). "A neutron crystallographic study of lead nitrate". Acta Crystallogr. 10 (2): 103–107. doi:10.1107/S0365110X57000304.
- ^ a b Nowotny, H.; G. Heger (1986). "Structure refinement of lead nitrate". Acta Crystallogr. C. 42 (2): 133–35. doi:10.1107/S0108270186097032.
- ^ a b c Othmer, D.F. (1967). Kirk-Othmer Encyclopedia of Chemical Technology. 12 (Iron to Manganese) (edisi ke-second completely revised). New York: John Wiley & Sons. hlm. 272. ISBN 0-471-02040-0.
- ^ Adlam, George Henry Joseph; Price, Leslie Slater (1938). A Higher School Certificate Inorganic Chemistry. London: John Murray.
- ^ "Product catalog; other products". Tilly, Belgium: Sidech. Diakses tanggal 2008-01-05.
- ^ Ferris, L.M. (1959). "Lead nitrate—Nitric acid—Water system". Journal of Chemicals and Engineering Date. 5 (3): 242–242. doi:10.1021/je60007a002.
- ^ http://www.mallbaker.com/americas/msds/english/L3130_msds_us_Default.pdf
- ^ Pauley, J. L.; M. K. Testerman (1954). "Basic Salts of Lead Nitrate Formed in Aqueous Media". Journal of the American Chemical Society. 76 (16): 4220–4222. doi:10.1021/ja01645a062.
Pranala luar
- Woodbury, William D. (1982). "Lead". Mineral yearbook metals and minerals. Bureau of Mines: 515–42. Diakses tanggal 2008-01-18.
- "Lead". NIOSH Pocket Guide to Chemical Hazards. National Institute for Occupational Safety and Health. September 2005. NIOSH 2005-149. Diakses tanggal 2008-01-19.
- "Lead and Lead Compounds Fact Sheet". National Pollutant Inventory. Australian Government, Department of the Environment and Water Resources. July 2007. Diarsipkan dari versi asli tanggal January 11, 2008. Diakses tanggal 2008-01-19.
- "Lead". A Healthy home environment, Health hazards. US Alliance for healthy homes. Diakses tanggal 2008-01-19.
- "Demonstration movie: Bright Orange Yellow How can you get it". Diakses tanggal 2008-01-19.
- Lembar Data Keselamatan Bahan (MSDS)
- MSDS timbal nitrat, PTCL, Oxford University
- MSDS for lead nitrate, ProSciTechPDF (126 KiB)
- MSDS timbal nitrat, Science Stuff Inc
- MSDS timbal nitrat, Iowa State University
- MSDS timbal nitrat, NIST
| HNO3 | He | ||||||||||||||||||
| LiNO3 | Be(NO''"; | B(NO''"; | C | N | O | FNO3 | Ne | ||||||||||||
| NaNO3 | Mg(NO''"; | Al(NO''"; | Si | P | S | ClONO2 | Ar | ||||||||||||
| KNO3 | Ca(NO''"; | Sc(NO''"; | Ti(NO''"; | VO(NO''"; | Cr(NO''"; | Mn(NO''"; | Fe(NO''"; | Co(NO''";, Co(NO''"; |
Ni(NO''"; | Cu(NO''"; | Zn(NO''"; | Ga(NO''"; | Ge | As | Se | Br | Kr | ||
| RbNO | Sr(NO''"; | Y | Zr(NO''"; | Nb | Mo | Tc | Ru | Rh | Pd(NO''"; | AgNO | Cd(NO''"; | In | Sn | Sb | Te | I | Xe(NO''"; | ||
| CsNO | Ba(NO''"; | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg, Hg(NO''"; |
Tl(NO''"; | Pb(NO''"; | Bi(NO''"; | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |||
| ↓ | |||||||||||||||||||
| La | Ce(NO''";, Ce(NO''"; |
Pr | Nd | Pm | Sm | Eu | Gd(NO''"; | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Th | Pa | UO | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||