Magnesium bikarbonat
| |
| Nama | |
|---|---|
| Nama IUPAC
Magnesium hidrogen karbonat
| |
| Nama lain
Magnesium bikarbonat
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| Sifat | |
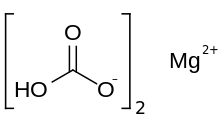
| Mg(HCO3)2 | |
| Massa molar | 146.34 g/mol |
| 0.077 g / (100 mL) | |
| Senyawa terkait | |
Kation lainnya
|
Kalsium bikarbonat |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Magnesium bikarbonat atau magnesium hidrogen karbonat, Mg(HCO3)2, adalah garam bikarbonat dari magnesium. Senyawa ini dapat dibentuk melalui reaksi larutan encer asam karbonat (seperti air soda) dan magnesium hidroksida (susu magnesium).[1]
Preparasi
Senyawa ini dapat dibuat melalui sintesis magnesium asetat dan natrium bikarbonat.
- Mg(CH3COO)2 + 2NaHCO3 → Mg(HCO3)2 + 2CH3COONa
Magnesium bikarbonat hanya terdapat dalam larutan berair. Magnesium tidak membentuk bikarbonat padat seperti Litium. Untuk memproduksinya, suspensi magnesium hidroksida diperlakukan dengan karbon dioksida bertekanan, menghasilkan larutan magnesium bikarbonat:[2]
- Mg(OH)2 + 2 CO2 → Mg(HCO3)2
Pengeringan larutan yang dihasilkan menyebabkan magnesium bikarbonat menjadi terurai, menghasilkan magnesium karbonat, karbon dioksida, dan air:[3]
- Mg2+ + 2 HCO3− → MgCO3 + CO2 + H2O
Kegunaan
Magnesium bikarbonat memiliki banyak manfaat kesehatan dan digunakan untuk menahan perubahan pH darah dan menjaganya dalam rentang yang optimal.[4]
Sebagai mineral penting, senyawa ini membantu dalam pengaturan tekanan darah, sintesis protein, fungsi saraf dan otot, dan kontrol glukosa darah dalam tubuh manusia.[4][5]
Senyawa ini digunakan sebagai aditif makanan seperti pengatur keasaman, kebasaan, anti-retak dan bahan pemutih.[6]
Lihat pula
Referensi
- ^ Cheremisinoff, Nicholas P. (1994). Handbook of Water and Wastewater Treatment Technology (dalam bahasa Inggris). Boca Raton, FL: CRC Press. hlm. 54. ISBN 0824792777.
- ^ Margarete Seeger; Walter Otto; Wilhelm Flick; Friedrich Bickelhaupt; Otto S. Akkerman (2005), "Magnesium Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a15_595.pub2
- ^ Wilson, W., McKiel, M., Gear, J., & MacClaren, R. (1978). "Preparation of Solutions of Magnesium Bicarbonate for Deacidification". The American Archivist. 41 (1): 67–70.
- ^ a b "Magnesium Bicarbonate Water – The importance of bicarbonates and magnesium". Dancing with Water (dalam bahasa Inggris). Diakses tanggal 6 Agustus 2019.
- ^ Splane, Lily (2002). Nutritional Self-Defense: Better Health in a Polluted, Over-Processed, and Stressful World (dalam bahasa Inggris). Anaphase II Publishing. hlm. 47. ISBN 0945962134.
- ^ M. Hanssen (1987). E for Additives (dalam bahasa Inggris). Wellingborough, Northants, UK: Thorsons Publishers Limited. ISBN 0722511507.
