Tabel periodik perluasan
| Tabel periodik perluasan |
| Ununenium (unsur 119) pada periode 8 (baris 8) menandai dimulainya teorisasi ini |
Sebuah tabel periodik perluasan berteori tentang unsur-unsur kimia setelah unsur-unsur yang saat ini telah terbukti dan telah diketahui dalam tabel periodik. Hingga 2024[update], unsur dengan nomor atom tertinggi yang telah diketahui adalah oganeson (Z = 118), yang melengkapi periode (baris) ketujuh dalam tabel periodik. Dengan demikian, semua unsur dalam periode kedelapan dan seterusnya tetaplah murni menjadi hipotesis.
Unsur-unsur setelah 118 akan ditempatkan dalam periode tambahan ketika mereka ditemukan, ditata (seperti dengan periode yang ada) untuk menggambarkan tren berulang secara berkala dalam sifat dari unsur yang bersangkutan. Setiap periode tambahan diperkirakan akan mengandung lebih banyak unsur daripada periode ketujuh, karena mereka telah dihitung untuk memiliki blok tambahan yang disebut blok-g, yang mengandung setidaknya 18 unsur dengan orbital g yang terisi sebagian di setiap periode. Tabel delapan periode yang berisi blok ini diusulkan oleh Glenn T. Seaborg pada tahun 1969.[1][2] Unsur pertama dalam blok-g mungkin memiliki nomor atom 121, dan dengan demikian, ia akan memiliki nama sistematis unbiunium. Meskipun telah dilakukan banyak pencarian, tidak ada satu pun unsur di wilayah ini yang telah disintesis atau ditemukan di alam.[3]
Menurut pendekatan orbital dalam deskripsi mekanika kuantum struktur atom, blok-g akan sesuai dengan unsur dengan orbital g yang terisi sebagian, tetapi efek kopling spin–orbit mengurangi validitas pendekatan orbital secara substansial untuk unsur dengan nomor atom yang tinggi. Versi milik Seaborg dari periode yang diperluas ini memiliki unsur-unsur yang lebih berat mengikuti pola yang ditetapkan oleh unsur-unsur yang lebih ringan, karena versi ini tidak memperhitungkan efek relativistik. Model yang memperhitungkan efek relativistik memprediksi bahwa polanya akan rusak. Pekka Pyykkö dan Burkhard Fricke menggunakan pemodelan komputer untuk menghitung posisi unsur hingga Z = 172, dan menemukan bahwa beberapa dari mereka digeser dari aturan Madelung.[4] Sebagai akibat dari ketidakpastian dan variabilitas dalam prediksi sifat kimia dan fisik unsur setelah 120, saat ini tidak ada konsensus tentang penempatannya dalam tabel periodik perluasan.
Unsur-unsur di wilayah ini cenderung sangat tidak stabil sehubungan dengan peluruhan radioaktif dan mengalami peluruhan alfa atau fisi spontan dengan waktu paruh yang sangat singkat, meskipun unsur 126 dihipotesiskan berada dalam pulau stabilitas yang tahan terhadap fisi tetapi tidak terhadap peluruhan alfa. Pulau-pulau stabilitas lain di luar unsur-unsur yang telah diketahui juga dimungkinkan, termasuk satu pulau yang diteorikan berada di sekitar unsur 164, meskipun tingkat efek penstabilan dari kulit nuklir tertutup tidak pasti. Tidak jelas berapa banyak unsur di luar pulau stabilitas yang diperkirakan mungkin secara fisik, apakah periode 8 dapat selesai, atau periode 9 dapat ada. Persatuan Kimia Murni dan Terapan Internasional (IUPAC) mendefinisikan bahwa suatu unsur dapat ada jika masa hidupnya lebih lama dari 10−14 detik (0,01 pikodetik, atau 10 femtodetik), yang merupakan waktu yang dibutuhkan inti untuk membentuk awan elektron.[5]
Pada awal 1940, telah dicatat bahwa interpretasi sederhana dari persamaan Dirac yang relativistik mengalami masalah dengan orbital elektron pada Z > 1/α ≈ 137, menunjukkan bahwa atom netral tidak dapat eksis setelah unsur 137, dan bahwa tabel periodik unsur berdasarkan pada orbital elektron akan menjadi rusak pada titik ini.[6] Di sisi lain, analisis yang lebih teliti menghitung batas analog menjadi Z ≈ 173 di mana subkulit 1s menyelam ke dalam laut Dirac, dan ia bukanlah atom netral yang tidak dapat eksis setelah unsur 173, tetapi inti telanjang, sehingga tidak menunjukkan hambatan untuk perpanjangan lebih lanjut dari sistem periodik. Atom di luar nomor atom kritis ini disebut atom superkritis.
Sejarah
Unsur-unsur yang lebih berat setelah aktinida pertama kali diusulkan ada pada awal tahun 1895, ketika ahli kimia Denmark Hans Peter Thomsen meramalkan bahwa torium dan uranium membentuk bagian dari periode 32 unsur yang akan berakhir pada unsur yang inaktif secara kimia dengan berat atom 292 (tidak jauh dari 294 yang dikenal saat ini untuk isotop oganeson pertama dan satu-satunya yang telah ditemukan). Pada tahun 1913, fisikawan Swedia Johannes Rydberg dengan cara yang sama meramalkan bahwa gas mulia berikutnya setelah radon akan memiliki nomor atom 118, dan secara murni diturunkan secara formal bahkan kongener radon yang lebih berat pada Z = 168, 218, 290, 362, dan 460, persis di mana prinsip Aufbau memprediksi tempat mereka. Pada tahun 1922, Niels Bohr meramalkan struktur elektronik gas mulia berikutnya pada Z = 118, dan memperkirakan bahwa alasan mengapa unsur-unsur setelah uranium tidak terlihat di alam adalah karena mereka terlalu tidak stabil. Pada tahun 1926, fisikawan dan insinyur Jerman Richard Swinne menerbitkan makalah ulasan yang berisi prediksi mengenai unsur transuranik (dia mungkin telah menciptakan istilah tersebut) di mana dia mengantisipasi prediksi modern tentang pulau stabilitas: dia telah berhipotesis sejak 1914 bahwa waktu paruh seharusnya tidak menurun secara ketat dengan nomor atom, tetapi memperkirakan bahwa mungkin ada beberapa unsur yang berumur lebih lama pada Z = 98–102 dan Z = 108–110, dan berspekulasi bahwa unsur tersebut mungkin ada di dalam inti Bumi, di dalam meteorit besi, atau di lapisan es Greenland di mana mereka telah dikurung dari asal usul kosmik mereka.[7] Pada tahun 1955, unsur-unsur ini disebut sebagai unsur superberat.[8]
Prediksi pertama mengenai sifat dari unsur-unsur superberat yang belum ditemukan dibuat pada tahun 1957, ketika konsep kulit nuklir pertama kali dieksplorasi dan sebuah pulau stabilitas diteorikan muncul di sekitar unsur 126.[9] Pada tahun 1967, perhitungan yang lebih ketat dilakukan, dan pulau stabilitas diteorikan berpusat pada flerovium (unsur 114) yang saat itu belum ditemukan; penelitian ini dan penelitian selanjutnya lainnya memotivasi banyak peneliti untuk mencari unsur-unsur superberat di alam atau mencoba menyintesis mereka di dalam akselerator.[8] Banyak pencarian unsur-unsur superberat dilakukan pada tahun 1970-an, semuanya dengan hasil negatif. Hingga April 2022[update], telah dicoba untuk setiap unsur hingga dan termasuk unbiseptium (Z = 127), kecuali unbitrium (Z = 123),[10][11][12] dengan unsur terberat yang berhasil disintesis adalah oganeson pada tahun 2002 dan penemuan terbaru adalah tenesin pada tahun 2010.[10]
Karena beberapa unsur superberat diprediksi berada di luar tabel periodik tujuh periode, sebuah periode tambahan, periode kedelapan, yang mengandung unsur-unsur ini pertama kali diusulkan oleh Glenn T. Seaborg pada tahun 1969. Model ini melanjutkan pola pada unsur-unsur yang sudah ada dan memperkenalkan blok-g dan deret superaktinida yang dimulai dari unsur 121, menaikkan jumlah unsur pada periode 8 dibandingkan dengan periode yang telah diketahui.[1][2][8] Perhitungan awal ini gagal mempertimbangkan efek relativistik yang memecah tren periodik dan membuat ekstrapolasi sederhana menjadi tidak mungkin. Pada tahun 1971, Fricke menghitung tabel periodik hingga Z = 172, dan menemukan bahwa beberapa unsur memang memiliki sifat berbeda yang mematahkan pola yang telah ditetapkan,[4] dan perhitungan tahun 2010 oleh Pekka Pyykkö juga mencatat bahwa beberapa unsur mungkin berperilaku berbeda dari yang telah diperkirakan.[13] Tidak diketahui seberapa jauh tabel periodik dapat melampaui 118 unsur yang telah diketahui, karena unsur-unsur yang lebih berat diprediksi semakin tidak stabil. Glenn T. Seaborg memperkirakan bahwa secara praktis, akhir dari tabel periodik mungkin datang sedini mungkin, sekitar Z = 120 karena ketidakstabilan nuklir.[14]
Struktur yang diprediksi dari tabel periodik perluasan
Saat ini tidak ada konsensus mengenai penempatan unsur-unsur setelah nomor atom 120 dalam tabel periodik.
Semua unsur yang belum ditemukan secara hipotetis ini diberi nama berdasarkan standar nama unsur sistematis dari Persatuan Kimia Murni dan Terapan Internasional (IUPAC) yang menciptakan nama generik untuk digunakan sampai unsur tersebut ditemukan, dikonfirmasi, dan nama resminya disetujui. Nama-nama ini biasanya tidak digunakan dalam literatur, dan disebut dengan nomor atomnya; karenanya, unsur 157 biasanya tidak disebut "unpentseptium" atau "Ups" (nama dan lambang sistematis IUPAC), melainkan "unsur 157" dengan lambang "157", "(157)", atau "E157".[15]
Prinsip Aufbau
Pada unsur 118, orbital 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 5f, 6s, 6p, 6d, 7s dan 7p diasumsikan terisi, dengan orbital yang tersisa tidak terisi. Ekstrapolasi sederhana dari prinsip Aufbau akan memprediksi baris kedelapan untuk mengisi orbital dengan urutan 8s, 5g, 6f, 7d, 8p; tetapi setelah unsur 120, kedekatan kulit elektron membuat penempatan dalam tabel sederhana menjadi bermasalah.
| 1 | 1 H |
2 He | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||||||||||||||||||||||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||||||||||||||||||||||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||||||||||||||||||||||||||||||||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||||||||||||||||||||||||||||||||
| 6 | 55 Cs |
56 Ba |
57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | ||||||||||||||||||
| 7 | 87 Fr |
88 Ra |
89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | ||||||||||||||||||
| 8 | 119 Uue |
120 Ubn |
121 Ubu |
122 Ubb |
123 Ubt |
124 Ubq |
125 Ubp |
126 Ubh |
127 Ubs |
128 Ubo |
129 Ube |
130 Utn |
131 Utu |
132 Utb |
133 Utt |
134 Utq |
135 Utp |
136 Uth |
137 Uts |
138 Uto |
139 Ute |
140 Uqn |
141 Uqu |
142 Uqb |
143 Uqt |
144 Uqq |
145 Uqp |
146 Uqh |
147 Uqs |
148 Uqo |
149 Uqe |
150 Upn |
151 Upu |
152 Upb |
153 Upt |
154 Upq |
155 Upp |
156 Uph |
157 Ups |
158 Upo |
159 Upe |
160 Uhn |
161 Uhu |
162 Uhb |
163 Uht |
164 Uhq |
165 Uhp |
166 Uhh |
167 Uhs |
168 Uho |
Legenda
| ||||||
|
Pyykkö
Tidak semua model menunjukkan unsur yang lebih tinggi mengikuti pola yang dibuat oleh unsur yang lebih ringan. Misalnya, Pekka Pyykkö menggunakan pemodelan komputer untuk menghitung posisi unsur hingga Z = 172 dan kemungkinan sifat kimia mereka dalam sebuah artikel yang diterbitkan pada tahun 2011. Dia menemukan bahwa beberapa unsur digeser dari aturan pengurutan energi Madelung sebagai akibat dari orbital yang tumpang tindih; ini disebabkan oleh meningkatnya peran efek relativistik dalam unsur-unsur berat.[13]

Fricke
Burkhard Fricke dkk., yang melakukan perhitungan hingga unsur 184 dalam sebuah artikel yang diterbitkan pada tahun 1971, juga menemukan beberapa unsur yang tergeser dari prinsip Aufbau sebagai konsekuensi dari efek relativistik.[4][16]
| H | He | |||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 119 | 120 | 121 | 122–141 | 142 | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | ||||||
| 165 | 166 | 167 | 168 | 169 | 170 | 171 | 172 |
Nefedov
Nefedov, Trzhaskovskaya, dan Yarzhemskii melakukan perhitungan hingga 164 (hasilnya diterbitkan pada tahun 2006). Bertentangan dengan Pyykkö, serta Fricke dkk., mereka menganggap bahww unsur 158 sampai 164 sebagai homolog golongan 4 sampai 10, dan bukan 6 sampai 12, mencatat kesamaan konfigurasi elektron dengan logam transisi periode 5. Unsur 111 dan 112 dipindahkan dari bidang untuk mencerminkan konfigurasi yang berbeda dari Au dan Hg.[17]
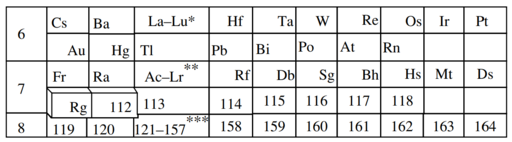
Kulsha
Kimiawan komputasi Andrey Kulsha telah menyarankan dua bentuk tabel periodik perluasan. Berdasarkan kemungkinan sifat kimianya, unsur 157–172 ditempatkan sebagai kongener periode kedelapan dari itrium hingga xenon pada periode kelima;[18] ini sesuai dengan perhitungan tahun 2006 dari Nefedov dkk.[17] Dalam saran pertama Kulsha (2011, setelah makalah Pyykkö diterbitkan),[19] unsur 121–138 dan 139–156 ditempatkan sebagai dua baris terpisah (bersama-sama disebut "unsur ultransisi"), terkait dengan penambahan subkulit 5g18 ke dalam inti mereka, karena mereka masing-masing meniru lantanida dan aktinida.[18] Dalam saran keduanya (2016), unsur 121–142 membentuk blok-g (karena memiliki aktivitas 5g), sedangkan unsur 143–156 membentuk blok-f yang ditempatkan di bawah aktinium hingga nobelium.[20]


Pencarian unsur yang belum ditemukan
Upaya sintesis
Beberapa upaya yang gagal telah dilakukan untuk menyintesis unsur periode 8 hingga unbiseptium, kecuali unbitrium. Upaya untuk menyintesis ununenium, unsur periode 8 pertama, masih terus dilakukan hingga 2024[update].
Ununenium
Penyintesisan unsur 119 (ununenium) pertama kali dicoba pada tahun 1985 dengan membombardir target einsteinium-254 dengan ion kalsium-48 pada akselerator superHILAC di Berkeley, California:
- 254
99Es + 48
20Ca → 302119* → tidak ada atom
Tidak ada atom yang teridentifikasi, yang mengarah pada penampang pembatas sebesar 300 nb.[21] Perhitungan selanjutnya menunjukkan bahwa penampang reaksi 3n (yang akan menghasilkan 299119 dan tiga neutron sebagai produk) sebenarnya akan enam ratus ribu kali lebih rendah dari batas atas ini, pada 0,5 pb.[22]
Dari April hingga September 2012, sebuah upaya untuk menyintesis isotop 295119 dan 296119 dilakukan dengan membombardir target berkelium-249 dengan titanium-50 di Gesellschaft für Schwerionenforschung di Darmstadt, Jerman.[23][24] Berdasarkan penampang yang diprediksi secara teoretis, diperkirakan bahwa atom ununenium akan disintesis dalam waktu lima bulan dari awal percobaan.[25] Selain itu, karena berkelium-249 meluruh menjadi kalifornium-249 (unsur berikutnya) dengan waktu paruh yang pendek, 327 hari, hal ini memungkinkan pencarian unsur 119 dan 120 secara bersamaan.[26]
- 249
97Bk + 50
22Ti → 299119* → 296119 + 3 10n - 249
97Bk + 50
22Ti → 299119* → 295119 + 4 10n
Percobaan ini awalnya direncanakan untuk dilanjutkan hingga November 2012,[27] tetapi dihentikan lebih awal untuk memanfaatkan target 249Bk untuk mengkonfirmasi penyintesisan tenesin (sehingga mengubah proyektil menjadi 48Ca).[28] Reaksi antara 249Bk dan 50Ti ini diprediksi menjadi reaksi praktis yang paling menguntungkan untuk pembentukan unsur 119,[24] karena agak asimetris,[25] meskipun juga agak dingin.[28] (Reaksi antara 254Es dan 48Ca akan lebih baik, tetapi menyiapkan, 254Es dalam jumlah miligram untuk target sangatlah sulit.)[25] Namun demikian, perubahan yang diperlukan dari "peluru perak" 48Ca menjadi 50Ti membagi hasil yang diperkirakan dari unsur 119 dengan dua puluh, karena hasilnya sangat tergantung pada asimetri reaksi fusi.[25]
Karena waktu paruh yang diperkirakan pendek, tim GSI menggunakan alat elektronik baru dan "cepat" yang mampu mencatat peristiwa peluruhan dalam mikrodetik.[24] Tidak ada atom dari unsur 119 yang teridentifikasi, menyiratkan penampang pembatas sebesar 70 fb.[28] Penampang sebenarnya yang diprediksi adalah sekitar 40 fb, yang berada pada batas teknologi saat ini.[25]
Tim yang berada di Joint Institute for Nuclear Research di Dubna, Rusia, berencana untuk memulai eksperimen pada penyintesisan unsur 119 dan 120 menggunakan reaksi 249Bk+50Ti dan 249Cf+50Ti reactions in 2019 using a new experimental complex.[29][30] Tim yang berada di RIKEN di Jepang juga berencana untuk mencoba membuat unsur ini mulai tahun 2018 dengan target 248Cm menggunakan reaksi 248Cm+51V[31] dan 248Cm+54Cr.[32] Reaksi yang pertama disebutkan sudah berlangsung sejak Juni 2018.[31]
Unbinilium
Menyusul keberhasilan mereka dalam memperoleh oganeson melalui reaksi antara 249Cf dan 48Ca pada tahun 2006, tim yang berada di Joint Institute for Nuclear Research (JINR) di Dubna memulai eksperimen serupa pada Maret–April 2007, dengan harapan dapat menciptakan unsur 120 (unbinilium) dari inti 58Fe dan 244Pu.[33][34] Isotop unbinilium diperkirakan memiliki waktu paruh peluruhan alfa dalam urutan mikrodetik.[35][36] Analisis awal mengungkapkan bahwa tidak ada atom unsur 120 yang terproduksi, memberikan batas 400 fb untuk penampang pada energi yang dipelajari.[37]
- 244
94Pu + 58
26Fe → 302120* → tidak ada atom
Tim Rusia berencana untuk meningkatkan fasilitas mereka sebelum mencoba reaksi lagi.[37]
Pada bulan April 2007, tim di Gesellschaft für Schwerionenforschung di Darmstadt, Jerman mencoba membuat unsur 120 menggunakan uranium-238 dan nikel-64:[38]
- 238
92U + 64
28Ni → 302120* → tidak ada atom
Tidak ada atom yang terdeteksi memberikan batas 1,6 pb untuk penampang pada energi yang disediakan. GSI mengulangi percobaan dengan sensitivitas yang lebih tinggi dalam tiga proses terpisah pada April–Mei 2007, Januari–Maret 2008, dan September–Oktober 2008, semuanya dengan hasil yang negatif, mencapai batas penampang 90 fb.[38]
Pada Juni–Juli 2010, dan sekali lagi pada 2011, setelah meningkatkan peralatan mereka untuk memungkinkan penggunaan lebih banyak target radioaktif, para ilmuwan di GSI mencoba reaksi fusi yang lebih asimetris:[39]
- 248
29Cu + 54
24Cr → 302120 → tidak ada atom
Diperkirakan bahwa perubahan reaksi akan melipatgandakan kemungkinan penyintesisan unsur 120,[40] karena hasil reaksi tersebut sangat bergantung pada asimetri mereka.[25] Tiga sinyal berkorelasi telah teramati yang cocok dengan energi peluruhan alfa 299120 yang diprediksi dan anaknya, 295Og, serta energi peluruhan yang diketahui secara eksperimental dari cucunya, 291Lv. Namun, waktu hidup peluruhan ini mungkin lebih lama dari yang diperkirakan, dan hasilnya tidak dapat dikonfirmasi.[41][42][39]
Pada Agustus–Oktober 2011, sebuah tim lain di GSI yang menggunakan fasilitas TASCA mencoba reaksi baru yang lebih asimetris:[43][28]
- 249
98Cf + 50
22Ti → 299120* → tidak ada atom
Karena asimetrinya,[44] reaksi antara 249Cf dan 50Ti diprediksi menjadi reaksi praktis yang paling menguntungkan untuk menyintesis unbinilium, meskipun ia juga agak dingin. Tidak ada atom unbinilium yang teridentifikasi, menyiratkan pembatas penampang melintang sebesar 200 fb.[28] Jens Volker Kratz memperkirakan penampang maksimum yang sebenarnya untuk memproduksi unsur 120 oleh salah satu dari reaksi ini adalah sekitar 0,1 fb;[45] sebagai perbandingan, rekor dunia untuk penampang terkecil dari reaksi yang berhasil adalah 30 fb untuk reaksi 209Bi(70Zn,n)278Nh,[25] dan Kratz memperkirakan penampang maksimum sebesar 20 fb untuk menghasilkan unsur tetangganya, unsur 119.[45] Jika prediksi ini akurat, maka penyintesisan unsur 119 akan berada pada batas teknologi saat ini, dan penyintesisan unsur 120 akan membutuhkan metode baru.[45]
Unbiunium
Penyintesisan unsur 121 (unbiunium) pertama kali dicoba pada tahun 1977 dengan membombardir target uranium-238 dengan ion tembaga-65 di Gesellschaft für Schwerionenforschung di Darmstadt, Jerman:
- 238
92U + 65
29Cu → 303121* → tidak ada atom
Tidak ada atom yang teridentifikasi.[11]
Unbibium
Upaya pertama untuk menyintesis unsur 122 (unbibium) dilakukan pada tahun 1972 oleh Flyorov dkk. di Joint Institute for Nuclear Research (JINR), menggunakan reaksi fusi panas yang terinduksi ion berat:[10]
- 238
92U + 66,68
30Zn → 304, 306122* → tidak ada atom
Eksperimen ini dimotivasi oleh prediksi awal tentang keberadaan pulau stabilitas pada N = 184 dan Z > 120. Tidak ada atom yang terdeteksi dan batas hasil 5 nb (5,000 pb) telah diukur. Hasil saat ini (lihat flerovium) telah menunjukkan bahwa sensitivitas eksperimen ini terlalu rendah setidaknya 3 kali lipat.[12]
Pada tahun 2000, Gesellschaft für Schwerionenforschung (GSI) melakukan eksperimen yang sangat mirip dengan sensitivitas yang jauh lebih tinggi:[10]
- 238
92U + 70
30Zn → 308122* → tidak ada atom
Hasil-hasil ini menunjukkan bahwa penyintesisan unsur-unsur yang lebih berat tetap menjadi tantangan yang signifikan dan peningkatan lebih lanjut dari intensitas sinar dan efisiensi eksperimental tetap diperlukan. Sensitivitasnya harus ditingkatkan menjadi 1 fb di masa depan untuk hasil yang lebih berkualitas.
Upaya lain yang gagal untuk menyintesis unsur 122 dilakukan pada tahun 1978 di GSI Helmholtz Center, di mana target erbium alami dibombardir dengan ion xenon-136:[10]
- nat
68Er + 136
54Xe → 298, 300, 302, 303, 304, 306122* → tidak ada atom
Secara khusus, reaksi antara 170Er dan 136Xe diperkirakan menghasilkan pemancar alfa dengan waktu paruh mikrodetik yang akan meluruh menjadi isotop flerovium dengan waktu paruh mungkin hingga beberapa jam, karena flerovium diprediksi terletak di dekat pusat pulau stabilitas. Setelah dua belas jam penyinaran, tidak ada yang ditemukan dalam reaksi ini. Setelah upaya serupa yang gagal untuk menyintesis unsur 121 dari 238U dan 65Cu, disimpulkan bahwa waktu paruh inti superberat harus kurang dari satu mikrodetik atau penampangnya sangat kecil.[46] Penelitian yang lebih baru mengenai penyintesisan unsur-unsur superberat menunjukkan bahwa kedua kesimpulan itu benar.[25][47] Dua upaya pada tahun 1970-an untuk menyintesis elemen 122 didorong oleh penelitian yang menyelidiki apakah unsur-unsur superberat berpotensi terjadi secara alami.[10]
Beberapa percobaan mempelajari karakteristik fisi dari berbagai inti senyawa superberat seperti 306122* were performed dilakukan antara tahun 2000 dan 2004 di Flerov Laboratory of Nuclear Reactions. Dua reaksi nuklir digunakan, yaitu 248Cm + 58Fe dan 242Pu + 64Ni.[10] Hasil penelitian mengungkapkan bagaimana fisi inti superberat secara dominan dengan mengeluarkan inti kulit tertutup seperti 132Sn (Z = 50, N = 82). Juga ditemukan bahwa hasil untuk jalur fusi-fisi serupa antara proyektil 48Ca dan 58Fe, menunjukkan kemungkinan penggunaan proyektil 58Fe di masa depan dalam pembentukan unsur superberat.[48]
Unbiquadium
Para ilmuwan di GANIL (Grand Accélérateur National d'Ions Lourds) mencoba mengukur fisi langsung dan tertunda dari inti senyawa unsur dengan Z = 114, 120, dan 124 untuk menyelidiki efek kulit di wilayah ini dan untuk menentukan kulit proton sferis berikutnya. Hal ini karena memiliki kulit inti yang lengkap (atau, secara setara, memiliki jumlah proton atau neutron yang ajaib) akan memberikan lebih banyak stabilitas pada inti unsur superberat tersebut, sehingga bergerak lebih dekat ke arah pulau stabilitas. Pada tahun 2006, dengan hasil penuh diterbitkan pada tahun 2008, tim ini memberikan hasil dari reaksi yang melibatkan pemboman target germanium alami dengan ion uranium:
- 238
92U + nat
32Ge → 308, 310, 311, 312, 314124* → fisi
Tim ini melaporkan bahwa mereka telah mampu mengidentifikasi fisi inti senyawa dengan waktu paruh > 10−18 detik. Hasil ini menunjukkan efek stabilisasi yang kuat pada Z = 124 dan menunjuk ke kulit proton berikutnya pada Z > 120, bukan pada Z = 114 seperti yang diperkirakan sebelumnya. Inti senyawa adalah kombinasi longgar dari nukleon yang belum tersusun menjadi kulit inti. Ia tidak memiliki struktur internal dan disatukan hanya oleh gaya tumbukan antara target dan inti proyektil. Diperkirakan bahwa dibutuhkan sekitar 10−14 detik bagi nukleon untuk menyusun diri mereka menjadi kulit inti, di mana inti senyawa menjadi nuklida, dan angka ini digunakan oleh IUPAC sebagai waktu paruh minimum yang harus dimiliki oleh sebuah isotop yang diklaim yang berpotensi untuk diakui telah ditemukan. Jadi, eksperimen yang dilakukan di GANIL tidak dihitung sebagai penemuan unsur 124.[10]
Pembelahan inti senyawa 312124 juga dipelajari pada tahun 2006 dalam akselerator ion berat ALPI tandem di Laboratori Nazionali di Legnaro (Laboratorium Nasional Legnaro) di Italia:[49]
- 232
90Th + 80
34Se → 312124* → fisi
Serupa dengan eksperimen sebelumnya yang dilakukan di JINR (Joint Institute for Nuclear Research), fragmen fisi berkerumun di sekitar inti ajaib ganda seperti 132Sn (Z = 50, N = 82), mengungkapkan kecenderungan inti superberat untuk mengeluarkan inti ajaib ganda tersebut di dalam fisi.[48] Jumlah rata-rata neutron per fisi dari inti senyawa 312124 (relatif terhadap sistem yang lebih ringan) juga ditemukan meningkat, menegaskan bahwa tren inti yang lebih berat memancarkan lebih banyak neutron selama fisi berlanjut ke wilayah massa superberat.[49]
Unbipentium
Upaya pertama dan satu-satunya untuk menyintesis unsur 125 (unbipentium) dilakukan di Dubna pada 1970–1971 menggunakan ion seng dan target amerisium-243:[12]
- 243
95Am + 66, 68
30Zn → 309, 311125* → tidak ada atom
Tidak ada atom yang terdeteksi, dan batas penampang 5 nb telah ditentukan. Eksperimen ini dimotivasi oleh kemungkinan stabilitas yang lebih besar untuk inti di sekitar Z ~ 126 dan N ~ 184,[12] meskipun penelitian yang lebih baru menunjukkan bahwa pulau stabilitas mungkin terletak pada nomor atom yang lebih rendah (seperti kopernisium, Z = 112), dan penyintesisan unsur yang lebih berat seperti unsur 125 akan membutuhkan eksperimen yang lebih sensitif.[25]
Unbiheksium
Upaya pertama dan satu-satunya untuk menyintesis unsur 126 (unbiheksium), yang tidak berhasil, dilakukan pada tahun 1971 di CERN (Organisasi Eropa untuk Riset Nuklir) oleh René Bimbot dan John M. Alexander menggunakan reaksi fusi panas:[10]
- 232
90Th + 84
36Kr → 316126* → tidak ada atom
Partikel alfa berenergi tinggi (13–15 MeV) telah teramati dan diambil sebagai bukti yang mungkin untuk penyintesisan unsur 126. Eksperimen yang gagal berikutnya dengan sensitivitas yang lebih tinggi menunjukkan bahwa sensitivitas 10 mb dari eksperimen ini terlalu rendah; karenanya, pembentukan inti unsur 126 dalam reaksi ini sangat tidak mungkin.[8]
Unbiseptium
Upaya pertama dan satu-satunya untuk menyintesis unsur 127 (unbiseptium), yang tidak berhasil, dilakukan pada tahun 1978 dalam akselerator UNILAC di GSI Helmholtz Center, di mana target tantalum alami dibombardir dengan ion xenon-136:[10]
- nat
73Ta + 136
54Xe → 316, 317127* → tidak ada atom
Pencarian di alam
Sebuah studi pada tahun 1976 oleh sekelompok peneliti Amerika dari beberapa universitas mengusulkan bahwa unsur superberat primordial, terutama unsur 116, 124, 126, dan 127, dapat menjadi penyebab kerusakan radiasi yang tidak dapat dijelaskan (terutama radiohalo) dalam mineral.[8] Hal ini mendorong banyak peneliti untuk mencari mereka di alam dari tahun 1976 hingga 1983. Pada tahun 1976, sebuah kelompok yang dipimpin oleh Tom Cahill, seorang profesor di Universitas California di Davis, mengklaim bahwa mereka telah mendeteksi partikel alfa dan sinar-X dengan energi yang tepat untuk menyebabkan kerusakan yang diamati, mendukung keberadaan unsur-unsur tersebut. Secara khusus, keberadaan inti berumur panjang (pada urutan 109 tahun) dari unsur 124 dan 126, bersama dengan produk peluruhannya, pada kelimpahan 10−11 relatif terhadap kemungkinan kongener mereka, uranium dan plutonium, telah diduga.[50] Yang lain mengklaim bahwa tidak ada yang terdeteksi, dan mempertanyakan karakteristik yang diusulkan dari inti superberat primordial.[8] Secara khusus, mereka menyebutkan bahwa setiap inti superberat seperti itu harus memiliki kulit neutron tertutup pada N = 184 atau N = 228, dan kondisi yang diperlukan untuk meningkatkan stabilitas ini hanya ada pada isotop livermorium yang kekurangan neutron atau isotop yang kaya neutron dari unsur-unsur lain yang tidak akan stabil terhadap peluruhan beta[8] tidak seperti kebanyakan isotop alami.[51] Aktivitas ini juga diduga disebabkan oleh transmutasi nuklir dalam serium alami, meningkatkan ambiguitas lebih lanjut atas pengamatan yang diklaim dari unsur superberat ini.[8]
Pada tanggal 24 April 2008, sebuah kelompok yang dipimpin oleh Amnon Marinov di Universitas Ibrani Yerusalem mengklaim telah menemukan atom 292122 tunggal dalam deposit torium alami dengan kelimpahan antara 10−11 dan 10−12 relatif terhadap torium.[52] Klaim Marinov dkk. dikritik oleh sebagian komunitas ilmiah. Marinov mengklaim bahwa dia telah mengirimkan artikel itu ke jurnal Nature dan Nature Physics tetapi keduanya menolaknya tanpa mengirimkannya untuk ditinjau oleh rekan sejawat.[53] Atom 292122 diklaim sebagai isomer tersuperdeformasi atau terhiperdeformasi dengan waktu paruh setidaknya 100 juta tahun.[10]
Kritik terhadap teknik ini, yang sebelumnya digunakan untuk mengidentifikasi isotop torium yang lebih ringan dengan spektrometri massa,[54] diterbitkan dalam Physical Review C pada tahun 2008.[55] Sebuah bantahan oleh kelompok Marinov diterbitkan di Physical Review C setelah komentar tersebut diterbitkan.[56]
Pengulangan eksperimen torium menggunakan metode spektrometri massa pemercepat (Accelerator Mass Spectrometry, AMS) yang unggul gagal mengkonfirmasi hasil, meskipun sensitivitasnya 100 kali lipat lebih baik.[57] Hasil ini menimbulkan keraguan besar pada hasil kolaborasi Marinov sehubungan dengan klaim mereka mengenai isotop torium,[54] roentgenium,[58] dan unsur 122 yang berumur panjang.[52] Masih cukup mungkin bahwa jejak unbibium mungkin hanya ada dalam beberapa sampel torium, meskipun hal ini tidaklah mungkin.[10]
Tingkat kemungkinan unsur superberat primordial di Bumi saat ini tidaklah pasti. Bahkan jika mereka dipastikan telah menyebabkan kerusakan radiasi sejak lama, mereka mungkin sekarang telah meluruh menjadi jejak belaka, atau bahkan benar-benar hilang.[59] Juga tidak pasti apakah inti superberat seperti itu dapat diproduksi secara alami sama sekali, karena fisi spontan diperkirakan untuk mengakhiri proses r yang bertanggung jawab atas pembentukan unsur berat antara nomor massa 270 dan 290, jauh sebelum unsur setelah 120 dapat terbentuk.[60]
Sebuah hipotesis baru-baru ini mencoba menjelaskan spektrum Bintang Przybylski dengan flerovium dan unsur 120 yang terjadi secara alami.[61][62][63]
Sifat yang diprediksi dari unsur periode kedelapan
Unsur 118, oganeson, adalah unsur terberat yang telah disintesis. Dua unsur berikutnya, unsur 119 dan 120, harus membentuk deret 8s dan masing-masing menjadi logam alkali dan alkali tanah. Setelah unsur 120, deret superaktinida diperkirakan akan dimulai, ketika elektron 8s dan pengisian subkulit 8p1/2, 7d3/2, 6f, dan 5g menentukan sifat kimia unsur-unsur ini. Perhitungan CCSD yang lengkap dan akurat tidak tersedia untuk unsur setelah 122 karena situasi yang sangat rumit: orbital 5g, 6f, dan 7d harus memiliki tingkat energi yang hampir sama, dan di wilayah unsur 160, orbital 9s, 8p3/2, dan 9p1/2 juga harus memiliki energi yang hampir sama. Ini akan menyebabkan kulit elektron bercampur sehingga konsep blok tidak lagi berlaku dengan baik, dan juga akan menghasilkan sifat kimia baru yang akan membuat penentuan posisi unsur-unsur ini dalam tabel periodik menjadi sangat sulit.[15]

Sifat kimia dan fisik
Unsur 119 dan 120
Beberapa sifat yang diprediksi dari unsur 119 dan 120[4][15] Sifat 119 120 Berat atom standar [322] [325] Golongan 1 2 Konfigurasi elektron valensi 8s1 8s2 Bilangan oksidasi stabil 1, 3 2, 4 Energi ionisasi pertama 463,1 kJ/mol 563,3 kJ/mol Jari-jari logam 260 pm 200 pm Massa jenis 3 g/cm3 7 g/cm3 Titik lebur 0–30 °C (32–86 °F) 680 °C (1.300 °F) Titik didih 630 °C (1.200 °F) 1.700 °C (3.100 °F)
Dua unsur pertama dari periode 8 adalah ununenium dan unbinilium, unsur 119 dan 120. Konfigurasi elektron mereka harus memiliki orbital 8s yang terisi. Orbital ini secara relativistik stabil dan berkontraksi; dengan demikian, unsur 119 dan 120 harus lebih mirip rubidium dan stronsium daripada tetangga terdekat mereka di atas, fransium dan radium. Efek lain dari kontraksi relativistik orbital 8s adalah bahwa jari-jari atom kedua unsur ini harus hampir sama dengan fransium dan radium. Mereka harus berperilaku seperti logam alkali dan alkali tanah normal (walaupun kurang reaktif daripada tetangga vertikal terdekatnya), biasanya masing-masing membentuk bilangan oksidasi +1 dan +2, tetapi destabilisasi relativistik dari subkulit 7p3/2 dan energi ionisasi yang relatif rendah dari elektron 7p3/2 seharusnya memungkinkan mereka untuk memiliki (masing-masing) bilangan oksidasi yang lebih tinggi seperti +3 dan +4.[4][15]
Superaktinida
Superaktinida dapat dianggap berkisar dari unsur 121 sampai 157, yang dapat diklasifikasikan sebagai unsur 5g dan 6f dari periode kedelapan, bersama dengan unsur 7d pertama.[17] Dalam seri superaktinida, kulit 7d3/2, 8p1/2, 6f5/2 dan 5g7/2 harus terisi secara bersamaan.[16] Hal ini menciptakan situasi yang sangat rumit, sedemikian rupa sehingga perhitungan CCSD yang lengkap dan akurat hanya dapat dilakukan untuk unsur 121 dan 122.[15] Superaktinida pertama, unbiunium (unsur 121), harus serupa dengan lantanum dan aktinium:[64] bilangan oksidasi utamanya harus +3, meskipun kedekatan tingkat energi subkulit valensi memungkinkan bilangan oksidasi yang lebih tinggi, seperti pada unsur 119 dan 120.[15] Stabilisasi relativistik dari subkulit 8p akan menghasilkan konfigurasi elektron valensi 8s28p1 keadaan dasar untuk unsur 121, berbeda dengan konfigurasi ds2 lantanum dan aktinium;[15] meskipun demikian, konfigurasi anomali ini tampaknya tidak mempengaruhi perhitungan kimianya, yang tetap mirip dengan aktinium.[65] Energi ionisasi pertamanya diperkirakan 429,4 kJ/mol, yang akan lebih rendah daripada semua unsur yang telah diketahui kecuali untuk logam alkali kalium, rubidium, sesium, dan fransium: nilai ini bahkan lebih rendah daripada logam alkali periode 8, ununenium (463,1 kJ/mol). Demikian pula, superaktinida berikutnya, unbibium (unsur 122), mungkin mirip dengan serium dan torium, dengan bilangan oksidasi utama +4, tetapi akan memiliki konfigurasi elektron valensi 7d18s28p1 atau 8s28p2 keadaan dasar,[66] tidak seperti konfigurasi 6d27s2 milik torium. Oleh karena itu, energi ionisasi pertamanya akan lebih kecil daripada milik torium (Th: 6,3 eV; unsur 122: 5,6 eV) karena lebih mudah mengionisasi elektron 8p1/2 milik unbibium daripada elektron 6d milik torium.[15] Runtuhnya orbital 5g itu sendiri tertunda hingga sekitar unsur 125; konfigurasi elektron deret isoelektronik 119 elektron diperkirakan menjadi [Og]8s1 untuk unsur 119 hingga 122, [Og]6f1 untuk unsur 123 dan 124, serta [Og]5g1 untuk unsur 125 dan seterusnya.[67]
Dalam beberapa superaktinida pertama, energi pengikatan elektron yang ditambahkan diperkirakan cukup kecil sehingga mereka dapat kehilangan semua elektron valensinya; misalnya, unbiheksium (unsur 126) dapat dengan mudah membentuk bilangan oksidasi +8, dan bahkan bilangan oksidasi yang lebih tinggi untuk beberapa unsur berikutnya mungkin terjadi. Unsur 126 juga diprediksi menampilkan berbagai bilangan oksidasi lainnya: perhitungan terbaru menunjukkan bahwa monofluorida 126F yang stabil mungkin dimungkinkan, yang dihasilkan dari interaksi ikatan antara orbital 5g pada unsur 126 dan orbital 2orbital-p|p pada fluorin.[68] Bilangan oksidasi yang diprediksi lainnya termasuk +2, +4, dan +6; +4 diperkirakan menjadi bilangan oksidasi unbiheksium yang paling umum.[16] Superaktinida dari unbipentium (unsur 125) hingga unbiennium (unsur 129) diperkirakan menunjukkan bilangan oksidasi +6 dan membentuk heksafluorida, meskipun 125F6 dan 126F6 diperkirakan terikat secara relatif lemah.[67] Energi disosiasi ikatan diperkirakan akan sangat meningkat pada unsur 127 dan terlebih lagi pada unsur 129. Hal ini menunjukkan pergeseran dari sifat ionik kuat pada fluorida unsur 125 ke sifat yang lebih kovalen, yang melibatkan orbital 8p, pada fluorida unsur 129. Pengikatan dalam heksafluorida superaktinida ini sebagian besar antara subkulit 8p tertinggi dari superaktinida dan subkulit 2p fluorin, tidak seperti bagaimana uranium menggunakan orbital 5f dan 6d untuk pengikatan dalam uranium heksafluorida.[67]
Terlepas dari kemampuan superaktinida awal untuk mencapai bilangan oksidasi yang tinggi, telah dihitung bahwa elektron 5g akan menjadi subkulit yang paling sulit untuk terionisasi; ion 1256+ dan 1267+ ions diprediksi memiliki konfigurasi 5g1, mirip dengan konfigurasi 5f1 milik ion Np6+.[13][67] Perilaku serupa diamati pada aktivitas kimia rendah dari elektron 4f dalam lantanida; hal ini merupakan konsekuensi dari orbital 5g yang kecil dan terkubur dalam di awan elektron.[13] Kehadiran elektron dalam orbital g, yang tidak terdapat dalam konfigurasi elektron keadaan dasar dari semua unsur yang diketahui saat ini, seharusnya memungkinkan orbital hibrid yang saat ini tidak diketahui untuk membentuk dan mempengaruhi sifat kimia superaktinida dengan cara baru, meskipun tidak adanya elektron g dalam unsur-unsur yang telah diketahui membuat prediksi sifat kimia superaktinida lebih sulit.[4]
Beberapa senyawa yang diprediksi dari superaktinida (X = sebuah halogen)[13][67][69] 121 122 123 124 125 126 127 128 129 132 142 143 144 145 146 148 153 154 155 156 157 Senyawa 121X3 122X4 123X5 124X6 125F
125F6
125O2+2126F
126F6
126O4127F6 128F6 129F
129F6142X4
142X6143F6 144X6
144O2+2
144F8
144O4145F6 148O6 Analog LaX3
AcX3CeX4
ThX4NpO2+2 ThF4 UF6
UO2+2
PuF8
PuO4UO6 Bilangan oksidasi 3 4 5 6 1, 6, 7 1, 2, 4, 6, 8 6 6 1, 6 6 4, 6 6, 8 3, 4, 5, 6, 8 6 8 12 3 0, 2 3, 5 2 3
Dalam superaktinida yang lebih akhir, bilangan oksidasi harus menjadi lebih rendah. Mulai dari unsur 132, bilangan oksidasi paling stabil yang dominan hanya +6; ini selanjutnya direduksi menjadi +3 dan +4 mulai dari unsur 144, dan pada akhir deret superaktinida hanya akan menjadi +2 (dan mungkin bahkan 0) karena kulit 6f, yang sedang diisi pada titik itu, berada jauh di dalam awan elektron serta elektron 8s dan 8p1/2 terikat terlalu kuat untuk menjadi aktif secara kimia. Kulit 5g seharusnya terisi pada unsur 144 dan kulit 6f pada sekitar unsur 154, dan pada daerah superaktinida ini elektron 8p1/2 terikat sangat kuat sehingga tidak lagi aktif secara kimia, sehingga hanya beberapa elektron yang dapat berpartisipasi dalam reaksi kimia. Perhitungan oleh Fricke dkk. memprediksi bahwa pada unsur 154, kulit 6f akan menjadi penuh dan tidak ada fungsi gelombang elektron -d atau yang lainnya di luar kulit 8s dan 8p1/2 yang tidak aktif secara kimiawi. Hal ini dapat menyebabkan unsur 154 menjadi agak tidak reaktif dengan sifat seperti gas mulia.[4][15] Perhitungan oleh Pyykkö tetap memperkirakan bahwa pada unsur 155, kulit 6f masih dapat terionisasi secara kimia: 1553+ harus memiliki kulit 6f yang penuh, dan potensial ionisasi keempat harus seperti terbium dan disprosium, yang keduanya dikenal dengan bilangan +4.[13]
Demikian pula dengan kontraksi lantanida dan aktinida, harus ada kontraksi superaktinida dalam deret superaktinida di mana jari-jari ionik superaktinida lebih kecil dari yang diperkirakan. Dalam lantanida, kontraksinya sekitar 4,4 pm per unsur; dalam aktinida, kontraksinya sekitar 3 pm per unsur. Kontraksinya lebih besar di lantanida daripada di aktinida karena lokalisasi yang lebih besar dari fungsi gelombang 4f dibandingkan dengan fungsi gelombang 5f. Perbandingan dengan fungsi gelombang elektron terluar dari lantanida, aktinida, dan superaktinida mengarah pada prediksi kontraksi sekitar 2 pm per unsur dalam superaktinida; meskipun nilai ini lebih kecil daripada kontraksi dalam lantanida dan aktinida, efek totalnya lebih besar dikarenakan fakta bahwa 32 elektron akan terisi dalam kulit 5g dan 6f yang terkubur dalam, bukan hanya 14 elektron yang terisi dalam kulit 4f dan 5f pada lantanida dan aktinida, masing-masing.[4]
Pekka Pyykkö membagi superaktinida menjadi tiga deret: deret 5g (unsur 121 hingga 138), deret 8p1/2 (unsur 139 hingga 140), dan deret 6f (unsur 141 hingga 155), juga mencatat bahwa akan ada kesepakatan tumpang tindih antara tingkat energi dan bahwa orbital 6f, 7d, atau 8p1/2 juga dapat ditempati oleh atom atau ion superaktinida yang lebih awal. Dia juga memperkirakan bahwa mereka akan berperilaku lebih seperti "superlantanida, dalam artian bahwa elektron 5g sebagian besar tidak aktif secara kimia, mirip dengan bagaimana hanya satu atau dua elektron 4f di setiap lantanida yang pernah terionisasi dalam senyawa kimia. Dia juga meramalkan bahwa kemungkinan bilangan oksidasi superaktinida mungkin meningkat sangat tinggi pada deret 6f, hingga nilai seperti +12 pada unsur 148.[13]
Andrey Kulsha telah menyebut tiga puluh enam unsur dari 121 hingga 156 sebagai unsur "ultransisi" dan telah mengusulkan untuk membaginya menjadi dua deret dengan masing-masing berisi delapan belas unsur, yang pertama berisi unsur 121 hingga 138 dan yang kedua berisi unsur 139 hingga 156. Deret yang pertama akan analog dengan lantanida, dengan bilangan oksidasi terutama berkisar dari +4 hingga +6, karena pengisian kulit 5g akan mendominasi dan unsur yang bertetangga akan sangat mirip satu sama lain, menciptakan analogi dengan uranium, neptunium, dan plutonium. Deret yang kedua akan analog dengan aktinida: pada awalnya (di sekitar unsur 140-an), diperkirakan bilangan oksidasi yang sangat tinggi akan terjadi karena kulit 6f naik di atas kulit 7d, tetapi setelah itu bilangan oksidasi khas akan lebih rendah dan dalam unsur di sekitar unsur 150-an dan seterusnya, elektron 8p1/2 akan berhenti aktif secara kimia. Karena dua baris ini dipisahkan dengan penambahan subkulit 5g18 yang lengkap, keduanya dapat dianggap analog satu sama lain juga.[18]
Sebagai contoh dari superaktinida akhir, unsur 156 diperkirakan menunjukkan terutama bilangan oksidasi +2, karena konfigurasi elektronnya dengan elektron 7d2 yang mudah dilepas pada inti [Og]5g186f148s28p21/2 yang stabil. Dengan demikian, ia dapat dianggap sebagai kongener nobelium yang lebih berat, yang juga memiliki sepasang elektron 7s2 yang mudah dilepas di atas inti [Rn]5f14 yang stabil, dan biasanya dalam biloks +2 (pengoksidasi kuat diperlukan untuk mendapatkan nobelium dalam biloks +3).[18] Energi ionisasi pertamanya harus sekitar 400 kJ/mol dan jari-jari logamnya sekitar 170 pikometer. Dengan massa atom relatif sekitar 445 u,[4] ia seharusnya merupakan logam yang sangat berat dengan kerapatan sekitar 26 g/cm3.
Unsur 157 hingga 166
Logam transisi 7d pada periode 8 diperkirakan akan menjadi unsur 157 hingga 166. Meskipun elektron 8s dan 8p1/2 terikat sangat kuat dalam unsur-unsur ini sehingga mereka tidak dapat mengambil bagian dalam reaksi kimia apa pun, tingkat 9s dan 9p1/2 diperkirakan akan tersedia untuk hibridisasi.[4][15] Unsur-unsur 7d ini harus serupa dengan unsur-unsur 4d, itrium hingga kadmium.[18] Secara khusus, unsur 164 yang memiliki konfigurasi elektron 7d109s0 menunjukkan analogi yang jelas dengan paladium yang memiliki konfigurasi elektron 4d105s0.[16]
Logam mulia dari rangkaian logam transisi ini diperkirakan tidak semulia homolognya yang lebih ringan, karena tidak adanya kulit s di bagian luar untuk menjadi pelindung dan juga karena kulit 7d sangat terbelah menjadi dua subkulit akibat efek relativistik. Hal ini menyebabkan energi ionisasi pertama dari logam transisi 7d lebih kecil daripada energi ionisasi dari kongener mereka yang lebih ringan.[4][15][16]
Ketertarikan teoretis dalam kimia unheksquadium sebagian besar dimotivasi oleh prediksi teoretis bahwa ia, terutama isotop 472164 dan 482164 (dengan 164 proton dan 308 atau 318 neutron), akan berada di pusat pulau stabilitas kedua yang hipotetis kedua (yang pertama berpusat pada kopernisium, khususnya isotop 291Cn, 293Cn, dan 296Cn yang diperkirakan memiliki waktu paruh ratusan atau ribuan tahun).[70][45][71][72]
Perhitungan memperkirakan bahwa elektron 7d dari unsur 164 (unheksquadium) harus berpartisipasi dengan sangat mudah dalam reaksi kimia, sehingga harus dapat menunjukkan bilangan oksidasi +6 dan +4 yang stabil selain biloks +2 yang normal dalam larutan berair dengan ligan yang kuat. Dengan demikian, unsur 164 harus dapat membentuk senyawa seperti 164(CO)4, 164(PF3)4 (keduanya tetrahedron seperti senyawa paladium yang sesuai), dan 164(CN)2−2 (linear), yang perilakunya sangat berbeda dari timbal, yang mana unsur 164 akan menjadi homolognya yang lebih berat jika bukan karena efek relativistik. Namun demikian, keadaan divalen akan menjadi yang utama dalam larutan berair (walaupun biloks +4 dan +6 akan dimungkinkan dengan ligan yang lebih kuat), dan unheksquadium(II) harus berperilaku lebih mirip dengan timbal daripada unheksquadium(IV) dan unhexquadium(VI).[15][16]
Unsur 164 diperkirakan akan menjadi asam Lewis lunak dan memiliki parameter kelembutan Ahrlands mendekati 4 eV. Ia paling tidak haruslah reaktif, memiliki energi ionisasi pertama sekitar 685 kJ/mol, sebanding dengan molibdenum.[4][16] Karena kontraksi dari lantanida, aktinida, dan superaktinida, unsur 164 seharusnya memiliki jari-jari logam hanya 158 pm, sangat dekat dengan magnesium yang jauh lebih ringan, meskipun berat atomnya diperkirakan sekitar 474 u, sekitar 19,5 kali berat atom. magnesium.[4] Jari-jari yang kecil dan berat yang tinggi ini menyebabkannya diperkirakan memiliki kerapatan yang sangat tinggi, sekitar 46 g·cm−3, lebih dari dua kali lipat osmium, unsur paling padat yang diketahui saat ini, pada 22,61 g·cm−3; unsur 164 seharusnya menjadi unsur terpadat kedua dalam 172 unsur pertama dalam tabel periodik, dengan hanya tetangganya unhekstrium (unsur 163) yang lebih rapat (pada 47 g·cm−3).[4] Unsur metalik 164 harus memiliki energi kohesif (entalpi kristalisasi) yang sangat besar karena ikatan kovalennya, kemungkinan besar menghasilkan titik lebur yang tinggi. Dalam keadaan metalik, unsur 164 harus cukup mulia dan analog dengan paladium dan platina. Frike dkk. memperkirakan beberapa kesamaan formal dengan oganeson, karena kedua unsur ini memiliki konfigurasi kulit tertutup dan energi ionisasi yang serupa, meskipun mereka mencatat bahwa sementara oganeson akan menjadi gas mulia yang sangat buruk, unsur 164 akan menjadi logam mulia yang baik.[16]
Unsur 165 (unhekspentium) dan 166 (unheksheksium), dua logam 7d terakhir, harus berperilaku serupa dengan logam alkali dan alkali tanah ketika masing-masing dalam bilangan oksidasi +1 dan +2. Elektron 9s harus memiliki energi ionisasi yang sebanding dengan elektron 3s seperti natrium dan magnesium, karena efek relativistik yang menyebabkan elektron 9s menjadi terikat jauh lebih kuat daripada perkiraan perhitungan nonrelativistik. Unsur 165 dan 166 biasanya harus menunjukkan bilangan oksidasi masing-masing +1 dan +2, meskipun energi ionisasi elektron 7d cukup rendah untuk memungkinkan bilangan oksidasi yang lebih tinggi seperti +3 untuk unsur 165. Bilangan oksidasi +4 untuk unsur 166 kemungkinan lebih kecil, menciptakan situasi yang mirip dengan unsur yang lebih ringan di golongan 11 dan 12 (khususnya emas dan raksa).[4][15] Seperti raksa tetapi tidak seperti kopernisium, ionisasi unsur 166 hingga 1662+ diperkirakan menghasilkan konfigurasi 7d10 yang sesuai dengan hilangnya elektron s tetapi bukan elektron d, membuatnya lebih analog dengan unsur-unsur golongan 12 " yang kurang relativistik", seperti seng, kadmium, dan raksa, yang pada dasarnya tidak memiliki karakter logam transisi.[13]
Beberapa sifat prediksi dari unsur 156–166
Jari-jari dan densitas logam adalah perkiraan pertama.[4][13][15]
Golongan yang paling analog diberikan terlebih dahulu, diikuti oleh golongan lain yang sejenis.[16]Sifat 156 157 158 159 160 161 162 163 164 165 166 Berat atom standar [445] [448] [452] [456] [459] [463] [466] [470] [474] [477] [481] Golongan Golongan Yb
(4)3
(5)4
(6)5
(7)6
(8)7
(9)8
(10)9
(11)10
(12, 14, 18)11
(1, 13)12
(2, 14)Konfigurasi elektron valensi 7d2 7d3 7d4 7d5 7d6 7d7 7d8 7d9 7d10 7d10 9s1 7d10 9s2 Bilangan oksidasi stabil 2 3 4 1, 5 2, 6 3, 7 4, 8 5 0, 2, 4, 6 1, 3 2 Energi ionisasi pertama 400 kJ/mol 450 kJ/mol 520 kJ/mol 340 kJ/mol 420 kJ/mol 470 kJ/mol 560 kJ/mol 620 kJ/mol 690 kJ/mol 520 kJ/mol 630 kJ/mol Jari-jari logam 170 pm 163 pm 157 pm 152 pm 148 pm 148 pm 149 pm 152 pm 158 pm 250 pm 200 pm Massa jenis 26 g/cm3 28 g/cm3 30 g/cm3 33 g/cm3 36 g/cm3 40 g/cm3 45 g/cm3 47 g/cm3 46 g/cm3 7 g/cm3 11 g/cm3
Unsur 167 hingga 172
Enam unsur berikutnya pada tabel periodik diperkirakan menjadi unsur golongan utama terakhir pada periode mereka,[13] dan kemungkinan akan mirip dengan unsur-unsur 5p, indium hingga xenon.[18] Dalam unsur 167 hingga 172, kulit 9p1/2 dan 8p3/2 akan terisi. Nilai eigen energi mereka sangat berdekatan sehingga berperilaku sebagai satu subkulit p yang tergabung, mirip dengan subkulit 2p dan 3p yang nonrelativistik. Dengan demikian, efek pasangan lengai tidak akan terjadi dan bilangan oksidasi yang paling umum dari unsur 167 hingga 170 diperkirakan berturut-turut adalah +3, +4, +5, dan +6. Unsur 171 (unseptunium) menunjukkan beberapa kesamaan dengan halogen, menunjukkan berbagai bilangan oksidasi mulai dari −1 hingga +7, meskipun sifat fisiknya diperkirakan lebih dekat dengan sifat logam. Afinitas elektronnya diperkirakan sebesar 3,0 eV, memungkinkannya membentuk H171, analog dengan hidrogen halida. Ion 171− diperkirakan akan menjadi basa lunak, yang sebanding dengan iodida (I−). Unsur 172 (unseptbium) diperkirakan akan menjadi gas mulia dengan perilaku kimia yang mirip dengan xenon, karena energi ionisasinya seharusnya sangat mirip (Xe, 1170,4 kJ/mol; unsur 172, 1090 kJ/mol). Satu-satunya perbedaan utama di antara mereka adalah bahwa unsur 172, tidak seperti xenon, diperkirakan akan berwujud cair atau padat pada temperatur dan tekanan standar karena berat atomnya yang jauh lebih tinggi.[4] Unseptbium diperkirakan akan menjadi asam Lewis yang kuat, membentuk fluorida dan oksida, mirip dengan xenon, kongener ringannya.[16] Karena analogi unsur 165–172 dengan periode 2 dan 3, Fricke dkk. menganggap mereka membentuk periode kesembilan dari tabel periodik, sedangkan periode kedelapan berakhir pada unsur logam mulia 164. Periode kesembilan ini akan serupa dengan periode kedua dan ketiga yang diperkirakan tidak memiliki logam transisi.[16]
Beberapa sifat yang diprediksi dari unsur 167–172
Jari-jari dan massa jenis logam atau kovalen adalah perkiraan pertama.[4][15][16]Sifat 167 168 169 170 171 172 Berat atom standar [485] [489] [493] [496] [500] [504] Golongan 13 14 15 16 17 18 Konfigurasi elektron valensi 9s2 9p1 9s2 9p2 9s2 9p2 8p1 9s2 9p2 8p2 9s2 9p2 8p3 9s2 9p2 8p4 Bilangan oksidasi stabil 3 4 5 6 −1, 3, 7 0, 4, 6, 8 Energi ionisasi pertama 620 kJ/mol 720 kJ/mol 800 kJ/mol 890 kJ/mol 984 kJ/mol 1090 kJ/mol Jari-jari logam atau kovalen 190 pm 180 pm 175 pm 170 pm 165 pm 220 pm Massa jenis 17 g/cm3 19 g/cm3 18 g/cm3 17 g/cm3 16 g/cm3 9 g/cm3
Setelah unsur 172
Setelah unsur 172, deret transisi panjang lainnya seperti superaktinida seharusnya dimulai, mengisi setidaknya kulit 6g, 7f, dan 8d (dengan energi 10s, 10p1/2, dan 6h11/2 terlalu tinggi untuk berkontribusi di awal deret). Elektron ini akan terikat sangat longgar, berpotensi membuat bilangan oksidasi yang sangat tinggi dapat dicapai, meskipun elektron akan menjadi lebih terikat erat saat muatan ionik naik.[16]
Pada unsur 173 (unseptrium), elektron terluar akan memasuki subkulit 6g7/2. Karena interaksi spin–orbit akan menciptakan sela energi yang sangat besar antara subkulit 8p3/2 dan 6g7/2, elektron terluar ini diperkirakan terikat sangat longgar dan sangat mudah hilang untuk membentuk kation 173+. Akibatnya, unsur 173 diperkirakan berperilaku secara kimiawi seperti logam alkali, satu jauh lebih reaktif daripada sesium (fransium dan unsur 119 kurang reaktif daripada sesium akibat dari efek relativistik).[73][18]
Unsur 184 (unoktquadium) secara signifikan ditargetkan dalam prediksi awal, karena awalnya 184 diperkirakan akan menjadi bilangan ajaib proton: ia diprediksi memiliki konfigurasi elektron [172] 6g5 7f4 8d3, dengan setidaknya elektron 7f dan 8d aktif secara kimiawi. Perilaku kimianya diperkirakan akan mirip dengan uranium dan neptunium, karena ionisasi lebih lanjut yang melewati biloks +6 (sesuai dengan pelepasan elektron 6g) kemungkinan tidak menguntungkan; biloks +4 seharusnya menjadi yang paling umum dalam larutan berair, dengan +5 dan +6 dapat dicapai dalam senyawa padat.[4][16][74]
Akhir dari tabel periodik
Jumlah unsur yang mungkin secara fisik tidaklah diketahui. Perkiraan rendah mengatakan bahwa tabel periodik dapat berakhir segera setelah pulau stabilitas,[14] yang diperkirakan berpusat pada Z = 126, karena perpanjangan tabel periodik dan nuklida dibatasi oleh garis tetesan proton dan neutron serta stabilitas menuju peluruhan alfa dan fisi spontan.[75] Satu perhitungan yang dilakukan oleh Y. Gambhir dkk., menganalisis energi pengikatan inti dan stabilitas di berbagai saluran peluruhan, menunjukkan batas keberadaan inti terikat pada Z = 146.[76] Beberapa, seperti Walter Greiner, meramalkan bahwa mungkin tidak akan ada akhir dari tabel periodik.[77] Prediksi lain dari berakhirnya tabel periodik termasuk Z = 128 (John Emsley) dan Z = 155 (Albert Khazan).[10]
Unsur di atas nomor atom 137
Hal ini merupakan sebuah "legenda rakyat" di antara fisikawan bahwa Richard Feynman memperkirakan bahwa atom netral tidak dapat eksis untuk nomor atom yang lebih besar dari Z = 137, dengan alasan bahwa persamaan Dirac yang relativistik memprediksi bahwa energi keadaan dasar elektron terdalam dari sebuah atom akan menjadi bilangan imajiner. Di sini, angka 137 muncul sebagai kebalikan dari konstanta struktur halus. Dengan argumen ini, sebuah atom netral tidak dapat eksis setelah nomor atom 137, dan oleh karena itu tabel periodik unsur berdasarkan orbital elektron akan rusak pada titik ini. Namun, argumen ini menganggap bahwa inti atom berbentuk seperti titik. Perhitungan yang lebih akurat harus memperhitungkan ukuran inti yang kecil, tetapi bukan nol, yang diprediksi akan mendorong batas lebih jauh menjadi Z ≈ 173.[77]
Model Bohr
Model Bohr menunjukkan kesulitan untuk atom dengan nomor atom lebih besar dari 137, untuk kecepatan elektron dalam orbital elektron 1s, v, diberikan oleh
di mana Z merupakan nomor atom, dan α merupakan konstanta struktur halus, sebuah ukuran kekuatan interaksi elektromagnetik.[78] Di bawah pendekatan ini, setiap unsur dengan nomor atom lebih besar dari 137 akan membutuhkan elektron 1s untuk bergerak lebih cepat dari c, laju cahaya. Oleh karena itu, model Bohr yang nonrelativistik tidak akan akurat bila diterapkan pada unsur seperti itu.
Persamaan Dirac relativistik

Persamaan Dirac yang relativistik memberikan energi keadaan dasar sebagai
di mana m merupakan massa diam elektron.[79] Untuk Z > 137, fungsi gelombang dari keadaan dasar Dirac adalah berosilasi, bukan terikat, dan tidak ada sela antara spektrum energi positif dan negatif, seperti dalam paradoks Klein.[80] Perhitungan yang lebih akurat dengan mempertimbangkan efek dari ukuran terbatas inti menunjukkan bahwa energi pengikatan pertama melebihi 2mc2 untuk Z > Zcr ≈ 173. Untuk Z > Zcr, jika orbital terdalam (1s) tidak terisi, maka medan listrik inti akan menarik elektron keluar dari ruang hampa, menghasilkan emisi spontan positron.[81][82] Penyelaman subkulit 1s ke dalam kontinum negatif ini sering dianggap sebagai "akhir" dari tabel periodik, meskipun perlakuan yang lebih rinci menunjukkan hasil yang tidak terlalu suram.[13][77][83]
Atom dengan nomor atom di atas Zcr ≈ 173 telah disebut sebagai atom superkritis. Atom superkritis tidak dapat terionisasi total karena subkulit 1s-nya akan diisi oleh pasangan spontan di mana pasangan elektron-positron dibuat dari kontinum negatif, dengan elektron terikat dan positron lepas. Namun, medan kuat di sekitar inti atom terbatas pada wilayah ruang yang sangat kecil, sehingga asas larangan Pauli melarang penciptaan pasangan spontan lebih lanjut setelah subkulit yang telah menyelam ke dalam kontinum negatif terisi. Unsur 173–184 telah disebut sebagai atom superkritis lemah atoms as for them only the 1s karena hanya kulit 1s yang masuk ke dalam kontinum negatif; kulit 2p1/2 diperkirakan bergabung di sekitar unsur 185 dan kulit 2s di sekitar unsur 245. Eksperimen sejauh ini tidak berhasil mendeteksi penciptaan pasangan spontan dari perakitan muatan superkritis melalui tumbukan inti berat (misalnya, tumbukan timbal dengan uranium untuk memberikan Z 174 yang efektif sesaat; uranium dengan uranium menghasilkan Z = 184 yang efektif and uranium dan uranium dengan kalifornium menghasilkan Z = 190 yang efektif).[84]
Bahkan jika melewati Zcr bukanlah sebuah masalah, peningkatan konsentrasi massa jenis 1s yang dekat dengan inti kemungkinan akan membuat elektron ini lebih rentan terhadap penangkapan elektron K saat Zcr didekati. Untuk unsur-unsur berat seperti ini, elektron 1s ini kemungkinan akan menghabiskan sebagian kecil waktu yang signifikan untuk berada begitu dekat dengan inti sehingga mereka benar-benar berada di dalamnya. Hal ini mungkin menimbulkan batasan lain pada tabel periodik.[85]
Zat kuark
Juga telah dikemukakan bahwa dalam wilayah di luar A > 300, seluruh "benua stabilitas" yang terdiri dari fase hipotetis zat kuark yang stabil, terdiri dari kuark naik dan turun yang bebas dan bukannya kuark yang terikat menjadi proton dan neutron, mungkin eksis. Bentuk materi seperti ini diteorikan sebagai keadaan dasar dari zat barionik dengan energi pengikatan per barion yang lebih besar daripada zat nuklir, mendukung peluruhan zat nuklir di luar ambang batas massa ini menjadi zat kuark. Jika keadaan zat ini eksis, ia mungkin dapat disintesis dalam reaksi fusi yang sama yang mengarah pada inti superberat normal, dan akan distabilkan terhadap fisi sebagai konsekuensi dari pengikatannya yang lebih kuat yang cukup untuk mengatasi tolakan Coulomb.[86]
Perhitungan terbaru[87] menunjukkan stabilitas nuget zat kuark naik-turun (up-down quark matter, udQM) terhadap inti konvensional setelah A ~ 266, dan juga menunjukkan bahwa nuget udQM akan menjadi superkritis lebih awal (Zcr ~ 163, A ~ 609) daripada inti konvensional (Zcr ~ 177, A ~ 480).
Sifat nuklir
Bilangan ajaib dan pulau stabilitas
Kestabilan inti sangat menurun dengan bertambahnya nomor atom setelah kurium, unsur 96, sehingga semua isotop dengan nomor atom di atas 101 meluruh secara radioaktif dengan waktu paruh di bawah satu hari, kecuali dubnium-268. Tidak ada unsur dengan nomor atom di atas 82 (setelah timbal) yang memiliki isotop stabil.[88] Namun demikian, karena alasan yang belum dipahami dengan baik, ada sedikit peningkatan stabilitas nuklir di sekitar nomor atom 110–114, yang mengarah pada munculnya apa yang dikenal dalam fisika nuklir sebagai "pulau stabilitas". Konsep ini, diusulkan oleh profesor di Universitas California, Glenn Seaborg, menjelaskan mengapa unsur-unsur superberat bertahan lebih lama dari yang diperkirakan.[89]
Perhitungan menurut metode Hartree–Fock–Bogoliubov menggunakan interaksi Skyrme yang nonrelativistik telah mengusulkan Z = 126 sebagai sebuah kulit proton tertutup. Di wilayah tabel periodik ini, N = 184, N = 196, dan N = 228 telah diusulkan sebagai kulit neutron tertutup. Oleh karena itu, isotop yang paling menarik adalah 310126, 322126, dan 354126, karena mereka mungkin berumur jauh lebih lama daripada isotop lainnya. Unsur 126, yang memiliki jumlah proton ajaib, diperkirakan lebih stabil daripada unsur-unsur lain di wilayah ini, dan mungkin memiliki isomer nuklir dengan waktu paruh yang sangat panjang.[59] Mungkin juga pulau stabilitas malah berpusat di 306122, yang mungkin berbentuk bola dan ajaib ganda.[45]
Dengan mempertimbangkan deformasi nuklir dan efek relativistik, analisis tingkat partikel tunggal memprediksi bilangan ajaib baru untuk inti superberat pada Z = 126, 138, 154, dan 164 serta N = 228, 308, dan 318.[9][70] Oleh karena itu, selain pulau stabilitas yang berpusat di 291Cn, 293Cn,[25] dan 298Fl, pulau stabilitas lebih lanjut mungkin ada di sekitar bilangan ajaib ganda 354126 serta 472164 atau 482164.[71][72] Inti-inti ini diperkirakan beta-stabil dan meluruh melalui peluruhan alfa atau fisi spontan dengan waktu paruh yang relatif lama, dan memberikan stabilitas tambahan pada isoton N = 228 dan unsur 152–168, masing-masing.[90] Di sisi lain, analisis yang sama menunjukkan bahwa penutupan kulit proton mungkin relatif lemah atau bahkan tidak ada dalam beberapa kasus seperti 354126, yang berarti bahwa inti tersebut mungkin bukanlah ajaib ganda dan stabilitasnya akan ditentukan terutama oleh penutupan kulit neutron yang kuat.[70] Selain itu, karena gaya tolakan elektromagnetik yang jauh lebih besar yang harus diatasi oleh gaya kuat di pulau kedua (Z = 164),[91] ada kemungkinan bahwa inti di sekitar wilayah ini hanya eksis sebagai resonansi dan tidak dapat tetap bersama selama beberapa waktu. Ada juga kemungkinan bahwa beberapa superaktinida di antara deret ini mungkin tidak benar-benar eksis karena terlalu jauh dari kedua pulau,[91] dalam hal ini tabel periodik mungkin berakhir di sekitar Z = 130.[16]
Setelah unsur 164, garis fisilitas yang mendefinisikan batas stabilitas sehubungan dengan fisi spontan mungkin dapat menyatu dengan garis tetesan neutron, yang membatasi keberadaan unsur yang lebih berat.[90] Namun demikian, bilangan ajaib lebih lanjut telah diprediksi akan berada pada Z = 210, 274, dan 354 serta N = 308, 406, 524, 644, dan 772,[92] dengan dua inti ajaib ganda beta-stabil ditemukan pada 616210 dan 798274; metode perhitungan yang sama mereproduksi prediksi untuk 298Fl dan 472164. (Inti ajaib ganda yang diprediksi untuk Z = 354 adalah beta-tidak stabil, dengan 998354 kekurangan neutron dan 1126354 kaya akan neutron.) Meskipun stabilitas tambahan terhadap peluruhan alfa dan fisi adalah diprediksi untuk 616210 dan 798274, dengan waktu paruh hingga ratusan mikrodetik untuk 616210,[92] tidak akan ada pulau stabilitas yang signifikan seperti yang diprediksi pada Z = 114 dan 164. Karena keberadaan unsur superberat sangat bergantung pada efek stabilisasi dari kulit tertutup, ketidakstabilan nuklir dan fisi kemungkinan akan menentukan akhir dari tabel periodik di luar pulau stabilitas ini.[16][76][90]
Persatuan Kimia Murni dan Terapan Internasional (IUPAC) mendefinisikan bahwa suatu unsur dapat eksis jika masa hidupnya lebih lama dari 10−14 detik, yang merupakan waktu yang dibutuhkan inti untuk membentuk awan elektron. Namun, sebuah nuklida umumnya dianggap ada jika masa hidupnya lebih lama dari sekitar 10−22 detik, yang merupakan waktu yang diperlukan untuk membentuk struktur nuklir. Akibatnya adalah mungkin bahwa beberapa nilai Z hanya dapat diwujudkan dalam nuklida dan unsur yang sesuai tidak akan eksis.[85]
Ada kemungkinan juga bahwa tidak ada pulau lain yang benar-benar ada setelah 126, karena struktur kulit nuklir akan tercoreng (karena struktur kulit elektron diperkirakan sudah berada di sekitar oganeson) dan mode peluruhan berenergi rendah dapat tersedia.[93]
Sifat peluruhan yang diprediksi dari unsur yang belum ditemukan
Karena pulau stabilitas yang utama diperkirakan terletak di sekitar 291Cn dan 293Cn, unsur-unsur yang belum ditemukan setelah oganeson mungkin sangat tidak stabil dan mengalami peluruhan alfa atau fisi spontan dalam hitungan mikrodetik atau kurang. Wilayah yang tepat di mana waktu paruh melebihi satu mikrodetik tidaklah diketahui, meskipun berbagai model menunjukkan bahwa isotop unsur yang lebih berat daripada unbinilium yang dapat diproduksi dalam reaksi fusi dengan target dan proyektil yang tersedia akan memiliki waktu paruh di bawah satu mikrodetik, sehingga mereka mungkin tidak terdeteksi.[47] Secara konsisten diprediksi bahwa akan ada daerah stabilitas pada N = 184 dan N = 228, serta mungkin juga pada Z ~ 124 dan N ~ 198. Inti-inti ini mungkin memiliki waktu paruh beberapa detik dan mengalami peluruhan alfa dan fisi spontan yang dominan, meskipun cabang peluruhan beta plus (atau penangkapan elektron) kecil mungkin juga eksis.[94] Di luar daerah dengan stabilitas yang ditingkatkan ini, perintang fisi diperkirakan akan turun secara signifikan karena hilangnya efek stabilisasi, yang mengakibatkan waktu paruh fisi di bawah 10−18 detik, terutama pada inti genap–genap yang hambatannya bahkan lebih rendah karena pemasangan nukleon.[90] Secara umum, waktu paruh peluruhan alfa diperkirakan meningkat dengan jumlah neutron, dari hitungan nanodetik pada isotop yang paling kekurangan neutron hingga hitungan detik jika berada lebih dekat ke garis stabilitas beta.[36] Untuk inti dengan hanya beberapa neutron lebih dari bilangan ajaib, energi pengikatan turun secara substansial, mengakibatkan pemutusan tren dan waktu paruh yang lebih pendek.[36] Isotop yang paling kekurangan neutron dari unsur-unsur ini mungkin juga tidak terikat dan mengalami emisi proton. Peluruhan gugus (emisi partikel berat) juga telah diusulkan sebagai mode peluruhan alternatif untuk beberapa isotop,[95] menimbulkan rintangan lain untuk pengidentifikasian unsur-unsur ini.
Konfigurasi elektron
Berikut ini adalah konfigurasi elektron yang diperkirakan dari unsur 119–173 dan 184. Lambang [Og] menunjukkan kemungkinan konfigurasi elektron oganeson (Z = 118), yang saat ini merupakan unsur terakhir yang diketahui. Konfigurasi unsur-unsur dalam tabel ini ditulis dimulai dengan [Og] karena oganeson diperkirakan menjadi unsur terakhir dengan konfigurasi kulit tertutup (gas lengai), 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d10 7s2 7p6. Demikian pula, [172] in the configurations for elements 173 and 184 denotes the likely closed-shell configuration of element 172.
Setelah unsur 123, tidak ada perhitungan lengkap yang tersedia dan karenanya data dalam tabel ini harus dianggap tentatif.[16][73][96] Dalam kasus unsur 123, dan mungkin juga unsur yang lebih berat, beberapa kemungkinan konfigurasi elektron diprediksi memiliki tingkat energi yang sangat mirip, sehingga sangat sulit untuk memprediksi keadaan dasarnya. Semua konfigurasi yang telah diusulkan (sejak dipahami bahwa aturan Madelung mungkin berhenti bekerja di sini) disertakan.[96][66][97]
Penetapan blok yang diprediksi hingga 172 adalah prediksi Kulsha,[20] mengikuti orbital valensi yang tersedia yang diperkirakan. Namun, tidak ada konsensus dalam literatur tentang bagaimana blok harus bekerja setelah unsur 138.
Unsur kimia Blok Konfigurasi elektron yang diprediksi[15][16][73][17] 119 Uue Ununenium blok-s [Og] 8s1 120 Ubn Unbinilium blok-s [Og] 8s2 121 Ubu Unbiunium blok-g [Og] 8s2 8p11/2[66] 122 Ubb Unbibium blok-g [Og] 8s2 8p21/2[66]
[Og] 7d1 8s2 8p11/2123 Ubt Unbitrium blok-g [Og] 6f1 8s2 8p21/2[98]
[Og] 6f1 7d1 8s2 8p11/2[96][66]
[Og] 6f2 8s2 8p11/2
[Og] 8s2 8p21/2 8p13/2[96]124 Ubq Unbiquadium blok-g [Og] 6f2 8s2 8p21/2[66][98]
[Og] 6f3 8s2 8p11/2125 Ubp Unbipentium blok-g [Og] 6f4 8s2 8p11/2[66]
[Og] 5g1 6f2 8s2 8p21/2[98]
[Og] 5g1 6f3 8s2 8p11/2
[Og] 8s2 0,81(5g1 6f2 8p21/2) + 0,17(5g1 6f1 7d2 8p11/2) + 0,02(6f3 7d1 8p11/2)126 Ubh Unbiheksium blok-g [Og] 5g1 6f4 8s2 8p11/2[66]
[Og] 5g2 6f2 8s2 8p21/2[98]
[Og] 5g2 6f3 8s2 8p11/2
[Og] 8s2 0,998(5g2 6f3 8p11/2) + 0,002(5g2 6f2 8p21/2)127 Ubs Unbiseptium blok-g [Og] 5g2 6f3 8s2 8p21/2[66]
[Og] 5g3 6f2 8s2 8p21/2[98]
[Og] 8s2 0,88(5g3 6f2 8p21/2) + 0,12(5g3 6f1 7d2 8p11/2)128 Ubo Unbioktium blok-g [Og] 5g3 6f3 8s2 8p21/2[66]
[Og] 5g4 6f2 8s2 8p21/2[98]
[Og] 8s2 0,88(5g4 6f2 8p21/2) + 0,12(5g4 6f1 7d2 8p11/2)129 Ube Unbienium blok-g [Og] 5g4 6f3 7d1 8s2 8p11/2
[Og] 5g4 6f3 8s2 8p21/2[66][98]
[Og] 5g5 6f2 8s2 8p21/2
[Og] 5g4 6f3 7d1 8s2 8p11/2130 Utn Untrinilium blok-g [Og] 5g5 6f3 7d1 8s2 8p11/2
[Og] 5g5 6f3 8s2 8p21/2[66][98]
[Og] 5g6 6f2 8s2 8p21/2
[Og] 5g5 6f3 7d1 8s2 8p11/2131 Utu Untriunium blok-g [Og] 5g6 6f3 8s2 8p21/2[66][98]
[Og] 5g7 6f2 8s2 8p21/2
[Og] 8s2 0,86(5g6 6f3 8p21/2) + 0,14(5g6 6f2 7d2 8p11/2)132 Utb Untribium blok-g [Og] 5g7 6f3 8s2 8p21/2[98]
[Og] 5g8 6f2 8s2 8p21/2133 Utt Untritrium blok-g [Og] 5g8 6f3 8s2 8p21/2[98] 134 Utq Untriquadium blok-g [Og] 5g8 6f4 8s2 8p21/2[98] 135 Utp Untripentium blok-g [Og] 5g9 6f4 8s2 8p21/2[98] 136 Uth Untriheksium blok-g [Og] 5g10 6f4 8s2 8p21/2[98] 137 Uts Untriseptium blok-g [Og] 5g11 6f4 8s2 8p21/2[98] 138 Uto Untrioktium blok-g [Og] 5g12 6f4 8s2 8p21/2[98]
[Og] 5g12 6f3 7d1 8s2 8p21/2139 Ute Untrienium blok-g [Og] 5g13 6f3 7d1 8s2 8p21/2[98]
[Og] 5g13 6f2 7d2 8s2 8p21/2140 Uqn Unquadnilium blok-g [Og] 5g14 6f3 7d1 8s2 8p21/2[98]
[Og] 5g15 6f1 8s2 8p21/2 8p23/2141 Uqu Unquadunium blok-g [Og] 5g15 6f2 7d2 8s2 8p21/2[98] 142 Uqb Unquadbium blok-g [Og] 5g16 6f2 7d2 8s2 8p21/2[98] 143 Uqt Unquadtrium blok-f [Og] 5g17 6f2 7d2 8s2 8p21/2[98] 144 Uqq Unquadquadium blok-f [Og] 5g18 6f2 7d2 8s2 8p21/2[98]
[Og] 5g18 6f1 7d3 8s2 8p21/2
[Og] 5g17 6f2 7d3 8s2 8p21/2
[Og] 8s2 0,95(5g17 6f2 7d3 8p21/2) + 0,05(5g17 6f4 7d1 8p21/2)145 Uqp Unquadpentium blok-f [Og] 5g18 6f3 7d2 8s2 8p21/2[98] 146 Uqh Unquadheksium blok-f [Og] 5g18 6f4 7d2 8s2 8p21/2[98] 147 Uqs Unquadseptium blok-f [Og] 5g18 6f5 7d2 8s2 8p21/2[98] 148 Uqo Unquadoktium blok-f [Og] 5g18 6f6 7d2 8s2 8p21/2[98] 149 Uqe Unquadenium blok-f [Og] 5g18 6f6 7d3 8s2 8p21/2[98] 150 Upn Unpentnilium blok-f [Og] 5g18 6f6 7d4 8s2 8p21/2
[Og] 5g18 6f7 7d3 8s2 8p21/2[98]151 Upu Unpentunium blok-f [Og] 5g18 6f8 7d3 8s2 8p21/2[98] 152 Upb Unpentbium blok-f [Og] 5g18 6f9 7d3 8s2 8p21/2[98] 153 Upt Unpenttrium blok-f [Og] 5g18 6f10 7d3 8s2 8p21/2
[Og] 5g18 6f11 7d2 8s2 8p21/2[98]154 Upq Unpentquadium blok-f [Og] 5g18 6f11 7d3 8s2 8p21/2
[Og] 5g18 6f12 7d2 8s2 8p21/2[98]155 Upp Unpentpentium blok-f [Og] 5g18 6f12 7d3 8s2 8p21/2
[Og] 5g18 6f13 7d2 8s2 8p21/2[98]156 Uph Unpentheksium blok-f [Og] 5g18 6f13 7d3 8s2 8p21/2
[Og] 5g18 6f14 7d2 8s2 8p21/2[98]157 Ups Unpentseptium blok-d [Og] 5g18 6f14 7d3 8s2 8p21/2[98] 158 Upo Unpentoktium blok-d [Og] 5g18 6f14 7d4 8s2 8p21/2[98] 159 Upe Unpentenium blok-d [Og] 5g18 6f14 7d5 8s2 8p21/2
[Og] 5g18 6f14 7d4 8s2 8p21/2 9s1[98]160 Uhn Unheksnilium blok-d [Og] 5g18 6f14 7d6 8s2 8p21/2
[Og] 5g18 6f14 7d5 8s2 8p21/2 9s1[98]161 Uhu Unheksunium blok-d [Og] 5g18 6f14 7d7 8s2 8p21/2
[Og] 5g18 6f14 7d6 8s2 8p21/2 9s1[98]162 Uhb Unheksbium blok-d [Og] 5g18 6f14 7d8 8s2 8p21/2
[Og] 5g18 6f14 7d7 8s2 8p21/2 9s1[98]163 Uht Unhekstrium blok-d [Og] 5g18 6f14 7d9 8s2 8p21/2
[Og] 5g18 6f14 7d8 8s2 8p21/2 9s1[98]164 Uhq Unheksquadium blok-d [Og] 5g18 6f14 7d10 8s2 8p21/2[98] 165 Uhp Unhekspentium blok-d [Og] 5g18 6f14 7d10 8s2 8p21/2 9s1[98] 166 Uhh Unheksheksium blok-d [Og] 5g18 6f14 7d10 8s2 8p21/2 9s2[98] 167 Uhs Unheksseptium blok-p [Og] 5g18 6f14 7d10 8s2 8p21/2 9s2 9p11/2
[Og] 5g18 6f14 7d10 8s2 8p21/2 8p13/2 9s2[98]168 Uho Unheksoktium blok-p [Og] 5g18 6f14 7d10 8s2 8p21/2 9s2 9p21/2
[Og] 5g18 6f14 7d10 8s2 8p21/2 8p23/2 9s2[98]169 Uhe Unheksenium blok-p [Og] 5g18 6f14 7d10 8s2 8p21/2 8p13/2 9s2 9p21/2
[Og] 5g18 6f14 7d10 8s2 8p21/2 8p33/2 9s2[98]170 Usn Unseptnilium blok-p [Og] 5g18 6f14 7d10 8s2 8p21/2 8p23/2 9s2 9p21/2
[Og] 5g18 6f14 7d10 8s2 8p21/2 8p43/2 9s2[98]171 Usu Unseptunium blok-p [Og] 5g18 6f14 7d10 8s2 8p21/2 8p33/2 9s2 9p21/2
[Og] 5g18 6f14 7d10 8s2 8p21/2 8p43/2 9s2 9p11/2[98]172 Usb Unseptbium blok-p [Og] 5g18 6f14 7d10 8s2 8p21/2 8p43/2 9s2 9p21/2[98] 173 Ust Unsepttrium ? [172] 6g1
[172] 9p13/2... ... ... ... ... 184 Uoq Unoktquadium ? [172] 6g5 7f4 8d3
Lihat pula
Referensi
- ^ a b Seaborg, Glenn T. (26 Agustus 1996). "An Early History of LBNL". Diarsipkan dari versi asli tanggal 2010-11-15. Diakses tanggal 7 Agustus 2022.
- ^ a b Frazier, K. (1978). "Superheavy Elements". Science News. 113 (15): 236–238. doi:10.2307/3963006. JSTOR 3963006.
- ^ Unsur 122 diklaim muncul secara alami pada bulan April 2008, tetapi klaim ini telah diyakini salah secara luas. "Heaviest element claim criticised". Rsc.org. 2 Mei 2008. Diakses tanggal 7 Agustus 2022.
- ^ a b c d e f g h i j k l m n o p q r s t Fricke, B.; Greiner, W.; Waber, J. T. (1971). "The continuation of the periodic table up to Z = 172. The chemistry of superheavy elements". Theoretica Chimica Acta. 21 (3): 235–260. doi:10.1007/BF01172015.
- ^ "Kernchemie". www.kernchemie.de. Diakses tanggal 7 Agustus 2022.
- ^ Schiff, L. I.; Snyder, H.; Weinberg, J. (1940). "On the Existence of Stationary States of the Mesotron Field". Physical Review. 57 (4): 315–318. Bibcode:1940PhRv...57..315S. doi:10.1103/PhysRev.57.315.
- ^ Kragh, Helge (2018). From Transuranic to Superheavy Elements: A Story of Dispute and Creation. Springer. hlm. 6–10. ISBN 9783319758138.
- ^ a b c d e f g h Hoffman, D.C; Ghiorso, A.; Seaborg, G.T. (2000). The Transuranium People: The Inside Story. Imperial College Press. ISBN 978-1-86094-087-3.
- ^ a b Maly, J.; Walz, D.R. (1980). "Search for superheavy elements among fossil fission tracks in zircon" (PDF). Diakses tanggal 10 Agustus 2022.
- ^ a b c d e f g h i j k l m Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (edisi ke-New). New York, NY: Oxford University Press. hlm. 588. ISBN 978-0-19-960563-7.
- ^ a b Hofmann, Sigurd (2002). On Beyond Uranium. Taylor & Francis. hlm. 105. ISBN 978-0-415-28496-7.
- ^ a b c d Epherre, M.; Stephan, C. (1975). "Les éléments superlourds" (PDF). Le Journal de Physique Colloques (dalam bahasa Prancis). 11 (36): C5–159–164. doi:10.1051/jphyscol:1975541.
- ^ a b c d e f g h i j k Pyykkö, Pekka (2011). "A suggested periodic table up to Z≤ 172, based on Dirac–Fock calculations on atoms and ions". Physical Chemistry Chemical Physics. 13 (1): 161–8. Bibcode:2011PCCP...13..161P. doi:10.1039/c0cp01575j. PMID 20967377.
- ^ a b Seaborg, Glenn T. (sekitar 2006). "transuranium element (chemical element)". Encyclopædia Britannica. Diakses tanggal 10 Agustus 2022.
- ^ a b c d e f g h i j k l m n o p Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). "Transactinides and the future elements". Dalam Morss; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements (edisi ke-3). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 978-1-4020-3555-5.
- ^ a b c d e f g h i j k l m n o p q r s Fricke, Burkhard (1975). Superheavy elements: a prediction of their chemical and physical properties. Recent Impact of Physics on Inorganic Chemistry. Structure and Bonding. 21. hlm. 89–144. doi:10.1007/BFb0116498. ISBN 978-3-540-07109-9. Diakses tanggal 8 Agustus 2022.
- ^ a b c d Nefedov, V.I.; Trzhaskovskaya, M.B.; Yarzhemskii, V.G. (2006). "Electronic Configurations and the Periodic Table for Superheavy Elements" (PDF). Doklady Physical Chemistry. 408 (2): 149–151. doi:10.1134/S0012501606060029. ISSN 0012-5016.
- ^ a b c d e f g Kulsha, A. V. "Есть ли граница у таблицы Менделеева?" [Is there a boundary to the Mendeleev table?] (PDF). www.primefan.ru (dalam bahasa Rusia). Diakses tanggal 10 Agustus 2022.
- ^ "Есть ли граница у таблицы Менделеева? - Форум химиков".
- ^ a b "Feasible electron configurations of dications up to Z = 172". Diakses tanggal 11 Agustus 2022.
- ^ Lougheed, R.; et al. (1985). "Search for superheavy elements using 48Ca + 254Esg reaction". Physical Review C. 32 (5): 1760–1763. Bibcode:1985PhRvC..32.1760L. doi:10.1103/PhysRevC.32.1760. PMID 9953034.
- ^ Feng, Z; Jin, G.; Li, J.; Scheid, W. (2009). "Production of heavy and superheavy nuclei in massive fusion reactions". Nuclear Physics A. 816 (1): 33. arXiv:0803.1117
 . Bibcode:2009NuPhA.816...33F. doi:10.1016/j.nuclphysa.2008.11.003.
. Bibcode:2009NuPhA.816...33F. doi:10.1016/j.nuclphysa.2008.11.003.
- ^ Modern alchemy: Turning a line, The Economist, 12 Mei 2012.
- ^ a b c Superheavy Element Search Campaign at TASCA. J. Khuyagbaatar
- ^ a b c d e f g h i j Zagrebaev, Valeriy; Karpov, Alexander; Greiner, Walter (2013). "Future of superheavy element research: Which nuclei could be synthesized within the next few years?" (PDF). Journal of Physics. 420 (1): 012001. arXiv:1207.5700
 . Bibcode:2013JPhCS.420a2001Z. doi:10.1088/1742-6596/420/1/012001.
. Bibcode:2013JPhCS.420a2001Z. doi:10.1088/1742-6596/420/1/012001.
- ^ Khuyagbaatar, J.; Yakushev, A.; Düllmann, Ch. E.; et al. (2020). "Search for elements 119 and 120" (PDF). Physical Review C. 102 (6). 064602. Bibcode:2020PhRvC.102f4602K. doi:10.1103/PhysRevC.102.064602. Diakses tanggal 25 January 2021.
- ^ "Search for element 119: Christoph E. Düllmann for the TASCA E119 collaboration" (PDF). Diarsipkan dari versi asli (PDF) tanggal 4 Maret 2016. Diakses tanggal 7 Agustus 2022.
- ^ a b c d e Yakushev, A. (2012). "Superheavy Element Research at TASCA" (PDF). asrc.jaea.go.jp. Diakses tanggal 7 Agustus 2022.
- ^ "Scientists will begin experiments on the synthesis of element 119 in 2019". www.jinr.ru. JINR. 28 September 2016. Diakses tanggal 7 Agustus 2022.
"Penemuan unsur 115, 117 dan 118 adalah fakta yang sempurna; mereka ditempatkan dalam tabel periodik, meskipun nama mereka masih belum disebutkan dan akan dikonfirmasi hanya pada akhir tahun. Tabel Periodik D.I.Mendeleev tidaklah terbatas. Pada 2019, para ilmuwan akan memulai penyintesisan unsur 119 dan 120 yang merupakan dua unsur pertama dalam periode ke-8," ucap S.N. Dmitriev.
- ^ Dmitriev, Sergey; Itkis, Mikhail; Oganessian, Yuri (2016). Status and perspectives of the Dubna superheavy element factory (PDF). Nobel Symposium NS160 – Chemistry and Physics of Heavy and Superheavy Elements. doi:10.1051/epjconf/201613108001
 .
.
- ^ a b Ball, P. (2019). "Extreme chemistry: experiments at the edge of the periodic table". Nature. 565 (7741): 552–555. Bibcode:2019Natur.565..552B. doi:10.1038/d41586-019-00285-9
 . ISSN 1476-4687. PMID 30700884.
. ISSN 1476-4687. PMID 30700884.
- ^ "What it takes to make a new element". Chemistry World. Diakses tanggal 7 Agustus 2022.
- ^ "A New Block on the Periodic Table" (PDF). Lawrence Livermore National Laboratory. April 2007. Diarsipkan dari versi asli (PDF) tanggal 28 Mei 2008. Diakses tanggal 7 Agustus 2022.
- ^ Itkis, M. G.; Oganessian, Yu. Ts. (2007). "Synthesis of New Nuclei and Study of Nuclear Properties and Heavy-Ion Reaction Mechanisms". jinr.ru. Joint Institute for Nuclear Research. Diakses tanggal 7 Agustus 2022.
- ^ Chowdhury, P. Roy; Samanta, C.; Basu, D. N. (2008). "Search for long lived heaviest nuclei beyond the valley of stability". Physical Review C. 77 (4): 044603. arXiv:0802.3837
 . Bibcode:2008PhRvC..77d4603C. doi:10.1103/PhysRevC.77.044603.
. Bibcode:2008PhRvC..77d4603C. doi:10.1103/PhysRevC.77.044603.
- ^ a b c Chowdhury, R. P.; Samanta, C.; Basu, D.N. (2008). "Nuclear half-lives for α -radioactivity of elements with 100 ≤ Z ≤ 130". Atomic Data and Nuclear Data Tables. 94 (6): 781–806. arXiv:0802.4161
 . Bibcode:2008ADNDT..94..781C. doi:10.1016/j.adt.2008.01.003.
. Bibcode:2008ADNDT..94..781C. doi:10.1016/j.adt.2008.01.003.
- ^ a b Oganessian, Yu. Ts.; Utyonkov, V.; Lobanov, Yu.; Abdullin, F.; Polyakov, A.; Sagaidak, R.; Shirokovsky, I.; Tsyganov, Yu.; et al. (2009). "Attempt to produce element 120 in the 244Pu+58Fe reaction". Phys. Rev. C. 79 (2): 024603. Bibcode:2009PhRvC..79b4603O. doi:10.1103/PhysRevC.79.024603.
- ^ a b Hoffman, S.; et al. (2008). Probing shell effects at Z=120 and N=184 (Laporan). GSI Scientific Report. hlm. 131.
- ^ a b Hofmann, S.; Heinz, S.; Mann, R.; Maurer, J.; Münzenberg, G.; Antalic, S.; Barth, W.; Burkhard, H. G.; Dahl, L.; Eberhardt, K.; Grzywacz, R.; Hamilton, J. H.; Henderson, R. A.; Kenneally, J. M.; Kindler, B.; Kojouharov, I.; Lang, R.; Lommel, B.; Miernik, K.; Miller, D.; Moody, K. J.; Morita, K.; Nishio, K.; Popeko, A. G.; Roberto, J. B.; Runke, J.; Rykaczewski, K. P.; Saro, S.; Scheidenberger, C.; Schött, H. J.; Shaughnessy, D. A.; Stoyer, M. A.; Thörle-Popiesch, P.; Tinschert, K.; Trautmann, N.; Uusitalo, J.; Yeremin, A. V. (2016). "Review of even element super-heavy nuclei and search for element 120". The European Physical Journal A. 2016 (52): 180. Bibcode:2016EPJA...52..180H. doi:10.1140/epja/i2016-16180-4.
- ^ GSI (5 April 2012). "Searching for the island of stability". www.gsi.de. GSI. Diakses tanggal 7 Agustus 2022.
- ^ Adcock, Colin (2 Oktober 2015). "Weighty matters: Sigurd Hofmann on the heaviest of nuclei". JPhys+. Diakses tanggal 7 Agustus 2022.
- ^ Hofmann, S. (12 Mei 2015), "Search for isotopes of element 120 on the island of shn", Exotic Nuclei, WORLD SCIENTIFIC, hlm. 213–224, doi:10.1142/9789814699464_0023, ISBN 978-981-4699-45-7, diakses tanggal 7 Agustus 2022
- ^ Düllmann, C. E. (20 Oktober 2011). "Superheavy Element Research: News from GSI and Mainz". Diakses tanggal 7 Agustus 2022.
- ^ Siwek-Wilczyńska, K.; Cap, T.; Wilczyński, J. (April 2010). "How can one synthesize the element Z = 120?". International Journal of Modern Physics E. 19 (4): 500. Bibcode:2010IJMPE..19..500S. doi:10.1142/S021830131001490X.
- ^ a b c d e Kratz, J. V. (5 September 2011). The Impact of Superheavy Elements on the Chemical and Physical Sciences (PDF). 4th International Conference on the Chemistry and Physics of the Transactinide Elements. Diakses tanggal 8 Agustus 2022.
- ^ Hofmann, Sigurd (2014). On Beyond Uranium: Journey to the End of the Periodic Table. CRC Press. hlm. 105. ISBN 978-0415284950.
- ^ a b c Karpov, A; Zagrebaev, V; Greiner, W (2015). "Superheavy Nuclei: which regions of nuclear map are accessible in the nearest studies" (PDF). cyclotron.tamu.edu. Texas A & M University. Diakses tanggal 7 Agustus 2022.
- ^ a b see Flerov lab annual reports 2000–2004 inclusive http://www1.jinr.ru/Reports/Reports_eng_arh.html
- ^ a b Thomas, R.G.; Saxena, A.; Sahu, P.K.; Choudhury, R.K.; Govil, I.M.; Kailas, S.; Kapoor, S.S.; Barubi, M.; Cinausero, M.; Prete, G.; Rizzi, V.; Fabris, D.; Lunardon, M.; Moretto, S.; Viesti, G.; Nebbia, G.; Pesente, S.; Dalena, B.; D'Erasmo, G.; Fiore, E.M.; Palomba, M.; Pantaleo, A.; Paticchio, V.; Simonetti, G.; Gelli, N.; Lucarelli, F. (2007). "Fission and binary fragmentation reactions in 80Se+208Pb and 80Se+232Th systems". Physical Review C. 75 (2): 024604–1–024604–9. doi:10.1103/PhysRevC.75.024604. hdl:2158/776924
 .
.
- ^ Lodhi, M.A.K., ed. (March 1978). Superheavy Elements: Proceedings of the International Symposium on Superheavy Elements. Lubbock, Texas: Pergamon Press. ISBN 978-0-08-022946-1.
- ^ Audi, G.; Kondev, F.G.; Wang, M.; Huang, W.J.; Naimi, S. (2017). "The NUBASE2016 evaluation of nuclear properties" (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001. Diarsipkan dari versi asli (PDF) tanggal 2021-08-09. Diakses tanggal 2022-08-11.
- ^ a b Marinov, A.; Rodushkin, I.; Kolb, D.; Pape, A.; Kashiv, Y.; Brandt, R.; Gentry, R. V.; Miller, H. W. (2010). "Evidence for a long-lived superheavy nucleus with atomic mass number A=292 and atomic number Z=~122 in natural Th". International Journal of Modern Physics E. 19 (1): 131–140. arXiv:0804.3869
 . Bibcode:2010IJMPE..19..131M. doi:10.1142/S0218301310014662.
. Bibcode:2010IJMPE..19..131M. doi:10.1142/S0218301310014662.
- ^ Royal Society of Chemistry, "Klaim dari unsur terberat dikritik", Chemical World.
- ^ a b Marinov, A.; Rodushkin, I.; Kashiv, Y.; Halicz, L.; Segal, I.; Pape, A.; Gentry, R. V.; Miller, H. W.; Kolb, D.; Brandt, R. (2007). "Existence of long-lived isomeric states in naturally-occurring neutron-deficient Th isotopes". Phys. Rev. C. 76 (2): 021303(R). arXiv:nucl-ex/0605008
 . Bibcode:2007PhRvC..76b1303M. doi:10.1103/PhysRevC.76.021303.
. Bibcode:2007PhRvC..76b1303M. doi:10.1103/PhysRevC.76.021303.
- ^ R. C. Barber; J. R. De Laeter (2009). "Comment on 'Existence of long-lived isomeric states in naturally-occurring neutron-deficient Th isotopes'". Phys. Rev. C. 79 (4): 049801. Bibcode:2009PhRvC..79d9801B. doi:10.1103/PhysRevC.79.049801.
- ^ A. Marinov; I. Rodushkin; Y. Kashiv; L. Halicz; I. Segal; A. Pape; R. V. Gentry; H. W. Miller; D. Kolb; R. Brandt (2009). "Reply to "Comment on 'Existence of long-lived isomeric states in naturally-occurring neutron-deficient Th isotopes'"". Phys. Rev. C. 79 (4): 049802. Bibcode:2009PhRvC..79d9802M. doi:10.1103/PhysRevC.79.049802.
- ^ J. Lachner; I. Dillmann; T. Faestermann; G. Korschinek; M. Poutivtsev; G. Rugel (2008). "Search for long-lived isomeric states in neutron-deficient thorium isotopes". Phys. Rev. C. 78 (6): 064313. arXiv:0907.0126
 . Bibcode:2008PhRvC..78f4313L. doi:10.1103/PhysRevC.78.064313.
. Bibcode:2008PhRvC..78f4313L. doi:10.1103/PhysRevC.78.064313.
- ^ Marinov, A.; Rodushkin, I.; Pape, A.; Kashiv, Y.; Kolb, D.; Brandt, R.; Gentry, R. V.; Miller, H. W.; Halicz, L.; Segal, I. (2009). "Existence of Long-Lived Isotopes of a Superheavy Element in Natural Au" (PDF). International Journal of Modern Physics E. 18 (3): 621–629. arXiv:nucl-ex/0702051
 . Bibcode:2009IJMPE..18..621M. doi:10.1142/S021830130901280X. Diarsipkan dari versi asli (PDF) tanggal 14 Juli 2014. Diakses tanggal 7 Agustus 2022.
. Bibcode:2009IJMPE..18..621M. doi:10.1142/S021830130901280X. Diarsipkan dari versi asli (PDF) tanggal 14 Juli 2014. Diakses tanggal 7 Agustus 2022.
- ^ a b Emsley, John (2011). Nature's Building Blocks: An A–Z Guide to the Elements (edisi ke-New). New York: Oxford University Press. hlm. 592. ISBN 978-0-19-960563-7.
- ^ Petermann, I; Langanke, K.; Martínez-Pinedo, G.; Panov, I.V; Reinhard, P.G.; Thielemann, F.K. (2012). "Have superheavy elements been produced in nature?". European Physical Journal A. 48 (122): 122. arXiv:1207.3432
 . Bibcode:2012EPJA...48..122P. doi:10.1140/epja/i2012-12122-6.
. Bibcode:2012EPJA...48..122P. doi:10.1140/epja/i2012-12122-6.
- ^ Jason Wright (16 Maret 2017). "Przybylski's Star III: Neutron Stars, Unbinilium, and aliens". Diakses tanggal 7 Agustus 2022.
- ^ V. A. Dzuba; V. V. Flambaum; J. K. Webb (2017). "Isotope shift and search for metastable superheavy elements in astrophysical data". Physical Review A. 95 (6): 062515. arXiv:1703.04250
 . Bibcode:2017PhRvA..95f2515D. doi:10.1103/PhysRevA.95.062515.
. Bibcode:2017PhRvA..95f2515D. doi:10.1103/PhysRevA.95.062515.
- ^ Diarsipkan di Ghostarchive dan di Wayback Machine: SciShow Space (31 Juli 2018). "This Star Might Be Hiding Undiscovered Elements. Przybylski's Star". youtube.com. Diakses tanggal 7 Agustus 2022.
- ^ Waber, J. T. (1969). "SCF Dirac–Slater Calculations of the Translawrencium Elements". The Journal of Chemical Physics. 51 (2): 664. Bibcode:1969JChPh..51..664W. doi:10.1063/1.1672054.
- ^ Amador, Davi H. T.; de Oliveira, Heibbe C. B.; Sambrano, Julio R.; Gargano, Ricardo; de Macedo, Luiz Guilherme M. (12 September 2016). "4-Component correlated all-electron study on Eka-actinium Fluoride (E121F) including Gaunt interaction: Accurate analytical form, bonding and influence on rovibrational spectra". Chemical Physics Letters. 662: 169–175. Bibcode:2016CPL...662..169A. doi:10.1016/j.cplett.2016.09.025. hdl:11449/168956
 .
.
- ^ a b c d e f g h i j k l m Umemoto, Koichiro; Saito, Susumu (1996). "Electronic Configurations of Superheavy Elements". Journal of the Physical Society of Japan. 65 (10): 3175–9. Bibcode:1996JPSJ...65.3175U. doi:10.1143/JPSJ.65.3175. Diakses tanggal 11 Agustus 2022.
- ^ a b c d e Dongon, J.P.; Pyykkö, P. (2017). "Chemistry of the 5g elements. Relativistic calculations on hexafluorides". Angewandte Chemie International Edition. 56 (34): 10132–10134. doi:10.1002/anie.201701609. PMID 28444891.
- ^ Jacoby, Mitch (2006). "As-yet-unsynthesized superheavy atom should form a stable diatomic molecule with fluorine". Chemical & Engineering News. 84 (10): 19. doi:10.1021/cen-v084n010.p019a.
- ^ Makhyoun, M. A. (Oktober 1988). "On the electronic structure of 5g1 complexes of element 125: a quasi-relativistic MS-Xα study". Journal de Chimie Physique et de Physico-Chimie Biologique. 85 (10): 917–24. Bibcode:1988JCP....85..917M. doi:10.1051/jcp/1988850917.
- ^ a b c Koura, H.; Chiba, S. (2013). "Single-Particle Levels of Spherical Nuclei in the Superheavy and Extremely Superheavy Mass Region". Journal of the Physical Society of Japan. 82 (1): 014201. Bibcode:2013JPSJ...82a4201K. doi:10.7566/JPSJ.82.014201.
- ^ a b "Nuclear scientists eye future landfall on a second 'island of stability'". EurekAlert!. 6 April 2008. Diakses tanggal 8 Agustus 2022.
- ^ a b Grumann, Jens; Mosel, Ulrich; Fink, Bernd; Greiner, Walter (1969). "Investigation of the stability of superheavy nuclei aroundZ=114 andZ=164". Zeitschrift für Physik. 228 (5): 371–386. Bibcode:1969ZPhy..228..371G. doi:10.1007/BF01406719.
- ^ a b c Fricke, Burkhard (1977). "Dirac–Fock–Slater calculations for the elements Z = 100, fermium, to Z = 173" (PDF). Recent Impact of Physics on Inorganic Chemistry. 19: 83–192. Bibcode:1977ADNDT..19...83F. doi:10.1016/0092-640X(77)90010-9. Diakses tanggal 10 Agustus 2022.
- ^ Penneman, R. A.; Mann, J. B.; Jørgensen, C. K. (Februari 1971). "Speculations on the chemistry of superheavy elements such as Z = 164". Chemical Physics Letters. 8 (4): 321–326. Bibcode:1971CPL.....8..321P. doi:10.1016/0009-2614(71)80054-4.
- ^ Cwiok, S.; Heenen, P.-H.; Nazarewicz, W. (2005). "Shape coexistence and triaxiality in the superheavy nuclei". Nature. 433 (7027): 705–9. Bibcode:2005Natur.433..705C. doi:10.1038/nature03336. PMID 15716943.
- ^ a b Gambhir, Y. K.; Bhagwat, A.; Gupta, M. (2015). "The highest limiting Z in the extended periodic table". Journal of Physics G: Nuclear and Particle Physics. 42 (12): 125105. Bibcode:2015JPhG...42l5105G. doi:10.1088/0954-3899/42/12/125105.
- ^ a b c Philip Ball (November 2010). "Would element 137 really spell the end of the periodic table? Philip Ball examines the evidence". Chemistry World. Royal Society of Chemistry. Diakses tanggal 10 Agustus 2022.
- ^ Eisberg, R.; Resnick, R. (1985). Quantum Physics of Atoms, Molecules, Solids, Nuclei and Particles
 . Wiley. ISBN 9780471873730.
. Wiley. ISBN 9780471873730.
- ^ "Solution of the Dirac Equation for Hydrogen".
- ^ Bjorken, J. D.; Drell, S. D. (1964). Relativistic Quantum Mechanics
 . McGraw-Hill.
. McGraw-Hill.
- ^ Greiner, W.; Schramm, S. (2008). "Resource Letter QEDV-1: The QED vacuum". American Journal of Physics. 76 (6): 509. Bibcode:2008AmJPh..76..509G. doi:10.1119/1.2820395., dan referensi didalamnya
- ^ Wang, Yang; Wong, Dillon; Shytov, Andrey V.; Brar, Victor W.; Choi, Sangkook; Wu, Qiong; Tsai, Hsin-Zon; Regan, William; Zettl, Alex; Kawakami, Roland K.; Louie, Steven G.; Levitov, Leonid S.; Crommie, Michael F. (10 Mei 2013). "Observing Atomic Collapse Resonances in Artificial Nuclei on Graphene". Science. 340 (6133): 734–737. arXiv:1510.02890
 . Bibcode:2013Sci...340..734W. doi:10.1126/science.1234320. PMID 23470728.
. Bibcode:2013Sci...340..734W. doi:10.1126/science.1234320. PMID 23470728.
- ^ Indelicato, Paul; Bieroń, Jacek; Jönsson, Per (1 Juni 2011). "Are MCDF calculations 101% correct in the super-heavy elements range?". Theoretical Chemistry Accounts (dalam bahasa Inggris). 129 (3–5): 495–505. doi:10.1007/s00214-010-0887-3. hdl:2043/12984
 . ISSN 1432-881X.
. ISSN 1432-881X.
- ^ Reinhardt, Joachim; Greiner, Walter (2015). "Probing Supercritical Fields with Real and with Artificial Nuclei". Nuclear Physics: Present and Future. hlm. 195–210. doi:10.1007/978-3-319-10199-6_19. ISBN 978-3-319-10198-9.
- ^ a b Giuliani, S. A.; Matheson, Z.; Nazarewicz, W.; Olsen, E.; Reinhard, P.-G.; Sadhukhan, J.; Schtruempf, B.; Schunck, N.; Schwerdtfeger, P. (2019). "Colloquium: Superheavy elements: Oganesson and beyond". Reviews of Modern Physics. 91 (1): 011001–1–011001–25. Bibcode:2019RvMP...91a1001G. doi:10.1103/RevModPhys.91.011001.
- ^ Holdom, B.; Ren, J.; Zhang, C. (2018). "Quark matter may not be strange". Physical Review Letters. 120 (1): 222001–1–222001–6. arXiv:1707.06610
 . Bibcode:2018PhRvL.120v2001H. doi:10.1103/PhysRevLett.120.222001. PMID 29906186.
. Bibcode:2018PhRvL.120v2001H. doi:10.1103/PhysRevLett.120.222001. PMID 29906186.
- ^ Cheng-Jun, Xia; She-Sheng, Xue; Ren-Xin, Xu; Shan-Gui, Zhou (2020). "Supercritically charged objects and electron-positron pair creation". Physical Review D. 101 (10): 103031. arXiv:2001.03531
 . Bibcode:2020PhRvD.101j3031X. doi:10.1103/PhysRevD.101.103031.
. Bibcode:2020PhRvD.101j3031X. doi:10.1103/PhysRevD.101.103031.
- ^ Marcillac, Pierre de; Noël Coron; Gérard Dambier; Jacques Leblanc; Jean-Pierre Moalic (April 2003). "Experimental detection of α-particles from the radioactive decay of natural bismuth". Nature. 422 (6934): 876–878. Bibcode:2003Natur.422..876D. doi:10.1038/nature01541. PMID 12712201.
- ^ Considine, Glenn D.; Kulik, Peter H. (2002). Van Nostrand's scientific encyclopedia (edisi ke-9). Wiley-Interscience. ISBN 978-0-471-33230-5. OCLC 223349096.
- ^ a b c d Koura, H. (2011). Decay modes and a limit of existence of nuclei in the superheavy mass region (PDF). 4th International Conference on the Chemistry and Physics of the Transactinide Elements. Diakses tanggal 10 Agustus 2022.
- ^ a b Greiner, W. (2013). "Nuclei: superheavy-superneutronic-strange-and of antimatter" (PDF). Journal of Physics: Conference Series. 413 (1): 012002. Bibcode:2013JPhCS.413a2002G. doi:10.1088/1742-6596/413/1/012002
 .
.
- ^ a b Denisov, V. (2005). "Magic numbers of ultraheavy nuclei". Physics of Atomic Nuclei. 68 (7): 1133–1137. Bibcode:2005PAN....68.1133D. doi:10.1134/1.1992567.
- ^ Schwerdtfeger, Peter; Pašteka, Lukáš F.; Punnett, Andrew; Bowman, Patrick O. (2015). "Relativistic and quantum electrodynamic effects in superheavy elements". Nuclear Physics A. 944 (Desember 2015): 551–577. Bibcode:2015NuPhA.944..551S. doi:10.1016/j.nuclphysa.2015.02.005.
- ^ Palenzuela, Y. M.; Ruiz, L. F.; Karpov, A.; Greiner, W. (2012). "Systematic Study of Decay Properties of Heaviest Elements" (PDF). Bulletin of the Russian Academy of Sciences: Physics. 76 (11): 1165–1171. Bibcode:2012BRASP..76.1165P. doi:10.3103/S1062873812110172. ISSN 1062-8738.
- ^ Poenaru, Dorin N.; Gherghescu, R. A.; Greiner, W. (2012). "Cluster decay of superheavy nuclei". Physical Review C. 85 (3): 034615. Bibcode:2012PhRvC..85c4615P. doi:10.1103/PhysRevC.85.034615. Diakses tanggal 11 Agustus 2022.
- ^ a b c d van der Schoor, K. (2016). Electronic structure of element 123 (Tesis). Rijksuniversiteit Groningen. http://fse.studenttheses.ub.rug.nl/14531/1/report.pdf.
- ^ Indelicato, Paul; Bieroń, Jacek; Jönsson, Per (2011). "Are MCDF calculations 101% correct in the super-heavy elements range?". Theoretical Chemistry Accounts. 129 (3–5): 495–505. doi:10.1007/s00214-010-0887-3. hdl:2043/12984
 .
.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax "Archived copy". www.primefan.ru. Diarsipkan dari versi asli tanggal 5 Maret 2016. Diakses tanggal 11 Agustus 2022.
Bacaan lebih lanjut
- Kaldor, U. (2005). "Superheavy Elements—Chemistry and Spectroscopy". Encyclopedia of Computational Chemistry. doi:10.1002/0470845015.cu0044. ISBN 978-0470845011.
- Seaborg, G. T. (1968). "Elements Beyond 100, Present Status and Future Prospects". Annual Review of Nuclear Science. 18: 53–152. Bibcode:1968ARNPS..18...53S. doi:10.1146/annurev.ns.18.120168.000413
 .
. - Scerri, Eric. (2011). A Very Short Introduction to the Periodic Table, Oxford University Press, Oxford. ISBN 978-0-19-958249-5.
Pranala luar
- Holler, Jim. "Images of g-orbitals". University of Kentucky. Diarsipkan dari versi asli tanggal 2021-02-11. Diakses tanggal 11 Agustus 2022.
- Rihani, Jeries A. "The extended periodic table of the elements". Diakses tanggal 11 Agustus 2022.
- Scerri, Eric. "Eric Scerri's website for the elements and the periodic table". Diakses tanggal 11 Agustus 2022.




