Logam berat
Logam berat umumnya didefinisikan sebagai logam dengan densitas, berat atom, atau nomor atom tinggi. Kriteria yang digunakan, dan jika metaloid disertakan, bervariasi tergantung pada penulis dan konteksnya. Dalam metalurgi, misalnya, logam berat dapat didefinisikan berdasarkan kerapatan, sedangkan pada fisika, kriteria pembeda adalah nomor atom, sementara kimiawan kemungkinan akan lebih memperhatikan sifat kimia zatnya. Definisi yang lebih spesifik telah dipublikasikan, namun tidak satu pun yang diterima secara luas. Definisi yang disurvei dalam artikel ini mencakup 96 dari 118 unsur kimia yang diketahui; hanya raksa, timbal dan bismut yang memenuhi semua kriteria. Terlepas dari kurang kesepakatnya ini, istilah tersebut (jamak atau tunggal) banyak digunakan dalam sains. Densitas lebih dari 5 g/cm3 kadang-kadang dikutip sebagai kriteria yang umum digunakan dalam batang tubuh artikel ini.
Logam yang paling awal dikenal—logam biasa seperti besi, tembaga, dan timah, dan logam mulia seperti perak, emas, dan platina—adalah logam berat. Sejak tahun 1809 dan seterusnya, ditemukan logam ringan, seperti magnesium, aluminium, dan titanium, dan juga logam berat yang kurang terkenal termasuk galium, talium, dan hafnium.
Beberapa logam berat ada yang merupakan nutrisi esensial (biasanya besi, kobalt, dan seng), atau relatif tidak berbahaya (seperti ruthenium, perak, dan indium), tetapi dapat beracun dalam jumlah besar atau dalam bentuk tertentu. Logam berat lainnya, seperti kadmium, raksa, dan timbal, sangat beracun. Sumber potensi keracunan logam berat antara lain limbah penambangan dan industri, limpasan pertanian, paparan kerja, dan cat serta pengawetan kayu.
Karakterisasi fisika dan kimia logam berat harus dilakukan dengan hati-hati, karena logam yang terlibat tidak selalu didefinisikan dengan baik. Selain relatif padat, logam berat cenderung kurang reaktif daripada logam yang lebih ringan dan memiliki sulfida dan hidroksida terlarut yang jauh lebih sedikit. Meskipun relatif mudah untuk mengenali logam berat seperti tungsten dari logam yang lebih ringan seperti natrium, beberapa logam berat seperti seng, raksa, dan timbal memiliki karakteristik logam yang lebih ringan, sebaliknya logam yang lebih ringan seperti berilium, skandium, dan titanium memiliki beberapa karakteristik logam berat.
Logam berat relatif langka di kerak bumi tetapi hadir dalam banyak aspek kehidupan modern. Mereka digunakan pada tongkat golf, mobil, antiseptik, oven yang dapat membersihkan sendiri, plastik, panel surya, telepon genggam, dan pemercepat partikel.
Definisi
| Peta panas logam berat dalam tabel periodik | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||
| 1 | H | He | ||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||
| 6 | Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||||||||||||
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||||||||||||
| ||||||||||||||||||||||||||||
| Tabel ini menunjukkan jumlah kriteria logam berat yang cocok untuk masing-masing logam, dari sepuluh kriteria yang tercantum dalam bagian ini yaitu dua berdasarkan kepadatan, tiga pada berat atom, dua pada nomor atom, dan tiga pada perilaku kimia.[n 1] Ini mengilustrasikan kurangnya kesepakatan yang menyelimuti konsep, dengan kemungkinan perkecualian raksa, timbal dan bismut. Enam unsur di penghujung periode (baris) 4 sampai 7 kadang-kadang dianggap metaloid dan diperlakukan di sini sebagai logam, termasuk di antaranya adalah germanium (Ge), arsenik (As), selenium (Se), antimon (Sb), telurium (Te), dan astatin (At).[15][n 2] Oganesson (Og) diperlakukan sebagai nonlogam. Logam yang ditandai dengan garis putus-putus (atau untuk At dan Fm-Ts, diprediksi) mempunyai densitas lebih dari 5 g/cm3. | ||||||||||||||||||||||||||||
Tidak ada kesepakatan luas tentang kriteria berdasarkan definisi logam berat. Makna yang berbeda-beda dapat disematkan pada istilah tersebut, tergantung konteksnya. Dalam metalurgi, misalnya, logam berat didefinisikan berdasarkan densitas,[16] sementara dalam fisika, kriteria pembedanya adalan nomor atom,[17] dan kimiawan lebih suka mendefinisikannya dengan perilaku kimianya.[9]
Rentang kriteria densitas dari di atas 3,5 g/cm3 hingga di atas 7 g/cm3.[2] Definisi berat atom dapat memiliki rentang mulai lebih besar daripada natrium (berat atom 22,98);[2] lebih besar daripada 40 (kecuali logam blok-s dan -f, artinya dimulai dari skandium);[3] atau lebih dari 200, yaitu mulai dari raksa dan seterusnya.[4] Nomor atom logam berat umumnya lebih besar daripada 20 (kalsium);[2] kadang-kadang dibatasi hinga 92 (uranium).[5] Definisi berdasarkan nomor atom telah dikritisi dengan memasukkan logam dengan densitas rendah. Misalnya, rubidium yang termasuk golongan (kolom) 1 pada tabel periodik memiliki nomor atom 37 tetapi densitasnya hanya 1,532 g/cm3, yang artinya di bawah nilai ambang bawah yang digunakan oleh penulis lain.[18] Masalah yang sama dapat terjadi dengan definisi berdasarkan berat atom.[19]
Kriteria berdasarkan perilaku kimia atau posisi tabel periodik telah lama digunakan atau diusulkan. United States Pharmacopeia memasukkan suatu pengujian logam berat yang melibatkan pengendapan ketakmurnian logam sebagai sulfida berwarnanya."[6][n 3] Pada tahun 1997, Stephen Hawkes, guru besar kimia yang menulis dalam konteks pengalaman lima puluh tahun dengan istilah logam berat, menyatakan sebagai:
"logam yang membentuk sulfida dan hidroksida tak larut, yang garamnya menghasilkan larutan berwarna dalam air, dan yang senyawa kompleksnya biasanya berwarna"
Berdasarkan logam yang dirujuknya sebagai logam berat, ia menyarankan lebih bermanfaat untuk mendefinisikan mereka sebagai (secara umum) seluruh logam dalam tabel periodik kolom ke-3 hingga 16 yang berada pada baris 4 dan seterusnya, dengan kata lain, logam transisi dan logam pasca transisi adalah logam berat.[9][n 4] Lantanida dapat memenuhi penjelasan tiga bagian Hawkes; tetapi status aktinida tidak sepenuhnya mapan;[n 5][n 6]
Dalam biokimia, logam berat kadang-kadang didefinisikan—berdasarkan perilaku asam Lewis (akseptor pasangan elektron) ion mereka dalam laruta akuatik—sebagai logam kelas B dan garis batas.[40] Dalam skema ini, ion logam kelas A lebih menyukai donor oksigen; ion kelas B memilih donor nitrogen atau belerang; dan ion perbatasan atau ambivalen menunjukkan karakteristik kelas A atau B, tergantung situasinya.[n 7] Logam kelas A, yang cenderung memiliki elektronegativitas rendah dan membentuk ikatan dengan karakter ion yang besar, adalah logam alkali dan alkali tanah, aluminium, logam golongan 3, dan lantanida serta aktinida.[n 8] Logam kelas B, yang cenderung memiliki elektronegativitas lebih tinggi dan membentuk ikatan dengan karakter kovalen yang cukup besar, terutama adalah logam transisi dan logam pasca-transisi yang lebih berat. Logam garis batas sebagian besar terdiri dari logam transisi dan pasca-transisi yang lebih ringan (ditambah arsenik dan antimon). Perbedaan antara logam kelas A dan dua kategori lainnya cukup tajam.[44] Proposal yang sering dikutip[n 9] untuk menggunakan kategori klasifikasi ini daripada[10] nama logam berat yang lebih menggugah belum banyak diadopsi.[46]
Daftar logam berat berdasarkan densitas
Densitas di atas 5 g/cm3 kadang-kadang disebut sebagai faktor pendefinisi logam berat secara umum[47] dan, dengan tidak adanya definisi yang bulat, digunakan untuk mengisi daftar ini serta (kecuali jika dinyatakan lain) sebagai patokan dalam artikel ini. Metaloid yang memenuhi kriteria logam berat—arsen dan antimon misalnya—kadang kala diperhitungkan sebagai logam berat, terutama dalam kimia lingkungan,[48] seperti dalam kasus ini. Selenium (densitas 8 g/cm3)[49] juga termasuk dalam daftar. Ia sedikit di bawah kriteria kerapatan dan kurang dikenal sebagai metaloid,[15] tetapi memiliki sifat kelarutan dalam dan reaktivitas dengan air yang serupa dengan arsen dan antimon dalam beberapa hal.[50] Logam lain kadang diklasifikasikan atau diperlakukan sebagai logam "berat", seperti berilium[51] (densitas 1,8 g/cm3), aluminium[51] (2,7 g/cm3), kalsium[52] (1,55 g/cm3),[53] dan barium[52] (3,6 g/cm3)[54] di sini diuji sebagai logam ringan dan, secara umum, tidak lagi dianggap.
| Diproduksi oleh pertambangan komersial (diklasifikasikan secara informal berdasarkan kepentingan ekonomi) | |||||||||
|
|||||||||
|
| ||||||||
|
| ||||||||
|
|||||||||
| Diproduksi melalui transmutasi buatan (Diklasifikasikan secara informal berdasarkan stabilitas) | |||||||||
|
|||||||||
|
|||||||||
| |||||||||
Asal dan penggunaan istilah
Seberapa berat logam yang terbentuk secara alami seperti emas, tembaga, dan besi mungkin telah diperhatikan sejak masa prasejarah dan, mengingat kelenturannya, mencetuskan usaha pertama untuk menciptakan ornamen, alat, dan senjata logam.[61] Semua logam yang ditemukan sejak saat itu sampai 1809 memiliki kerapatan yang relatif tinggi; seberapa berat mereka dianggap sebagai kriteria yang sangat berbeda.[62]
Sejak 1809 dan seterusnya, logam ringan seperti natrium, kalium, dan strontium diisolasi. Densitas mereka yang rendah menantang pemikiran konvensional dan diusulkan untuk menyebut mereka sebagai metaloid (artinya "menyerupai logam dalam bentuk maupun penampilan").[63] Saran ini diabaikan; unsur baru kemudian dikenali sebagai logam, dan istilah metaloid kemudian digunakan untuk merujuk pada unsur non-logam dan, kemudian, untuk unsur yang sulit dijelaskan sebagai logam atau non-logam.[64]
Penggunaan awal istilah "logam berat" berasal dari tahun 1817, ketika kimiawan Jerman Leopold Gmelin membagi unsur-unsur ke dalam kelompok nonlogam, logam ringan, dan logam berat.[65] Logam ringan memiliki densitas 0,860-5,0 g/cm3; logam berat 5,308-22,000.[66][n 10] Istilah ini kemudian dikaitkan dengan unsur-unsur dengan berat atom atau nomor atom tinggi.[18] Kadang-kadang istilah ini digunakan secara bergantian dengan istilah unsur berat. Misalnya, dalam membahas sejarah kimia nuklir, Magee[67] mencatat bahwa aktinida itu pernah dianggap mewakili kelompok transisi elemen berat yang baru sedangkan Seaborg beserta rekan kerjanya, "menyukai ... suatu deret seperti logam-berat-tanah langka ...". Dalam astronomi, unsur berat adalah unsur yang lebih berat daripada hidrogen dan helium.[68]
Kritik
Pada tahun 2002, toksikolog Skotlandia John Duffus meninjau kembali definisi yang telah digunakan selama 60 tahun dan menyimpulkan bahwa definisi tersebut begitu beragam sehingga secara efektif membuat istilah itu tidak berarti.[69] Seiring dengan temuan ini, status logam berat beberapa logam terkadang ditentang dengan alasan bahwa mereka terlalu ringan, atau terlibat dalam proses biologis, atau jarang membahayakan lingkungan. Contohnya antara lain skandium (terlalu ringan);[18][70] vanadium hingga seng (terlibat proses biologis);[71] dan rhodium, indium, serta osmium (terlalu langka).[72]
Popularitas
Meski memiliki makna yang dipertanyakan, referensi tentang istilah logam berat muncul secara teratur dalam literatur ilmiah. Sebuah penelitian tahun 2010 menemukan bahwa hal itu telah semakin banyak digunakan dan tampaknya telah menjadi bagian dari bahasa sains.[73] Istilah tersebut dikatakan sebagai istilah yang dapat diterima, mengingat kenyamanan dan keakrabannya, asalkan disertai dengan definisi yang ketat.[40] Rekanan logam berat, logam ringan, disinggung oleh The Minerals, Metals and Materials Society termasuk "aluminium, magnesium, berilium, titanium, litium, dan logam reaktif lainnya."[74] Logam-logam tersebut memiliki kerapatan 0,534 sampai 4,54 g/cm3.
Peran biologis
| Unsur | Miligram[75] | |
|---|---|---|
| Besi | 4000 | |
| Seng | 2500 | |
| Timbal[n 11] | 120 | |
| Tembaga | 70 | |
| Timah[n 12] | 30 | |
| Vanadium | 20 | |
| Kadmium | 20 | |
| Nikel[n 13] | 15 | |
| Selenium | 14 | |
| Mangan | 12 | |
| Lain-lain[n 14] | 200 | |
| Total | 7000 | |
Sejumlah renik beberapa logam berat, sebagian besar berada pada periode 4, diperlukan untuk proses biologis tertentu. Logam tersebut adalah besi dan tembaga (untuk transportasi oksigen dan elektron); kobalt (sintesis kompleks dan metabolisme sel); seng (hidroksilasi);[80] vanadium dan mangan (fungsi dan pengatur enzim); kromium (pemanfaatan glukosa); nikel (reproduksi sel); arsenik (pertumbuhan metabolik pada beberapa hewan dan mungkin pada manusia) dan selenium (fungsi antioksidan dan produksi hormon).[81] Periode 5 dan 6 mengandung lebih sedikit logam berat esensial, selaras dengan pola umum bahwa unsur yang lebih berat cenderung kurang melimpah dan unsur-unsur langka cenderung kurang penting dalam hal nutrisi.[82] Dalam periode 5, molibdenum diperlukan sebagai katalis dalam reaksi redoks; kadmium kadang-kadang digunakan oleh beberapa diatom laut untuk fungsi yang sama; dan timah mungkin diperlukan untuk pertumbuhan sedikit spesies.[83] Pada periode 6, tungsten diperlukan oleh beberapa arkea dan bakteri untuk proses metabolisme.[84] Tubuh manusia dengan berat rata-rata 70 kg mengandung sekitar 0,01% logam berat (~7 g, ekivalen dengan berat dua kacang polong kering, yang terdiri dari besi sekitar 4 g, seng 2,5 g, dan timbal 0,12 g), 2% logam ringan (~1,4 kg, setara berat botol anggur) dan hampir 98% nonlogam (sebagian besar air).[85][n 15]
Defisiensi logam berat esensial periode 4-6 ini dapat meningkatkan kerentanan terhadap keracunan logam berat.[86] Sebagian kecil logam berat non-esensial juga telah diamati memiliki efek biologis. Galium, germanium (suatu metaloid), indium, dan sebagian besar lantanida dapat menstimulasi metabolisme, sedangkan titanium meningkatkan pertumbuhan pada tanaman,[87] (meski tidak selalu dianggap sebagai logam berat).
Toksisitas
- Fokus bagian ini terutama pada efek toksik logam berat yang lebih serius, termasuk kanker, kerusakan otak atau kematian, dan bukan bahaya yang dapat menyebabkan salah satu dari kulit, paru-paru, perut, ginjal, hati, atau jantung. Untuk informasi lebih spesifik, lihat Toksisitas logam, Logam berat beracun, atau artikel masing-masing unsur atau senyawa.
Logam berat sering dianggap sangat beracun atau merusak lingkungan.[88] Memang ada beberapa, sementara beberapa lainnya beracun jika dan hanya jika dikonsumsi berlebihan atau ditemui dalam bentuk tertentu.
Logam berat lingkungan
Kromium, arsenik, kadmium, merkuri, dan timbal memiliki potensi terbesar yang dapat menyebabkan kerusakan karena penggunaannya yang luas, toksisitas beberapa bentuk gabungan atau unsurnya, dan penyebarannya yang luas di lingkungan.[89] Kromium heksavalen, misalnya, sangat beracun seperti uap raksa dan banyak senyawa raksa.[90] Kelima unsur ini memiliki affinitas yang kuat terhadap belerang; dalam tubuh manusia mereka biasanya terikat pada enzim, melalui gugus tiol (-SH), yang bertanggung jawab untuk mengendalikan laju reaksi metabolik. Ikatan belerang-logam yang dihasilkan menghambat fungsi enzim yang terlibat; memperburuk kesehatan manusia, kadang-kadang berakibat fatal.[91] Kromium (dalam bentuk heksavalennya) dan arsenik adalah karsinogen; kadmium menyebabkan penyakit tulang degeneratif; dan raksa dan timbal merusak sistem saraf pusat
-
Kristal kromium
dan kubus 1 cm3 -
Arsenik, disegel dalam
wadah untuk menghentikan pemudaran -
Batangan kadmium
dan kubus 1 cm3 -
-
Timbal adalah kontaminan logam berat yang paling umum.[92] Tingkatannya di lingkungan perairan masyarakat industri diperkirakan dua sampai tiga kali tingkatan di masa pra-industri.[93] Sebagai komponen tetraetil timbal, (CH''";, timbal digunakan secara luas dalam bensin selama tahun 1930-1970-an.[94] Meskipun penggunaan bensin bertimbal sudah lenyap dari bumi Amerika Utara pada tahun 1996, tanah di sekitar jalan yang dibangun sebelum masa ini mengandung timbal dalam konsentrasi tinggi.[95] Penelitian terakhir menunjukkan korelasi statistik yang signifikan antara laju penggunaan bensin bertimbal dan tingkat kriminalitas dengan kekerasan di Amerika Serikat; dengan memperhitungkan jeda waktu 22 tahun (untuk usia rata-rata kriminal dengan kekerasan), kurva kejahatan dengan kekerasan sebanding dengan kurva paparan timbal.[96]
Logam berat lainnya yang dicatat untuk sifat potensi bahayanya, biasanya sebagai polutan toksik lingkungan, termasuk mangan (kerusakan sitem saraf pusat);[97] kobalt dan nikel (karsinogen);[98] tembaga,[99] seng,[100] selenium[101] dan perak[102] (gangguan endokrin, kelainan bawaan, atau efek keracunan umum pada ikan, tumbuhan, unggas, atau organisme air lainnya); timah, sebagai organotimah (kerusakan sistem saraf pusat);[103] antimon (ditengarai karsinogen);[104] dan talium (kerusakan sistem saraf pusat).[99][n 16][n 17]
Logam berat nutrisi esensial
Logam berat yang penting untuk kehidupan bisa menjadi racun jika dikonsumsi berlebihan; beberapa memiliki bentuk beracun yang sangat penting. Vanadium pentoksida (V) bersifat karsinogenik pada hewan dan, bila dihirup, menyebabkan kerusakan DNA.[99] Ion ungu permanganat MnO–4 adalah racun liver dan ginjal.[108] Menelan lebih dari 0,5 gram zat besi dapat menyebabkan gagal jantung; Overdosis semacam itu paling sering terjadi pada anak-anak dan bisa berakibat kematian dalam waktu 24 jam.[99] Nikel karbonil (Ni), dengan kadar 30 ppm, dapat menyebabkan kegagalan pernafasan, kerusakan otak dan kematian.[99] Mengkonsumsi 1 gram atau lebih tembaga sulfat (Cu(SO''";) dapat berakibat fatal; korban selamat mungkin mengalami kerusakan organ yang parah.[109] Lebih dari lima miligram selenium sangat beracun; ini kira-kira sepuluh kali dari asupan harian maksimum yang direkomendasikan (0,45 mg);[110] keracunan jangka panjang bisa mengakibatkan efek paralitik.[99][n 18]
Logam berat lainnya
Beberapa logam berat non-esensial memiliki satu atau lebih bentuk yang beracun. Kegagalan dan fatalitas ginjal telah tercatat timbul dari konsumsi suplemen germannium (konsumsi total ~15 hingga 300 g selama periode dua bulan hingga tiga tahun).[99] Paparan osmium tetroksida (OsO) dapat menyebabkan kerusakan mata permanen dan memicu kegagalan respirasi[112] serta kematian.[113] Garam indium beracun jika dikonsumsi lebih dari beberapa miligram dan akan berdampak pada ginjal, liver, dan jantung.[114] Cisplatin (PtCl), yang merupakan obat penting yang digunakan untuk membunuh sel kanker, juga merupakan racun bagi ginjal dan saraf.[99] Senyawa bismut dapat menyebabkan kerusakan liver jika dikonsumsi berlebih; senyawa uranium yang tidak larut, serta radiasi berbahaya yang dipancarkannya, dapat menyebabkan kerusakan ginjal permanen.[115]
Sumber paparan
Logam berat dapat menurunkan kualitas udara, air, dan tanah, dan kemudian menyebabkan masalah kesehatan bagi tanaman, hewan, dan manusia, ketika terjadi penumpukan sebagai hasil aktivitas industri.[116] Sumber logam berat yang umum dalam konteks ini meliputi aktivitas pertambangan dan limbah industri; gas buang kendaraan; baterai asam timbal; pupuk; cat; dan kayu olahan;[117] infrastruktur pasokan air yang sudah tua;[118] dan mikroplastik yang terapung di samudera dunia.[119] Contoh terkini kontaminasi logam berat dan risiko kesehatan meliputi kasus penyakit Minamata, Jepang (1932-1968; tuntutan hukum tahun 2016);[120] bencana bendungan Bento Rodrigues di Brazil,[121] kandungan timbal yang tinggi pada pasokan air minum kepada penduduk Flint, Michigan, di timur laut Amerika Serikat.[122]
Pembentukan, kelimpahan, keterjadian, dan ekstraksi
| Logam berat dalam kerak bumi: | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| kelimpahan dan kemunculan atau sumber utama[n 19] | |||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 1 | H | He | |||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||
| 6 | Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | ||||
| 7 | |||||||||||||||||||
| Ce | Pr | Nd | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||||
| Th | U | ||||||||||||||||||
Paling melimpah (56.300 ppm berat)
|
Jarang (0,01–0,99 ppm)
| ||||||||||||||||||
Melimpah (100–999 ppm)
|
Langka (0,0001–0,0099 ppm)
| ||||||||||||||||||
Tidak umum (1–99 ppm)
|
|||||||||||||||||||
| Logam berat di sebelah kiri garis pemisah terjadi (atau bersumber) terutama sebagai litofili; yang di sebelah kanan, sebagai kalkofili kecuali emas (siderofili) dan timah (litofili). | |||||||||||||||||||
Logam berat sampai sekitar besi (dalam tabel periodik) sebagian besar terbentuk melalui nukleosintesis bintang. Dalam proses ini, unsur yang lebih ringan mulai dari hidrogen hingga silikon mengalami reaksi fusi berturut-turut di dalam bintang, melepaskan cahaya dan panas dan membentuk unsur yang lebih berat dengan nomor atom yang lebih tinggi.[126]
Logam berat yang lebih berat biasanya tidak terbentuk melalui cara ini karena reaksi fusi yang melibatkan inti tersebut akan lebih mengkonsumsi energi daripada melepaskan energi.[127] Sebaliknya, sebagian besar disintesis (dari unsur dengan nomor atom yang lebih rendah) melalui penangkapan neutron, dengan dua moda utama penangkapan berulang ini adalah proses s dan proses r. Dalam proses s ("s" singkatan dari "slow", lambat), tangkapan tunggal dipisahkan oleh tahun atau dekade, sehingga inti yang tidak stabil mengalami peluruhan beta,[128] Sementara dalam proses r ("rapid", cepat), tangkapan terjadi lebih cepat daripada peluruhan nuklir. Oleh karena itu, proses s membutuhkan jalur yang kurang lebih jelas: sebagai contoh, inti kadmium-110 yang stabil dibombardir secara berturut-turut oleh neutron bebas di dalam bintang sampai membentuk inti kadmium-115 yang tidak stabil dan meluruh membentuk indium-115 (yang hampir stabil, dengan waktu paruh 30.000 kali usia alam semesta). Inti ini menangkap neutron dan membentuk indium-116, yang tidak stabil, dan meluruh membentuk timah-116, dan seterusnya.[126][129][n 20] Sebaliknya, tidak ada jalur seperti itu dalam proses r. Proses s berhenti di bismut karena dua unsur berikutnya, polonium dan astatin, memiliki waktu paruh pendek, yang meluruh menjadi bismut atau timbal. Proses r sangat cepat sehingga bisa melewati zona ketidakstabilan ini dan terus membentuk unsur yang lebih berat seperti thorium dan uranium.[131]
Logam berat memadat di planet-planet sebagai hasil proses evolusi dan destruksi bintang. Bintang kehilangan sebagian besar massa mereka saat terlontar di akhir masa hidup mereka, dan kadang-kadang, sebagai hasil penggabungan bintang neutron,[132][n 21] akan meningkatkan kelimpahan unsur yang lebih berat daripada helium di media antar bintang. Ketika daya tarik gravitasi menyebabkan materi ini menyatu dan runtuh, terbentuklah bintang dan planet baru.[134]
Kerak bumi terbuat dari kira-kira 5% logam berat, dengan 95%nya (dari 5% tersebut) adalah besi. Sedangkan 95% sisanya adalah logam ringan (~20%) dan non-logam (~75%).[123] Meskipun logam berat secara keseluruhan langka, ia dapat terkonsentrasi dalam jumlah yang dapat diekstraksi secara ekonomis akibat pembentukan gunung, erosi, atau proses geologi lainnya.[135]
Logam berat terutama ditemukan sebagai litofil (kecenderungan menyatu dengan batu) atau kalkofil (kecenderungan menyatu dengan mineral). Logam berat litofil terutama adalah unsur-unsur blok-f dan blok-d yang lebih reaktif. Mereka memiliki afinitas yang kuat terhadap oksigen dan sebagian besar berada sebagai mineral silikat dengan densitas relatif rendah.[136] Logam berat kalkofil terutama adalah unsur-unsur blok d yang kurang reaktif, dan logam blok-p periode 4-6 serta metaloid. Mereka biasanya ditemukan dalam mineral sulfida yang tidak larut. Kalkofil lebih padat daripada litofil, sehingga tenggelam lebih rendah ke dalam kerak pada saat pemadatannya, ia cenderung kurang melimpah dibandingkan dengan litofil.[137]
Di sisi lain, emas adalah unsur siderofil, atau cenderung menyatu dengan besi. Ia tidak mudah membentuk senyawa dengan oksigen maupun belerang.[138] Pada saat pembentukan bumi, dan sebagai logam yang paling mulia (inert), emas tenggelam ke dalam inti karena kecenderungannya untuk membentuk logam paduan densitas tinggi. Konsekuensinya, ini adalah logam yang relatif langka.[139] Beberapa logam berat (kurang) mulia lainnya—molibdenum, rhenium, logam golongan platina (ruthenium, rhodium, paladium, osmium, iridium, dan platina), germanium, dan timah—dapat diperhitungkan sebagai siderofil tapi hanya dalam hal kejadian utama mereka di bumi (inti, mantel, dan kerak), bukan kerak bumi. Logam-logam ini dinyatakan terjadi di kerak bumi, dalam jumlah kecil, terutama sebagai kalkofil (jarang yang berada dalam bentuk aslinya).[140][n 22]
Konsentrasi logam berat di bawah kerak bumi umumnya lebih tinggi, sebagian besar ditemukan dalam inti besi-silikon-nikel. Platina, misalnya, menyusun sekitar 1 bagian per miliar kerak sedangkan konsentrasinya pada intinya diperkirakan hampir 6.000 kali lebih tinggi.[141][142] Spekulasi terkini menunjukkan bahwa uranium (dan torium) dalam inti bumi dapat menghasilkan panas dalam jumlah besar yang mendorong lempeng tektonik dan (akhirnya) menopang medan magnet bumi.[143][n 23]
Untuk memperoleh logam berat dari bijihnya cukup kompleks karena harus memperhatikan jenis bijih, sifat kimia logam yang terlibat, dan nilai ekonomis dari berbagai metode ekstraksi yang tersedia. Negara dan pengolahan yang berbeda mungkin menggunakan proses yang berbeda, termasuk yang berbeda dari yang dikupas di sini.
Secara garis besar, dan dengan beberapa pengecualian, logam berat litofil dapat diekstraksi dari bijihnya dengan memberi perlakuan listrik atau kimia, sedangkan logam berat kalkofil diperoleh dengan memanggang bijih sulfida mereka untuk menghasilkan oksida yang sesuai, dan kemudian memanaskannya untuk mendapatkan logam mentah.[145][n 24] Radium terjadi dalam jumlah yang terlalu kecil untuk ditambang ekonomis malah dapat diperoleh dari pemakaian bahan bakar nuklir.[148] Kalkofil logam golongan platina (PGM) terutama terjadi dalam jumlah kecil (campuran) dengan bijih kalkofil lainnya. Bijih yang terlibat perlu dilebur, dipanggang, lalu dilindi (leaching) dengan asam sulfat untuk menghasilkan residu PGM. Ini kemudian disuling secara kimia untuk mendapatkan masing-masing logam dalam bentuk murni mereka.[149] Dibandingkan logam lainnya, PGM relatif mahal karena kelangkaannya[150] dan biaya produksinya yang tinggi.[151]
Emas, suatu siderofil, paling umum diperoleh dengan melarutkan bijihnya dalam larutan sianida.[152] Emas membentuk disianoaurat(I), misalnya:
Seng ditambahkan ke dalam campuran dan, karena lebih reaktif daripada emas, mengusir emas:
- 2 [Au(CN)2] + Zn → K] + 2 Au.
Emas mengendap dalam larutan sebagai lumpur, dan dipisahkan dari larutannya dengan cara disaring, kemudian dilelehkan.[153]
Sifat logam berat dibandingkan dengan logam ringan
Beberapa sifat fisika dan kimia umum logam ringan dan berat dirangkum dalam tabel di bawah. Perbandingannya harus dicermati dengan hati-hati karena istilah logam ringan dan logam berat tidak selalu didefinisikan secara konsisten. Selain itu, sifat fisika kekerasan dan kekuatan tarik dapat sangat bervariasi tergantung pada kemurnian, ukuran butir dan perlakuan awal.[154]
| Sifat fisika | Logam ringan | Logam berat |
|---|---|---|
| Densitas | Biasanya lebih rendah | Biasanya lebih tinggi |
| Kekerasan[155] | Cenderung lunak, mudah dipotong atau ditekuk | Sebagian besar cukup keras |
| Ekspansivitas termal[156] | Sebagian besar lebih tinggi | Sebagian besar lebih rendah |
| Titik lebur | Sebagian besar rendah[157] | Rendah sampai yang sangat tinggi[158] |
| Kekuatan tarik[159] | Sebagian besar lebih rendah | Sebagian besar lebih tinggi |
| Sifat kimia | Logam ringan | Logam berat |
| Lokasi Tabel periodik | Paling banyak ditemukan dalam golongan 1 dan 2[160] | Hampir semua ditemukan dalam golongan 3 sampai 16 |
| Kelimpahan dalam kerak bumi[123][161] | Lebih melimpah | Kurang melimpah |
| Keterjadian (atau sumber) utama | Litofil[125] | Litofil atau kalkofils (Au adalah suatu siderofil) |
| Reaktivitas[74][161] | Lebih reaktif | Kurang reaktif |
| Sulfida | Dapat larut sampai tak larut[n 25] | Sangat tidak dapat larut[166] |
| Hidroksida | Dapat larut sampai tak larut[n 26] | Umumnya tidak dapat larut[170] |
| Garam[163] | Sebagian besar membentuk larutan tak berwarna dalam air | Sebagian besar membentuk larutan berwarna dalam air |
| Kompleks | Sebagian besar tak berwarna[171] | Sebagian besar berwarna[172] |
| Peran biologis[173] | Termasuk makronutrien (Na, Mg, K, Ca) | Termasuk mikronutrien (V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo) |
Sifat ini membuatnya relatif mudah untuk membedakan logam ringan seperti natrium dari logam berat seperti tungsten, namun perbedaannya menjadi kurang jelas pada daerah perbatasan. Logam struktural ringan seperti berilium, skandium, dan titanium memiliki beberapa karakteristik logam berat, seperti titik leleh yang lebih tinggi;[n 27] logam berat pasca-transisi seperti seng, kadmium, dan timbal memiliki beberapa karakteristik logam ringan, seperti relatif lunak, memiliki titik lebur yang lebih rendah,[n 28] dan membentuk kompleks yang tidak berwarna.[20][22][23]
Penggunaan
Logam berat hadir di hampir semua aspek kehidupan modern. Besi mungkin yang paling umum karena menyumbang 90% dari semua logam olahan. Platina bisa jadi yang paling banyak dijumpai, atau digunakan untuk memproduksi, 20% dari semua barang konsumsi[178]
Beberapa penggunaan logam berat yang umum bergantung pada karakteristik umum logam seperti konduktivitas listrik dan reflektivitas atau karakteristik umum logam berat seperti densitas, kekuatan, dan daya tahan. Kegunaan lainnya bergantung pada karakteristik unsur tertentu, seperti peran biologisnya sebagai nutrisi atau racun atau beberapa sifat atom tertentu lainnya. Contoh sifat atom tersebut meliputi: orbital d atau f yang terisi sebagian (dalam banyak logam berat transisi, lantanida, dan aktinida) yang memungkinkan pembentukan senyawa berwarna;[179] kapasitas sebagian besar ion logam berat (seperti platina,[180] serium[181] atau bismut[182]) ada di tingkat oksidasi yang berbeda dan oleh karena itu bertindak sebagai katalis;[183] orbital 3d atau 4f yang tumpangsuh (dalam besi, kobal, dan nikel, atau logam berat lantanida dari europium sampai thulium) yang menimbulkan efek magnetik;[184] dan jumlah atom dan kerapatan elektron yang tinggi yang mendukung aplikasi sains nuklir.[185] Penggunaan logam berat yang umum dapat dikelompokkan secara luas ke dalam enam kategori berikut.[186][n 29]
Berdasarkan berat atau densitas

Beberapa penggunaan logam berat, termasuk di bidang olahraga, teknik mesin, persenjataan militer, dan teknik nuklir, memanfaatkan kerapatan mereka yang relatif tinggi. Dalam dunia penyelaman, timbal digunakan sebagai ballast;[188] dalam pacuan kuda cacat masing-masing kuda harus membawa timbal dengan bobot yang telah ditentukan, berdasarkan faktor termasuk kinerja sebelumnya, sehingga dapat mengimbangi peluang berbagai pesaing.[189] Dalam golf, sisipan tungsten, kuningan, atau tembaga pada tongkat golf (club) untuk fairway menurunkan pusat gravitasi club sehingga memudahkan untuk melayangkan bola ke udara;[190] dan bola golf dengan inti tungsten diklaim memiliki karakteristik layang yang lebih baik.[191] Dalam fly fishing,[n 30] umpan lalat memiliki lapisan PVC yang dicampur dengan bubuk tungsten, sehingga mereka tenggelam pada tingkat yang dibutuhkan.[192] Dalam olahraga lapangan, bola baja yang digunakan dalam event lontar martil dan tolak peluru diisi dengan timbal untuk mencapai berat minimum yang dibutuhkan berdasarkan peraturan internasional.[193] Tungsten digunakan dalam bola lontar martil setidaknya sampai tahun 1980; ukuran bola minimum meningkat pada tahun 1981 untuk menghilangkan kebutuhan akan logam mahal (tiga kali lipat biaya martil lainnya) yang umumnya tidak tersedia di semua negara.[194] Martil tungsten sangat padat sehingga mereka menembus terlalu dalam ke rumput.[195]
Dalam teknik mesin, logam berat digunakan untuk pemberat di kapal,[196] pesawat terbang,[197] dan kendaraan bermotor;[198] atau pada penyeimbang pada roda dan crankshaft,[199] giroskop, dan baling-baling,[200] serta kopling sentrifugal, dalam situasi yang membutuhkan berat maksimum dalam ruang minimum (misalnya dalam penggerak arloji).[197]
Semakin tinggi kerapatan proyektil, semakin efektif daya tembusnya pada pelat baja yang berat;... Os, Ir, Pt, dan Re ... mahal ... U menawarkan kombinasi yang menarik antara kepadatan tinggi, biaya terjangkau dan ketangguhan fraktur yang tinggi.
AM Russell and KL Lee
Structure–property relations
in nonferrous metals (2005, p. 16)
Dalam persenjataan militer, tungsten atau uranium digunakan dalam pelapisan perisai tempur[201] dan proyektil pembobol perisai,[202] serta senjata nuklir untuk meningkatkan efisiensi (dengan merefleksikan neutron dan sesaat menunda perluasan bahan reaksi).[203] Pada tahun 1970-an, tantalum ditemukan lebih efektif daripada tembaga untuk shaped charge dan senjata anti-perisai bentukan ledakan (bahasa Inggris: explosively formed anti-armour weapons) karena kerapatannya yang lebih tinggi, yang memungkinkan konsentrasi gaya yang lebih besar, dan deformabilitas yang lebih baik.[204] Logam berat yang kurang beracun, seperti tembaga, timah, tungsten, dan bismut, dan mungkin juga mangan (dan juga boron, metaloid), telah menggantikan timbal dan antimon dalam peluru hijau yang digunakan oleh beberapa tentara dan dalam beberapa amunisi tembak-tembakan rekreasi.[205] Keraguan telah diajukan tentang keamanan (atau kredensial hijau) tungsten.[206]
Karena bahan yang lebih padat menyerap lebih banyak emisi radioaktif daripada yang ringan, logam berat berguna sebagai perisai radiasi dan memusatkan sinar radiasi pada akselerator linier dan aplikasi radioterapi.[207]
Berdasarkan kekuatan atau daya tahan

Kekuatan atau daya tahan logam berat seperti kromium, besi, nikel, tembaga, seng, molibdenum, timah, tungsten, dan timbal, serta paduannya, membuat mereka berguna untuk pembuatan artefak seperti alat, mesin,[210] peralatan rumah tangga[211] perabotan,[212] pipa,[211] rel kereta,[213] gedung[214] dan jembatan,[215] mobil,[211] kunci,[216] furnitur,[217] kapal,[196] pesawat terbang,[218] koin[219] dan perhiasan.[220] Mereka juga digunakan sebagai aditif paduan untuk meningkatkan sifat logam lainnya.[n 32] Dari dua lusin unsur, hanya dua yang telah digunakan dalam mata uang monetisasi dunia, karbon dan aluminium, bukan logam berat.[222][n 33] Emas, perak, dan platina digunakan dalam perhiasan[n 34] seperti nikel, tembaga, indium, dan kobalt dalam emas berwarna.[225] Perhiasan imitasi dan mainan anak mungkin terbuat dari logam berat, pada tingkat yang signifikan, seperti kromium, nikel, kadmium, atau timbal.[226]
Tembaga, seng, timah, dan timbal adalah logam yang secara mekanis lebih lemah namun memiliki sifat pencegahan korosi yang berguna. Sementara masing-masing akan bereaksi dengan udara, dihasilkan patina dari berbagai macam garam tembaga,[227] seng karbonat, timah oksida, atau campuran timbal oksida, karbonat, dan sulfat, memberikan sifat perlindungan yang berharga.[228] Oleh karena itu, tembaga dan timbal digunakan untuk, misalnya bahan atap;[229][n 35] seng bertindak sebagai zat anti korosi dalam baja galvanisir;[230] dan timah bertindak sebagai fungsi yang sama pada kaleng baja.[231]
Daya tahan dan ketahanan korosi besi dan kromium dapat ditingkatkan dengan penambahan gadolinium; hambatan rayapan nikel ditingkatkan dengan penambahan thorium. Telurium ditambahkan ke paduan tembaga dan baja untuk meningkatkan kemampuan mesin; dan untuk membuatnya lebih keras dan lebih tahan asam.[232]
Biologi dan kimia

Efek biosida beberapa logam berat telah dikenal sejak zaman purba.[234] Platina, osmium, tembaga, rutenium, dan logam berat lainnya, termasuk arsenik, digunakan dalam perawatan anti kanker, atau menunjukkan potensi untuk itu.[235] Antimon (anti-protozoa), bismut (anti tukak), emas (anti artritis), dan besi (anti malaria), juga penting untuk pengobatan.[236] Tembaga, seng, perak, emas, atau raksa digunakan dalam formulasi antiseptik;[237] sejumlah kecil beberapa logam berat digunakan untuk mengendalikan pertumbuhan alga, misalnya, menara pendingin.[238] Bergantung pada penggunaan yang dimaksudkan sebagai pupuk atau biosida, agrokimia mungkin mengandung logam berat seperti kromium, kobalt, nikel, tembaga, seng, arsen, kadmium, raksa, atau timbal.[239]
Logam berat yang dipilih digunakan sebagai katalis dalam pengolahan bahan bakar (renium, misalnya), produksi karet dan serat sintetis (bismut), alat kontrol emisi (paladium), dan dalam oven swaresik (di mana cerium(IV) oksida di dinding oven semacam itu membantu mengoksidasi residu memasak berbasis karbon).[240] Dalam kimia sabun, logam berat membentuk sabun yang tidak larut yang digunakan dalam gemuk pelumas, pengering cat, dan fungisida (terlepas dari litium, logam alkali dan ion amonium yang membentuk sabun yang dapat larut).[241]
Pewarnaan dan optik

Warna kaca, glazur keramik, cat, pigmen, dan plastik umumnya diproduksi dengan memasukkan logam berat (atau senyawanya) seperti kromium, mangan, kobalt, tembaga, seng, selenium, zirkonium, molibdenum, perak, timah, praseodimium, neodimium, erbium, tungsten, iridium, emas, timbal, atau uranium.[243] Tinta tattoo mungkin mengandung logam berat, seperti kromium, kobalt, nikel, dan tembaga.[244] Reflektivitas tinggi beberapa logam berat penting dalam konstruksi cermin, termasuk instrumen astronomi yang presisi. Reflektor lampu bergantung pada pantulan yang sangat baik dari film tipis rhodium.[245]
Elektronik, magnet, dan pencahayaan

Logam berat atau senyawanya dapat ditemukan di komponen elektronik, elektroda, dan kabel serta panel surya di mana mereka dapat digunakan sebagai konduktor, semikonduktor, atau isolator. Bubuk molibdenum digunakan dalam tinta papan sirkuit.[246] Anoda titanium bersalut ruthenium(IV) oksida digunakan dalam industri produksi klorin.[247] Sistem kelistrikan rumah sebagian besar dihubungkan dengan kawat tembaga karena konduktivitasnya yang baik.[248] Perak dan emas digunakan dalam perangkat listrik dan elektronik, terutama pada tombol on/off, karena konduktivitas listriknya yang tinggi dan kapasitasnya untuk menahan atau meminimalkan pembentukan kotoran pada permukaannya.[249] Semikonduktor kadmium telurida dan galium arsenida digunakan untuk membuat panel surya. Hafnium oksida, isolator, digunakan sebagai pengontrol tegangan dalam mikrochip; tantalum oksida, isolator lain, digunakan pada kapasitor dalam ponsel.[250] Logam berat telah digunakan dalam baterai selama lebih dari 200 tahun, setidaknya sejak Alessandro Volta menemukan tumpukan volta tembaga dan peraknya pada tahun 1800.[251] Prometium, lantanum, dan raksa adalah contoh lebih lanjut yang ditemukan pada baterai atom, nickel-metal hidrida, dan baterai arloji.[252]
Magnet terbuat dari logam berat seperti mangan, besi, kobalt, nikel, niobium, bismut, praseodimium, neodimium, gadolinium, dan disprosium. Magnet neodimium adalah jenis magnet permanen paling kuat yang tersedia secara komersial. Mereka adalah komponen kunci, misalnya kunci pintu mobil, starter motor, pompa bahan bakar, dan power window.[253]
Logam berat digunakan di pencahayaan, laser, dan diode pancaran cahaya (light-emitting diode, LED). Tampilan layar datar menggabungkan film tipis penghantar listrik indium timah oksida. Lampu fluorescent bergantung pada uap raksa untuk beroperasi. Laser ruby menghasilkan sinar merah tajam dengan mengeksitasi atom kromium; lantanida juga banyak digunakan untuk laser. Galium, indium, dan arsen;[254] serta tembaga, iridium, dan platinum digunakan dalam LED (yang tiga terakhir dalam LED organik).[255]
Nuklir
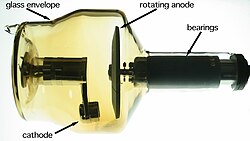
Penggunaan niché logam berat dengan nomor atom tinggi terdapat pada pencitraan diagnostik, mikroskopi elektron, dan teknik nuklir. Dalam pencitraan diagnostik, logam berat seperti kobalt atau tungsten membentuk bahan anoda yang dijumpai dalam tabung sinar-X.[259] Dalam mikroskopi elektron, logam berat seperti timbal, emas, paladium, platina, atau uranium digunakan untuk membuat salutan konduktif dan untuk memasukkan kerapatan elektron ke spesimen biologis dengan cara pewarnaan, pewarnaan negatif, atau deposisi vakum.[260] Dalam teknik nuklir, inti logam berat seperti kromium, besi, atau seng kadang-kadang ditembakkan pada target logam berat lainnya untuk menghasilkan unsur superberat;[261] logam berat juga digunakan sebagai target spalasi untuk produksi neutron[262] atau radioisotop seperti astatine (menggunakan timbal, bismut, thorium, atau uranium dalam kasus terakhir).[263]
Catatan
- ^ Kriteria yang digunakan adalah densitas:[2] (1) di atas 3,5 g/cm3; (2) di atas 7 g/cm3; berat atom: (3) > 22,98;[2] (4) > 40 (kecuali logam blok-s dan -f);[3] (5) > 200;[4] nomor atom: (6) > 20; (7) 21–92;[5] perilaku kimia: (8) United States Pharmacopeia;[6][7][8] (9) Definisi berdasarkan tabel periodik Hawkes (tidak termasuk lantanida dan aktinida);[9] dan (10) Klasifikasi biokimia Nieboer and Richardson.[10] Densitas unsur terutama dirujuk dari Emsley.[11] Digunakan prediksi densitas untuk At, Fr dan Fm–Ts.[12] Densitas indikatif diturunkan untuk Fm, Md, No dan Lr berdasarkan berat atom mereka, estimasi jari-jari logam,[13] dan prediksi struktur kristal.[14] Berat atom dirujuk dari Emsley.,[11] dalam penutup belakang
- ^ Namun, metaloid dikeluarkan dari definisi berdasarkan tabel periodik Hawkes, dan ia memberi catatan "tidak perlu untuk menentukan apakah semilogam (yaitu metaloid) harus dimasukkan sebagai logam berat."[9]
- ^ Pengujian tidak spesifik untuk logam tertentu, tetapi dikatakan mampu sekurang-kurangnya mendeteksi Mo, Cu, Ag, Cd, Hg, Sn, Pb, As, Sb, dan Bi.[7] Bagaimanapun juga, ketika pengujian menggunakan hidrogen sulfida sebagai pereaksi, ia tidak dapat mendeteksi Th, Ti, Zr, Nb, Ta, atau Cr.[8]
- ^ Logam transisi dan pasca transisi yang tidak selalu membentuk kompleks berwarna adalah Sc dan Y di golongan 3;[20] Ag di golongan 11;[21] Zn dan Cd di golongan 12;[20][22] dan logam-logam golongan 13–16.[23]
- ^ Sulfida dan hidroksida lantanida (Ln) tidak larut;[24] yang terakhir dapat diperoleh dari larutan akuatik garam Ln sebagai endapan gelatin berwarna;[25] dan kompleks Ln memiliki warna yang sama dengan ion akuanya (yang mayoritas berwarna).[26] Sulfida aktinida (An) mungkin larut atau tidak larut, tergantung penulisnya. Uranium monosulfida divalen tidak diserang oleh air mendidih.[27] Ion aktinida trivalen berperilaku mirip dengan ion lantanida trivalen, sehingga sulfidanya masih mungkin tidak larut tetapi hal ini tidak dinyatakan secara jelas.[28] Sulfida An tetravalen terdekomposisi,[29] tetapi Edelstein et al. menyatakan bahwa mereka dapat larut;[30] sementara Haynes menyatakan thorium(IV) sulfida tidak larut.[31] Di awal sejarah fisi nuklir, telah dinyatakan bahwa pengendapan dengan hidrogen sulfida adalah cara yang "luar biasa" efektif untuk mengisolasi dan mendeteksi unsur transuranium dalam larutan.[32] Dengan nada yang sama, Deschlag menulis bahwa unsur-unsur setelah uranium diperkirakan mempunyai sulfida tak larut yang analog dengan logam transisi baris ketiga. Tetapi, ia melanjutkan bahwa unsur setelah aktinium ditemukan memiliki sifat yang berbeda dari logam transisi dan menyatakan mereka tidak membentuk sulfida tak larut.[33] Namun, hidroksida An tidak larut[30] dan dapat diendapkan dari larutan akuatik garamnya.[34] Akhirnya, banyak kompleks An memiliki warna "dalam dan cerah".[35]
- ^ Unsur yang lebih berat yang dikenal sebagai metaloid—Ge; As, Sb; Se, Te, Po; At—memenuhi beberapa dari tiga definisi Hawkes. Seluruhnya memiliki sulfida tak larut[34][36] tetapi hanya Ge, Te, dan Po yang tampaknya memiliki hidroksida tak larut yang efektif.[37] Seluruh batang At dapat diperoleh sebagai endapan (sulfida) berwarna dari larutan akuatik garamnya;[34] astatin tampaknya mengendap dari larutannya dengan hidrogen sulfida tetapi, karena At tidak pernah disintesis dalam jumlah yang layak, warna endapat tidak diketahui.[36][38] Sebagai unsur blok-p, kompleks mereka biasanya tak berwarna.[39]
- ^ Terminologi kelas A dan B analog dengan terminologi "asam keras" dan "basa lunak" yang kadang-kadang digunakan untuk merujuk perilaku ion logam sistem anorganik.[41]
- ^ Be dan Al adalah pengecualian untuk tren umum ini. Mereka memiliki nilai elektronegativitas yang lebih tinggi.[42] Karena ukurannya yang relatif kecil, ion +2 dan +3 mereka memiliki kerapatan muatan yang tinggi, sehingga mempolarisasi awan elektron di sekitarnya. Hasil bersihnya adalah bahwa senyawa Be dan Al memiliki karakter kovalen.[43]
- ^ Google Scholar has recorded lebih dari 900 kutipan untuk makalah yang dimaksud.[45]
- ^ Jika Gmelin telah bekerja dengan ukuran sistem bobot imperial, mungkin dia memilih 300 lbs/ft3 sebagai cutoff logam ringan/beratnya dimana selenium (densitas 300,27 lbs/ft3) akan dibuat sebagai patokan, sementara 5 g/cm3 = 312,14 lbs/ft3.
- ^ Timbal, yang merupakan racun kumulatif, memiliki kelimpahan yang relatif tinggi karena penggunaan historisnya yang luas dan pembuangan yang disebabkan manusia ke lingkungan.[76]
- ^ Haynes menunjukkan jumlah <17 mg untuk timah[77]
- ^ Iyengar mencatat angka 5 mg untuk nikel;[78] Haynes menunjukkan jumlah 10 mg[77]
- ^ Mencakup 45 logam berat yang terjadi dalam jumlah kurang dari 10 mg masing-masing, termasuk As (7 mg), Mo (5), Co (1,5), dan Cr (1,4)[79]
- ^ Dari unsur-unsur yang umum dikenal sebagai metaloid, B dan Si dihitung sebagai non-logam; Ge, As, Sb, dan Te sebagai logam berat.
- ^ Ni, Cu, Zn, Se, Ag dan Sb terdaftar dalam Daftar Polutan Beracun yang diterbitkan oleh Pemerintah Amerika Serikat;[105] Mn, Co, dan Sn terdaftar dalam Inventaris Polutan Nasional yang diterbitkan oleh Pemerintah Australia.[106]
- ^ Tungsten bisa jadi logam berat beracun lainnya.[107]
- ^ Selenium logam berat esensial bagi mamalia yang paling beracun.[111]
- ^ Unsur renik yang memiliki kelimpahan setara atau kurang dari satu bagian per triliun (sebut saja Tc, Pm, Po, At, Ra, Ac, Pa, Np, dan Pu) tidak ditampilkan. Kelimpahan berasal dari Lide[123] dan Emsley;[124] sedangkan tipe keterjadian dari McQueen.[125]
- ^ Dalam beberapa kasus, misalnya dengan adanya sinar gamma energi tinggi atau dalam suatu lingkungan kaya hidrogen pada suhu sangat tinggi, inti subjek dapat mengalami kehilangan neutron atau menarik proton yang menghasilkan (relatif jarang) isotop yang kekurangan neutron.[130]
- ^ Pelontatan materi ketika dua bintang neutron bertabrakan dikaitkan dengan interaksi gaya Tidal, kemungkinan gangguan kerak bumi, dan guncangan akibat panas (itulah yang terjadi jika Anda meletakkan akselerator ke dalam mobil saat mesin masih dingin).[133]
- ^ Besi, kobalt, nikel, germanium dan timah juga merupakan siderophiles dari perspektif Bumi secara keseluruhan.[125]
- ^ Panas yang keluar dari inti padat bagian dalam diyakini bisa menghasilkan gerakan di bagian luar, yang terbuat dari paduan besi cair. Gerakan cairan ini menghasilkan arus listrik yang menimbulkan medan magnet.[144]
- ^ Logam berat yang terjadi secara alami dalam jumlah yang terlalu kecil untuk ditambang secara ekonomis (Tc, Pm, Po, At, Ac, Np dan Pu), diproduksi melalui transmutasi buatan.[146] Metode yang terakhir ini juga digunakan untuk menghasilkan logam berat dari americium dan seterusnya.[147]
- ^ Sulfida logam golongan 1 dan 2, serta aluminium, dihidrolisis oleh air;[162] skandium,[163] yttrium[164] dan titanium sulfida[165] tidak larut.
- ^ Misalnya, hidroksida kalium, rubidium, dan cesium memiliki kelarutan melebihi 100 gram per 100 gram air[167] sementara hidroksida alumium (0,0001)[168] dan skandium (<0,000 000 15 gram)[169] dianggap tidak dapat larut.
- ^ Berilium memiliki apa yang digambarkan sebagai titik leleh "tinggi" 1560 K; skandium dan titanium meleleh pada 1814 dan 1941 K.[174]
- ^ Seng adalah logam lunak dengan kekerasan Mohs 2,5;[175] kadmium dan timbal memiliki tingkat kekerasan lebih rendah masing-masing 2,0 and 1,5.[176] Seng memiliki titik lebur "rendah" pada 693&nbps;K; kadmium dan timbal masing-masing meleleh pada 595 dan 601 K.[177]
- ^ Beberapa kekerasan dan abstraksi detail diterapkan pada skema pemilahan untuk menjaga agar jumlah kategori tetap terjaga.
- ^ Fly fishing adalah teknik memancing dengan menggunakan umpan artifisial yang menyerupai lalat atau serangga
- ^ Kulit sebagian besar berubah menjadi hijau karena pembentukan patina pelindung yang terdiri dari antlerit (Cu), atakamit (Cu), brokantit (Cu), kupro oksida (Cu), dan tenorit (CuO).[209]
- ^ Untuk lantanida, ini adalah satu-satunya penggunaan struktural karena mereka terlalu reaktif, relatif mahal, dan cukup kuat.[221]
- ^ Weller[223] mengklasifikasikan logam koin sebagai logam berharga (misalnya: perak, emas, platina); logam berat berdaya tahan tinggi (nikel); logam berat berdaya tahan rendah (tembaga, besi, seng, timah, dan timbal); dan logam ringan (aluminium).
- ^ Emsley[224] memperkirakan kehilangan global enam ton emas per tahun karena cincin kawin 18 karat perlahan habis.
- ^ Kertas timbal yang terpapar kerasnya iklim industri dan pesisir akan bertahan berabad-abad[188]
- ^ Elektron yang menumbuk anoda tungsten menghasilkan sinar-X;[257] renium memberi ketahanan yang lebih baik kepada tungsten terhadap sengatan termal;[258] molibdenum dan grafit bertindak sebagai peredam panas. Molybdenum juga memiliki kepadatan hampir setengah dari tungsten sehingga mengurangi berat anoda.[256]
Sumber
Kutipan
- ^ Emsley 2011, hlm. 288; 374
- ^ a b c d e Duffus 2002, hlm. 798
- ^ a b Rand, Wells & McCarty 1995, hlm. 23
- ^ a b Baldwin & Marshall 1999, hlm. 267
- ^ a b Lyman 2003, hlm. 452
- ^ a b The United States Pharmacopeia 1985, hlm. 1189
- ^ a b Raghuram, Soma Raju & Sriramulu 2010, hlm. 15
- ^ a b Thorne & Roberts 1943, hlm. 534
- ^ a b c d Hawkes 1997
- ^ a b Nieboer & Richardson 1980, hlm. 4
- ^ a b Emsley 2011
- ^ Hoffman, Lee & Pershina 2011, hlm. 1691,1723; Bonchev & Kamenska 1981, hlm. 1182
- ^ Silva 2010, hlm. 1628, 1635, 1639, 1644
- ^ Fournier 1976, hlm. 243
- ^ a b c Vernon 2013, hlm. 1703
- ^ Morris 1992, hlm. 1001
- ^ Gorbachev, Zamyatnin & Lbov 1980, hlm. 5
- ^ a b c Duffus 2002, hlm. 797
- ^ Liens 2010, hlm. 1415
- ^ a b c Longo 1974, hlm. 683
- ^ Tomasik & Ratajewicz 1985, hlm. 433
- ^ a b Herron 2000, hlm. 511
- ^ a b Nathans 1963, hlm. 265
- ^ Topp 1965, hlm. 106: Schweitzer & Pesterfield 2010, hlm. 284
- ^ King 1995, hlm. 297; Mellor 1924, hlm. 628
- ^ Cotton 2006, hlm. 66
- ^ Albutt & Dell 1963, hlm. 1796
- ^ Wiberg 2001, hlm. 1722–1723
- ^ Wiberg 2001, hlm. 1724
- ^ a b Edelstein et al. 2010, hlm. 1796
- ^ Haynes 2015, hlm. 4–95
- ^ Weart 1983, hlm. 94
- ^ Deschlag 2011, hlm. 226
- ^ a b c Wulfsberg 2000, hlm. 209–211
- ^ Ahrland, Liljenzin & Rydberg 1973, hlm. 478
- ^ a b Korenman 1959, hlm. 1368
- ^ Yang, Jolly & O'Keefe 1977, hlm. 2980; Wiberg 2001, hlm. 592; Kolthoff & Elving 1964, hlm. 529
- ^ Close 2015, hlm. 78
- ^ Parish 1977, hlm. 89
- ^ a b Rainbow 1991, hlm. 416
- ^ Nieboer & Richardson 1980, hlm. 6–7
- ^ Lee 1996, hlm. 332; 364
- ^ Clugston & Flemming 2000, hlm. 294; 334, 336
- ^ Nieboer & Richardson 1980, hlm. 7
- ^ Nieboer & Richardson 1980
- ^ Hübner, Astin & Herbert 2010, hlm. 1511–1512
- ^ Järup & 2003, hlm. 168; Rasic-Milutinovic & Jovanovic 2013, hlm. 6; Wijayawardena, Megharaj & Naidu 2016, hlm. 176
- ^ Duffus 2002, hlm. 794–795; 800
- ^ Emsley 2011, hlm. 480
- ^ USEPA 1988, hlm. 1; Uden 2005, hlm. 347–348; DeZuane 1997, hlm. 93; Dev 2008, hlm. 2–3
- ^ a b Ikehata et al. 2015, hlm. 143
- ^ a b Podsiki 2008, hlm. 1
- ^ Emsley 2011, hlm. 106
- ^ Emsley 2011, hlm. 62
- ^ Chakhmouradian, Smith & Kynicky 2015, hlm. 456–457
- ^ Cotton 1997, hlm. ix; Ryan 2012, hlm. 369
- ^ Hermann, Hoffmann & Ashcroft 2013, hlm. 11604-1
- ^ Emsley 2011, hlm. 75
- ^ Gribbon 2016, hlm. x
- ^ Emsley 2011, hlm. 428–429; 414; Wiberg 2001, hlm. 527; Emsley 2011, hlm. 437; 21–22; 346–347; 408–409
- ^ Raymond 1984, hlm. 8–9
- ^ Chambers 1743: "Yang membedakan logam dari semua benda lainnya ... adalah beratnya ..."
- ^ Oxford English Dictionary 1989; Gordh & Headrick 2003, hlm. 753
- ^ Goldsmith 1982, hlm. 526
- ^ Habashi 2009, hlm. 31
- ^ Gmelin 1849, hlm. 2
- ^ Magee 1969, hlm. 14
- ^ Ridpath 2012, hlm. 208
- ^ Duffus 2002, hlm. 794
- ^ Leeper 1978, hlm. ix
- ^ Housecroft 2008, hlm. 802
- ^ Shaw, Sahu & Mishra 1999, hlm. 89; Martin & Coughtrey 1982, hlm. 2–3
- ^ Hübner, Astin & Herbert 2010, hlm. 1513
- ^ a b The Minerals, Metals and Materials Society 2016
- ^ Emsley 2011, hlm. 35; passim
- ^ Emsley 2011, hlm. 280, 286; Baird & Cann 2012, hlm. 549, 551
- ^ a b Haynes 2015, hlm. 7–48
- ^ Iyengar 1998, hlm. 553
- ^ Emsley 2011, hlm. 47; 331; 138; 133; passim
- ^ Nieboer & Richardson 1978, hlm. 2
- ^ Emsley 2011, hlm. 604; 31; 133; 358; 47; 475
- ^ Valkovic 1990, hlm. 214, 218
- ^ Emsley 2011, hlm. 331; 89; 552
- ^ Emsley 2011, hlm. 571
- ^ Emsley 2011, hlm. 24; passim
- ^ Venugopal & Luckey 1978, hlm. 307
- ^ Emsley 2011, hlm. 192; 197; 240; 120, 166, 188, 224, 269, 299, 423, 464, 549, 614; 559
- ^ Duffus 2002, hlm. 794; 799
- ^ Baird & Cann 2012, hlm. 519
- ^ Kozin & Hansen 2013, hlm. 80
- ^ Baird & Cann 2012, hlm. 519–520; 567; Rusyniak et al. 2010, hlm. 387
- ^ Di Maio 2001, hlm. 208
- ^ Perry & Vanderklein 1996, hlm. 208
- ^ Love 1998, hlm. 208
- ^ Hendrickson 2016, hlm. 42
- ^ Reyes 2007, hlm. 1, 20, 35–36
- ^ Emsley 2011, hlm. 311
- ^ Wiberg 2001, hlm. 1474, 1501
- ^ a b c d e f g h Tokar et al. 2013
- ^ Eisler 1993, hlm. 3, passim
- ^ Lemony 1997, hlm. 259; Ohlendorf 2003, hlm. 490
- ^ State Water Control Resources Board 1987, hlm. 63
- ^ Scott 1989, hlm. 107–108
- ^ International Antimony Association 2016
- ^ United States Government 2014
- ^ Australian Government 2016
- ^ United States Environmental Protection Agency 2014
- ^ Ong, Tan & Cheung 1997, hlm. 44
- ^ Emsley 2011, hlm. 146
- ^ Emsley 2011, hlm. 476
- ^ Selinger 1978, hlm. 369
- ^ Cole & Stuart 2000, hlm. 315
- ^ Clegg 2014
- ^ Emsley 2011, hlm. 240
- ^ Emsley 2011, hlm. 595
- ^ Stankovic & Stankovic 2013, hlm. 154–159
- ^ Bradl 2005, hlm. 15, 17–20
- ^ Harvey, Handley & Taylor 2015, hlm. 12276
- ^ Howell et al. 2012; Cole et al. 2011, hlm. 2589–2590
- ^ Amasawa et al. 2016, hlm. 95–101
- ^ Massarani 2015
- ^ Torrice 2016
- ^ a b c Lide 2004, hlm. 14–17
- ^ Emsley 2011, hlm. 29; passim
- ^ a b c McQueen 2009, hlm. 74
- ^ a b Cox 1997, hlm. 73–89
- ^ Cox 1997, hlm. 32, 63, 85
- ^ Podosek 2011, hlm. 482
- ^ Padmanabhan 2001, hlm. 234
- ^ Rehder 2010, hlm. 32, 33
- ^ Hofmann 2002, hlm. 23–24
- ^ Hadhazy 2016
- ^ Choptuik, Lehner & Pretorias 2015, hlm. 383
- ^ Cox 1997, hlm. 83, 91, 102–103
- ^ Berry & Mason 1959, hlm. 210–211; Rankin 2011, hlm. 69
- ^ Hartmann 2005, hlm. 197
- ^ Yousif 2007, hlm. 11–12
- ^ Berry & Mason 1959, hlm. 214
- ^ Yousif 2007, hlm. 11
- ^ Wiberg 2001, hlm. 1511
- ^ Emsley 2011, hlm. 403
- ^ Litasov & Shatskiy 2016, hlm. 27
- ^ Sanders 2003; Preuss 2011
- ^ Natural Resources Canada 2015
- ^ MacKay, MacKay & Henderson 2002, hlm. 203–204
- ^ Emsley 2011, hlm. 525–528; 428–429; 414; 57–58; 22; 346–347; 408–409; Keller, Wolf & Shani 2012, hlm. 98
- ^ Emsley 2011, hlm. 32 et seq.
- ^ Emsley 2011, hlm. 437
- ^ Chen & Huang 2006, hlm. 208; Crundwell et al. 2011, hlm. 411–413; Renner et al. 2012, hlm. 332; Seymour & O'Farrelly 2012, hlm. 10–12
- ^ Crundwell et al. 2011, hlm. 409
- ^ International Platinum Group Metals Association n.d., hlm. 3–4
- ^ McLemore 2008, hlm. 44
- ^ Wiberg 2001, hlm. 1277
- ^ Russell & Lee 2005, hlm. 437
- ^ McCurdy 1992, hlm. 186
- ^ von Zeerleder 1949, hlm. 68
- ^ Chawla & Chawla 2013, hlm. 55
- ^ von Gleich 2006, hlm. 3
- ^ Biddle & Bush 1949, hlm. 180
- ^ Magill 1992, hlm. 1380
- ^ a b Gidding 1973, hlm. 335–336
- ^ Wiberg 2001, hlm. 520
- ^ a b Schweitzer & Pesterfield 2010, hlm. 230
- ^ Macintyre 1994, hlm. 334
- ^ Booth 1957, hlm. 85; Haynes 2015, hlm. 4–96
- ^ Schweitzer & Pesterfield 2010, hlm. 230. Bagaimanapun, para penulis mencatat bahwa, "Sulfida ... Ga(III) dan Cr(III) cenderung larut dan/atau terdekomposisi di dalam air."
- ^ Sidgwick 1950, hlm. 96
- ^ Ondreička, Kortus & Ginter 1971, hlm. 294
- ^ Gschneidner 1975, hlm. 195
- ^ Hasan 1996, hlm. 251
- ^ Brady & Holum 1995, hlm. 825
- ^ Cotton 2006, hlm. 66; Ahrland, Liljenzin & Rydberg 1973, hlm. 478
- ^ Nieboer & Richardson 1980, hlm. 10
- ^ Russell & Lee 2005, hlm. 158, 434, 180
- ^ Schweitzer 2003, hlm. 603
- ^ Samsonov 1968, hlm. 432
- ^ Russell & Lee 2005, hlm. 338–339; 338; 411
- ^ Emsley 2011, hlm. 260; 401
- ^ Jones 2001, hlm. 3
- ^ Berea, Rodriguez-lbelo & Navarro 2016, hlm. 203
- ^ Alves, Berutti & Sánchez 2012, hlm. 94
- ^ Yadav, Antony & Subba Reddy 2012, hlm. 231
- ^ Masters 1981, hlm. 5
- ^ Wulfsberg 1987, hlm. 200–201
- ^ Bryson & Hammond 2005, hlm. 120 (high electron density); Frommer & Stabulas-Savage 2014, hlm. 69–70 (high atomic number)
- ^ Landis, Sofield & Yu 2011, hlm. 269
- ^ Prieto 2011, hlm. 10; Pickering 1991, hlm. 5–6, 17
- ^ a b Emsley 2011, hlm. 286
- ^ Berger & Bruning 1979, hlm. 173
- ^ Jackson & Summitt 2006, hlm. 10, 13
- ^ Shedd 2002, hlm. 80.5; Kantra 2001, hlm. 10
- ^ Spolek 2007, hlm. 239
- ^ White 2010, hlm. 139
- ^ Dapena & Teves 1982, hlm. 78
- ^ Burkett 2010, hlm. 80
- ^ a b Moore & Ramamoorthy 1984, hlm. 102
- ^ a b National Materials Advisory Board 1973, hlm. 58
- ^ Livesey 2012, hlm. 57
- ^ VanGelder 2014, hlm. 354, 801
- ^ National Materials Advisory Board 1971, hlm. 35–37
- ^ Rockhoff 2012, hlm. 314
- ^ Russell & Lee 2005, hlm. 16, 96
- ^ Morstein 2005, hlm. 129
- ^ Russell & Lee 2005, hlm. 218–219
- ^ Lach et al. 2015; Di Maio 2016, hlm. 154
- ^ Preschel 2005; Guandalini et al. 2011, hlm. 488
- ^ Scoullos et al. 2001, hlm. 315; Ariel, Barta & Brandon 1973, hlm. 126
- ^ Wingerson 1986, hlm. 35
- ^ Matyi & Baboian 1986, hlm. 299; Livingston 1991, hlm. 1401, 1407
- ^ Casey 1993, hlm. 156
- ^ a b c Bradl 2005, hlm. 25
- ^ Kumar, Srivastava & Srivastava 1994, hlm. 259
- ^ Nzierżanowski & Gawroński 2012, hlm. 42
- ^ Pacheco-Torgal, Jalali & Fucic 2012, hlm. 283–294; 297–333
- ^ Venner et al. 2004, hlm. 124
- ^ Technical Publications 1958, hlm. 235:"Berikut adalah pemotong logam keras yang kasar ... untuk memotong ... hingga ... gembok, kisi baja dan logam berat lainnya."
- ^ Naja & Volesky 2009, hlm. 41
- ^ Department of the Navy 2009, hlm. 3.3–13
- ^ Rebhandl et al. 2007, hlm. 1729
- ^ Greenberg & Patterson 2008, hlm. 239
- ^ Russell & Lee 2005, hlm. 437, 441
- ^ Roe & Roe 1992
- ^ Weller 1976, hlm. 4
- ^ Emsley 2011, hlm. 208
- ^ Emsley 2011, hlm. 206
- ^ Guney & Zagury 2012, hlm. 1238; Cui et al. 2015, hlm. 77
- ^ Brephol & McCreight 2001, hlm. 15
- ^ Russell & Lee 2005, hlm. 337, 404, 411
- ^ Emsley 2011, hlm. 141; 286
- ^ Emsley 2011, hlm. 625
- ^ Emsley 2011, hlm. 555, 557
- ^ Emsley 2011, hlm. 531
- ^ Emsley 2011, hlm. 123
- ^ Weber & Rutula 2001, hlm. 415
- ^ Dunn 2009; Bonetti et al. 2009, hlm. 1, 84, 201
- ^ Desoize 2004, hlm. 1529
- ^ Atlas 1986, hlm. 359; Lima et al. 2013, hlm. 1
- ^ Volesky 1990, hlm. 174
- ^ Nakbanpote, Meesungnoen & Prasad 2016, hlm. 180
- ^ Emsley 2011, hlm. 447; 74; 384; 123
- ^ Elliot 1946, hlm. 11; Warth 1956, hlm. 571
- ^ McColm 1994, hlm. 215
- ^ Emsley 2011, hlm. 135; 313; 141; 495; 626; 479; 630; 334; 495; 556; 424; 339; 169; 571; 252; 205; 286; 599
- ^ Everts 2016
- ^ Emsley 2011, hlm. 450
- ^ Emsley 2011, hlm. 334
- ^ Emsley 2011, hlm. 459
- ^ Moselle 2004, hlm. 409–410
- ^ Russell & Lee 2005, hlm. 323
- ^ Emsley 2011, hlm. 212
- ^ Tretkoff 2006
- ^ Emsley 2011, hlm. 428; 276; 326–327
- ^ Emsley 2011, hlm. 73; 141; 141; 141; 355; 73; 424; 340; 189; 189
- ^ Emsley 2011, hlm. 192; 242; 194
- ^ Baranoff 2015, hlm. 80; Wong et al. 2015, hlm. 6535
- ^ a b Ball, Moore & Turner 2008, hlm. 177
- ^ Ball, Moore & Turner 2008, hlm. 248–249, 255
- ^ Russell & Lee 2005, hlm. 238
- ^ Tisza 2001, hlm. 73
- ^ Chandler & Roberson 2009, hlm. 47, 367–369, 373; Ismail, Khulbe & Matsuura 2015, hlm. 302
- ^ Ebbing & Gammon 2017, hlm. 695
- ^ Pan & Dai 2015, hlm. 69
- ^ Brown 1987, hlm. 48
Referensi
- Ahrland S.; Liljenzin J.O.; Rydberg J. (1973), J.C. Bailar; A.F. Trotman-Dickenson, ed., "Solution chemistry", Comprehensive Inorganic Chemistry, 5, The Actinides .
- Albutt M. & Dell R. (1963), The nitrites and sulphides of uranium, thorium and plutonium: A review of present knowledge, UK Atomic Energy Authority Research Group, Harwell, Berkshire.
- Alves A. K., Berutti, F. A. & Sánche, F. A. L. 2012, "Nanomaterials and catalysis", in C. P. Bergmann & M. J. de Andrade (ads), Nanonstructured Materials for Engineering Applications, Springer-Verlag, Berlin, ISBN 978-3-642-19130-5.
- Amasawa E., Yi Teah H., Yu Ting Khew, J., Ikeda I. & Onuki M. 2016, "Drawing Lessons from the Minamata Incident for the General Public: Exercise on Resilience, Minamata Unit AY2014", in M. Esteban, T. Akiyama, C. Chen, I. Ikea, T. Mino (eds), Sustainability Science: Field Methods and Exercises, Springer International, Switzerland, pp. 93–116, DOI:10.1007/978-3-319-32930-7_5 ISBN 978-3-319-32929-1.
- Ariel E., Barta J. & Brandon D. 1973, "Preparation and properties of heavy metals", Powder Metallurgy International, vol. 5, no. 3, pp. 126–129.
- Atlas R. M. 1986, Basic and Practical Microbiology, Macmillan Publishing Company, New York, ISBN 978-0-02-304350-5.
- Australian Government 2016, National Pollutant Inventory Diarsipkan 2010-03-28 di Wayback Machine., Department of the Environment and Energy, accessed 16 August 2016.
- Baird C. & Cann M. 2012, Environmental Chemistry, 5th ed., W. H. Freeman and Company, New York, ISBN 978-1-4292-7704-4.
- Baldwin D. R. & Marshall W. J. 1999, "Heavy metal poisoning and its laboratory investigation", Annals of Clinical Biochemistry, vol. 36, no. 3, pp. 267–300, doi:10.1177/000456329903600301.
- Ball J. L., Moore A. D. & Turner S. 2008, Ball and Moore's Essential Physics for Radiographers, 4th ed., Blackwell Publishing, Chichester, ISBN 978-1-4051-6101-5.
- Bánfalvi G. 2011, "Heavy metals, trace elements and their cellular effects", in G. Bánfalvi (ed.), Cellular Effects of Heavy Metals, Springer, Dordrecht, pp. 3–28, ISBN 978-94-007-0427-5.
- Baranoff E. 2015, "First-row transition metal complexes for the conversion of light into electricity and electricity into light", in W-Y Wong (ed.), Organometallics and Related Molecules for Energy Conversion, Springer, Heidelberg, pp. 61–90, ISBN 978-3-662-46053-5.
- Berea E., Rodriguez-lbelo M. & Navarro J. A. R. 2016, "Platinum Group Metal—Organic frameworks" in S. Kaskel (ed.), The Chemistry of Metal-Organic Frameworks: Synthesis, Characterisation, and Applications, vol. 2, Wiley-VCH Weinheim, pp. 203–230, ISBN 978-3-527-33874-0.
- Berger A. J. & Bruning N. 1979, Lady Luck's Companion: How to Play ... How to Enjoy ... How to Bet ... How to Win, Harper & Row, New York, ISBN 978-0-06-014696-2.
- Berry L. G. & Mason B. 1959, Mineralogy: Concepts, Descriptions, Determinations, W. H. Freeman and Company, San Francisco.
- Biddle H. C. & Bush G. L 1949, Chemistry Today, Rand McNally, Chicago.
- Bonchev D. & Kamenska V. 1981, "Predicting the properties of the 113–120 transactinide elements", The Journal of Physical Chemistry, vo. 85, no. 9, pp. 1177–1186, doi:10.1021/j150609a021.
- Bonetti A., Leone R., Muggia F. & Howell S. B. (eds) 2009, Platinum and Other Heavy Metal Compounds in Cancer Chemotherapy: Molecular Mechanisms and Clinical Applications, Humana Press, New York, ISBN 978-1-60327-458-6.
- Booth H. S. 1957, Inorganic Syntheses, vol. 5, McGraw-Hill, New York.
- Bradl H. E. 2005, "Sources and origins of heavy metals", in Bradl H. E. (ed.), Heavy Metals in the Environment: Origin, Interaction and Remediation, Elsevier, Amsterdam, ISBN 978-0-12-088381-3.
- Brady J. E. & Holum J. R. 1995, Chemistry: The Study of Matter and its Changes, 2nd ed., John Wiley & Sons, New York, ISBN 978-0-471-10042-3.
- Brephohl E. & McCreight T. (ed) 2001, The Theory and Practice of Goldsmithing, C. Lewton-Brain trans., Brynmorgen Press, Portland, Maine, ISBN 978-0-9615984-9-5.
- Brown I. 1987, "Astatine: Its organonuclear chemistry and biomedical applications," in H. J. Emeléus & A. G. Sharpe (eds), Advances in Inorganic Chemistry, vol. 31, Academic Press, Orlando, pp. 43–88, ISBN 978-0-12-023631-2.
- Bryson R. M. & Hammond C. 2005, "Generic methodologies for nanotechnology: Characterisation"', in R. Kelsall, I. W. Hamley & M. Geoghegan, Nanoscale Science and Technology, John Wiley & Sons, Chichester, pp. 56–129, ISBN 978-0-470-85086-2.
- Burkett B. 2010, Sport Mechanics for Coaches, 3rd ed., Human Kinetics, Champaign, Illinois, ISBN 978-0-7360-8359-1.
- Casey C. 1993, "Restructuring work: New work and new workers in post-industrial production", in R. P. Coulter & I. F. Goodson (eds), Rethinking Vocationalism: Whose Work/life is it?, Our Schools/Our Selves Education Foundation, Toronto, ISBN 978-0-921908-15-9.
- Chakhmouradian A.R., Smith M. P. & Kynicky J. 2015, "From "strategic" tungsten to "green" neodymium: A century of critical metals at a glance", Ore Geology Reviews, vol. 64, January, pp. 455–458, doi:10.1016/j.oregeorev.2014.06.008.
- Chambers E. 1743, "Metal", in Cyclopedia: Or an Universal Dictionary of Arts and Sciences (etc.), vol. 2, D. Midwinter, London.
- Chandler D. E. & Roberson R. W. 2009, Bioimaging: Current Concepts in Light & Electron Microscopy, Jones & Bartlett Publishers, Boston, ISBN 978-0-7637-3874-7.
- Chawla N. & Chawla K. K. 2013, Metal matrix composites, 2nd ed., Springer Science+Business Media, New York, ISBN 978-1-4614-9547-5.
- Chen J. & Huang K. 2006, "A new technique for extraction of platinum group metals by pressure cyanidation", Hydrometallurgy, vol. 82, nos. 3–4, pp. 164–171, doi:10.1016/j.hydromet.2006.03.041.
- Choptuik M. W., Lehner L. & Pretorias F. 2015, "Probing strong-field gravity through numerical simulation", in A. Ashtekar, B. K. Berger, J. Isenberg & M. MacCallum (eds), General Relativity and Gravitation: A Centennial Perspective, Cambridge University Press, Cambridge, ISBN 978-1-107-03731-1.
- Clegg B 2014, "Osmium tetroxide Diarsipkan 2016-09-15 di Wayback Machine.", Chemistry World, accessed 2 September 2016.
- Close F. 2015, Nuclear Physics: A Very Short Introduction, Oxford University Press, Oxford, ISBN 978-0-19-871863-5.
- Clugston M & Flemming R 2000, Advanced Chemistry, Oxford University, Oxford, ISBN 978-0-19-914633-8.
- Cole M., Lindeque P., Halsband C. & Galloway T. S. 2011, "Microplastics as contaminants in the marine environment: A review", Marine Pollution Bulletin, vol. 62, no. 12, pp. 2588–2597, doi:10.1016/j.marpolbul.2011.09.025.
- Cole S. E. & Stuart K. R. 2000, "Nuclear and cortical histology for brightfield microscopy", in D. J. Asai & J. D. Forney (eds), Methods in Cell Biology, vol. 62, Academic Press, San Diego, pp. 313–322, ISBN 978-0-12-544164-3.
- Cotton S. A. 1997, Chemistry of Precious Metals, Blackie Academic & Professional, London, ISBN 978-94-010-7154-3.
- Cotton S. 2006, Lanthanide and Actinide Chemistry, reprinted with corrections 2007, John Wiley & Sons, Chichester, ISBN 978-0-470-01005-1.
- Cox P. A. 1997, The elements: Their Origin, Abundance and Distribution, Oxford University Press, Oxford, ISBN 978-0-19-855298-7.
- Crundwell F. K., Moats M. S., Ramachandran V., Robinson T. G. & Davenport W. G. 2011, Extractive Metallurgy of Nickel, Cobalt and Platinum Group Metals, Elsevier, Kidlington, Oxford, ISBN 978-0-08-096809-4.
- Cui X-Y., Li S-W., Zhang S-J., Fan Y-Y., Ma L. Q. 2015, "Toxic metals in children's toys and jewelry: Coupling bioaccessibility with risk assessment", Environmental Pollution, vol. 200, pp. 77–84, doi:10.1016/j.envpol.2015.01.035.
- Dapena J. & Teves M. A. 1982, "Influence of the diameter of the hammer head on the distance of a hammer throw", Research Quarterly for Exercise and Sport, vol. 53, no. 1, pp. 78–81, doi:10.1080/02701367.1982.10605229.
- De Zuane J. 1997, Handbook of Drinking Water Quality, 2nd ed., John Wiley & Sons, New York, ISBN 978-0-471-28789-6.
- Department of the Navy 2009, Gulf of Alaska Navy Training Activities: Draft Environmental Impact Statement/Overseas Environmental Impact Statement Diarsipkan 2016-08-21 di Wayback Machine., U.S. Government, accessed 21 August 2016.
- Deschlag J. O. 2011, "Nuclear fission", in A. Vértes, S. Nagy, Z. Klencsár, R. G. Lovas, F. Rösch (eds), Handbook of Nuclear Chemistry, 2nd ed., Springer Science+Business Media, Dordrecht, pp. 223–280, ISBN 978-1-4419-0719-6.
- Desoize B. 2004, "Metals and metal compounds in cancer treatment", Anticancer Research, vol. 24, no. 3a, pp. 1529–1544, PMID 15274320.
- Dev N. 2008, 'Modelling Selenium Fate and Transport in Great Salt Lake Wetlands', PhD dissertation, University of Utah, ProQuest, Ann Arbor, Michigan, ISBN 978-0-549-86542-1.
- Di Maio V. J. M. 2001, Forensic Pathology, 2nd ed., CRC Press, Boca Raton, ISBN 0-8493-0072-X.
- Di Maio V. J. M. 2016, Gunshot Wounds: Practical Aspects of Firearms, Ballistics, and Forensic Techniques, 3rd ed., CRC Press, Boca Raton, Florida, ISBN 978-1-4987-2570-5.
- Duffus J. H. Diarsipkan 2021-12-30 di Wayback Machine. 2002, " 'Heavy metals'—A meaningless term?" Diarsipkan 2017-08-09 di Wayback Machine., Pure and Applied Chemistry, vol. 74, no. 5, pp. 793–807, doi:10.1351/pac200274050793.
- Dunn P. 2009, Unusual metals could forge new cancer drugs Diarsipkan 2016-04-04 di Wayback Machine., University of Warwick, accessed 23 March 2016.
- Ebbing D. D. & Gammon S. D. 2017, General Chemistry, 11th ed., Cengage Learning, Boston, ISBN 978-1-305-58034-3.
- Edelstein N. M., Fuger J., Katz J. L. & Morss L. R. 2010, "Summary and comparison of properties of the actinde and transactinide elements," in L. R. Morss, N. M. Edelstein & J. Fuger (eds), The Chemistry of the Actinide and Transactinide Elements, 4th ed., vol. 1–6, Springer, Dordrecht, pp. 1753–1835, ISBN 978-94-007-0210-3.
- Eisler R. 1993, Zinc Hazards to Fish, Wildlife, and Invertebrates: A Synoptic Review Diarsipkan 2016-12-21 di Wayback Machine., Biological Report 10, U. S. Department of the Interior, Laurel, Maryland, accessed 2 September 2016.
- Elliott S. B. 1946, The Alkaline-earth and Heavy-metal Soaps, Reinhold Publishing Corporation, New York.
- Emsley J. 2011, Nature's Building Blocks, new edition, Oxford University Press, Oxford, ISBN 978-0-19-960563-7.
- Everts S. 2016, "What chemicals are in your tattoo Diarsipkan 2016-08-12 di Wayback Machine.", Chemical & Engineering News, vol. 94, no. 33, pp. 24–26.
- Fournier J. 1976, "Bonding and the electronic structure of the actinide metals," Journal of Physics and Chemistry of Solids, vol 37, no. 2, pp. 235–244, doi:10.1016/0022-3697(76)90167-0.
- Frick J. P. (ed.) 2000, Woldman's Engineering Alloys, 9th ed., ASM International, Materials Park, Ohio, ISBN 978-0-87170-691-1.
- Frommer H. H. & Stabulas-Savage J. J. 2014, Radiology for the Dental Professional, 9th ed., Mosby Inc., St. Louis, Missouri, ISBN 978-0-323-06401-9.
- Gidding J. C. 1973, Chemistry, Man, and Environmental Change: An Integrated Approach, Canfield Press, New York, ISBN 978-0-06-382790-5.
- Gmelin L. 1849, Hand-book of chemistry, vol. III, Metals, translated from the German by H. Watts, Cavendish Society, London.
- Goldsmith R. H. 1982, "Metalloids", Journal of Chemical Education, vol. 59, no. 6, pp. 526–527, doi:10.1021/ed059p526.
- Gorbachev V. M., Zamyatnin Y. S. & Lbov A. A. 1980, Nuclear Reactions in Heavy Elements: A Data Handbook, Pergamon Press, Oxford, ISBN 978-0-08-023595-0.
- Gordh G. & Headrick D. 2003, A Dictionary of Entomology, CABI Publishing, Wallingford, ISBN 978-0-85199-655-4.
- Greenberg B. R. & Patterson D. 2008, Art in Chemistry; Chemistry in Art, 2nd ed., Teachers Ideas Press, Westport, Connecticut, ISBN 978-1-59158-309-7.
- Gribbon J. 2016, 13.8: The Quest to Find the True Age of the Universe and the Theory of Everything, Yale University Press, New Haven, ISBN 978-0-300-21827-5.
- Gschneidner Jr., K. A. 1975, Inorganic compounds, in C. T. Horowitz (ed.), Scandium: Its Occurrence, Chemistry, Physics, Metallurgy, Biology and Technology, Academic Press, London, pp. 152–251, ISBN 978-0-12-355850-3.
- Guandalini G. S., Zhang L., Fornero E., Centeno J. A., Mokashi V. P., Ortiz P. A., Stockelman M. D., Osterburg A. R. & Chapman G. G. 2011, "Tissue distribution of tungsten in mice following oral exposure to sodium tungstate," Chemical Research in Toxicology, vol. 24, no. 4, pp 488–493, doi:10.1021/tx200011k.
- Guney M. & Zagury G. J. 2012, "Heavy metals in toys and low-cost jewelry: Critical review of U.S. and Canadian legislations and recommendations for testing", Environmental Science & Technology, vol. 48, pp. 1238–1246, doi:10.1021/es4036122.
- Habashi F. 2009, "Gmelin and his Handbuch" Diarsipkan 2016-04-15 di Wayback Machine., Bulletin for the History of Chemistry, vol. 34, no. 1, pp. 30–1.
- Hadhazy A. 2016, "Galactic 'gold mine' explains the origin of nature's heaviest elements Diarsipkan 2016-05-24 di Wayback Machine.", Science Spotlights, 10 May 2016, accessed 11 July 2016.
- Hartmann W. K. 2005, Moons & Planets, 5th ed., Thomson Brooks/Cole, Belmont, California, ISBN 978-0-534-49393-6.
- Harvey P. J., Handley H. K. & Taylor M. P. 2015, "Identification of the sources of metal (lead) contamination in drinking waters in north-eastern Tasmania using lead isotopic compositions," Environmental Science and Pollution Research, vol. 22, no. 16, pp. 12276–12288, doi:10.1007/s11356-015-4349-2 PMID 25895456.
- Hasan S. E. 1996, Geology and Hazardous Waste Management, Prentice Hall, Upper Saddle River, New Jersey, ISBN 978-0-02-351682-5.
- Hawkes S. J. 1997, "What is a "heavy metal"?", Journal of Chemical Education, vol. 74, no. 11, p. 1374, doi:10.1021/ed074p1374.
- Haynes W. M. 2015, CRC Handbook of Chemistry and Physics, 96th ed., CRC Press, Boca Raton, Florida, ISBN 978-1-4822-6097-7.
- Hendrickson D. J. 2916, "Effects of early experience on brain and body", in D. Alicata, N. N. Jacobs, A. Guerrero and M. Piasecki (eds), Problem-based Behavioural Science and Psychiatry 2nd ed., Springer, Cham, pp. 33–54, ISBN 978-3-319-23669-8.
- Hermann A., Hoffmann R. & Ashcroft N. W. 2013, "Condensed astatine: Monatomic and metallic Diarsipkan 2016-03-16 di Wayback Machine.", Physical Review Letters, vol. 111, pp. 11604–1−11604-5, doi:10.1103/PhysRevLett.111.116404.
- Herron N. 2000, "Cadmium compounds," in Kirk-Othmer Encyclopedia of Chemical Technology, vol. 4, John Wiley & Sons, New York, pp. 507–523, ISBN 978-0-471-23896-6.
- Hoffman D. C., Lee D. M. & Pershina V. 2011, "Transactinide elements and future elements," in L. R. Morss, N. Edelstein, J. Fuger & J. J. Katz (eds), The Chemistry of the Actinide and Transactinide Elements, 4th ed., vol. 3, Springer, Dordrecht, pp. 1652–1752, ISBN 978-94-007-0210-3.
- Hofmann S. 2002, On Beyond Uranium: Journey to the End of the Periodic Table, Taylor & Francis, London, ISBN 978-0-415-28495-0.
- Housecroft J. E. 2008, Inorganic Chemistry, Elsevier, Burlington, Massachusetts, ISBN 978-0-12-356786-4.
- Howell N., Lavers J., Paterson D., Garrett R. & Banati R. 2012, Trace metal distribution in feathers from migratory, pelagic birds Diarsipkan 2016-06-16 di Wayback Machine., Australian Nuclear Science and Technology Organisation, accessed 3 May 2014.
- Hübner R., Astin K. B. & Herbert R. J. H. 2010, " 'Heavy metal'—time to move on from semantics to pragmatics?", Journal of Environmental Monitoring, vol. 12, pp. 1511–1514, doi:10.1039/C0EM00056F.
- Ikehata K., Jin Y., Maleky N. & Lin A. 2015, "Heavy metal pollution in water resources in China—Occurrence and public health implications", in S. K. Sharma (ed.), Heavy Metals in Water: Presence, Removal and Safety, Royal Society of Chemistry, Cambridge, pp. 141–167, ISBN 978-1-84973-885-9.
- International Antimony Association 2016, Antimony compounds Diarsipkan 2016-09-12 di Wayback Machine., accessed 2 September 2016.
- International Platinum Group Metals Association n.d., The Primary Production of Platinum Group Metals (PGMs) Diarsipkan 2016-08-04 di Wayback Machine., accessed 4 September 2016.
- Ismail A. F., Khulbe K. & Matsuura T. 2015, Gas Separation Membranes: Polymeric and Inorganic, Springer, Cham, Switzerland, ISBN 978-3-319-01095-3.
- IUPAC 2016, "IUPAC is naming the four new elements nihonium, moscovium, tennessine, and oganesson Diarsipkan 2018-09-27 di Wayback Machine." accessed 27 August 2016.
- Iyengar G. V. 1998, "Reevaluation of the trace element content in Reference Man", Radiation Physics and Chemistry, vol. 51, nos 4–6, pp. 545–560, DOI:10.1016/S0969-806X(97)00202-8
- Jackson J. & Summitt J. 2006, The Modern Guide to Golf Clubmaking: The Principles and Techniques of Component Golf Club Assembly and Alteration, 5th ed., Hireko Trading Company, City of Industry, California, ISBN 978-0-9619413-0-7.
- Järup L 2003, "Hazards of heavy metal contamination", British Medical Bulletin, vol. 68, no. 1, pp. 167–182, doi:10.1093/bmb/ldg032.
- Jones C. J. 2001, d- and f-Block Chemistry, Royal Society of Chemistry, Cambridge, ISBN 978-0-85404-637-9.
- Kantra S. 2001, "What's new", Popular Science, vol. 254, no. 4, April, p. 10.
- Keller C., Wolf W. & Shani J. 2012, "Radionuclides, 2. Radioactive elements and artificial radionuclides", in F. Ullmann (ed.), Ullmann's Encyclopedia of Industrial Chemistry, vol. 31, Wiley-VCH, Weinheim, pp. 89–117, doi:10.1002/14356007.o22_o15.
- King R. B. 1995, Inorganic Chemistry of Main Group Elements, Wiley-VCH, New York, ISBN 978-1-56081-679-9.
- Kolthoff I. M. & Elving P. J. FR 1964, Treatise on Analytical Chemistry, part II, vol. 6, Interscience Encyclopedia, New York, ISBN 978-0-07-038685-3.
- Korenman I. M. 1959, "Regularities in properties of thallium", Journal of General Chemistry of the USSR, English translation, Consultants Bureau, New York, vol. 29, no. 2, pp. 1366–90, ISSN 0022-1279.
- Kozin L. F. & Hansen S. C. 2013, Mercury Handbook: Chemistry, Applications and Environmental Impact, RSC Publishing, Cambridge, ISBN 978-1-84973-409-7.
- Kumar R., Srivastava P. K., Srivastava S. P. 1994, "Leaching of heavy metals (Cr, Fe, and Ni) from stainless steel utensils in food simulates and food materials", Bulletin of Environmental Contamination and Toxicology, vol. 53, no. 2, doi:10.1007/BF00192942, pp. 259–266.
- Lach K., Steer B., Gorbunov B., Mička V. & Muir R. B. 2015, "Evaluation of exposure to airborne heavy metals at gun shooting ranges", The Annals of Occupational Hygiene, vol. 59, no. 3, pp. 307–323, doi:10.1093/annhyg/meu097.
- Landis W., Sofield R. & Yu M-H. 2010, Introduction to Environmental Toxicology: Molecular Substructures to Ecological Landscapes, 4th ed., CRC Press, Boca Raton, Florida, ISBN 978-1-4398-0411-7.
- Lane T. W., Saito M. A., George G. N., Pickering, I. J., Prince R. C. & Morel F. M. M. 2005, "Biochemistry: A cadmium enzyme from a marine diatom", Nature, vol. 435, no. 7038, p. 42, doi:10.1038/435042a.
- Lee J. D. 1996, Concise Inorganic Chemistry, 5th ed., Blackwell Science, Oxford, ISBN 978-0-632-05293-6.
- Leeper G. W. 1978, Managing the Heavy Metals on the Land Marcel Dekker, New York, ISBN 0-8247-6661-X.
- Lemony A. D. 1997, "A teratogenic deformity index for evaluating impacts of selenium on fish populations", Ecotoxicology and Environmental Safety, vol. 37, no. 3, pp. 259–266, doi:10.1006/eesa.1997.1554.
- Lide D. R. (ed.) 2004, CRC Handbook of Chemistry and Physics, 85th ed., CRC Press, Boca Raton, Florida, ISBN 978-0-8493-0485-9.
- Liens J. 2010, "Heavy metals as pollutants", in B. Warf (ed.), Encyclopaedia of Geography, Sage Publications, Thousand Oaks, California, pp. 1415–1418, ISBN 978-1-4129-5697-0.
- Lima E., Guerra R., Lara V. & Guzmán A. 2013, "Gold nanoparticles as efficient antimicrobial agents for Escherichia coli and Salmonella typhi " Chemistry Central, vol. 7:11, doi:10.1186/1752-153X-7-11 PMID 23331621 PMC 3556127.
- Litasov K. D. & Shatskiy A. F. 2016, "Composition of the Earth's core: A review", Russian Geology and Geophysics, vol. 57, no. 1, pp. 22–46, doi:10.1016/j.rgg.2016.01.003.
- Livesey A. 2012, Advanced Motorsport Engineering, Routledge, London, ISBN 978-0-7506-8908-3.
- Livingston R. A. 1991, "Influence of the Environment on the Patina of the Statue of Liberty", Environmental Science & Technology, vol. 25, no. 8, pp. 1400–1408, doi:10.1021/es00020a006.
- Longo F. R. 1974, General Chemistry: Interaction of Matter, Energy, and Man, McGraw-Hill, New York, ISBN 978-0-07-038685-3.
- Love M. 1998, Phasing Out Lead from Gasoline: Worldwide Experience and Policy Implications, World Bank Technical Paper volume 397, The World Bank, Washington DC, ISBN 0-8213-4157-X.
- Lyman W. J. 1995, "Transport and transformation processes", in Fundamentals of Aquatic Toxicology, G. M. Rand (ed.), Taylor & Francis, London, pp. 449–492, ISBN 978-1-56032-090-6.
- Macintyre J. E. 1994, Dictionary of inorganic compounds, supplement 2, Dictionary of Inorganic Compounds, vol. 7, Chapman & Hall, London, ISBN 978-0-412-49100-9.
- MacKay K. M., MacKay R. A. & Henderson W. 2002, Introduction to Modern Inorganic Chemistry, 6th ed., Nelson Thornes, Cheltenham, ISBN 978-0-7487-6420-4.
- Magee R. J. 1969, Steps to Atomic Power, Cheshire for La Trobe University, Melbourne.
- Magill F. N. I (ed.) 1992, Magill's Survey of Science, Physical Science series, vol. 3, Salem Press, Pasadena, ISBN 978-0-89356-621-0.
- Martin M. H. & Coughtrey P. J. 1982, Biological Monitoring of Heavy Metal Pollution, Applied Science Publishers, London, ISBN 978-0-85334-136-9.
- Massarani M. 2015, "Brazilian mine disaster releases dangerous metals Diarsipkan 2016-03-25 di Wayback Machine.," Chemistry World, November 2015, accessed 16 April 2016.
- Masters C. 1981, Homogenous Transition-metal Catalysis: A Gentle Art, Chapman and Hall, London, ISBN 978-0-412-22110-1.
- Matyi R. J. & Baboian R. 1986, "An X-ray Diffraction Analysis of the Patina of the Statue of Liberty", Powder Diffraction, vol. 1, no. 4, pp. 299–304, doi:10.1017/S0885715600011970.
- McColm I. J. 1994, Dictionary of Ceramic Science and Engineering, 2nd ed., Springer Science+Business Media, New York, ISBN 978-1-4419-3235-8.
- McCurdy R. M. 1975, Qualities and quantities: Preparation for College Chemistry, Harcourt Brace Jovanovich, New York, ISBN 978-0-15-574100-3.
- McLemore V. T. (ed.) 2008, Basics of Metal Mining Influenced Water, vol. 1, Society for Mining, Metallurgy, and Exploration, Littleton, Colorado, ISBN 978-0-87335-259-8.
- McQueen K. G. 2009, Regolith geochemistry, in K. M. Scott & C. F. Pain (eds), Regolith Science, CSIRO Publishing, Collingwood, Victoria, ISBN 978-0-643-09396-6.
- Mellor J. W. 1924, A comprehensive Treatise on Inorganic and Theoretical Chemistry, vol. 5, Longmans, Green and Company, London.
- Moore J. W. & Ramamoorthy S. 1984, Heavy Metals in Natural Waters: Applied Monitoring and Impact Assessment, Springer Verlag, New York, ISBN 978-1-4612-9739-0.
- Morris C. G. 1992, Academic Press Dictionary of Science and Technology, Harcourt Brace Jovanovich, San Diego, ISBN 978-0-12-200400-1.
- Morstein J. H. 2005, "Fat Man", in E. A. Croddy & Y. Y. Wirtz (eds), Weapons of Mass Destruction: An Encyclopedia of Worldwide Policy, Technology, and History, ABC-CLIO, Santa Barbara, California, ISBN 978-1-85109-495-0.
- Moselle B. (ed.) 2005, 2004 National Home Improvement Estimator, Craftsman Book Company, Carlsbad, California, ISBN 978-1-57218-150-2.
- Naja G. M. & Volesky B. 2009, "Toxicity and sources of Pb, Cd, Hg, Cr, As, and radionuclides", in L. K. Wang, J. P. Chen, Y. Hung & N. K. Shammas, Heavy Metals in the Environment, CRC Press, Boca Raton, Florida, ISBN 978-1-4200-7316-4.
- Nakbanpote W., Meesungneon O. & Prasad M. N. V. 2016, "Potential of ornamental plants for phytoremediation of heavy metals and income generation", in M. N. V. Prasad (ed.), Bioremediation and Bioeconomy, Elsevier, Amsterdam, pp. 179–218, ISBN 978-0-12-802830-8.
- Nathans M. W. 1963, Elementary Chemistry, Prentice Hall, Englewood Cliffs, New Jersey.
- National Materials Advisory Board 1971, Trends in the Use of Depleted Uranium, National Academy of Sciences – National Academy of Engineering, Washington DC.
- National Materials Advisory Board 1973, Trends in Usage of Tungsten, National Academy of Sciences – National Academy of Engineering, Washington DC.
- National Organization for Rare Disorders 2015, Heavy metal poisoning Diarsipkan 2015-06-14 di Wayback Machine., accessed 3 March 2016.
- Natural Resources Canada 2015, "Generation of the Earth's magnetic field Diarsipkan 2016-08-23 di Wayback Machine.", accessed 30 August 2016.
- Nieboer E. & Richardson D. 1978, "Lichens and 'heavy metals' ", International Lichenology Newsletter, vol. 11, no. 1, pp. 1–3.
- Nieboer E. & Richardson D. H. S. 1980, "The replacement of the nondescript term 'heavy metals' by a biologically and chemically significant classification of metal ions", Environmental Pollution Series B, Chemical and Physical, vol. 1, no. 1, pp. 3–26, doi:10.1016/0143-148X(80)90017-8.
- Nzierżanowski K. & Gawroński S. W. 2012, "Heavy metal concentration in plants growing on the vicinity of railroad tracks: a pilot study Diarsipkan 2016-09-16 di Wayback Machine.", Challenges of Modern Technology, vol. 3, no. 1, pp. 42–45, ISSN 2353-4419, accessed 21 August 2016.
- Ohlendorf H. M. 2003, "Ecotoxicology of selenium", in D. J. Hoffman, B. A. Rattner, G. A. Burton & J. Cairns, Handbook of Ecotoxicology, 2nd ed., Lewis Publishers, Boca Raton, pp. 466–491, ISBN 978-1-56670-546-2.
- Ondreička R., Kortus J. & Ginter E. 1971, "Aluminium, its absorption, distribution, and effects on phosphorus metabolism", in S. C. Skoryna & D. Waldron-Edward (eds), Intestinal Absorption of Metal Ions, Trace Elements and Radionuclides, Pergamon press, Oxford.
- Ong K. L., Tan T. H. & Cheung W. L. 1997, "Potassium permanganate poisoning—a rare cause of fatal poisoning", Journal of Accident & Emergency Medicine, vol. 14, no. 1, pp. 43–45, PMC 1342846.
- Oxford English Dictionary 1989, 2nd ed., Oxford University Press, Oxford, ISBN 978-0-19-861213-1.
- Pacheco-Torgal F., Jalali S. & Fucic A. (eds) 2012, Toxicity of building materials, Woodhead Publishing, Oxford, ISBN 978-0-85709-122-2.
- Padmanabhan T. 2001, Theoretical Astrophysics, vol. 2, Stars and Stellar Systems, Cambridge University Press, Cambridge, ISBN 978-0-521-56241-6.
- Pan W. & Dai J. 2015, "ADS based on linear accelerators", in W. Chao & W. Chou (eds), Reviews of accelerator science and technology, vol. 8, Accelerator Applications in Energy and Security, World Scientific, Singapore, pp. 55–76, ISBN 981-3108-89-4.
- Parish R. V. 1977, The Metallic Elements, Longman, New York, ISBN 978-0-582-44278-8.
- Perry J. & Vanderklein E. L. Water Quality: Management of a Natural Resource, Blackwell Science, Cambridge, Massachusetts ISBN 0-86542-469-1.
- Pickering N. C. 1991, The Bowed String: Observations on the Design, Manufacture, Testing and Performance of Strings for Violins, Violas and Cellos, Amereon, Mattituck, New York.
- Podosek F. A. 2011, "Noble gases", in H. D. Holland & K. K. Turekian (eds), Isotope Geochemistry: From the Treatise on Geochemistry, Elsevier, Amsterdam, pp. 467–492, ISBN 978-0-08-096710-3.
- Podsiki C. 2008, "Heavy metals, their salts, and other compounds Diarsipkan 2014-05-14 di Wayback Machine.", AIC News, November, special insert, pp. 1–4.
- Preschel J. July 29, 2005, "Green bullets not so eco-friendly Diarsipkan 2016-06-29 di Wayback Machine.", CBS News, accessed 18 March 2016.
- Preuss P. 17 July 2011, "What keeps the Earth cooking? Diarsipkan 2022-01-21 di Wayback Machine.," Berkeley Lab, accessed 17 July 2016.
- Prieto C. 2011, The Adventures of a Cello: Revised Edition, with a New Epilogue, University of Texas Press, Austin, ISBN 978-0-292-72393-1
- Raghuram P., Soma Raju I. V. & Sriramulu J. 2010, "Heavy metals testing in active pharmaceutical ingredients: an alternate approach", Pharmazie, vol. 65, no. 1, pp. 15–18, doi:10.1691/ph.2010.9222.
- Rainbow P. S. 1991, "The biology of heavy metals in the sea", in J. Rose (ed.), Water and the Environment, Gordon and Breach Science Publishers, Philadelphia, pp. 415–432, ISBN 978-2-88124-747-7.
- Rand G. M., Wells P. G. & McCarty L. S. 1995, "Introduction to aquatic toxicology", in G. M. Rand (ed.), Fundamentals of Aquatic Toxicology: Effects, Environmental Fate and Risk Assessment, 2nd ed., Taylor & Francis, London, pp. 3–70, ISBN 978-1-56032-090-6.
- Rankin W. J. 2011, Minerals, Metals and Sustainability: Meeting Future Material Needs, CSIRO Publishing, Collingwood, Victoria, ISBN 978-0-643-09726-1.
- Rasic-Milutinovic Z. & Jovanovic D. 2013, "Toxic metals", in M. Ferrante, G. Oliveri Conti, Z. Rasic-Milutinovic & D. Jovanovic (eds), Health Effects of Metals and Related Substances in Drinking Water, IWA Publishing, London, ISBN 978-1-68015-557-0.
- Raymond R. 1984, Out of the Fiery Furnace: The Impact of Metals on the History of Mankind, Macmillan, South Melbourne, ISBN 978-0-333-38024-6.
- Rebhandl W., Milassin A., Brunner L., Steffan I., Benkö T., Hörmann M., Burschen J. 2007, "In vitro study of ingested coins: Leave them or retrieve them?", Journal of Paediatric Surgery, vol. 42, no. 10, pp. 1729–1734, doi:10.1016/j.jpedsurg.2007.05.031.
- Rehder D. 2010, Chemistry in Space: From Interstellar Matter to the Origin of Life, Wiley-VCH, Weinheim, ISBN 978-3-527-32689-1.
- Renner H., Schlamp G., Kleinwächter I., Drost E., Lüchow H. M., Tews P., Panster P., Diehl M., Lang J., Kreuzer T., Knödler A., Starz K. A., Dermann K., Rothaut J., Drieselmann R., Peter C. & Schiele R. 2012, "Platinum Group Metals and compounds", in F. Ullmann (ed.), Ullmann's Encyclopedia of Industrial Chemistry, vol. 28, Wiley-VCH, Weinheim, pp. 317–388, doi:10.1002/14356007.a21_075.
- Reyes J. W. 2007, Environmental Policy as Social Policy? The Impact of Childhood Lead Exposure on Crime Diarsipkan 2007-09-29 di Wayback Machine., National Bureau of Economic Research Working Paper 13097, accessed 16 October 2016.
- Ridpath I. (ed.) 2012, Oxford Dictionary of Astronomy, 2nd ed. rev., Oxford University Press, New York, ISBN 978-0-19-960905-5.
- Rockhoff H. 2012, America's Economic Way of War: War and the US Economy from the Spanish–American War to the Persian Gulf War, Cambridge University Press, Cambridge, ISBN 978-0-521-85940-0.
- Roe J. & Roe M. 1992, "World's coinage uses 24 chemical elements", World Coinage News, vol. 19, no. 4, pp. 24–25; no. 5, pp. 18–19.
- Russell A. M. & Lee K. L. 2005, Structure–Property Relations in Nonferrous Metals, John Wiley & Sons, Hoboken, New Jersey, ISBN 978-0-471-64952-6.
- Rusyniak D. E., Arroyo A., Acciani J., Froberg B., Kao L. & Furbee B. 2010, "Heavy metal poisoning: Management of intoxication and antidotes", in A. Luch (ed.), Molecular, Clinical and Environmental Toxicology, vol. 2, Birkhäuser Verlag, Basel, pp. 365–396, ISBN 978-3-7643-8337-4.
- Ryan J. 2012, Personal Financial Literacy, 2nd ed., South-Western, Mason, Ohio, ISBN 978-0-8400-5829-4.
- Samsonov G. V. (ed.) 1968, Handbook of the Physicochemical Properties of the Elements, IFI-Plenum, New York, ISBN 978-1-4684-6066-7.
- Sanders R. 2003, "Radioactive potassium may be major heat source in Earth's core Diarsipkan 2013-08-26 di Wayback Machine.," UCBerkelyNews, 10 December, accessed 17 July 20016.
- Schweitzer P. A. 2003, Metallic materials: Physical, Mechanical, and Corrosion properties, Marcel Dekker, New York, ISBN 978-0-8247-0878-8.
- Schweitzer G. K. & Pesterfield L. L. 2010, The Aqueous Chemistry of the Elements, Oxford University Press, Oxford, ISBN 978-0-19-539335-4.
- Scott R. M. 1989, Chemical Hazards in the Workplace, CRC Press, Boca Raton, Orlando, ISBN 978-0-87371-134-0.
- Scoullos M. (ed.), Vonkeman G. H., Thornton I. & Makuch Z. 2001, Mercury — Cadmium — Lead Handbook for Sustainable Heavy Metals Policy and Regulation, Kluwer Academic Publishers, Dordrecht, ISBN 978-1-4020-0224-3.
- Selinger B. 1978, Chemistry in the Market Place, 2nd ed., Australian National University Press, Canberra, ISBN 978-0-7081-0728-7.
- Seymour R. J. & O'Farrelly J. 2012, "Platinum Group Metals", Kirk-Other Encyclopaedia of Chemical Technology, John Wiley & Sons, New York, doi:10.1002/0471238961.1612012019052513.a01.pub3.
- Shaw B. P., Sahu S. K. & Mishra R. K. 1999, "Heavy metal induced oxidative damage in terrestrial plants", in M. N. V. Prased (ed.), Heavy Metal Stress in Plants: From Biomolecules to Ecosystems Springer-Verlag, Berlin, ISBN 978-3-540-40131-5.
- Shedd K. B. 2002, "Tungsten" Diarsipkan 2019-01-11 di Wayback Machine., Minerals Yearbook, United States Geological Survey.
- Sidgwick N. V. 1950, The Chemical Elements and their Compounds, vol. 1, Oxford University Press, London.
- Silva R. J. 2010, "Fermium, mendelevium, nobelium, and lawrencium", in L. R. Morss, N. Edelstein & J. Fuger (eds), The Chemistry of the Actinide and Transactinide Elements, vol. 3, 4th ed., Springer, Dordrecht, pp. 1621–1651, ISBN 978-94-007-0210-3.
- Spolek G. 2007, "Design and materials in fly fishing", in A. Subic (ed.), Materials in Sports Equipment, Volume 2, Woodhead Publishing, Abington, Cambridge, pp. 225–247, ISBN 978-1-84569-131-8.
- Stankovic S. & Stankocic A. R. 2013, "Bioindicators of toxic metals", in E. Lichtfouse, J. Schwarzbauer, D. Robert 2013, Green materials for energy, products and depollution, Springer, Dordrecht, ISBN 978-94-007-6835-2, pp. 151–228.
- State Water Control Resources Board 1987, Toxic substances monitoring program, issue 79, part 20 of the Water Quality Monitoring Report, Sacramento, California.
- Technical Publications 1953, Fire Engineering, vol. 111, p. 235, ISSN 0015-2587.
- The Minerals, Metals and Materials Society, Light Metals Division 2016 Diarsipkan 2017-04-23 di Wayback Machine., accessed 22 June 2016.
- The United States Pharmacopeia 1985, 21st revision, The United States Pharmacopeial Convention, Rockville, Maryland, ISBN 978-0-913595-04-6.
- Thorne P. C. L. & Roberts E. R. 1943, Fritz Ephraim Inorganic Chemistry, 4th ed., Gurney and Jackson, London.
- Tisza M. 2001, Physical Metallurgy for Engineers, ASM International, Materials Park, Ohio, ISBN 978-0-87170-725-3.
- Tokar E. J., Boyd W. A., Freedman J. H. & Wales M. P. 2013, "Toxic effects of metals Diarsipkan 2021-07-07 di Wayback Machine.", in C. D. Klaassen (ed.), Casarett and Doull's Toxicology: the Basic Science of Poisons, 8th ed., McGraw-Hill Medical, New York, ISBN 978-0-07-176923-5, accessed 9 September 2016 (perlu berlangganan).
- Tomasik P. & Ratajewicz Z. 1985, Pyridine metal complexes, vol. 14, no. 6A, The Chemistry of Heterocyclic Compounds, John Wiley & Sons, New York, ISBN 978-0-471-05073-5.
- Topp N. E. 1965, The Chemistry of the Rare-earth Elements, Elsevier Publishing Company, Amsterdam.
- Torrice M. 2016, "How lead ended up in Flint's tap water Diarsipkan 2016-02-13 di Wayback Machine.," Chemical & Engineering News, vol. 94, no. 7, pp. 26–27.
- Tretkoff E. 2006, "March 20, 1800: Volta describes the Electric Battery Diarsipkan 2007-09-11 di Wayback Machine.", APS News, This Month in Physics History, American Physical Society, accessed 26 August 2016.
- Uden P. C. 2005, 'Speciation of Selenium,' in R. Cornelis, J. Caruso, H. Crews & K. Heumann (eds), Handbook of Elemental Speciation II: Species in the Environment, Food, Medicine and Occupational Health, John Wiley & Sons, Chichester, pp. 346–65, ISBN 978-0-470-85598-0.
- United States Environmental Protection Agency 1988, Ambient Aquatic Life Water Quality Criteria for Antimony (III), draft, Office of Research and Development, Environmental Research Laboratories, Washington.
- United States Environmental Protection Agency 2014, Technical Fact Sheet–Tungsten Diarsipkan 2020-11-06 di Wayback Machine., accessed 27 March 2016.
- United States Government 2014, Toxic Pollutant List Diarsipkan 2017-01-25 di Wayback Machine., Code of Federal Regulations, 40 CFR 401.15., accessed 27 March 2016.
- Valkovic V. 1990, "Origin of trace element requirements by living matter", in B. Gruber & J. H. Yopp (eds), Symmetries in Science IV: Biological and biophysical systems, Plenum Press, New York, pp. 213–242, ISBN 978-1-4612-7884-9.
- VanGelder K. T. 2014, Fundamentals of Automotive Technology: Principles and Practice, Jones & Bartlett Learning, Burlington MA, ISBN 978-1-4496-7108-2.
- Venner M., Lessening M., Pankani D. & Strecker E. 2004, Identification of Research Needs Related to Highway Runoff Management Diarsipkan 2016-08-22 di Wayback Machine., Transportation Research Board, Washington DC, ISBN 978-0-309-08815-2, accessed 21 August 2016.
- Venugopal B. & Luckey T. D. 1978, Metal Toxicity in Mammals, vol. 2, Plenum Press, New York, ISBN 978-0-306-37177-6.
- Vernon R. E. 2013, "Which elements are metalloids", Journal of Chemical Education, vol. 90, no. 12, pp. 1703–1707, doi:10.1021/ed3008457.
- Volesky B. 1990, Biosorption of Heavy Metals, CRC Press, Boca Raton, ISBN 978-0-8493-4917-1.
- von Gleich A. 2013, "Outlines of a sustainable metals industry", in A. von Gleich, R. U. Ayres & S. Gößling-Reisemann (eds), Sustainable Metals Management, Springer, Dordrecht, pp. 3–40, ISBN 978-1-4020-4007-8.
- von Zeerleder A. 1949, Technology of Light Metals, Elsevier Publishing Company, New York.
- Warth A. H. 1956, The Chemistry and Technology of Waxes, Reinhold Publishing Corporation, New York.
- Weart S. R. 1983, "The discovery of nuclear fission and a nuclear physics paradigm", in W. Shea (ed.), Otto Hahn and the Rise of Nuclear Physics, D. Reidel Publishing Company, Dordrecht, pp. 91–133, ISBN 978-90-277-1584-5.
- Weber D. J. & Rutula W. A. 2001, "Use of metals as microbicides in preventing infections in healthcare", in Disinfection, Sterilization, and Preservation, 5th ed., S. S. Block (ed.), Lippincott, Williams & Wilkins, Philadelphia, ISBN 978-0-683-30740-5.
- Weller G. 1976, Cleaning and Preservation of Coins and Medals, S. J. Durst, New York, ISBN 978-0-915262-03-8.
- White C. 2010, Projectile Dynamics in Sport: Principles and Applications, Routledge, London, ISBN 978-0-415-47331-6.
- Wiberg N. 2001, Inorganic Chemistry, Academic Press, San Diego, ISBN 978-0-12-352651-9.
- Wijayawardena M. A. A., Megharaj M. & Naidu R. 2016, "Exposure, toxicity, health impacts and bioavailability of heavy metal mixtures", in D. L. Sparks, Advances in Agronomy, vol. 138, pp. 175–234, Academic Press, London, ISBN 978-0-12-804774-3.
- Wingerson L. 1986, "America cleans up Liberty", New Scientist, 25 December/1 January 1987, pp. 31–35, accessed 1 October 2016.
- Wong M. Y., Hedley G. J., Xie G., Kölln L. S, Samuel I. D. W., Pertegaś A., Bolink H. J., Mosman-Colman, E., "Light-emitting electrochemical cells and solution-processed organic light-emitting diodes using small molecule organic thermally activated delayed fluorescence emitters", Chemistry of Materials, vol. 27, no. 19, pp. 6535–6542, doi:10.1021/acs.chemmater.5b03245.
- Wulfsberg G. 1987, Principles of Descriptive Inorganic Chemistry, Brooks/Cole Publishing Company, Monterey, California, ISBN 978-0-534-07494-4.
- Wulfsberg G. 2000, Inorganic Chemistry, University Science Books, Sausalito, California, ISBN 978-1-891389-01-6.
- Yadav J. S., Antony A., Subba Reddy, B. V. 2012, "Bismuth(III) salts as synthetic tools in organic transformations", in T. Ollevier (ed.), Bismuth-mediated Organic Reactions, Topics in Current Chemistry 311, Springer, Heidelberg, ISBN 978-3-642-27238-7.
- Yang D. J., Jolly W. L. & O'Keefe A. 1977, "Conversion of hydrous germanium(II) oxide to germynyl sesquioxide, (HGe)2O3", 'Inorganic Chemistry, vol. 16, no. 11, pp. 2980–2982, doi:10.1021/ic50177a070.
- Yousif N. 2007, Geochemistry of stream sediment from the state of Colorado using NURE data, ETD Collection for the University of Texas, El Paso, paper AAI3273991 Diarsipkan 2018-11-06 di Wayback Machine..
Bacaan lebih lanjut
Definisi dan penggunaan
- Duffus J.H. (2002), "'Heavy metals'—A meaningless term?", Pure and Applied Chemistry, 74 (5): 793–807, doi:10.1351/pac200274050793 Hapus pranala luar di parameter
|title=(bantuan). Termasuk survei tentang berbagai makna istilah ini. - Hawkes S.J. (1997), "What is a "heavy metal"?", Journal of Chemical Education, 74 (11): 1374, doi:10.1021/ed074p1374 Hapus pranala luar di parameter
|title=(bantuan). Perspektif seorang kimiawan. - Hübner R.; Astin K.B.; Herbert R.J.H. (2010), "'Heavy metal'—time to move on from semantics to pragmatics?", Journal of Environmental Monitoring, 12: 1511–1514, doi:10.1039/C0EM00056F. Dijumpai bahwa, meski tidak spesifik, istilah tersebut tampaknya telah menjadi bagian dari bahasa sains.
Toksisitas dan peran biologis
- Baird C. & Cann M. (2012), "12, Toxic heavy metals", Environmental Chemistry (edisi ke-5th), W. H. Freeman and Company, New York, ISBN 1-4292-7704-1. Membahas penggunaan, toksisitas, dan penyebaran Hg, Pb, Cd, As, dan Cr.
- Nieboer E. & Richardson D.H.S. (1980), "The replacement of the nondescript term 'heavy metals' by a biologically and chemically significant classification of metal ions", Environmental Pollution Series B, Chemical and Physical, 1 (1): 3–26, doi:10.1016/0143-148X(80)90017-8. Makalah yang banyak dikutip, fokus pada peran biologis logam berat.
Pembentukan
- Hadhazy A. (10 May 2016), "Galactic 'gold mine' explains the origin of nature's heaviest elements", Science Spotlights, diakses tanggal 11 July 2016
Penggunaan
- Koehler C.S.W. (2001), "Heavy metal medicine", Chemistry Chronicles, American Chemical Society, diakses tanggal 11 July 2016
- Morowitz N. (2006), "The heavy metals", Modern Marvels, HistoryChannel.com, season 12 (episode 14)
- Öhrström L. (24 September 2014), "Tantalum oxide", Chemistry World, diakses tanggal 4 October 2016. Penulis menjelaskan bagaimana tantalum(V) oksida menghancurkan ponsel berukuran batu bata. Juga tersedia sebagai podcast.
Pranala luar
 Media tentang Logam berat di Wikimedia Commons
Media tentang Logam berat di Wikimedia Commons






