Trifenilfosfina

| |

| |

| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Trifenilfosfana
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C18H15P | |
| Massa molar | 262,29 g·mol−1 |
| Penampilan | Padatan putih |
| Densitas | 1.1 g cm−3, padat |
| Titik didih | 377 °C |
| Tidak larut | |
| Kelarutan | pelarut organik |
| Keasaman (pKa) | 7.61[1] (pKa asam konjugat dalam asetonitril) |
| -166.8·10−6 cm3/mol | |
| Indeks bias (nD) | 1.59; εr, dll. |
| Struktur | |
| Piramidal | |
| 1.4 - 1.44 D [2] | |
| Bahaya | |
| Lembar data keselamatan | JT Baker |
Klasifikasi UE (DSD) (usang)
|
Tidak terdaftar |
| Frasa-R | R20 R22 R40 R43 R50 R53 |
| Frasa-S | S36 S37 S45 S57 S60 |
| Titik nyala | 180 °C (356 °F; 453 K) |
| Senyawa terkait | |
Related fosfina tersier
|
Trimetilfosfina Fosfina |
Senyawa terkait
|
Trifenilamina Trifenilarsin Trifenilfosfina oksida Trifenilfosfina sulfida Trifenilfosfina diklorida Trifenilfosfina selenida, Pd(PPh3)4 |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Trifenilfosfina (nama IUPAC: trifenilfosfana) adalah suatu senyawa organofosforus umum dengan rumus kimia P(C6H5)3 - terkadang disingkat sebagai PPh3 atau Ph3P. Senyawa ini banyak digunakan dalam sintesis senyawa organik dan organologam. PPh3 hadir sebagai kristal yang stabil di udara dan tidak berwarna pada suhu kamar. Senyawa ini larut dalam pelarut organik non-polar seperti benzena dan dietil eter.
Persiapan, struktur dan bawaan
[sunting | sunting sumber]Trifenilfosfina adalah zat yang relatif murah. Senyawa ini dapat disiapkan di laboratorium dengan perlakuan fosforus triklorida dengan fenilmagnesium bromida atau fenillitium. Sintesis industri melibatkan reaksi antara fosforus triklorida, klorobenzena, dan natrium:[3]
- PCl3 + 3PhCl + 6Na → PPh3 + 6NaCl
Reaksi dasar dengan kalkogen, halogen, dan asam
[sunting | sunting sumber]Trifenilfosfina mengalami oksidasi lambat oleh udara untuk menghasilkan trifenilfosfina oksida, Ph3PO:
- 2 PPh3 + O2 → 2 OPPh3
Pengotornya dapat dimurnikan dengan rekristalisasi PPh3 baik dari etanol panas atau isopropanol panas.[4] Metode ini dilakukan berdasarkan fakta bahwa OPPh3 lebih polar dan karenanya lebih larut dalam pelarut polar dibandingkan PPh3.
Trifenilfosfina mengabstraksi belerang dari senyawa polisulfida, episulfida, dan unsur belerang. Senyawa organosulfur sederhana seperti tiol dan tioeter tidak reaktif. Produk yang mengandung fosforus ini adalah trifenilfosfina sulfida, Ph3PS. Reaksi ini dapat dilakukan untuk menguji kandungan S0 "labil" pada sampel, seperti karet vulkanisir. Trifenilfosfina selenida, Ph3PSe, dapat disiapkan dengan mudah dari PPh3 dengan Se merah (alfa-monoklinik). Garam selenosianat, SeCN−, digunakan sebagai sumber Se0. PPh3 dapat pula membetuk aduk dengan Te, walaupun aduk ini hadir sebagai (Ph3P)2Te daripada PPh3Te.[5]
Aril azida bereaksi dengan PPh3 untuk menghasilkan fosfanimina, analog dari OPPh3, melalui reaksi Staudinger. Ilustrasi berikut adalah preparasi trifenilfosfina fenilimida:
- PPh3 + PhN3 → PhNPPh3 + N2
Fosfanimina dapat dihidrolisis menjadi amina. Biasanya zat antara fosfanimina tidak diisolasi.
- PPh3 + RN3 + H2O → OPPh3 + N2 + RNH2
Cl2 ditambahkan pada PPh3 untuk menghasilkan trifenilfosfina diklorida ([PPh3Cl]Cl), yang hadir sebagai fosfonium halida yang sensitif terhadap kelembaban. Pereaksi ini digunakan untuk mengubah alkohol menjadi alkil klorida dalam sintesis organik.
PPh3 adalah basa lemah, namun membentuk garam stabil dengan asam kuat seperti HBr. Produknya mengandung kation fosfonium [HPPh3]+.
PPh3 berbentuk piramidal dengan suatu penataan seperti baling-baling kiral dari tiga cincin fenil. kekakuan PPh3 memberikan kontribusi terhadap kemudahan yang dengannya derivatifnya mengkristal.
Reaksi organik dasar
[sunting | sunting sumber]PPh3 sangat luas digunakan dalam sintesis organik.Sifat-sifat yang memandu penggunaannya adalah nukleofilisitas dan karakter reduksinya.[6] Nukleofilisitas PPh3 ditunjukkan oleh reaktivitasnya terhadap alkena elektrofilik, seperti akseptor Michael, dan alkil halida. Senyawa ini juga digunakan dalam sintesis senyawa biaryl, seperti reaksi Suzuki.
PPh3 bergabung dengan sebagian besar alkil halida untuk menghasilkani garam fosfonium. Fasilitas reaksi ini mengikuti pola yang biasa dimana alkil iodida dan halida benzil dan alilik adalah reaktan yang sangat efisien.:
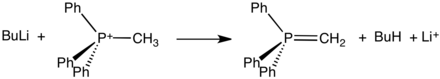
- PPh3 + CH3I → [CH3PPh3]+I−
Garam tersebut, yang mudah terisolasi sebagai padatan kristal, bereaksi dengan basa kuat untuk membentuk ilida:
Ilida tersebut adalah pereaksi kunci dalam reaksi Wittig, yang digunakan untuk mengubah aldehida dan keton menjadi alkena. Garam nikel dibutuhkan untuk mereaksikan PPh3 dengan PhBr untuk menghasilkan [PPh4]Br. Kation tetrafenilfosfonium banyak digunakan untuk menyiapkan garam lipofilik yang mudah mengkristal.
Reaksi Mitsunobu
[sunting | sunting sumber]Dalam reaksi ini, campuran PPh3 dan diisopropil azodikarboksilat ("DIAD", atau analog dietilnya, DEAD) mengubah suatu alkohol dan asam karboksilat menjadi ester. DIAD direduksi karena berfungsi sebagai akseptor hidrogen, dan PPh3 dioksidasi menjadi OPPh3.
Reaksi Appel
[sunting | sunting sumber]Dalam reaksi ini, PPh3 dan CX4 (X = Cl, Br) digunakan untuk mengubah alkohol menjadi alkil halida, membentuk OPPh3 sebagai produk samping.
- PPh3 + CBr4 + RCH2OH → OPPh3 + RCH2Br + HCBr3
Reaksi ini dimulai dengan serangan nukleofilik PPh3 pada CBr4, perpanjangan dari reaksi kuarternisasi yang tercantum di atas.
Deoksigenasi
[sunting | sunting sumber]Oksigenasi mudah dari PPh3 dieksploitasi dalam penggunaannya untuk mengoksidasi peroksida organik, yang umumnya terjadi dengan retensi konfigurasi:
- PPh3 + RO2H → OPPh3 + ROH (R = alkil)
Senyawa ini digunakan pula dalam penguraian ozonida organik menjadi keton dan aldehida, walaupun dimetil sulfida lebih populer untuk reaksi karena produk sampingannya, dimetil sulfoksida lebih mudah dipisahkan dari campuran reaksi daripada trifenilfosfina oksida. Aromatik N-oksida direduksi menjadi amina yang sesuai dengan hasil tinggi pada suhu kamar dengan iradiasi:[7]
Sulfonasi
[sunting | sunting sumber]Sulfonasi PPh3 menghasilkan tris(3-sulfofenil)fosfina, P(C6H4-3-SO3−)3. Fosfina anionik ini biasanya diisolasi sebagai garam trinatrium dan dikenal sebagai TPPTS. Berbeda dengan PPh3, TPPTS larut dalam air, begitu pula turunan logamnya. Kompleks Rodium TPPTS digunakan dalam reaksi hidroformilasi industri tertentu karena katalis yang larut dalam air mudah dipisahkan dari produk organik.[8]
Lihat pula
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ Kaljurand, I.; Kütt, A.; Sooväli, L.; Rodima, T.; Mäemets, V.; Leito, I.; Koppel, I. A. (2005). "Extension of the Self-Consistent Spectrophotometric Basicity Scale in Acetonitrile to a Full Span of 28 pKa Units: Unification of Different Basicity Scales". J. Org. Chem. 70: 1019–1028. doi:10.1021/jo048252w. PMID 15675863.
- ^ Warchol, M.; Dicarlo, E. N.; Maryanoff, C. A.; Mislow, K. (1975). "Evidence for the Contribution of the Lone Pair to the Molecular Dipole Moment of Triarylphosphines". Tetrahedron Letters. 16 (11): 917–920. doi:10.1016/S0040-4039(00)72019-3.
- ^ Corbridge, D. E. C. Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology (edisi ke-5th). Amsterdam: Elsevier. ISBN 0-444-89307-5.
- ^ Armarego, W. L. F.; Perrin, D. D.; Perrin, D. R. (1980). Purification of Laboratory Chemicals (edisi ke-2nd). New York: Pergamon. hlm. 455. ISBN 9780080229614.
- ^ Jones, C. H. W.; Sharma, R. D. (1987). "125Te NMR and Mössbauer Spectroscopy of Tellurium-Phosphine Complexes and the Tellurocyanates". Organometallics. 6 (7): 1419–1423. doi:10.1021/om00150a009.
- ^ Cobb, J. E.; Cribbs, C. M.; Henke, B. R.; Uehling, D. E.; Hernan, A. G.; Martin, C.; Rayner, C. M. (2004). "Triphenylphosphine". Dalam L. Paquette. Encyclopedia of Reagents for Organic Synthesis. New York: J. Wiley & Sons. doi:10.1002/047084289X.rt366.pub2.
- ^ Burke, S. D.; Danheiser, R. L. (1999). "Triphenylphosphine". Handbook of Reagents for Organic Synthesis, Oxidizing and Reducing Agents. Wiley. hlm. 495. ISBN 978-0-471-97926-5.
- ^ Herrmann, W. A.; Kohlpaintner, C. W. (1998). "Syntheses of Water-Soluble Phosphines and Their Transition Metal Complexes". Inorg. Synth. 32: 8–25. doi:10.1002/9780470132630.ch2. ISBN 978-0-470-13263-0.