Butana: Perbedaan antara revisi
Tampilan
Konten dihapus Konten ditambahkan
k Bot: Mengganti Butane-2D-Skeletal.svg dengan Butane_skeletal.svg |
k Bot: Mengganti Butane.svg dengan Butan_Lewis.svg |
||
| Baris 76: | Baris 76: | ||
|- |
|- |
||
|bgcolor="#ddeeff" |Gambar<br />molekul |
|bgcolor="#ddeeff" |Gambar<br />molekul |
||
|[[Image: |
|[[Image:Butan_Lewis.svg|150px]] |
||
|[[Image:Isobutane.png|120px]] |
|[[Image:Isobutane.png|120px]] |
||
|- |
|- |
||
Revisi per 8 Mei 2012 13.46
| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC (preferensi)
butane | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Nomor EC | |||
| KEGG | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C4H10 | |||
| Massa molar | 58,12 g·mol−1 | ||
| Penampilan | Gas tidak berwarna | ||
| Densitas | 2.48 kg/m3, gas (15 °C, 1 atm) 600 kg/m3, cairan (0 °C, 1 atm) | ||
| Titik lebur | −138.4 °C (135.4 K) | ||
| Titik didih | −0.5 °C (272.6 K) | ||
| 6.1 mg/100 ml (20 °C) | |||
| Bahaya | |||
Klasifikasi UE (DSD) (usang)
|
Mudah terbakar (F+) | ||
| Titik nyala | −60 °C | ||
| Ambang ledakan | 1.8 – 8.4% [1] | ||
| Senyawa terkait | |||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Butana, juga disebut n-butana, adalah alkana rantai lurus dengan empat atom karbon CH3CH2CH2CH3. Butana juga digunakan sebagai istilah kolektif untuk n-butana dan satu-satunya isomernya, isobutana (disebut juga metilpropana), CH(CH3)3. Butana sangat mudah terbakar, tidak berwarna, dan merupakan gas yang mudah dicairkan. Nama butana diturunkan dari nama asam butirat.
Isomer
| Nama umum | normal butana butana tak bercabang n-butana |
isobutana i-butana |
| Nama IUPAC | butana | metil propana |
| Gambar molekul |

|
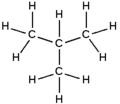
|
| Diagram kerangka |

|
Reaksi
Ketika oksigen tersedia dalam jumlah yang melimpah, maka butana akan terbakar dan membentuk karbon dioksida dan uap air. Sedangkan, apabila oksigen jumlahnya terbatas, maka akan terbentuk karbon monoksida.
- 2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
n-Butana juga dipakai sebagai bahan baku dalam proses katalis DuPont untuk membentuk maleat anhidrat:
- 2 CH3CH2CH2CH3 + 7 O2 → 2 C2H2(CO)2O + 8 H2O
Referensi
Pranala luar
- (Inggris) International Chemical Safety Card 0232
- (Inggris) NIOSH Pocket Guide to Chemical Hazards
- (Inggris) n-Butane Molecule of the Month
- (Inggris) Computational Chemistry Wiki




