Asam klorat
| |

| |
| Nama | |
|---|---|
| Nama lain
Asam klorat(V)
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
| Nomor UN | 2626 |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
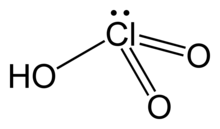
| HClO3 | |
| Massa molar | 84.45914 g mol−1 |
| Penampilan | larutan bening |
| Densitas | 1 g/mL, larutan (perkiraan) |
| >40 g/100 ml (20 °C) | |
| Keasaman (pKa) | ~ −1 |
| Basa konjugat | Klorat |
| Struktur | |
| Piramida | |
| Bahaya | |
| Bahaya utama | Oxidant, Corrosive |
| Piktogram GHS |  
|
| Keterangan bahaya GHS | {{{value}}} |
| H271, H314 | |
| P210, P220, P221, P260, P264, P280, P283, P301+330+331, P303+361+353, P304+340, P305+351+338, P306+360, P310, P321, P363, P370+378, P371+380+375, P405, P501 | |
| Senyawa terkait | |
Anion lain
|
asam bromat asam iodat |
Kation lainnya
|
amonium klorat natrium klorat kalium klorat |
Senyawa terkait
|
asam klorida asam hipoklorit asam klorit asam perklorat |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Asam klorat, HClO3, adalah suatu asam okso dari klorin, dan prekursor utama garam klorat. Senyawa ini adalah asam kuat (pKa ≈ −2.7) dan agen pengoksidasi.[1]
Sifat
Asam klorta secara termodinamika tidak stabil akibat disproporsionasi.[1]
Asam klorat stabil dalam larutan berair dingin hingga konsentrasi sekitar 30%, dan larutan hingga 40% dapat dibuat dengan penguapan hati-hati di bawah tekanan yang dikurangi. Di atas konsentrasi ini, larutan asam klorat terurai untuk menghasilkan berbagai produk, misalnya:[1]
- 8 HClO3 → 4 HClO4 + 2 H2O + 2 Cl2 + 3 O2
- 3 HClO3 → HClO4 + H2O + 2 ClO2
Bahaya
Asam klorat adalah oksidator kuat. Sebagian besar bahan organik dan mudah terbakar akan terkelupas jika terkena zat ini.[2]
Produksi
Senyawa ini dapat disiapkan dari reaksi asam sulfat dengan barium klorat, barium sulfat yang tak larut dihilangkan dengan presipitasi:[1]
- Ba(ClO3)2 + H2SO4 → 2 HClO3 + BaSO4
Metode lainnya adalah dengan pemanasan asam hipoklorit, menghasilkan asam klorat dan hidrogen klorida:[1]
- 3 HClO → HClO3 + 2 HCl
Lihat pula
Referensi
- ^ a b c d e Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ R. Bruce King, ed. (1994). "Chloric acid". Encyclopedia of Inorganic Chemistry. 2. Chichester: Wiley. hlm. 658. ISBN 0-471-93620-0.
