Belerang tetrafluorida
| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Belerang(IV) fluorida
| |||
| Nama lain
Belerang tetrafluorida
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| Nomor UN | 2418 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| SF4 | |||
| Massa molar | 108.07 g/mol | ||
| Penampilan | gas tak berwarna | ||
| Densitas | 1.95 g/cm3, −78 °C | ||
| Titik lebur | −121.0 °C | ||
| Titik didih | −38 °C | ||
| bereaksi | |||
| Tekanan uap | 10.5 atm (22 °C)[1] | ||
| Struktur | |||
| Jungkat-jungkit (C2v) | |||
| 0.632 D[2] | |||
| Bahaya | |||
| Bahaya utama | sangat beracun korosif | ||
| Lembar data keselamatan | ICSC 1456 | ||
| Batas imbas kesehatan AS (NIOSH): | |||
PEL (yang diperbolehkan)
|
tidak ada[1] | ||
REL (yang direkomendasikan)
|
C 0.1 ppm (0.4 mg/m3)[1] | ||
IDLH (langsung berbahaya)
|
N.D.[1] | ||
| Senyawa terkait | |||
Anion lain
|
Belernag diklorida Disulfur dibromida Belerang trifluorida | ||
Kation lainnya
|
Oksigen difluorida Selenium tetrafluorida Telurium tetrafluorida Polonium tetrafluorida | ||
Related belerang fluorida
|
Disulfur difluorida Belerang difluorida Disulfur dekafluorida Belerang heksafluorida | ||
Senyawa terkait
|
Tionil fluorida | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Belerang tetrafluorida adalah senyawa kimia dengan rumus SF4. Spesi ini hadir sebagai gas pada kondisi standar. Senyawa ini adalah spesi korosif yang melepaskan asam HF yang berbahaya saat terpapar air atau uap air. Terlepas dari karakteristik yang tidak diinginkan ini, senyawa ini merupakan pereaksi kimia berguna untuk pembuatan senyawa organofluorin,[3] beberapa di antaranya penting dalam industri farmasi dan industri kimia.
Struktur
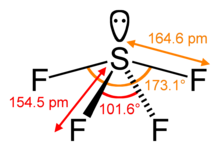
[sunting | sunting sumber]Belerang dalam SF4 berada dalam keadaan oksidasi formal +4. Dari total enam elektron valensi pada belerang, dua membentuk pasangan elektron sunyi. Struktur SF4 oleh karena itu, dapat diantisipasi dengan menggunakan prinsip teori VSEPR: molekul berbentuk jungkat-jungkit, dengan S di tengahnya. Salah satu dari tiga posisi ekuatorial ditempati oleh sepasang elektron ikatan. Akibatnya, molekul tersebut memiliki dua jenis ligan F yang berbeda, dua aksial dan dua ekuatorial. Jarak ikatan yang relevan adalah S–Fax = 164.3 pm dan S–Feq = 154.2 pm. Hal ini tipikal bagi ligan aksial dalam molekul hipervalensi untuk terikat kurang kuat. Berlawanan dengan SF4, molekul terkait SF6 memiliki belerang dalam keadaan +6, tidak ada elektron valensi yang tetap tidak terikat pada belerang, oleh karena itu molekul tersebut mengadopsi struktur oktahedral yang sangat simetris. Lebih jauh kontras dengan SF4, SF6 sangat inert secara kimia.
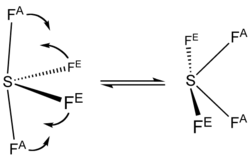
Spektrum 19F NMR dari SF4 hanya menunjukkan satu sinyal, yang mengindikasikan bahwa posisi atom F aksial dan ekuatorial dengan cepat saling dipertukarkan melalui pseudorotasi.[4]
Sintesis dan produksi
[sunting | sunting sumber]SF4 diproduksi melalui reaksi SCl2, Cl2, dan NaF:
- SCl2 + Cl2 + 4 NaF → SF4 + 4 NaCl
Perlakuan SCl2 dengan NaF juga menyediakan SF4, bukan SF2. SF2 tidak stabil, mengembun dengan sendirinya untuk membentuk SF4 dan SSF2.[5]
Reaksi
[sunting | sunting sumber]Belerang klorida pentafluorida (SF5Cl), suatu sumber berguna dari kelompok SF5, disiapkan dari SF4.[6]
Hidrolisis SF4 menghasilkan belerang dioksida:[7]
SF4 + 2 H2O → SO2 + 4 HF
Reaksi ini berlanjut melalui intermediasi tionil fluorida, yang biasanya tidak mengganggu penggunaan SF4 sebagai pereaksi.[5]
Penggunaan dalam sintesis fluorokarbon
[sunting | sunting sumber]Dalam sintesis organik, SF4 digunakan untuk mengubah gugus COH dan C=O menjadi gugus CF dan CF2, berturut-turut.[8] Alkohol tertentu dengan mudah menghasilkan fluorokarbon yang sesuai. Keton dan aldehida memberikan difluorida geminal. Kehadiran proton alfa pada karbonil menyebabkan reaksi samping dan hasil berkurang (30-40%). Juga diol dapat memberikan ester sulfit siklik, (RO)2SO. Asam karboksilat diubah menjadi turunan trifluorometil. Misalnya perlakuan asam heptanoat dengan SF4 pada suhu 100-130 °C menghasilkan 1,1,1-trifluoroheptana. Heksafluoro-2-butuna Dapat juga dihasilkan dari asam asetilendikarboksilat. Koproduk dari fluorinasi ini, termasuk SF4 yang tidak bereaksi bersama dengan SOF2 dan SO2, bersifat toksik namun dapat dinetralkan dengan perlakuannya dengan KOH berair.
Penggunaan SF4 sedang digantikan dalam beberapa tahun terakhir oleh dietilaminosulfur trifluorida yang lebih mudah ditangani, Et2NSF3, "DAST", di mana Et = CH3CH2.[9] Pereaksi ini disiapkan dari SF4:[10]
- SF4 + Me3SiNEt2 → Et2NSF3 + Me3SiF
Toksisitas
[sunting | sunting sumber]SF4 bereaksi di dalam paru-paru dengan kelembaban:[11]
- SF4 + 2 H2O → SO2 + 4 HF
Referensi
[sunting | sunting sumber]- ^ a b c d "NIOSH Pocket Guide to Chemical Hazards #0580". National Institute for Occupational Safety and Health (NIOSH).
- ^ Tolles, W. M.; W. M. Gwinn, W. D. (1962). "Structure and Dipole Moment for SF4". J. Chem. Phys. 36 (5): 1119–1121. doi:10.1063/1.1732702.
- ^ C.-L. J. Wang, "Sulfur Tetrafluoride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289.
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ a b F. S. Fawcett, C. W. Tullock, "Sulfur (IV) Fluoride: (Sulfur Tetrafluoride)" Inorganic Syntheses, 1963, vol. 7, pp 119–124. doi:10.1002/9780470132388.ch33
- ^ Nyman, F., Roberts, H. L., Seaton, T. Inorganic Syntheses, 1966, Volume 8, p. 160 McGraw-Hill Book Company, Inc., 1966, DOI:10.1002/9780470132395.ch42
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ Hasek, W. R.. "1,1,1-Trifluoroheptane". Org. Synth.; Coll. Vol. 5: 1082.
- ^ A. H. Fauq, "N,N-Diethylaminosulfur Trifluoride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289.
- ^ W. J. Middleton, E. M. Bingham. "Diethylaminosulfur Trifluoride". Org. Synth.; Coll. Vol. 6: 440.
- ^ Johnston, H. (2003). A Bridge not Attacked: Chemical Warfare Civilian Research During World War II. World Scientific. hlm. 33–36. ISBN 981-238-153-8.


