Melioidosis: Perbedaan antara revisi
Hanamanteo (bicara | kontrib) + |
Hanamanteo (bicara | kontrib) + |
||
| Baris 67: | Baris 67: | ||
== Patogenesis == |
== Patogenesis == |
||
[[Berkas:Pathogenesis of melioidosis.svg|thumb|upright=1.3|alt= Diagram showing the pathogenesis of melioidosis | Ways of ''B. pseudomallei'' bacteria infecting human cells and blood stream.]] |
[[Berkas:Pathogenesis of melioidosis.svg|thumb|upright=1.3|alt= Diagram showing the pathogenesis of melioidosis | Ways of ''B. pseudomallei'' bacteria infecting human cells and blood stream.]] |
||
''Burkholderia pseudomallei'' memiliki kemampuan untuk menjangkiti pelbagai jenis sel dan menghindari respons imun manusia. Bakteri pertama-tama masuk ke dalam celah di kulit atau selaput lendir dan bereplikasi di sel epitel. |
''Burkholderia pseudomallei'' memiliki kemampuan untuk menjangkiti pelbagai jenis sel dan menghindari respons imun manusia. Bakteri pertama-tama masuk ke dalam celah di kulit atau selaput lendir dan bereplikasi di sel epitel. Dari sana, bakteri ini menggunakan motilitas [[flagela]] untuk menyebar dan menjangkiti pelbagai jenis sel. Dalam aliran darah, bakteri ini dapat menjangkiti baik [[fagosit]] dan nonfagosit. ''Burkholderia pseudomallei'' menggunakan flagela untuk bergerak mendekati sel [[inang]], kemudian menempel pada sel menggunakan pelbagai protein adhesi termasuk protein [[pilus]] tipe IV PilA dan protein adhesi BoaA dan BoaB. Selain itu, adhesi bakteri sebagian tergantung pada keberadaan [[reseptor faktor II koagulasi|reseptor-1 yang diaktifkan protease]] protein inang yang ada pada permukaan [[endotelium|sel endotel]], [[keping darah]], dan [[monosit]]. Setelah terikat, bakteri ini memasuki sel inang melalui [[endositosis]] dan berakhir di dalam [[vesikel]] endositik. Saat vesikel menjadi asam, ''Burkholderia pseudomallei'' menggunakan sistem sekresi tipe 3 (T3SS) untuk menyuntikkan protein efektor ke dalam sel inang, mengganggu vesikel dan membiarkan bakteri keluar ke sitoplasma inang. Dalam sitoplasma inang, bakteri menghindari dibunuh oleh autofagi inang menggunakan berbagai protein efektor T3SS. Bakteri bereplikasi di sitoplasma inang.<ref name="Joost 2018"/><ref name="Gassiep 2020"/> |
||
Inside the host cell, the bacteria move by inducing the polymerization of the host [[actin]] behind them, propelling the bacteria forward.<ref name="Joost 2018"/> This actin-mediated motility is accomplished with the [[Secretion#Type V secretion system .28T5SS.29|autotransporter]] BimA, which interacts with actin at the tail-end of the bacterium. Propelled by actin, the bacteria push against the host membrane, creating protrusions that extend into neighbouring cells. These protrusions cause neighboring cells to fuse, leading to the formation of [[multinucleated giant cells]] (MNGCs). When MNGCs lyse, they form plaques (a central clear area with a ring of fused cells) that provide shelter for the bacteria for further replication or [[latent infection]]. This same process in infected neurons can allow bacteria to travel through nerve roots in the spinal cord and brain, leading to [[encephalomyelitis|inflammation of the brain and spinal cord]]. Besides spreading from cell to cell, the bacteria can also spread through the bloodstream, causing sepsis. The bacteria can survive in [[antigen-presenting cell]]s and [[dendritic cell]]s. Thus, these cells act as vehicles that transport the bacteria into the lymphatic system, causing widespread dissemination of the bacteria in the human body.<ref name="Joost 2018"/><ref name="Gassiep 2020"/> |
Inside the host cell, the bacteria move by inducing the polymerization of the host [[actin]] behind them, propelling the bacteria forward.<ref name="Joost 2018"/> This actin-mediated motility is accomplished with the [[Secretion#Type V secretion system .28T5SS.29|autotransporter]] BimA, which interacts with actin at the tail-end of the bacterium. Propelled by actin, the bacteria push against the host membrane, creating protrusions that extend into neighbouring cells. These protrusions cause neighboring cells to fuse, leading to the formation of [[multinucleated giant cells]] (MNGCs). When MNGCs lyse, they form plaques (a central clear area with a ring of fused cells) that provide shelter for the bacteria for further replication or [[latent infection]]. This same process in infected neurons can allow bacteria to travel through nerve roots in the spinal cord and brain, leading to [[encephalomyelitis|inflammation of the brain and spinal cord]]. Besides spreading from cell to cell, the bacteria can also spread through the bloodstream, causing sepsis. The bacteria can survive in [[antigen-presenting cell]]s and [[dendritic cell]]s. Thus, these cells act as vehicles that transport the bacteria into the lymphatic system, causing widespread dissemination of the bacteria in the human body.<ref name="Joost 2018"/><ref name="Gassiep 2020"/> |
||
Revisi per 31 Oktober 2021 18.00
Halaman ini sedang dipersiapkan dan dikembangkan sehingga mungkin terjadi perubahan besar. Anda dapat membantu dalam penyuntingan halaman ini. Halaman ini terakhir disunting oleh Hanamanteo (Kontrib • Log) 909 hari 844 menit lalu. Jika Anda melihat halaman ini tidak disunting dalam beberapa hari, mohon hapus templat ini. |
| Melioidosis | |
|---|---|
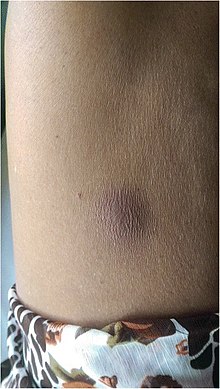 | |
| Bisul melioidosis di perut | |
| Informasi umum | |
| Spesialisasi | Penyakit menular |
| Penyebab | Burkholderia pseudomallei spread by contact to soil or water[1] |
| Faktor risiko | Diabetes mellitus, thalassaemia, alcoholism, chronic kidney disease[1] |
| Aspek klinis | |
| Gejala dan tanda | Tiada, demam, radang paru-paru, beberapa bisul[1] |
| Komplikasi | Encephalomyelitis, septic shock, acute pyelonephritis, septic arthritis, osteomyelitis[1] |
| Awal muncul | 1-21 hari setelah terjangkit[1] |
| Diagnosis | Mengembangkan bakteri di perantara kultur[1] |
| Kondisi serupa | Tuberculosis[2] |
| Tata laksana | |
| Pencegahan | Mencegah dari kontak dengan air yang terkontaminasi, profilaksis antibiotik[1] |
| Perawatan | Ceftazidime, meropenem, co-trimoxazole[1] |
| Distribusi dan frekuensi | |
| Prevalensi | 165,000 orang tiap tahun[1] |
| Kematian | 89,000 orang tiap tahunr[1] |
Melioidosis adalah penyakit infeksi yang disebabkan oleh bakteri Gram-negatif bernama Burkholderia pseudomallei.[1] Kebanyakan orang yang dijangkiti Burkholderia pseudomallei tidak mengalami satupun gejala, tetapi mereka yang mengalami gejala memiliki tanda dan gejala dari gejala ringan seperti demam, perubahan kulit, radang paru-paru, dan bisul, hingga gejala berat seperti radang otak, radang sendi, dan tekanan darah rendah yang berbahaya yang menyebabkan kematian.[1] Sekitar 10% dari orang penderita melioidosis mengalami gejala yang berlangsung lebih dari dua bulan yang disebut melioidosis kronis.[1]
Manusia dijangkiti Burkholderia pseudomallei melalui kontak dengan air yang tercemar. Bakteri ini masuk ke dalam tubuh melalui luka, tarikan napas, atau penelanan. Penularan dari manusia ke manusia atau dari hewan ke manusia sangat jarang terjadi.[1] Infeksi ini masih ada di Asia Tenggara, khususnya di timur laut Thailand dan utara Australia.[1] Di negara-negara maju seperti Eropa dan Amerika Serikat, kasus melioidosis umumnya diimpor dari negara-negara tempat melioidosis lebih sering terjadi.[3] Tanda dan gejala melioidosis menyerupai tuberkulosis dan sering terjadi kesalahan diagnosis.[4][2] Diagnosis biasanya dikonfirmasi oleh pertumbuhan Burkholderia pseudomallei dari darah atau cairan tubuh orang yang dijangkiti lainnya.[1] Mereka yang menderita melioidosis pertama-tama diobati dengan antibiotik intravena "fase intensif" (paling sering seftazidima) diikuti dengan pengobatan kotrimoksazol selama beberapa bulan.[1] Bahkan jika dirawat dengan cermat, sekitar 10% penderita melioidosis meninggal karenanya. Jika tidak ditangani dengan cermat, tingkat kematian bisa melonjak hingga 40%.[1]
Upaya pencegahan melioidosis antara lain memakai alat pelindung diri saat menangani air yang terkontaminasi, membiasakan kebersihan tangan, minum air matang, dan menghindari kontak langsung dengan tanah, air, atau hujan lebat. Antibiotik kotrimoksazol hanya digunakan sebagai pencegahan untuk individu yang berisiko tinggi terkena melioidosis setelah terpapar bakteri. Tiada vaksin untuk melioidosis yang telah disetujui.[1]
Sekitar 165 ribu orang dijangkiti melioidosis tiap tahun dan menewaskan 89 ribu orang. Diabetes adalah faktor risiko utama penyakit melioidosis dengan lebih dari setengah kasus melioidosis terjadi pada penderita diabetes.[1] Peningkatan curah hujan dikaitkan dengan lonjakan jumlah kasus melioidosis di daerah endemi.[2] Melioidosis pertama kali dideskripsikan oleh Alfred Whitmore pada tahun 1912 di wilayah yang saat ini bernama Myanmar.[5]
Tanda dan gejala
Akut




Pajanan terhadap Burkholderia pseudomallei biasanya dapat menyebabkan antibodi diproduksi untuk melawan bakteri itu tanpa gejala apapun. Dari pasien yang menderita infeksi klinis, 85% pasien mengalami gejala akut dari pemerolehan bakteri terkini.[1][6][7] Masa inkubasi rata-rata melioidosis akut adalah 9 hari (kisaran 1–21 hari).[1] Walau begitu, gejala melioidosis dapat muncul dalam 24 jam bagi mereka yang dijangkiti saat hampir tenggelam di air yang terkontaminasi.[7] Mereka yang terkena melioidosis akan memunculkan gejala sepsis (terutama demam) dengan atau tanpa radang paru-paru, atau bisul atau fokus infeksi lainnya. Adanya tanda dan gejala yang tidak spesifik yang menyebabkan melioidosis dijuluki "peniru ulung".[1]
Orang yang menderita diabetes melitus atau pajanan bakteri secara teratur berada pada peningkatan risiko menderita melioidosis. Penyakit ini harus dipertimbangkan pada mereka yang tinggal di daerah endemi yang mengalami demam, radang paru-paru, atau bisul di hati, limpa, prostat, atau kelenjar parotid mereka. Manifestasi klinis penyakit ini dapat membentang dari perubahan kulit yang sederhana hingga masalah organ yang parah.[1] Perubahan kulit dapat berupa bisul atau tukak nonspesifik.[8] Di utara Australia, 60% dari anak-anak yang terjangkit hanya menunjukkan lesi kilit, sedangkan 20% dari anak-anak yang terjangkit menunjukkan radang paru-paru.[3] Organ yang paling sering terkena melioidosis adalah hati, limpa, paru-paru, prostat, dan ginjal. Di antara tanda-tanda klinis yang paling umum adalah adanya bakteri dalam darah (dalam 40% sampai 60% kasus), radang paru-paru (50%), dan syok septik (20%).[1] Orang yang hanya mengalami radang paru-paru pneumonia mungkin mengalami batuk yang menonjol dengan dahak dan sesak napas. Namun, mereka yang mengalami syok septik bersama dengan radang paru-paru mungkin mengalami batuk yang minimal.[2] Hasil sinar-X dada dapat membentang dari infiltrat nodular difus pada mereka yang mengalami syok septik hingga pemadatan paru-paru progresif di lobus atas pada mereka yang hanya mengalami radang paru-paru. Kelebihan cairan di rongga pleura dan pengumpulan nanah di dalam rongga lebih sering terjadi pada melioidosis yang memengaruhi lobus bawah paru-paru.[2] Dalam 10% kasus, orang menderita radang paru-paru sekunder yang disebabkan oleh bakteri lain setelah infeksi primer.[3]
Manifestasi parah lainnya terjadi bergantung pada perjalanan infeksi. Sekitar 1% hingga 5% dari mereka yang terjangkit mengalami radang otak dan penutup otak atau kumpulan nanah di otak, 14% hingga 28% mengalami peradangan bakteri pada ginjal, bisul ginjal atau bisul prostat, 0% sampai 30% mengalami bisul leher atau kelenjar ludah, 10% hingga 33% mengalami bisul hati, limpa, atau paraintestinal, dan 4% sampai 14% mengalami artritis septik dan osteomielitis.[1] Manifestasi yang langka di antaranya penyakit kelenjar getah bening yang menyerupai tuberkulosis,[9] massa mediastinum, pengumpulan cairan di penutup jantung,[3] dilatasi abnormal pembuluh darah karena infeksi,[1] dan radang pankreas.[3] Di Australia, hingga 20% dari pria yang terjangkit mengalami bisul prostat yang ditandai dengan nyeri saat buang air kecil, kesulitan buang air kecil, dan retensi urin yang memerlukan kateterisasi.[1] Pemeriksaan rektum menunjukkan peradangan prostat.[3] Di Thailand, 30% dari anak-anak yang terjangkit mengalami bisul parotid.[1] Ensefalomielitis dapat terjadi pada orang sehat tanpa faktor risiko. Mereka yang menderita ensefalomielitis melioidosis cenderung memiliki pindaian tomografi terkomputasi normal, tetapi sinyal T2 oleh pencitraan resonansi magnetik sehingga meluas ke batak otak dan sumsum tulang belakang. Tanda-tanda klinis yaitu kelemahan anggota gerak neuron motorik atas unilateral, tanda-tanda serebelar, dan kelumpuhan saraf kranial (kelumpuhan saraf VI, VII, dan kelumpuhan bulbar). Beberapa kasus hanya mengalami kelumpuhan kulai.[3] Di utara Australia, semua kasus melioidosis beserta ensefalomielitis mengalami peningkatan sel darah putih dalam cairan serebrospinal (CSF), sebagian besar sel mononuklir dengan protein CSF yang meningkat.[9]
Kronis
Melioidosis kronis biasanya ditandai dengan gejala yang berlangsung lebih dari dua bulan dan terjadi pada sekitar 10% pesakit.[1] Penyajian klinis yaitu demam, penurunan berat badan, dan batuk berkelanjutan dengan atau tanpa dahak berdarah, yang mungkin menyerupai tuberkulosis. Selain itu, bisul di beberapa bagian tumbuh yang berlangsung lama juga dapat timbul.[2] Tuberkulosis harus diwaspadai jika kelenjar getah bening membesar di akar paru-paru. Melioidosis kronis dapat muncul dengan kavitasi radang paru-paru menyerupai tuberkulosis paru kronis.[10] Tidak seperti tuberkulosis, radang paru-paru yang disebabkan oleh melioidosis jarang menyebabkan jaringan parut dan pengapuran paru-paru, tidak seperti tuberkulosis.[9]
Laten
Dalam infeksi laten, orang yang imunokompeten dapat menghilangkan infeksi tanpa menunjukkan gejala apa pun, tetapi kurang dari 5% dari semua kasus melioidosis memiliki aktivasi setelah periode laten.[1] Pesakit melioidosis laten dapat saja bebas gejala selama beberapa dasawarsa.[11] Awalnya, periode terlama antara dugaan paparan dan presentasi klinis diperkirakan selama 62 tahun di tahanan perang Perang Dunia II di Burma-Thailand-Malaysia.[11] Genotipe isolat bakteri selanjutnya dari veteran Perang Vietnam menunjukkan bahwa isolat tersebut mungkin tidak berasal dari Asia Tenggara, melainkan Amerika Selatan.[12] Laporan ini membalikkan laporan lain yang menempatkan periode laten terpanjang untuk melioidosis yaitu 29 tahun.[13] Potensi inkubasi yang berkepanjangan diakui oleh prajurit Amerika Serikat yang terlibat dalam Perang Vietnam, sehingga melioidosis disebut sebagai "bom waktu Vietnam".[2][14] Di Australia, periode laten terpanjang yang tercatat adalah 24 tahun.[3] Berbagai komorbiditas seperti diabetes, gagal ginjal, dan alkoholisme dapat menjadi predisposisi reaktivasi melioidosis.[2]
Penyebab
Bakteri
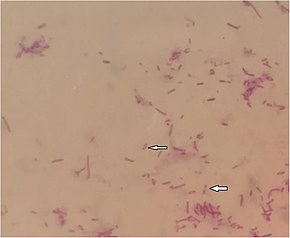
Melioidosis disebabkan oleh bakteri Gram-negatif, motil, saprofit bernama Burkholderia pseudomallei. Bakteri ini juga dapat menjadi patogen intraseluler fakultatif oportunistik.[1] Bakteri ini juga aerobik dan positif berdasarkan uji oksidase. Sebuah vakuola di tengah bakteri membuatnya menyerupai “peniti” saat diwarnai dengan Gram.[2] Bakteri ini mengeluarkan bau tanah yang kuat setelah 24 hingga 48 jam pertumbuhan dalam kultur. Burkholderia pseudomallei menghasilkan kapsul polisakarida glikokaliks yang membuatnya resisten terhadap banyak jenis antibiotik.[15] Bakteri ini umumnya resisten terhadap gentamisin dan kolistin, tetapi peka terhadap asam klavulanat (co-amoxiclav). Burkholderia pseudomallei adalah patogen level keselamatan biologi 3, yang memerlukan penanganan laboratorium khusus.[2] Pada hewan, makhluk hidup serupa lainnya bernama Burkholderia mallei adalah agen penyebab penyakit glanders.[1] Burkholderia pseudomallei dapat dibedakan dari Burkholderia thailandensis yang berkerabat dekat tetapi kurang patogen lewat kemampuannya mengasimilasi arabinose.[9] Burkholderia pseudomallei sangat mudah beradaptasi dengan berbagai lingkungan inang mulai dari spora jamur mikoriza hingga ameba.[2] Kemampuan beradaptasinya dapat memberikan keuntungan bertahan hidup dalam tubuh manusia.[1]
Genom Burkholderia pseudomallei terdiri dari dua replikon, yaitu kromosom 1 mengodekan fungsi urus rumah bakteri seperti sintesis, mobilitas, dan metabolisme dinding sel serta kromosom 2 mengodekan fungsi yang memungkinkan bakteri beradaptasi dengan berbagai lingkungan. Transfer gen horizontal di antara bakteri telah menghasilkan genom yang sangat bervariasi pada Burkholderia pseudomallei. Australia diperkirakan sebagai reservoir awal bagi Burkholderia pseudomallei karena variabilitas genetik yang tinggi dari bakteri yang ditemukan di wilayah ini. Bakteri yang diisolasi dari Afrika serta Amerika Tengah dan Selatan tampaknya memiliki nenek moyang sama yang hidup pada abad ke-17 hingga ke-19.[1] Burkholderia mallei adalah klon dari Burkholderia pseudomallei yang telah kehilangan sebagian besar genomnya karena beradaptasi untuk hidup secara eksklusif pada mamalia.[3]
Penularan
Burkholderia pseudomallei biasanya ditemukan di tanah dan air permukaan serta paling banyak ditemukan di kedalaman tanah 10 cm hingga 90 cm.[1] Bakteri ini juga ditemukan di tanah, kolam, sungai, lubuk, genangan air, dan sawah.[2] Bakteri ini dapat bertahan hidup dalam lingkungan yang miskin nutrisi seperti air suling, tanah gurun, dan tanah yang kekurangan nutrisi selama lebih dari 16 tahun. Bakteri ini juga dapat bertahan dalam larutan antiseptik dan deterjen, lingkungan asam (pH 4,5 selama 70 hari), dan lingkungan pada suhu berkisar antara 24°C hingga 32°C. Bakteri ini tidak bertahan hidup dengan adanya sinar ultraviolet.[1]
Bakteri dapat memasuki tubuh lewat luka, hirupan, dan menelan air yang tercemar.[1] Penularan dari orang ke orang sangat jarang terjadi.[2] Melioidosis adalah penyakit yang diakui terhadap hewan semisal kucing, anjing, kambing, domba, dan kuda. Sapi, kerbau, dan buaya dianggap relatif resisten terhadap melioidosis meskipun terus-menerus terpapar air dan tanah yang mengandung bakteri ini. Burung juga resisten terhadap melioidosis.[9][15] Penularan dari hewan ke manusia jarang terjadi.[1][2]
Klorinasi pasokan air yang tidak memadai dikaitkan dengan wabah Burkholderia pseudomallei di Australia Utara dan Barat. Bakteri ini juga ditemukan dalam pasokan air yang tidak diklorinasi di pedesaan Thailand. Cairan pengairan yang terkontaminasi dengan Burkholderia pseudomallei dikaitkan dengan infeksi luka nosokomial di rumah sakit.[1] Based on the whole genome sequencing of the bacteria, humans may play a role in moving B. pseudomallei from place to place.[16]
Patogenesis
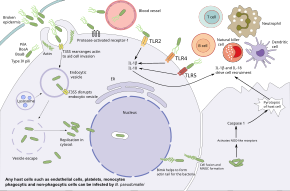
Burkholderia pseudomallei memiliki kemampuan untuk menjangkiti pelbagai jenis sel dan menghindari respons imun manusia. Bakteri pertama-tama masuk ke dalam celah di kulit atau selaput lendir dan bereplikasi di sel epitel. Dari sana, bakteri ini menggunakan motilitas flagela untuk menyebar dan menjangkiti pelbagai jenis sel. Dalam aliran darah, bakteri ini dapat menjangkiti baik fagosit dan nonfagosit. Burkholderia pseudomallei menggunakan flagela untuk bergerak mendekati sel inang, kemudian menempel pada sel menggunakan pelbagai protein adhesi termasuk protein pilus tipe IV PilA dan protein adhesi BoaA dan BoaB. Selain itu, adhesi bakteri sebagian tergantung pada keberadaan reseptor-1 yang diaktifkan protease protein inang yang ada pada permukaan sel endotel, keping darah, dan monosit. Setelah terikat, bakteri ini memasuki sel inang melalui endositosis dan berakhir di dalam vesikel endositik. Saat vesikel menjadi asam, Burkholderia pseudomallei menggunakan sistem sekresi tipe 3 (T3SS) untuk menyuntikkan protein efektor ke dalam sel inang, mengganggu vesikel dan membiarkan bakteri keluar ke sitoplasma inang. Dalam sitoplasma inang, bakteri menghindari dibunuh oleh autofagi inang menggunakan berbagai protein efektor T3SS. Bakteri bereplikasi di sitoplasma inang.[1][9]
Inside the host cell, the bacteria move by inducing the polymerization of the host actin behind them, propelling the bacteria forward.[1] This actin-mediated motility is accomplished with the autotransporter BimA, which interacts with actin at the tail-end of the bacterium. Propelled by actin, the bacteria push against the host membrane, creating protrusions that extend into neighbouring cells. These protrusions cause neighboring cells to fuse, leading to the formation of multinucleated giant cells (MNGCs). When MNGCs lyse, they form plaques (a central clear area with a ring of fused cells) that provide shelter for the bacteria for further replication or latent infection. This same process in infected neurons can allow bacteria to travel through nerve roots in the spinal cord and brain, leading to inflammation of the brain and spinal cord. Besides spreading from cell to cell, the bacteria can also spread through the bloodstream, causing sepsis. The bacteria can survive in antigen-presenting cells and dendritic cells. Thus, these cells act as vehicles that transport the bacteria into the lymphatic system, causing widespread dissemination of the bacteria in the human body.[1][9]
While B. pseudomallei can survive in phagocytic cells, these cells can kill B. pseudomallei by several mechanisms. Macrophages activated by interferon gamma have improved the killing of B. pseudomallei via the production of inducible nitric oxide synthase. Acidification of the endosome and degradation of the bacteria is also possible, however, the bacterial capsule and LPS makes B. pseudomallei resistant to lysosomal degradation. Once B. pseudomallei escapes into the host cytosol, it can be recognized by pattern recognition receptors such as NOD-like receptors, triggering the formation of the inflammasome and activation of caspase 1, which induces death of the host cell by pyroptosis and further activation of the immune system. Several systemic host defenses also contribute to the immune response. B. pseudomallei triggers both the complement system and coagulation cascade, however the thick bacterial capsule prevent the action of the complement membrane attack complex.[1][9]
Additional elements of the immune system are activated by the host toll-like receptors such as TLR2, TLR4, and TLR5 that recognize the conserved pieces of the bacteria such as LPS and flagella. This activation results in the production of cytokines such as interleukin 1 beta (IL-1β) and interleukin 18 (IL-18). IL-18 increases IFN production through natural killer cells, while IL-1beta reduces the IFN production. These immune molecules drive the recruitment of other immune cells such as neutrophils, dendritic cells, B cells, and T cells to the site of infection. T cells seem to be particularly important for controlling B. pseudomallei; T cell numbers are increased in survivors, and low T cell numbers are associated with a high risk of death from melioidosis. Despite this, HIV infection is not a risk factor for melioidosis. Although macrophages show deregulated cytokine responses in individuals with HIV infection, bacterial internalization and intracellular killing are still effective. People infected with B. pseudomallei develop antibodies against the bacteria, and people who live in endemic areas tend to have antibodies in their blood that recognize B. pseudomallei, but the effectiveness of these antibodies at preventing melioidosis is unclear.[1][9]
B. pseudomallei can remain latent in the human body from 19 to 29 years until it is reactivated during immunosuppression or stress response. The site of bacteria during latent infection and the mechanism by which they avoid immune recognition for years are both unclear. Amongst the mechanisms suggested are residing in the nucleus of the cell to prevent being digested, entering a stage of slower growth, antibiotic resistance, and genetic adaption to the host environment. Granulomas (containing neutrophils, macrophages, lymphocytes, and multinucleated giant cells) formed at the infection site in melioidosis have been associated with latent infection in humans.[1]
Referensi
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at Wiersinga WJ, Virk HS, Torres AG, Currie BJ, Peacock SJ, Dance DA, Limmathurotsakul D (February 2018). "Melioidosis". Nature Reviews. Disease Primers. 4 (17107): 17107. doi:10.1038/nrdp.2017.107. PMC 6456913
 . PMID 29388572.
. PMID 29388572.
- ^ a b c d e f g h i j k l m n Foong YC, Tan M, Bradbury RS (30 October 2014). "Melioidosis: a review". Rural and Remote Health. 14 (4): 2763. PMID 25359677.
- ^ a b c d e f g h i Currie BJ (February 2015). "Melioidosis: evolving concepts in epidemiology, pathogenesis, and treatment". Seminars in Respiratory and Critical Care Medicine. 36 (1): 111–25. doi:10.1055/s-0034-1398389
 . PMID 25643275.
. PMID 25643275.
- ^ Brightman, Christopher; Locum (2020). "Melioidosis: the Vietnamese time bomb". Trends in Urology & Men's Health (dalam bahasa Inggris). 11 (3): 30–32. doi:10.1002/tre.753
 . ISSN 2044-3749.
. ISSN 2044-3749.
- ^ Kesalahan pengutipan: Tag
<ref>tidak sah; tidak ditemukan teks untuk ref bernamaWhitmore 1912 - ^ Currie BJ, Ward L, Cheng AC (2010). "The epidemiology and clinical spectrum of melioidosis: 540 cases from the 20 year Darwin prospective study". PLOS Negl Trop Dis. 4 (11): e900. doi:10.1371/journal.pntd.0000900. PMC 2994918
 . PMID 21152057.
. PMID 21152057.
- ^ a b Bennett JE, Raphael D, Martin JB, Currie BJ (2015). "223". Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases (edisi ke-Eighth). Elsevier. hlm. 2541–2549. ISBN 978-1-4557-4801-3.
- ^ Fertitta L, Monsel G, Torresi J, Caumes E (February 2019). "Cutaneous melioidosis: a review of the literature". International Journal of Dermatology. 58 (2): 221–227. doi:10.1111/ijd.14167. hdl:11343/284394
 . PMID 30132827.
. PMID 30132827.
- ^ a b c d e f g h i Gassiep I, Armstrong M, Norton R (March 2020). "Human Melioidosis". Clinical Microbiology Reviews. 33 (2). doi:10.1128/CMR.00006-19. PMC 7067580
 . PMID 32161067.
. PMID 32161067.
- ^ Brightman, Christopher; Locum (2020). "Melioidosis: the Vietnamese time bomb". Trends in Urology & Men's Health (dalam bahasa Inggris). 11 (3): 30–32. doi:10.1002/tre.753
 . ISSN 2044-3749.
. ISSN 2044-3749.
- ^ a b Ngauy V, Lemeshev Y, Sadkowski L, Crawford G (February 2005). "Cutaneous melioidosis in a man who was taken as a prisoner of war by the Japanese during World War II". Journal of Clinical Microbiology. 43 (2): 970–2. doi:10.1128/JCM.43.2.970-972.2005. PMC 548040
 . PMID 15695721.
. PMID 15695721.
- ^ Gee JE, Gulvik CA, Elrod MG, Batra D, Rowe LA, Sheth M, Hoffmaster AR (July 2017). "Phylogeography of Burkholderia pseudomallei Isolates, Western Hemisphere". Emerging Infectious Diseases. 23 (7): 1133–1138. doi:10.3201/eid2307.161978. PMC 5512505
 . PMID 28628442.
. PMID 28628442.
- ^ Chodimella U, Hoppes WL, Whalen S, Ognibene AJ, Rutecki GW (May 1997). "Septicemia and suppuration in a Vietnam veteran". Hospital Practice. 32 (5): 219–21. doi:10.1080/21548331.1997.11443493. PMID 9153149.
- ^ Brightman, Christopher; Locum (2020). "Melioidosis: the Vietnamese time bomb". Trends in Urology & Men's Health (dalam bahasa Inggris). 11 (3): 30–32. doi:10.1002/tre.753
 . ISSN 2044-3749.
. ISSN 2044-3749.
- ^ a b Cheng AC, Currie BJ (April 2005). "Melioidosis: epidemiology, pathophysiology, and management". Clinical Microbiology Reviews. 18 (2): 383–416. doi:10.1128/CMR.18.2.383-416.2005. PMC 1082802
 . PMID 15831829.
. PMID 15831829.
- ^ Baker A, Pearson T, Price EP, Dale J, Keim P, Hornstra H, et al. (March 2011). "Molecular phylogeny of Burkholderia pseudomallei from a remote region of Papua New Guinea". PLOS ONE. 6 (3): e18343. Bibcode:2011PLoSO...618343B. doi:10.1371/journal.pone.0018343
 . PMC 3069084
. PMC 3069084  . PMID 21483841.
. PMID 21483841. 
Pranala luar
| Klasifikasi | |
|---|---|
| Sumber luar |
- Resource Center for melioidosis
- Templat:CDCDiseaseInfo
- Burkholderia pseudomallei genomes and related information at PATRIC, a Bioinformatics Resource Center funded by NIAID
- Monograph on Melioidosis (ISBN 978-0-444-53479-8); Elsevier Press, 2012, https://www.researchgate.net/publication/354857974_Monograph_Melioidosis-a-century-of-observation-and-research_ISBN_978-0-444-53479-8
