Melioidosis
Halaman ini sedang dipersiapkan dan dikembangkan sehingga mungkin terjadi perubahan besar. Anda dapat membantu dalam penyuntingan halaman ini. Halaman ini terakhir disunting oleh Hanamanteo (Kontrib • Log) 898 hari 65 menit lalu. Jika Anda melihat halaman ini tidak disunting dalam beberapa hari, mohon hapus templat ini. |
| Melioidosis | |
|---|---|
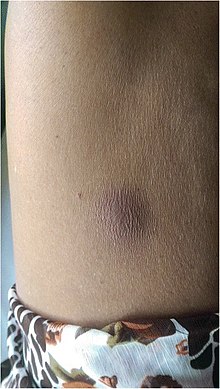 | |
| Bisul melioidosis di perut | |
| Informasi umum | |
| Spesialisasi | Penyakit menular |
| Penyebab | Burkholderia pseudomallei spread by contact to soil or water[1] |
| Faktor risiko | Diabetes mellitus, thalassaemia, alcoholism, chronic kidney disease[1] |
| Aspek klinis | |
| Gejala dan tanda | Tiada, demam, radang paru-paru, beberapa bisul[1] |
| Komplikasi | Encephalomyelitis, septic shock, acute pyelonephritis, septic arthritis, osteomyelitis[1] |
| Awal muncul | 1-21 hari setelah terjangkit[1] |
| Diagnosis | Mengembangkan bakteri di perantara kultur[1] |
| Kondisi serupa | Tuberculosis[2] |
| Tata laksana | |
| Pencegahan | Mencegah dari kontak dengan air yang terkontaminasi, profilaksis antibiotik[1] |
| Perawatan | Ceftazidime, meropenem, co-trimoxazole[1] |
| Distribusi dan frekuensi | |
| Prevalensi | 165,000 orang tiap tahun[1] |
| Kematian | 89,000 orang tiap tahunr[1] |
Melioidosis adalah penyakit infeksi yang disebabkan oleh bakteri Gram-negatif bernama Burkholderia pseudomallei.[1] Kebanyakan orang yang dijangkiti Burkholderia pseudomallei tidak mengalami satupun gejala, tetapi mereka yang mengalami gejala memiliki tanda dan gejala dari gejala ringan seperti demam, perubahan kulit, radang paru-paru, dan bisul, hingga gejala berat seperti radang otak, radang sendi, dan tekanan darah rendah yang berbahaya yang menyebabkan kematian.[1] Sekitar 10% dari orang penderita melioidosis mengalami gejala yang berlangsung lebih dari dua bulan yang disebut melioidosis kronis.[1]
Manusia dijangkiti Burkholderia pseudomallei melalui kontak dengan air yang tercemar. Bakteri ini masuk ke dalam tubuh melalui luka, tarikan napas, atau penelanan. Penularan dari manusia ke manusia atau dari hewan ke manusia sangat jarang terjadi.[1] Infeksi ini masih ada di Asia Tenggara, khususnya di timur laut Thailand dan utara Australia.[1] Di negara-negara maju seperti Eropa dan Amerika Serikat, kasus melioidosis umumnya diimpor dari negara-negara tempat melioidosis lebih sering terjadi.[3] Tanda dan gejala melioidosis menyerupai tuberkulosis dan sering terjadi kesalahan diagnosis.[4][2] Diagnosis biasanya dikonfirmasi oleh pertumbuhan Burkholderia pseudomallei dari darah atau cairan tubuh orang yang dijangkiti lainnya.[1] Mereka yang menderita melioidosis pertama-tama diobati dengan antibiotik intravena "fase intensif" (paling sering seftazidima) diikuti dengan pengobatan kotrimoksazol selama beberapa bulan.[1] Bahkan jika dirawat dengan cermat, sekitar 10% penderita melioidosis meninggal karenanya. Jika tidak ditangani dengan cermat, tingkat kematian bisa melonjak hingga 40%.[1]
Upaya pencegahan melioidosis antara lain memakai alat pelindung diri saat menangani air yang terkontaminasi, membiasakan kebersihan tangan, minum air matang, dan menghindari kontak langsung dengan tanah, air, atau hujan lebat. Antibiotik kotrimoksazol hanya digunakan sebagai pencegahan untuk individu yang berisiko tinggi terkena melioidosis setelah terpapar bakteri. Tiada vaksin untuk melioidosis yang telah disetujui.[1]
Sekitar 165 ribu orang dijangkiti melioidosis tiap tahun dan menewaskan 89 ribu orang. Diabetes adalah faktor risiko utama penyakit melioidosis dengan lebih dari setengah kasus melioidosis terjadi pada penderita diabetes.[1] Peningkatan curah hujan dikaitkan dengan lonjakan jumlah kasus melioidosis di daerah endemi.[2] Melioidosis pertama kali dideskripsikan oleh Alfred Whitmore pada tahun 1912 di wilayah yang saat ini bernama Myanmar.[5]
Tanda dan gejala
Akut




Pajanan terhadap Burkholderia pseudomallei biasanya dapat menyebabkan antibodi diproduksi untuk melawan bakteri itu tanpa gejala apapun. Dari pasien yang menderita infeksi klinis, 85% pasien mengalami gejala akut dari pemerolehan bakteri terkini.[1][6][7] Masa inkubasi rata-rata melioidosis akut adalah 9 hari (kisaran 1–21 hari).[1] Walau begitu, gejala melioidosis dapat muncul dalam 24 jam bagi mereka yang dijangkiti saat hampir tenggelam di air yang terkontaminasi.[7] Mereka yang terkena melioidosis akan memunculkan gejala sepsis (terutama demam) dengan atau tanpa radang paru-paru, atau bisul atau fokus infeksi lainnya. Adanya tanda dan gejala yang tidak spesifik yang menyebabkan melioidosis dijuluki "peniru ulung".[1]
Orang yang menderita diabetes melitus atau pajanan bakteri secara teratur berada pada peningkatan risiko menderita melioidosis. Penyakit ini harus dipertimbangkan pada mereka yang tinggal di daerah endemi yang mengalami demam, radang paru-paru, atau bisul di hati, limpa, prostat, atau kelenjar parotid mereka. Manifestasi klinis penyakit ini dapat membentang dari perubahan kulit yang sederhana hingga masalah organ yang parah.[1] Perubahan kulit dapat berupa bisul atau tukak nonspesifik.[8] Di utara Australia, 60% dari anak-anak yang terjangkit hanya menunjukkan lesi kilit, sedangkan 20% dari anak-anak yang terjangkit menunjukkan radang paru-paru.[3] Organ yang paling sering terkena melioidosis adalah hati, limpa, paru-paru, prostat, dan ginjal. Di antara tanda-tanda klinis yang paling umum adalah adanya bakteri dalam darah (dalam 40% sampai 60% kasus), radang paru-paru (50%), dan syok septik (20%).[1] Orang yang hanya mengalami radang paru-paru pneumonia mungkin mengalami batuk yang menonjol dengan dahak dan sesak napas. Namun, mereka yang mengalami syok septik bersama dengan radang paru-paru mungkin mengalami batuk yang minimal.[2] Hasil sinar-X dada dapat membentang dari infiltrat nodular difus pada mereka yang mengalami syok septik hingga pemadatan paru-paru progresif di lobus atas pada mereka yang hanya mengalami radang paru-paru. Kelebihan cairan di rongga pleura dan pengumpulan nanah di dalam rongga lebih sering terjadi pada melioidosis yang memengaruhi lobus bawah paru-paru.[2] Dalam 10% kasus, orang menderita radang paru-paru sekunder yang disebabkan oleh bakteri lain setelah infeksi primer.[3]
Manifestasi parah lainnya terjadi bergantung pada perjalanan infeksi. Sekitar 1% hingga 5% dari mereka yang terjangkit mengalami radang otak dan penutup otak atau kumpulan nanah di otak, 14% hingga 28% mengalami peradangan bakteri pada ginjal, bisul ginjal atau bisul prostat, 0% sampai 30% mengalami bisul leher atau kelenjar ludah, 10% hingga 33% mengalami bisul hati, limpa, atau paraintestinal, dan 4% sampai 14% mengalami artritis septik dan osteomielitis.[1] Manifestasi yang langka di antaranya penyakit kelenjar getah bening yang menyerupai tuberkulosis,[9] massa mediastinum, pengumpulan cairan di penutup jantung,[3] dilatasi abnormal pembuluh darah karena infeksi,[1] dan radang pankreas.[3] Di Australia, hingga 20% dari pria yang terjangkit mengalami bisul prostat yang ditandai dengan nyeri saat buang air kecil, kesulitan buang air kecil, dan retensi urin yang memerlukan kateterisasi.[1] Pemeriksaan rektum menunjukkan peradangan prostat.[3] Di Thailand, 30% dari anak-anak yang terjangkit mengalami bisul parotid.[1] Ensefalomielitis dapat terjadi pada orang sehat tanpa faktor risiko. Mereka yang menderita ensefalomielitis melioidosis cenderung memiliki pindaian tomografi terkomputasi normal, tetapi sinyal T2 oleh pencitraan resonansi magnetik sehingga meluas ke batak otak dan sumsum tulang belakang. Tanda-tanda klinis yaitu kelemahan anggota gerak neuron motorik atas unilateral, tanda-tanda serebelar, dan kelumpuhan saraf kranial (kelumpuhan saraf VI, VII, dan kelumpuhan bulbar). Beberapa kasus hanya mengalami kelumpuhan kulai.[3] Di utara Australia, semua kasus melioidosis beserta ensefalomielitis mengalami peningkatan sel darah putih dalam cairan serebrospinal (CSF), sebagian besar sel mononuklir dengan protein CSF yang meningkat.[9]
Kronis
Melioidosis kronis biasanya ditandai dengan gejala yang berlangsung lebih dari dua bulan dan terjadi pada sekitar 10% pesakit.[1] Penyajian klinis yaitu demam, penurunan berat badan, dan batuk berkelanjutan dengan atau tanpa dahak berdarah, yang mungkin menyerupai tuberkulosis. Selain itu, bisul di beberapa bagian tumbuh yang berlangsung lama juga dapat timbul.[2] Tuberkulosis harus diwaspadai jika kelenjar getah bening membesar di akar paru-paru. Melioidosis kronis dapat muncul dengan kavitasi radang paru-paru menyerupai tuberkulosis paru kronis.[10] Tidak seperti tuberkulosis, radang paru-paru yang disebabkan oleh melioidosis jarang menyebabkan jaringan parut dan pengapuran paru-paru, tidak seperti tuberkulosis.[9]
Laten
Dalam infeksi laten, orang yang imunokompeten dapat menghilangkan infeksi tanpa menunjukkan gejala apa pun, tetapi kurang dari 5% dari semua kasus melioidosis memiliki aktivasi setelah periode laten.[1] Pesakit melioidosis laten dapat saja bebas gejala selama beberapa dasawarsa.[11] Awalnya, periode terlama antara dugaan paparan dan presentasi klinis diperkirakan selama 62 tahun di tahanan perang Perang Dunia II di Burma-Thailand-Malaysia.[11] Genotipe isolat bakteri selanjutnya dari veteran Perang Vietnam menunjukkan bahwa isolat tersebut mungkin tidak berasal dari Asia Tenggara, melainkan Amerika Selatan.[12] Laporan ini membalikkan laporan lain yang menempatkan periode laten terpanjang untuk melioidosis yaitu 29 tahun.[13] Potensi inkubasi yang berkepanjangan diakui oleh prajurit Amerika Serikat yang terlibat dalam Perang Vietnam, sehingga melioidosis disebut sebagai "bom waktu Vietnam".[2][14] Di Australia, periode laten terpanjang yang tercatat adalah 24 tahun.[3] Berbagai komorbiditas seperti diabetes, gagal ginjal, dan alkoholisme dapat menjadi predisposisi reaktivasi melioidosis.[2]
Penyebab
Bakteri

Melioidosis disebabkan oleh bakteri Gram-negatif, motil, saprofit bernama Burkholderia pseudomallei. Bakteri ini juga dapat menjadi patogen intraseluler fakultatif oportunistik.[1] Bakteri ini juga aerobik dan positif berdasarkan uji oksidase. Sebuah vakuola di tengah bakteri membuatnya menyerupai “peniti” saat diwarnai dengan Gram.[2] Bakteri ini mengeluarkan bau tanah yang kuat setelah 24 hingga 48 jam pertumbuhan dalam kultur. Burkholderia pseudomallei menghasilkan kapsul polisakarida glikokaliks yang membuatnya resisten terhadap banyak jenis antibiotik.[15] Bakteri ini umumnya resisten terhadap gentamisin dan kolistin, tetapi peka terhadap asam klavulanat (co-amoxiclav). Burkholderia pseudomallei adalah patogen level keselamatan biologi 3, yang memerlukan penanganan laboratorium khusus.[2] Pada hewan, makhluk hidup serupa lainnya bernama Burkholderia mallei adalah agen penyebab penyakit glanders.[1] Burkholderia pseudomallei dapat dibedakan dari Burkholderia thailandensis yang berkerabat dekat tetapi kurang patogen lewat kemampuannya mengasimilasi arabinose.[9] Burkholderia pseudomallei sangat mudah beradaptasi dengan berbagai lingkungan inang mulai dari spora jamur mikoriza hingga ameba.[2] Kemampuan beradaptasinya dapat memberikan keuntungan bertahan hidup dalam tubuh manusia.[1]
Genom Burkholderia pseudomallei terdiri dari dua replikon, yaitu kromosom 1 mengodekan fungsi urus rumah bakteri seperti sintesis, mobilitas, dan metabolisme dinding sel serta kromosom 2 mengodekan fungsi yang memungkinkan bakteri beradaptasi dengan berbagai lingkungan. Transfer gen horizontal di antara bakteri telah menghasilkan genom yang sangat bervariasi pada Burkholderia pseudomallei. Australia diperkirakan sebagai reservoir awal bagi Burkholderia pseudomallei karena variabilitas genetik yang tinggi dari bakteri yang ditemukan di wilayah ini. Bakteri yang diisolasi dari Afrika serta Amerika Tengah dan Selatan tampaknya memiliki nenek moyang sama yang hidup pada abad ke-17 hingga ke-19.[1] Burkholderia mallei adalah klon dari Burkholderia pseudomallei yang telah kehilangan sebagian besar genomnya karena beradaptasi untuk hidup secara eksklusif pada mamalia.[3]
Penularan
Burkholderia pseudomallei biasanya ditemukan di tanah dan air permukaan serta paling banyak ditemukan di kedalaman tanah 10 cm hingga 90 cm.[1] Bakteri ini juga ditemukan di tanah, kolam, sungai, lubuk, genangan air, dan sawah.[2] Bakteri ini dapat bertahan hidup dalam lingkungan yang miskin nutrisi seperti air suling, tanah gurun, dan tanah yang kekurangan nutrisi selama lebih dari 16 tahun. Bakteri ini juga dapat bertahan dalam larutan antiseptik dan deterjen, lingkungan asam (pH 4,5 selama 70 hari), dan lingkungan pada suhu berkisar antara 24°C hingga 32°C. Bakteri ini tidak bertahan hidup dengan adanya sinar ultraviolet.[1]
Bakteri dapat memasuki tubuh lewat luka, hirupan, dan menelan air yang tercemar.[1] Penularan dari orang ke orang sangat jarang terjadi.[2] Melioidosis adalah penyakit yang diakui terhadap hewan semisal kucing, anjing, kambing, domba, dan kuda. Sapi, kerbau, dan buaya dianggap relatif resisten terhadap melioidosis meskipun terus-menerus terpapar air dan tanah yang mengandung bakteri ini. Burung juga resisten terhadap melioidosis.[9][15] Penularan dari hewan ke manusia jarang terjadi.[1][2]
Klorinasi pasokan air yang tidak memadai dikaitkan dengan wabah Burkholderia pseudomallei di Australia Utara dan Barat. Bakteri ini juga ditemukan dalam pasokan air yang tidak diklorinasi di pedesaan Thailand. Cairan pengairan yang terkontaminasi dengan Burkholderia pseudomallei dikaitkan dengan infeksi luka nosokomial di rumah sakit.[1] Berdasarkan pengurutan keseluruhan genom bakteri ini, manusia mungkin berperan dalam memindahkan Burkholderia pseudomallei dari satu tempat ke tempat lain.[16]
Patogenesis
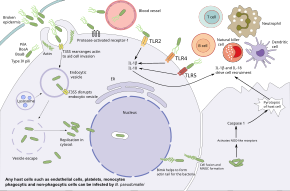
Burkholderia pseudomallei memiliki kemampuan untuk menjangkiti pelbagai jenis sel dan menghindari respons imun manusia. Bakteri pertama-tama masuk ke dalam celah di kulit atau selaput lendir dan bereplikasi di sel epitel. Dari sana, bakteri ini menggunakan motilitas flagela untuk menyebar dan menjangkiti pelbagai jenis sel. Dalam aliran darah, bakteri ini dapat menjangkiti baik fagosit dan nonfagosit. Burkholderia pseudomallei menggunakan flagela untuk bergerak mendekati sel inang, kemudian menempel pada sel menggunakan pelbagai protein adhesi termasuk protein pilus tipe IV PilA dan protein adhesi BoaA dan BoaB. Selain itu, adhesi bakteri sebagian tergantung pada keberadaan reseptor-1 yang diaktifkan protease protein inang yang ada pada permukaan sel endotel, keping darah, dan monosit. Setelah terikat, bakteri ini memasuki sel inang melalui endositosis dan berakhir di dalam vesikel endositik. Saat vesikel menjadi asam, Burkholderia pseudomallei menggunakan sistem sekresi tipe 3 (T3SS) untuk menyuntikkan protein efektor ke dalam sel inang, sehingga mengganggu vesikel dan membiarkan bakteri keluar ke sitoplasma inang. Dalam sitoplasma inang, bakteri menghindari dari dibunuh oleh autofagi inang menggunakan pelbagai protein efektor T3SS. Bakteri ini bereplikasi di sitoplasma inang.[1][9]
Di dalam sel inang, Burkholderia pseudomallei bergerak dengan menginduksi polimerisasi aktin inang di belakangnya, sehingga mendorong bakteri ini ke depan.[1] Motilitas yang dimediasi aktin ini dicapai dengan autotransporter BimA yang berinteraksi dengan aktin di ujung ekor bakteri. Didorong oleh aktin, bakteri ini mendorong membran inang, sehingga menciptakan tonjolan yang meluas ke sel tetangga. Tonjolan ini menyebabkan sel-sel tetangga menyatu yang mengarah kepada pembentukan sel raksasa berinti banyak (MNGC). Ketika MNGC lisis, sel-sel tetangga membentuk plak (daerah bening pusat dengan cincin sel yang menyatu) yang menyediakan perlindungan bagi bakteri untuk replikasi lebih lanjut atau infeksi laten. Proses yang sama pada neuron yang terjangkit ini dapat memungkinkan bakteri melakukan perjalanan melalui akar saraf di sumsum tulang belakang dan otak yang menyebabkan peradangan otak dan sumsum tulang belakang. Selain menyebar dari sel ke sel, bakteri juga dapat menyebar melalui aliran darah sehingga menyebabkan sepsis. Bakteri ini dapat bertahan hidup dalam sel penyaji antigen dan sel dendritik. Dengan demikian, sel-sel ini bertindak sebagai kendaraan yang mengangkut bakteri ke dalam sistem limfatik, sehingga menyebabkan penyebaran bakteri secara luas dalam tubuh manusia.[1][9]
Manakala Burkholderia pseudomallei dapat bertahan hidup dalam sel fagosit, sel-sel fagosit ini dapat membunuh Burkholderia pseudomallei melalui beberapa mekanisme. Makrofag yang diaktifkan oleh interferon gamma menaikkan daya bunuh terhadap Burkholderiapseudomallei melalui produksi sintase oksida nitrat yang dapat diinduksi. Pengasaman endosom dan degradasi bakteri juga mungkin, tetapi kapsul bakteri dan LPS membuat Burkholderia pseudomallei resisten terhadap degradasi lisosom. Setelah Burkholderia pseudomallei lolos ke sitosol inang, bakteri ini dapat dikenali oleh reseptor pengenal pola seperti reseptor mirip NOD, sehingga memicu pembentukan inflamasom dan aktivasi kaspase 1 yang menginduksi kematian sel inang oleh piroptosis dan aktivasi lebih lanjut dari sel inang. sistem kekebalan tubuh. Beberapa pertahanan inang sistemik juga berkontribusi kepada respons imun. Burkholderia pseudomallei memicu sistem komplemen dan kaskade penggumpalan darah, namun kapsul bakteri yang tebal mencegah aksi kompleks serangan membran komplemen.[1][9]
Unsur tambahan dari sistem imun diaktifkan oleh reseptor mirip tol inang seperti TLR2, TLR4, dan TLR5 yang mengenali bagian-bagian bakteri ini yang terlindung dari kerusakan seperti LPS dan flagela. Aktivasi ini menghasilkan produksi sitokin seperti interleukin 1 beta (IL-1β) dan interleukin-18 (IL-18). IL-18 meningkatkan produksi IFN melalui sel pembunuh alami, sedangkan IL-1β mengurangi produksi IFN. Molekul imun ini mendorong pendayagunaan sel imun lain seperti neutrofil, sel dendritik, sel B, dan sel T ke tempat infeksi. Sel T tampaknya sangat penting untuk mengendalikan Burkholderia pseudomallei; jumlah sel T meningkat pada orang yang bertahan hidup dan jumlah sel T yang rendah dikaitkan dengan risiko kematian yang tinggi akibat melioidosis. Meskipun demikian, infeksi HIV bukan merupakan faktor risiko melioidosis. Meskipun makrofag menunjukkan respons sitokin yang dideregulasi pada individu dengan infeksi HIV, internalisasi bakteri dan pembunuhan intraseluler masih efektif. Orang yang terinfeksi Burkholderia pseudomallei mengembangkan antibodi terhadap bakteri, dan orang yang tinggal di daerah endemik cenderung memiliki antibodi dalam darah mereka yang mengenali Burkholderia pseudomallei, tetapi efektivitas antibodi ini dalam mencegah melioidosis tidak jelas.[1][9]
Burkholderia pseudomallei tetap dapat laten dalam tubuh manusia dari 19 sampai 29 tahun sampai diaktifkan kembali selama imunosupresi atau respons stres. Tempat bakteri selama infeksi laten dan mekanisme bakteri menghindari pengenalan imun selama bertahun-tahun tidak jelas. Di antara mekanisme yang disarankan adalah berada di inti sel untuk mencegah dicerna, memasuki tahap pertumbuhan yang lebih lambat, resistensi antibiotik, dan adaptasi genetik dengan lingkungan inang. Granuloma (mengandung neutrofil, makrofag, limfosit, dan sel raksasa berinti banyak) yang terbentuk di tempat infeksi pada melioidosis telah dikaitkan dengan infeksi laten pada manusia.[1]
Diagnosis



Kultur bakteri adalah diagnosis definitif melioidosis. Burkholderia pseudomallei tidak pernah menjadi bagian dari flora manusia. Oleh karena itu, setiap pertumbuhan bakteri adalah diagnostik melioidosis. Kultur darah adalah sampel yang paling umum untuk diagnosis karena bakteri dapat dideteksi dalam darah pada 50% hingga 60% kasus melioidosis. Sampel lain seperti tenggorokan, usap dubur, nanah dari bisul, dan dahak juga dapat digunakan untuk kultur. Ketika bakteri ini tidak tumbuh dari orang yang diduga kuat menderita melioidosis, kultur berulang harus dilakukan karena kultur berikutnya dapat menjadi positif.[1] Burkholderia pseudomallei dapat ditumbuhkan pada agar darah domba, agar MacConkey, media Ashdown (mengandung gentamisin),[1] atau kaldu Ashdown (mengandung kolistin).[3] Cawan agar untuk melioidosis harus diinkubasi pada suhu 37°C di udara dan diperiksa selama empat hari berturut-turut.[2] Pada cawan agar, Burkholderia pseudomallei membentuk koloni yang berkrim dan nonhemolitik setelah diinkubasi selama dua hari. Setelah diinkubasi selama empat hari, koloni bakteri tampak kering dan berkerut.[1] Koloni Burkholderia pseudomallei yang ditumbuhkan pada media Francis (modifikasi media Ashdown dengan konsentrasi gentamisin ditingkatkan menjadi 8 mg/l) berwarna kuning. Untuk laboratorium yang berlokasi di luar daerah endemik, agar selektif Burkholderia cepacia atau agar selektif Pseudomonas dapat digunakan jika media Ashdown tidak tersedia.[2] Penting untuk tidak salah penafsiran bahwa pertumbuhan bakteri sebagai Pseudomonas atau Bacillus spp. Alat pemeriksaan biokimia lainnya juga dapat digunakan untuk mendeteksi Burkholderia pseudomallei, termasuk alay biokimia API 20NE atau 20E yang dipadukan dengan pewarnaan Gram, uji oksidase, ciri-ciri pertumbuhan yang khas, dan resistensi terhadap antibiotik tertentu dari bakteri tersebut.[3] Metode molekuler seperti kuar 16S rDNA dan reaksi berantai polimerase juga dapat digunakan untuk mendeteksi Burkholderia pseudomallei dalam kultur, tetapi hanya tersedia di laboratorium penelitian dan referensi.[1]
Tes darah umum pada penderita melioidosis menunjukkan jumlah sel darah putih yang rendah (menunjukkan infeksi), peningkatan enzim hati, peningkatan kadar bilirubin (menunjukkan disfungsi hati), dan peningkatan kadar urea dan kreatinin (menunjukkan disfungsi ginjal). Glukosa darah rendah dan asidosis memperkirakan prognosis yang lebih buruk pada mereka dengan melioidosis. Namun, uji lain seperti protein C-reaktif dan kadar prokalsitonin tidak dapat diandalkan dalam memperkirakan keparahan infeksi melioidosis.[15]
Dengan mikroskop, Burkholderia pseudomallei terlihat sebagai Gram-negatif dan berbentuk batang dengan pewarnaan bipolar mirip dengan peniti. Bakteri ini kadang-kadang dapat dilihat secara langsung dalam sampel klinis dari orang yang terinfeksi, tetapi identifikasi dengan mikroskop cahaya tidak spesifik atau sensitif. Mikroskop imunofluoresensi sangat spesifik untuk mendeteksi bakteri langsung dari spesimen klinis, tetapi sensitivitasnya kurang dari 50%. Sebuah immunoasai aliran lateral telah dikembangkan tetapi tidak dievaluasi secara ekstensif.[1][3] Semakin banyak laboratorium yang menggunakan spektrometri massa desorpsi/ionisasi laser berbantuan Matrix untuk mengidentifikasi bakteri secara akurat.[9]
Uji serologi seperti hemaglutinasi tidak langsung telah digunakan untuk mendeteksi keberadaan antibodi terhadap B. pseudomallei. Namun, kelompok orang yang berbeda memiliki tingkat antibodi yang sangat berbeda, jadi interpretasi tes ini bergantung pada lokasi. Di Australia, kurang dari 5% orang memiliki antibodi B. pseudomallei, sehingga keberadaan antibodi dalam jumlah yang relatif rendah tidak biasa dan dapat menunjukkan melioidosis. Di Thailand, banyak orang memiliki antibodi terhadap B. pseudomallei, sehingga hanya jumlah antibodi yang relatif tinggi dalam darah yang menunjukkan melioidosis.[1][3] Thailand juga menggunakan uji antibodi imunofluoresen langsung (IFAT) dan aglutinasi lateks. Dalam IFAT, antigen B. pseudomallei dan B. thailandensis dapat digunakan untuk mengukur jumlah antibodi yang dihasilkan terhadap bakteri. Oleh karena itu, hasil harus ditafsirkan dengan hati-hati karena reaksi positif palsu dapat ditemukan jika seseorang sebelumnya terpapar B. thailandensis nonpatogenik.[2] Aglutinasi lateks berguna dalam skrining untuk dugaan koloni B. pseudomallei colonies.[1] Alat ELISA komersial untuk melioidosis tidak lagi tersedia di pasaran karena sensitivitas yang rendah terhadap deteksi antibodi manusia.[9]
Berbagai modalitas pencitraan juga dapat membantu diagnosis melioidosis. Pada melioidosis akut dengan penyebaran bakteri melalui aliran darah, rontgen dada menunjukkan lesi nodular multifokal. Ini juga dapat menunjukkan penggabungan nodul atau kavitasi. Bagi mereka dengan melioidosis akut tanpa penyebaran ke aliran darah, rontgen dada menunjukkan konsolidasi lobus atas atau kavitasi. Pada melioidosis kronis, perkembangan lambat dari konsolidasi lobus atas paru-paru menyerupai tuberkulosis. Untuk abses yang terletak di bagian tubuh lain selain paru-paru, terutama di hati dan limpa, CT scan memiliki sensitivitas yang lebih tinggi jika dibandingkan dengan USG. Pada abses hati dan limpa, pemindaian ultrasound menunjukkan lesi "seperti target", sedangkan CT scan menunjukkan "tanda sarang lebah" pada abses hati. Untuk melioidosis yang melibatkan otak, MRI memiliki sensitivitas yang lebih tinggi daripada CT scan dalam mendiagnosis lesi. MRI menunjukkan lesi yang meningkatkan cincin untuk melioidosis otak.[9]
Pencegahan
Melioidosis adalah penyakit yang harus dilaporkan di Australia. Ini memungkinkan Australia untuk memantau penyakit ini dan mengendalikan wabah. Melioidosis baru menjadi keadaan yang dapat dilaporkan di Thailand sejak Juni 2016. Walau begitu, Australia juga memulai kampanye kesadaran untuk meningkatkan pemahaman masyarakat tentang penyakit ini.[9] Di Amerika Serikat, pekerja laboratorium dapat menangani spesimen klinis Burkholderia pseudomallei dalam keadaan BSL-2, sementara produksi massal makhluk hidup ini memerlukan tindakan pencegahan BSL-3.[17] Juga, beberapa kasus infeksi melioidosis yang didapat di rumah sakit telah dilaporkan, sehingga penyedia layanan kesehatan direkomendasikan untuk mempraktikkan kebersihan tangan dan kewaspadaan universal.[1]
Klorinasi air skala besar telah berhasil mengurangi B. pseudomallei di air di Australia. Di negara-negara berpenghasilan menengah ke bawah, air harus direbus sebelum dikonsumsi. Di negara-negara berpenghasilan tinggi, air dapat diolah dengan sinar ultraviolet bagi mereka yang berisiko tertular melioidosis. Mereka yang berisiko tinggi kontak dengan bakteri harus memakai alat pelindung (seperti sepatu bot dan sarung tangan) selama bekerja. Mereka yang tinggal di daerah endemik harus menghindari kontak langsung dengan tanah, dan paparan luar ruangan terhadap hujan lebat atau awan debu. Air kemasan atau air matang lebih disukai untuk diminum.[1]
Profilaksis pascapajanan
After exposure to B. pseudomallei (particularly following a laboratory accident), treatment with co-trimoxazole is recommended. Alternatively, co-amoxiclav and doxycycline can be used for those who are intolerant to co-trimoxazole. Since co-trimoxazole can cause severe side effects, only high-risk individuals tend to receive such treatments. Low-risk individuals would receive frequent monitoring, instead.[1]
Vaksinasi
Several vaccine candidates have been tested in animal models. Nevertheless, no vaccine candidates have been tried in humans. Major hurdles of the vaccines are limited efficacy in animal models, establishing the best method of vaccine administration in humans, and logistical and financial issues in establishing human trials in endemic areas.[9]
Perawatan
The treatment of melioidosis is divided into two stages, an intravenous intensive phase and an eradication phase to prevent recurrence. The choice of antibiotics depends upon the susceptibility of the bacteria to various antibiotics. B. pesudomallei is generally susceptible to ceftazidime, meropenem, imipenem, and co-amoxiclav. These drugs are designed to kill the bacteria. It is also susceptible to doxycycline, chloramphenicol, and co-trimoxazole. These drugs are designed to inhibit the growth of the bacteria. The bacteria are resistant to penicillin, ampicillin, first- and second-generation cephalosporin, gentamicin, streptomycin, tobramycin, macrolides, and polymyxins.[1] B. pseudomallei isolates from the region of Sarawak, Malaysia are susceptible to gentamicin, though.[1]
Tahap intensif
Intravenous ceftazidime is the current drug of choice for treatment of acute melioidosis and should be administered for at least 10 days.[1] Meropenem, imipenem, and the cefoperazone-sulbactam combination (Sulperazone) are also effective.[1][18] Intravenous amoxicillin-clavulanate (co-amoxiclav) may be used if none of the above four drugs is available;[1] co-amoxiclav prevents death from melioidosis, as does ceftazidime.[7] Intravenous antibiotics are given for a minimum of 10 days. The median fever clearance time in melioidosis is 9 days.[1]
Meropenem is the preferred antibiotic therapy for neurological melioidosis and those with septic shock admitted into intensive care units. Co-trimoxazole is recommended for neurological melioidosis, osteomyelitis, septic arthritis, skin and gastrointestinal infection, and deeply seated abscess. For deep-seated infections such as abscesses of internal organs, osteomyelitis, septic arthritis, and neurological melioidosis, the duration of antibiotics given should be longer (up to 4 to 8 weeks). The time taken for fever to be resolved can be more than 10 days in those with deep-seated infection. Resistance to ceftazidime, carbapenems, and co-amoxiclav are rare in the intensive phase, but are more prominent during eradication therapy. No differences are seen between using cefoperazone/sulbactam or ceftazidime to treat melioidosis, as both show similar death rates and disease progression following treatment.[2] For those with kidney impairment, the dosage of ceftazidime, meropenem, and co-trimoxazole should be lowered.[3] Once the clinical condition improved, meropenem can be switched back to ceftazidime.[1] Whether the ceftazidime or meropenem combination therapy reduces relapse rates in early phase of the therapy is unclear.[19]
Tahap pemberantasan
Following the treatment of the acute disease, eradication (or maintenance) treatment with co-trimoxazole is the drug of choice and should be used for at least 3 months. For those with neurological melioidosis and osteomyelitis, drugs should be given for more than 6 months. Co-amoxiclav and doxycycline are drugs of second choice. Co-trimoxazole should not be used in those with glucose-6-phosphate dehydrogenase deficiency, as it can cause haemolytic anemia. Other side effects, such as rash, hyperkalemia, renal dysfunction, and gastrointestinal symptoms, should prompt the reduction of co-trimoxazole doses. Chloramphenicol is no longer routinely recommended for this purpose. Co-amoxiclav is an alternative for patients unable to take co-trimoxazole and doxycycline (e.g. pregnant women and children under the age of 12), but is not as effective and has higher relapse rate. Single-agent treatment with fluoroquinolone (e.g., ciprofloxacin) or doxycycline for the oral maintenance phase is ineffective.[1]
In Australia, co-trimoxazole is used in children and pregnant mothers after the first 12 weeks of pregnancy. Meanwhile, in Thailand, co-amoxiclav is the drug of choice for children and pregnant women. However, B. pseudomallei often acquires resistance when co-amoxiclav is used. Cases have also been reported where melioidosis is successfully treated with co-trimoxazole for 3 months without going through intensive therapy provided that only skin manifestations are seen without the involvement of internal organs or sepsis.[1] Resistance to cotrimoxazole is rare in Australia.[2]
Pembedahan
Surgical drainage is indicated for single, large abscesses in the liver, muscle, and prostate. However, for multiple abscesses in the liver, spleen, and kidney, surgical drainage may not be possible or necessary. For septic arthritis, arthrotomy washout and drainage is required. Surgical debridement may be necessary. For those with mycotic aneurysm, urgent surgery is required for prosthetic vascular grafts. Life-long therapy with co-trimoxazole may be needed for those with prosthetic vascular grafts. Other abscesses rarely need to be drained because the majority of them can resolve with antibiotic treatment.[1] In Australia, prostate abscess may require routine imaging and drainage.[15]
Perawatan lain
Immunomodulating therapies such as granulocyte colony-stimulating factor,[9] Interleukin 7, and anti-PDI (programmed cell death) could be useful in melioidosis treatment, especially for those with septic shock. This is because these drugs could help to boost the human body immune function against the bacteria.[1]
Referensi
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bo Wiersinga WJ, Virk HS, Torres AG, Currie BJ, Peacock SJ, Dance DA, Limmathurotsakul D (February 2018). "Melioidosis". Nature Reviews. Disease Primers. 4 (17107): 17107. doi:10.1038/nrdp.2017.107. PMC 6456913
 . PMID 29388572.
. PMID 29388572.
- ^ a b c d e f g h i j k l m n o p q r s Foong YC, Tan M, Bradbury RS (30 October 2014). "Melioidosis: a review". Rural and Remote Health. 14 (4): 2763. PMID 25359677.
- ^ a b c d e f g h i j k l m n Currie BJ (February 2015). "Melioidosis: evolving concepts in epidemiology, pathogenesis, and treatment". Seminars in Respiratory and Critical Care Medicine. 36 (1): 111–25. doi:10.1055/s-0034-1398389
 . PMID 25643275.
. PMID 25643275.
- ^ Brightman, Christopher; Locum (2020). "Melioidosis: the Vietnamese time bomb". Trends in Urology & Men's Health (dalam bahasa Inggris). 11 (3): 30–32. doi:10.1002/tre.753
 . ISSN 2044-3749.
. ISSN 2044-3749.
- ^ Kesalahan pengutipan: Tag
<ref>tidak sah; tidak ditemukan teks untuk ref bernamaWhitmore 1912 - ^ Currie BJ, Ward L, Cheng AC (2010). "The epidemiology and clinical spectrum of melioidosis: 540 cases from the 20 year Darwin prospective study". PLOS Negl Trop Dis. 4 (11): e900. doi:10.1371/journal.pntd.0000900. PMC 2994918
 . PMID 21152057.
. PMID 21152057.
- ^ a b c Bennett JE, Raphael D, Martin JB, Currie BJ (2015). "223". Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases (edisi ke-Eighth). Elsevier. hlm. 2541–2549. ISBN 978-1-4557-4801-3.
- ^ Fertitta L, Monsel G, Torresi J, Caumes E (February 2019). "Cutaneous melioidosis: a review of the literature". International Journal of Dermatology. 58 (2): 221–227. doi:10.1111/ijd.14167. hdl:11343/284394
 . PMID 30132827.
. PMID 30132827.
- ^ a b c d e f g h i j k l m n o Gassiep I, Armstrong M, Norton R (March 2020). "Human Melioidosis". Clinical Microbiology Reviews. 33 (2). doi:10.1128/CMR.00006-19. PMC 7067580
 . PMID 32161067.
. PMID 32161067.
- ^ Brightman, Christopher; Locum (2020). "Melioidosis: the Vietnamese time bomb". Trends in Urology & Men's Health (dalam bahasa Inggris). 11 (3): 30–32. doi:10.1002/tre.753
 . ISSN 2044-3749.
. ISSN 2044-3749.
- ^ a b Ngauy V, Lemeshev Y, Sadkowski L, Crawford G (February 2005). "Cutaneous melioidosis in a man who was taken as a prisoner of war by the Japanese during World War II". Journal of Clinical Microbiology. 43 (2): 970–2. doi:10.1128/JCM.43.2.970-972.2005. PMC 548040
 . PMID 15695721.
. PMID 15695721.
- ^ Gee JE, Gulvik CA, Elrod MG, Batra D, Rowe LA, Sheth M, Hoffmaster AR (July 2017). "Phylogeography of Burkholderia pseudomallei Isolates, Western Hemisphere". Emerging Infectious Diseases. 23 (7): 1133–1138. doi:10.3201/eid2307.161978. PMC 5512505
 . PMID 28628442.
. PMID 28628442.
- ^ Chodimella U, Hoppes WL, Whalen S, Ognibene AJ, Rutecki GW (May 1997). "Septicemia and suppuration in a Vietnam veteran". Hospital Practice. 32 (5): 219–21. doi:10.1080/21548331.1997.11443493. PMID 9153149.
- ^ Brightman, Christopher; Locum (2020). "Melioidosis: the Vietnamese time bomb". Trends in Urology & Men's Health (dalam bahasa Inggris). 11 (3): 30–32. doi:10.1002/tre.753
 . ISSN 2044-3749.
. ISSN 2044-3749.
- ^ a b c d Cheng AC, Currie BJ (April 2005). "Melioidosis: epidemiology, pathophysiology, and management". Clinical Microbiology Reviews. 18 (2): 383–416. doi:10.1128/CMR.18.2.383-416.2005. PMC 1082802
 . PMID 15831829.
. PMID 15831829.
- ^ Baker A, Pearson T, Price EP, Dale J, Keim P, Hornstra H, et al. (March 2011). "Molecular phylogeny of Burkholderia pseudomallei from a remote region of Papua New Guinea". PLOS ONE. 6 (3): e18343. Bibcode:2011PLoSO...618343B. doi:10.1371/journal.pone.0018343
 . PMC 3069084
. PMC 3069084  . PMID 21483841.
. PMID 21483841. 
- ^ Centers for Disease Control and Prevention (2009). Biosafety in Microbiological and Biomedical Laboratories (edisi ke-5th). Atlanta, Georgia: National Institutes of Health.
- ^ Kesalahan pengutipan: Tag
<ref>tidak sah; tidak ditemukan teks untuk ref bernamaMatthew 2018 - ^ Samuel M, Ti TY, et al. (Cochrane Infectious Diseases Group) (2002-10-21). "Interventions for treating melioidosis". The Cochrane Database of Systematic Reviews (4): CD001263. doi:10.1002/14651858.CD001263. PMC 6532693
 . PMID 12519552.
. PMID 12519552.
Pranala luar
| Klasifikasi | |
|---|---|
| Sumber luar |
- Resource Center for melioidosis
- Templat:CDCDiseaseInfo
- Burkholderia pseudomallei genomes and related information at PATRIC, a Bioinformatics Resource Center funded by NIAID
- Monograph on Melioidosis (ISBN 978-0-444-53479-8); Elsevier Press, 2012, https://www.researchgate.net/publication/354857974_Monograph_Melioidosis-a-century-of-observation-and-research_ISBN_978-0-444-53479-8
