Antimon pentaklorida
| |||

| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Antimon pentaklorida
Antimon(V) klorida | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChemSpider | |||
| Nomor EC | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| Cl5Sb | |||
| Massa molar | 299,01 g·mol−1 | ||
| Penampilan | cairan tidak berwarna atau kuning-kemerahan (berasap), berminyak | ||
| Bau | tajam | ||
| Densitas | 2.336 g/cm3 (20 °C)[1] 2.36 g/cm3 (25 °C)[2] | ||
| Titik lebur | 28 °C (82 °F; 301 K) | ||
| Titik didih | 140 °C (284 °F; 413 K) berdekomposisi dari 106 °C[3] 79 °C (174 °F; 352 K) pada 22 mmHg[1] 92 °C (198 °F; 365 K) pada 30 mmHg[2] | ||
| Kelarutan | larut dalam alkohol, HCl, asam tartarat, CHCl3, CS2, CCl4 | ||
| Kelarutan dalam selenium(IV) oksiklorida | 62.97 g/100 g (25 °C) | ||
| Tekanan uap | 0.16 kPa (25 °C) 4 kPa (40 °C) 7.7 kPa (100 °C)[4] | ||
| -120.0·10−6 cm3/mol | |||
| Indeks bias (nD) | 1.59255 | ||
| Viskositas | 2.034 cP (29.4 °C)[1] 1.91 cP (35 °C) | ||
| Struktur | |||
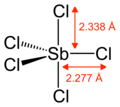
| Trigonal bipyramidal | |||
| 0 D | |||
| Termokimia | |||
| Kapasitas kalor (C) | 120.9 J/mol·K (gas)[3] | ||
| Entropi molar standar (S |
295 J/mol·K[3] | ||
| Entalpi pembentukan standar (ΔfH |
-437.2 kJ/mol[3] | ||
| Energi bebas Gibbs (ΔfG) | -345.35 kJ/mol[3] | ||
| Bahaya | |||
| Piktogram GHS |   [2] [2]
| ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H314, H411[2] | |||
| P273, P280, P305+351+338, P310[2] | |||
| Bahaya jika terhirup | Toxic | ||
| Titik nyala | 77 °C (171 °F; 350 K) | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LD50 (dosis median)
|
1115 mg/kg, (rat, oral)[3] | ||
| Batas imbas kesehatan AS (NIOSH): | |||
PEL (yang diperbolehkan)
|
TWA 0.5 mg/m3 (sebagai Sb)[5] | ||
REL (yang direkomendasikan)
|
TWA 0.5 mg/m3 (sebagai Sb)[5] | ||
| Senyawa terkait | |||
Anion lain
|
Antimon pentafluorida | ||
Kation lainnya
|
Fosfor pentaklorida | ||
Senyawa terkait
|
Antimon triklorida | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Antimon pentaklorida adalah senyawa kimia dengan rumus SbCl5. Senyawa ini merupakan minyak yang tidak berwarna, tetapi sampeknya biasanya berwarna kuning akibat ketidakmurnian yang mungkin terjadi. Senyawa ini cenderung berhidrolisis menjadi asam klorida, sehingga SbCl5 adalah bahan yang sangat korosif.
Preparasi dan struktur
[sunting | sunting sumber]Antimon pentaklorida dapat disiapkan dengan mengalirkan gas klor ke antimon triklorida yang telah dilebur:
- SbCl3 + Cl2 → SbCl5
SbCl5 dalam bentuk gas memiliki struktur prismatik trigonal.[6]
Reaksi
[sunting | sunting sumber]Antimon pentaklorida berhidrolisis menjadi asam klorida dan antimon oksiklorida. Reaksi ini dapat dihentikan dengan keberadaan klorida dalam jumlah yang berlebihan akibat pembentukan ion kompleks heksakloroantimonat:
- SbCl5 + Cl− → [SbCl6]−
Senyawa ini memiliki mono dan tetrahidrat, yaitu, SbCl5·H2O SbCl5·4 H2O.
Senyawa ini juga dapat berfungsi sebagai oksidator yang kuat.[7]
Aplikasi
[sunting | sunting sumber]Antimon pentaklorida digunakan sebagai katalis polimerisasi dan untuk proses klorinasi senyawa organik.
Referensi
[sunting | sunting sumber]- ^ a b c http://www.inchem.org/documents/ukpids/ukpids/ukpid36.htm
- ^ a b c d e Sigma-Aldrich Co., Antimony(V) chloride. Diakses tanggal 2014-05-29.
- ^ a b c d e f http://chemister.ru/Database/properties-en.php?dbid=1&id=1979
- ^ Antimony pentachloride dalam Linstrom, P.J.; Mallard, W.G. (eds.) NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD. http://webbook.nist.gov (diakses tanggal 2014-05-29)
- ^ a b "NIOSH Pocket Guide to Chemical Hazards #0036". National Institute for Occupational Safety and Health (NIOSH).
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ Connelly, N. G.; Geiger, W. E. (1996). "Chemical Redox Agents for Organometallic Chemistry". Chem. Rev. 96: 877–922. doi:10.1021/cr940053x. PMID 11848774.