Katalisis


Katalisis adalah proses peningkatan laju reaksi kimia dengan menambahkan zat yang dikenal sebagai katalis.[1][2] Katalis tidak akan terkonsumsi dalam reaksi dan tetap tidak berubah setelahnya. Jika reaksi berlangsung cepat dan katalis didaur ulang dengan cepat, jumlah katalis yang sangat kecil seringkali cukup;[3] pencampuran, luas permukaan, dan suhu merupakan faktor penting dalam laju reaksi. Katalis umumnya bereaksi dengan satu atau lebih reaktan untuk membentuk zat antara yang selanjutnya menghasilkan produk reaksi akhir, dalam proses regenerasi katalis.
Katalisis dapat diklasifikasikan sebagai katalisis homogen, di mana komponennya terdispersi dalam fase yang sama (biasanya gas atau cair) dengan reaktan, atau heterogen, di mana komponennya tidak berada dalam fase yang sama. Enzim dan biokatalis lainnya sering dianggap sebagai kategori ketiga.
Katalisis terdapat dalam berbagai jenis industri kimia.[4] Diperkirakan bahwa 90% dari semua produk kimia yang diproduksi secara komersial melibatkan katalis pada tahap tertentu dalam proses pembuatannya.
Kata "katalis" berasal dari bahasa Yunani καταλύειν, kataluein, yang berarti "melonggarkan" atau "melepaskan". Konsep katalisis ditemukan oleh kimiawan Elizabeth Fulhame, berdasarkan karya novelnya dalam eksperimen reduksi−oksidasi.[5][6]
Prinsip umum
[sunting | sunting sumber]Contoh
[sunting | sunting sumber]Salah satu contohnya adalah efek katalis untuk mempercepat dekomposisi hidrogen peroksida menjadi air dan oksigen:
- 2 H2O2 → 2 H2O + O2
Reaksi ini dapat berlangsung karena produk reaksi lebih stabil daripada senyawa awal, tetapi penguraian ini sangat lambat sehingga larutan hidrogen peroksida tersedia secara komersial. Dengan adanya katalis seperti mangan dioksida, reaksi ini akan berlangsung jauh lebih cepat. Efek ini mudah dilihat karena adanya buih oksigen.[7] Katalis itu tidak akan terkonsumsi dalam reaksi tersebut, dan dapat diperoleh kembali dalam keadaan yang sama dan digunakan kembali tanpa batas. Dengan demikian, mangan dioksida dikatakan mengatalisis reaksi ini. Pada organisme hidup, reaksi ini dikatalisis oleh enzim (protein yang berfungsi sebagai katalis) seperti katalase.
Satuan
[sunting | sunting sumber]Satuan turunan SI untuk mengukur aktivitas katalitis dari suatu katalis adalah katal, yang diukur dalam mol per detik. Produktivitas suatu katalis dapat dinotasikan dengan bilangan perputaran (atau TON) dan aktivitas katalitis dengan frekuensi perputaran (TOF), yang merupakan TON per satuan waktu. Satuan yang setara dalam biokimia adalah satuan enzim. Untuk informasi lebih lanjut mengenai efisiensi katalisis enzimatis, lihat artikel enzim.
Mekanisme reaksi katalitis
[sunting | sunting sumber]Secara umum, reaksi kimia lebih cepat terjadi dengan adanya katalis karena katalis menyediakan mekanisme reaksi (jalur reaksi) alternatif yang memiliki energi aktivasi lebih rendah daripada mekanisme tanpa katalis. Dalam mekanisme yang dikatalisis, katalis biasanya bereaksi dan membentuk zat antara, yang kemudian meregenerasi katalis asli dalam proses tersebut.[8][9][10][11]
Sebagai contoh sederhana yang terjadi pada fase gas, reaksi 2 SO2 + O2 → 2 SO3 dapat dikatalisis dengan penambahan nitrogen monoksida. Reaksi ini terjadi dalam dua langkah:
- 2 NO + O2 → 2 NO2 (menentukan laju)
- NO2 + SO2 → NO + SO3 (cepat)
Katalis NO diregenerasi. Laju keseluruhan adalah laju langkah lambat[11]
- v = 2k1[NO]2[O2].
Contoh katalisis heterogen adalah reaksi oksigen dan hidrogen pada permukaan titanium dioksida (TiO2, atau titania) untuk menghasilkan air. Mikroskop penerowongan payaran menunjukkan bahwa molekul tersebut mengalami adsorpsi dan disosiasi. Atom O dan H yang terdisosiasi dan terikat pada permukaan berdifusi bersama. Keadaan reaksi zat antara adalah: HO2, H2O2, kemudian H3O2 dan produk reaksi (dimer molekul air), setelah molekul air terdesorpsi dari permukaan katalis.[12][13]
Energetika reaksi
[sunting | sunting sumber]
Katalis akan membuka jalur yang berbeda dari reaksi tanpa katalis. Jalur ini memiliki energi aktivasi yang lebih rendah. Akibatnya, lebih banyak tumbukan molekul memiliki energi yang dibutuhkan untuk mencapai keadaan transisi. Oleh karena itu, katalis dapat mengaktifkan reaksi yang seharusnya diblokir atau diperlambat oleh penghalang kinetik. Katalis dapat meningkatkan laju reaksi atau selektivitas, atau mengaktifkan reaksi pada suhu yang lebih rendah. Efek ini dapat diilustrasikan dengan diagram profil energi.
Dalam reaksi elementer yang dikatalisis, katalis tidak akan mengubah luas suatu reaksi: mereka tidak berpengaruh pada kesetimbangan kimia dari suatu reaksi. Rasio laju reaksi maju dan mundur tidak akan terpengaruh (lihat pula termodinamika). Hukum termodinamika kedua menjelaskan mengapa katalis tidak mengubah kesetimbangan kimia suatu reaksi. Anggap bahwa ada sebuah katalis yang menggeser kesetimbangan. Memperkenalkan katalis ke sistem akan menghasilkan sebuah reaksi untuk pindah ke kesetimbangan baru, menghasilkan energi. Produksi energi adalah hasil yang diperlukan karena reaksi hanya bersifat spontan hanya jika energi bebas Gibbs dihasilkan, dan jika tidak ada penghalang energi, maka katalis tidak diperlukan. Kemudian, menghilangkan katalis juga akan menghasilkan reaksi, menghasilkan energi; yaitu penambahan dan proses kebalikannya, penghilangan, keduanya akan menghasilkan energi. Jadi, katalis yang dapat mengubah kesetimbangan adalah mesin gerak abadi, yang bertentangan dengan hukum termodinamika.[14] Dengan demikian, katalis tidak mengubah konstanta kesetimbangan. (Akan tetapi, katalis dapat mengubah konsentrasi kesetimbangan dengan mereaksikannya pada langkah berikutnya. Katalis tersebut kemudian dikonsumsi selama reaksi berlangsung, sehingga ia juga merupakan reaktan. Ilustrasinya adalah hidrolisis ester yang dikatalisis oleh basa, di mana asam karboksilat yang dihasilkan akan segera bereaksi dengan katalis basa sehingga kesetimbangan reaksi akan bergeser ke arah hidrolisis.)
Katalis akan menstabilkan keadaan transisi lebih dari ia menstabilkan bahan awal. Ia akan mengurangi penghalang kinetik dengan mengurangi perbedaan energi antara bahan awal dan keadaan transisi. Ia tidak mengubah perbedaan energi antara bahan awal dan produk (penghalang termodinamika), atau energi yang tersedia (ini disediakan oleh lingkungan sebagai panas atau cahaya).
Konsep terkait
[sunting | sunting sumber]Beberapa yang disebut katalis sebenarnya adalah prakatalis. Prakatalis akan berubah menjadi katalis dalam reaksi. Misalnya, katalis Wilkinson RhCl(PPh3)3 kehilangan satu ligan trifenilfosfina sebelum memasuki siklus katalitis yang sebenarnya. Prakatalis lebih mudah disimpan tetapi mudah diaktifkan di tempat. Karena langkah praaktivasi ini, banyak reaksi katalitis melibatkan periode induksi.
Dalam katalisis kooperatif, spesies kimia yang meningkatkan aktivitas katalitis disebut kokatalis atau promoter.
Dalam katalisis tandem, dua atau lebih katalis yang berbeda digabungkan dalam reaksi satu pot.
Dalam autokatalisis, katalis adalah produk dari reaksi keseluruhan, berbeda dengan semua jenis katalisis lain yang dibahas dalam artikel ini. Contoh paling sederhana dari autokatalisis adalah reaksi tipe A + B → 2 B, dalam satu atau beberapa langkah. Reaksi keseluruhan hanyalah A → B, sehingga B adalah produk. Tetapi karena B juga merupakan reaktan, ia mungkin ada dalam persamaan laju dan mempengaruhi laju reaksi. Seiring berjalannya reaksi, konsentrasi B meningkat dan dapat mempercepat reaksi sebagai katalis. Akibatnya, reaksi itu mempercepat dirinya sendiri atau dikatalisis secara otomatis. Contohnya adalah hidrolisis sebuah ester seperti aspirin menjadi asam karboksilat dan alkohol. Dengan tidak adanya katalis asam tambahan, produk asam karboksilat akan mengatalisis hidrolisis.
Katalis sebenarnya dapat bekerja bersama-sama dengan katalis pengorbanan. Katalis sebenarnya akan dikonsumsi dalam reaksi elementer dan diubah menjadi bentuk yang dinonaktifkan. Katalis pengorbanan akan meregenerasi katalis sebenarnya untuk siklus lain. Katalis pengorbanan akan dikonsumsi dalam reaksi, dan dengan demikian, ia sebenarnya bukanlah katalis, melainkan reagen. Misalnya, osmium tetroksida (OsO4) adalah reagen yang baik untuk dihidroksilasi, tetapi sangat beracun dan mahal. Dalam dihidroksilasi Upjohn, katalis pengorbanan N-metilmorfolina N-oksida (NMMO) meregenerasi OsO4, dan hanya OsO4 dalam jumlah katalitis yang diperlukan.
Klasifikasi
[sunting | sunting sumber]Katalisis dapat diklasifikasikan sebagai homogen atau heterogen. Katalisis homogen adalah di mana komponen reaksinya terdispersi dalam fase yang sama (biasanya gas atau cair) dengan molekul reaktan. Katalisis heterogen adalah di mana komponen reaksinya tidak berada dalam fase yang sama. Enzim dan biokatalis lainnya sering dianggap sebagai kategori ketiga. Prinsip mekanistis serupa berlaku untuk heterogen, homogen, dan biokatalisis.
Katalisis heterogen
[sunting | sunting sumber]

Katalis heterogen bertindak dalam fase yang berbeda dari reaktan. Sebagian besar katalis heterogen adalah padatan yang bekerja pada substrat dalam campuran reaksi cair atau gas. Katalis heterogen yang penting meliputi zeolit, alumina,[15] oksida orde-tinggi, karbon grafit, oksida logam transisi, logam seperti nikel Raney untuk hidrogenasi, dan vanadium(V) oksida untuk oksidasi belerang dioksida menjadi belerang trioksida melalui proses kontak.[16]
Beragam mekanisme reaksi pada permukaan telah diketahui, tergantung pada bagaimana adsorpsi berlangsung (Langmuir–Hinshelwood, Eley–Rideal, dan Mars–van Krevelen).[17] Luas permukaan total padatan memiliki efek penting pada laju reaksi. Semakin kecil ukuran partikel katalis, semakin besar luas permukaan untuk massa partikel tertentu.
Katalis heterogen memiliki bagian aktif, yaitu atom atau permukaan kristal tempat reaksi sebenarnya terjadi. Bergantung pada mekanismenya, bagian aktif dapat berupa permukaan logam yang terbuka rata, tepi kristal dengan valensi logam yang tidak sempurna, atau kombinasi rumit dari keduanya. Jadi, tidak hanya sebagian besar volume tetapi juga sebagian besar permukaan katalis heterogen mungkin tidak aktif secara katalitis. Mencari tahu sifat bagian aktif memerlukan penelitian yang menantang secara teknis. Dengan demikian, penelitian empiris untuk menemukan kombinasi logam baru untuk katalisis terus berlanjut.
Misalnya, dalam proses Haber, besi yang dibelah halus berfungsi sebagai katalis untuk sintesis amonia dari nitrogen dan hidrogen. Gas yang bereaksi akan teradsorpsi ke bagian aktif pada partikel besi. Setelah diadsorpsi secara fisik, reagen itu menjalani kemisorpsi yang menghasilkan disosiasi menjadi spesies atom yang teradsorpsi, dan ikatan baru antara fragmen yang dihasilkan terbentuk sebagian karena kedekatannya.[18] Dengan cara ini, ikatan rangkap tiga yang sangat kuat dalam nitrogen akan terputus, yang akan sangat jarang terjadi pada fase gas karena energi aktivasinya yang tinggi. Dengan demikian, energi aktivasi dari keseluruhan reaksi diturunkan, dan laju reaksinya meningkat.[19] Tempat lain di mana katalis heterogen digunakan adalah dalam oksidasi belerang dioksida pada vanadium(V) oksida untuk produksi asam sulfat.[16]
Katalis heterogen biasanya "didukung", yang berarti katalis itu akan tersebar pada bahan kedua yang meningkatkan efektivitas atau meminimalkan biayanya. Dukungan akan mencegah atau meminimalkan aglomerasi dan penyinteran partikel katalis kecil, membuka lebih banyak area permukaan, sehingga katalis memiliki aktivitas spesifik (per gram) yang lebih tinggi bila didukung. Kadang-kadang, pendukung itu hanyalah permukaan tempat katalis disebarkan untuk menambah luas permukaan. Lebih sering, pendukung dan katalis berinteraksi, mempengaruhi reaksi katalitis. Pendukung juga dapat digunakan dalam sintesis nanopartikel dengan menyediakan tempat bagi masing-masing molekul katalis untuk berikatan secara kimiawi. Pendukung adalah bahan berpori dengan luas permukaan yang tinggi, dengan yang paling sering adalah alumina, zeolit atau berbagai jenis karbon aktif. Terdapat pula heberapa pendukung khusus, seperti silikon dioksida, titanium dioksida, kalsium karbonat, dan barium sulfat.[20]
Dalam reaksi bubur, katalis heterogen dapat hilang dengan pelarutan.
Banyak katalis heterogen sebenarnya adalah nanomaterial. Katalis berbasis nanomaterial dengan aktivitas peniruan enzim secara kolektif disebut sebagai nanozim.[21]
Elektrokatalis
[sunting | sunting sumber]Dalam konteks elektrokimia, khususnya dalam rekayasa sel bahan bakar, berbagai katalis yang mengandung logam digunakan untuk meningkatkan laju setengah reaksi yang terdiri dari sel bahan bakar. Salah satu jenis elektrokatalis sel bahan bakar yang umum didasarkan pada nanopartikel platina yang didukung pada partikel karbon yang sedikit lebih besar. Saat bersentuhan dengan salah satu elektroda dalam sel bahan bakar, platina ini akan meningkatkan laju reduksi oksigen baik menjadi air ataupun menjadi hidroksida atau hidrogen peroksida.
Katalisis homogen
[sunting | sunting sumber]Katalis homogen berfungsi dalam fase yang sama dengan reaktan. Katalis homogen biasa dilarutkan dalam pelarut dengan substrat. Salah satu contoh katalisis homogen melibatkan pengaruh H+ pada esterifikasi asam karboksilat, seperti pembentukan metil asetat dari asam asetat dan metanol.[22] Proses volume tinggi yang membutuhkan katalis homogen meliputi hidroformilasi, hidrosililasi, hidrosianasi. Untuk kimiawan anorganik, katalisis homogen sering identik dengan katalis organologam.[23] Banyak dari katalis homogen yang tidak bersifat organologam, diilustrasikan dengan penggunaan garam kobalt yang mengatalisis oksidasi p-xilena menjadi asam tereftalat.
Organokatalisis
[sunting | sunting sumber]Walaupun logam transisi kadang-kadang menarik sebagian besar perhatian dalam studi katalisis, molekul organik kecil tanpa logam juga dapat menunjukkan sifat katalitis, seperti yang terlihat dari fakta bahwa banyak enzim yang kekurangan logam transisi. Biasanya, katalis organik membutuhkan pemuatan yang lebih tinggi (jumlah katalis per satuan jumlah reaktan, dinyatakan dalam mol% jumlah zat) daripada katalis berbasis (ion) logam transisi, tetapi katalis ini biasanya tersedia secara komersial dalam jumlah besar, membantu menurunkan biaya. Pada awal tahun 2000-an, organokatalis ini dianggap sebagai "generasi baru" dan dapat bersaing dengan katalis tradisional yang mengandung (ion) logam. Organokatalis seharusnya beroperasi seperti enzim bebas logam yang menggunakan, misalnya, interaksi nonkovalen seperti pengikatan hidrogen. Disiplin organokatalisis dibagi menjadi aplikasi organokatalis kovalen (misalnya prolina, DMAP) dan nonkovalen (misalnya organokatalisis tiourea) yang masing-masing mengacu pada pengikatan dan interaksi katalis-substrat yang disukai. Penghargaan Nobel Kimia 2021 diberikan bersama kepada Benjamin List dan David W.C. MacMillan "untuk pengembangan organokatalisis asimetris."[24]
Fotokatalisis
[sunting | sunting sumber]Fotokatalisis adalah suatu fenomena di mana katalis dapat menerima cahaya untuk menghasilkan keadaan tereksitasi yang mempengaruhi reaksi redoks.[25] Oksigen singlet biasanya diproduksi melalui fotokatalisis. Fotokatalis adalah komponen dari sel surya tersensitisasi pewarna.
Enzim dan biokatalis
[sunting | sunting sumber]Dalam biologi, enzim adalah katalis berbasis protein dalam metabolisme dan katabolisme. Sebagian besar biokatalis adalah enzim, tetapi kelas biomolekul berbasis nonprotein lainnya juga menunjukkan sifat katalitis seperti ribozim, dan deoksiribozim yang sintetis.[26]
Biokatalis dapat dianggap sebagai perantara antara katalis homogen dan heterogen, meskipun enzim yang larut secara tegas adalah katalis homogen dan enzim yang terikat membran adalah katalis heterogen. Beberapa faktor yang mempengaruhi aktivitas enzim (dan katalis lainnya) meliputi suhu, pH, serta konsentrasi enzim, substrat, dan produk. Reagen yang sangat penting dalam reaksi enzimatis adalah air, yang merupakan produk dari banyak reaksi pembentukan ikatan dan reaktan dalam banyak proses pemutusan ikatan.
Dalam biokatalisis, enzim digunakan untuk menyiapkan banyak bahan kimia komoditas, seperti sirop jagung fruktosa tinggi dan akrilamida.
Beberapa antibodi monoklonal yang target pengikatannya adalah molekul stabil yang menyerupai keadaan transisi reaksi kimia dapat berfungsi sebagai katalis lemah untuk reaksi kimia tersebut dengan menurunkan energi aktivasinya.[27] Antibodi katalitis semacam itu terkadang disebut "abzim".
Pentingnya katalis
[sunting | sunting sumber]
Diperkirakan bahwa 90% dari semua produk kimia yang diproduksi secara komersial melibatkan katalis pada tahap tertentu dalam proses pembuatannya.[29] Pada tahun 2005, proses katalitis menghasilkan produk bernilai sekitar AS$900 miliar di seluruh dunia.[30] Katalisis sangatlah meresap sehingga subarea-subarea tidak mudah diklasifikasikan. Beberapa area konsentrasi tertentu disurvei di bawah ini.
Pemrosesan energi
[sunting | sunting sumber]Pemurnian minyak bumi menggunakan katalisis secara intensif untuk alkilasi, perengkahan katalitis (memecah hidrokarbon rantai panjang menjadi potongan yang lebih kecil), reformasi nafta dan reformasi uap (konversi hidrokarbon menjadi gas sintetis). Bahkan, knalpot dari pembakaran bahan bakar fosil diolah melalui katalisis: Konverter katalitis, biasanya terdiri dari platina dan rodium, memecah beberapa produk sampingan yang lebih berbahaya dari knalpot mobil.
- 2 CO + 2 NO → 2 CO2 + N2
Berkaitan dengan bahan bakar sintetis, sebuah proses yang telah dikenal lama namun tetap penting adalah sintesis hidrokarbon Fischer–Tropsch dari gas sintetis, yang diproses sendiri melalui reaksi pergeseran air–gas, yang dikatalisis oleh besi. Reaksi Sabatier dapat menghasilkan metana dari karbon dioksida dan hidrogen. Biodiesel dan bahan bakar hayati terkait membutuhkan pemrosesan melalui anorganik dan biokatalis.
Sel bahan bakar mengandalkan katalis untuk reaksi anodik dan katodik. Pemanasan katalitis dapat menghasilkan panas tanpa nyala dari pasokan bahan bakar yang mudah terbakar.
Bahan kimia curah
[sunting | sunting sumber]
Beberapa bahan kimia skala terbesar diproduksi melalui oksidasi katalitis, seringkali menggunakan oksigen. Contohnya meliputi asam nitrat (dari amonia), asam sulfat (dari belerang dioksida menjadi belerang trioksida melalui proses kontak), asam tereftalat (dari p-xilena), asam akrilat (dari propilena atau propana), dan akrilonitril (dari propana dan amonia).[17]
Produksi amonia adalah salah satu proses skala terbesar dan paling padat energi. Dalam proses Haber, nitrogen digabungkan dengan hidrogen melalui katalis besi oksida.[31] Metanol dibuat dari karbon monoksida atau karbon dioksida tetapi menggunakan katalis tembaga–seng.
Polimer curah yang berasal dari etilena dan propilena sering dibuat melalui katalisis Ziegler–Natta. Poliester, poliamida, dan isosianat diturunkan melalui katalisis asam–basa.
Sebagian besar proses karbonilasi membutuhkan katalis logam, contohnya ialah proses asam asetat Monsanto dan hidroformilasi.
Bahan kimia murni
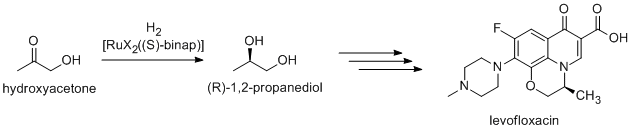
[sunting | sunting sumber]Banyak dari bahan kimia murni yang disiapkan melalui katalisis; beberapa metodenya meliputi proses yang dilakukan pada industri berat serta proses yang lebih khusus yang akan sangat mahal dalam skala besar. Contohnya ialah reaksi Heck dan reaksi Friedel–Crafts. Karena sebagian besar senyawa bioaktif adalah kiral, banyak obat-obatan diproduksi melalui katalisis enansioselektif (sintesis asimetris katalitis). (R)-1,2-Propandiol, prekursor levofloksasin antibakteri, dapat disintesis secara efisien dari hidroksiaseton dengan menggunakan katalis berdasarkan kompleks BINAP–rutenium, dalam hidrogenasi asimetris Noyori:[32]
Lingkungan
[sunting | sunting sumber]Katalisis dapat memengaruhi lingkungan dengan meningkatkan efisiensi proses industri, tetapi katalisis juga memainkan peran langsung dalam lingkungan. Salah satu contoh perannya yang penting adalah peran katalitis dari radikal bebas klorin dalam pemecahan ozon. Radikal-radikal ini dibentuk oleh aksi radiasi ultraungu pada klorofluorokarbon (CFC).
- Cl· + O3 → ClO· + O2
- ClO· + O· → Cl· + O2
Penggunaan katalis
[sunting | sunting sumber]Pemrosesan makanan
[sunting | sunting sumber]Salah satu aplikasi katalisis yang paling jelas adalah hidrogenasi (reaksi dengan gas hidrogen) lemak menggunakan katalis nikel untuk menghasilkan margarin.[33] Banyak bahan makanan lainnya disiapkan melalui biokatalisis (lihat di bawah).
Esterifikasi dan interesterifikasi
[sunting | sunting sumber]Reaksi esterifikasi memerlukan katalis asam atau katalis basa untuk mempercepat reaksi antara gliserol dengan asam lemak untuk menghasilkan monogliserida, digliserida, dan air. Katalis diberikan pada suhu pemanasan antara 210 °C hingga 230 °C. Rasio antara gliserol dan asam lemak dalam reaksi akan menentukan komposisi monogliserida. Sedangkan komposisi digliserida ditentukan oleh reaksi interesterifikasi yang melibatkan gliserol, lemak atau minyak dan katalis basa seperti kalsium hidroksida. Reaksi interesterifikasi hanya membutuhkan gliserol dalam jumlah yang lebih sedikit dibandingkan dengan reaksi interesterifikasi dengan asam lemak.[34]
Pembuatan sel bahan bakar
[sunting | sunting sumber]Katalis digunakan untuk mempercepat reaksi pada sistem elektroda yang membentuk sel bahan bakar. Setiap sel elektroda merupakan sel elektrokimia yang secara berkelanjutan mengubah energi kimia dalam bahan bakar dan oksidan menjadi air dan menghasilkan energi listrik. Proses pembuatan sel bahan bakar melibatkan sistem elektroda-elektrolit yang mengalami reaksi elektrokimia. Elektrolit digunakan untuk menghantarkan muatan listrik dari elektroda negatif (anoda) ke elektroda positif (katoda) sehingga menghasilkan arus listrik dan energi panas.[35] Katalis yang digunakan di dalam elektroda ialah lapisan platina.[36]
Reaksi alkilasi Friedel–Crafts
[sunting | sunting sumber]Reaksi alkilasi Friedel–Crafts menggunakan prinsip substitusi elektrofilik aromatik. Reaksi kimia dihasilkan melalui alkilasi benzena dengan alkil halida menggunakan katalis asam Lewis yang kuat. Jenis katalis yang umum digunakan ialah aluminium klorida atau besi klorida.[37]
Fermentasi
[sunting | sunting sumber]Manusia telah menggunakan enzim sebagai katalis fermentasi makanan sejak zaman prasejarah. Enzim khamir telah lama digunakan untuk melakukan fermentasi gula buah menjadi alkohol. Enzim pada bakteri Streptococcus thermophilus, Lactobacillus bulgaricus, dan Lactobacillus acidophilus digunakan untuk membuat yoghurt. Enzim juga digunakan sebagai katalis dalam pembuatan bir dari biji-bijian, pembuatan adonan roti dengan khamir dan fermentasi air kelapa menjadi cuka.[38] Keunggulan penggunaan enzim sebagai katalis ialah sifatnya yang tidak berubah meski telah mengalami reaksi kimia. Selain itu, enzim melakukan percepatan reaksi kimia dengan tetap mempertahankan kedudukan normal dari kesetimbangan kimia.[39]
Sintesis tabung nano karbon
[sunting | sunting sumber]Katalis logam digunakan untuk melakukan sintesis pada tabung nano karbon yang dapat terkendali. Tabung nano karbon digunakan untuk membuat peralatan dengan sifat nanoelektronik. Proses nukleasi dan perumbuhan tabung nano karbon memerlukan bantuan katalis logam.[40]
Sejarah
[sunting | sunting sumber]Istilah "katalis", secara luas didefinisikan sebagai segala sesuatu yang meningkatkan laju suatu proses, berasal dari bahasa Yunani καταλύειν, yang berarti "membatalkan", atau "melepaskan", atau "mengambil". Konsep katalisis ditemukan oleh kimiawan Elizabeth Fulhame dan dijelaskan dalam sebuah buku tahun 1794, berdasarkan karya novelnya dalam reaksi reduksi–oksidasi.[5][6][41] Reaksi kimia pertama dalam kimia organik yang secara sadar menggunakan katalis dipelajari pada tahun 1811 oleh Gottlieb Kirchhoff, yang menemukan konversi pati menjadi glukosa yang dikatalisis oleh asam. Istilah katalisis kemudian digunakan oleh Jöns Jakob Berzelius pada tahun 1835[42] untuk menjelaskan reaksi yang dipercepat oleh zat yang tidak berubah setelah reaksi. Fulhame, yang mendahului Berzelius, bekerja dengan air sebagai kebalikan dari logam dalam eksperimen reduksinya. Kimiawan abad ke-18 lainnya yang bekerja dalam katalisis adalah Eilhard Mitscherlich[43] yang menyebutnya sebagai proses kontak, dan Johann Wolfgang Döbereiner[44][45] yang berbicara mengenai aksi kontak. Dia mengembangkan lampu Döbereiner, sebuah pemantik berbahan dasar hidrogen dan spons platina, yang sukses secara komersial pada tahun 1820-an dan masih hidup hingga saat ini. Humphry Davy menemukan penggunaan platina dalam katalisis.[46] Pada tahun 1880-an, Wilhelm Ostwald di Universitas Leipzig memulai penyelidikan sistematis terhadap reaksi yang dikatalisis oleh adanya asam dan basa, dan menemukan bahwa reaksi kimia terjadi pada laju yang terbatas dan laju ini dapat digunakan untuk menentukan kekuatan asam dan basa. Karena pekerjaan ini, Ostwald dianugerahi Penghargaan Nobel Kimia tahun 1909.[47] Vladimir Ipatieff melakukan beberapa reaksi skala industri paling awal, termasuk penemuan dan komersialisasi oligomerisasi dan pengembangan katalis untuk hidrogenasi.[48]
Inhibitor, toksin, dan promotor
[sunting | sunting sumber]Zat tambahan yang menurunkan laju reaksi disebut inhibitor reaksi jika reversibel dan racun katalis jika ireversibel.[1] Promotor adalah zat yang meningkatkan aktivitas katalitis, meskipun mereka sendiri bukan katalis.[49]
Inhibitor kadang-kadang disebut sebagai "katalis negatif" karena menurunkan laju reaksi.[50] Namun istilah inhibitor lebih disukai karena mereka tidak bekerja dengan memasukkan jalur reaksi dengan energi aktivasi yang lebih tinggi; ini tidak akan menurunkan laju karena reaksi akan terus terjadi melalui jalur yang tidak dikatalisis. Sebaliknya, mereka bertindak baik dengan menonaktifkan katalis ataupun dengan menghilangkan perantara reaksi seperti radikal bebas.[8][50] Dalam katalisis heterogen, pengokasan akan menghambat katalis, yang ditutupi oleh produk sampingan polimer.
Inhibitor dapat memodifikasi selektivitas selain laju. Misalnya, dalam hidrogenasi alkuna menjadi alkena, katalis paladium (Pd) yang sebagian "diracuni" dengan timbal(II) asetat (Pb(CH3CO2)2) dapat digunakan.[51] Tanpa penonaktifan katalis, alkena yang dihasilkan akan terhidrogenasi lebih lanjut menjadi alkana.[52][53]
Inhibitor dapat menghasilkan efek ini dengan, misalnya, meracuni secara selektif hanya pada jenis bagian aktif tertentu. Mekanisme lainnya adalah modifikasi geometri permukaan. Misalnya, dalam operasi hidrogenasi, bidang besar permukaan logam berfungsi sebagai tempat katalisis hidrogenolisis sementara tempat yang mengatalisis hidrogenasi tak jenuh berukuran lebih kecil. Dengan demikian, racun yang menutupi permukaan secara acak akan cenderung menurunkan jumlah bidang besar yang tidak terkontaminasi tetapi meninggalkan bagian yang lebih kecil secara proporsional, sehingga mengubah selektivitas hidrogenasi vs. hidrogenolisis. Banyak mekanisme lain juga dimungkinkan.
Promotor dapat menutupi permukaan untuk mencegah produksi alas kokas, atau bahkan secara aktif menghilangkan bahan tersebut (misalnya, renium pada platina dalam platformasi). Mereka dapat membantu dispersi bahan katalitis atau mengikat reagen.
Lihat pula
[sunting | sunting sumber]- Reaksi kimia
- Abzim
- Adjuvan Farmasi
- Autokatalisis
- BIG-NSE (Sekolah Pascasarjana Ilmu Pengetahuan Alam dan Teknik Berlin)
- Catalysis Science & Technology (jurnal kimia)
- Elektrokatalis
- Enzim SUMO
- Fotokatalisis
- Katalis industri
- Katalis transfer fase
- Katalisis asam (meliputi Katalisis basa)
- Katalisis batas fase
- Katalisis enzim
- Konsep murburn
- Mikroskop gaya prob Kelvin
- Pemicu lingkungan
- Reagen pembatas
- Ribozim (biokatalis RNA)
- Reduksi diprogram suhu
- Spektroskopi desorpsi termal
- Teori resonansi katalitis
Referensi
[sunting | sunting sumber]- ^ a b "Catalyst". IUPAC Compendium of Chemical Terminology. Oxford: Blackwell Scientific Publications. 2009. doi:10.1351/goldbook.C00876. ISBN 978-0-9678550-9-7.
- ^ Masel, Richard I (2001). Chemical Kinetics and Catalysis. New York: Wiley-Interscience. ISBN 0-471-24197-0.
- ^ Lerner, Louise (2011). "7 things you may not know about catalysis". Laboratorium Nasional Argonne.
- ^ Carroll, Gregory T.; Kirschman, David L. (23 Januari 2023). "Catalytic Surgical Smoke Filtration Unit Reduces Formaldehyde Levels in a Simulated Operating Room Environment". ACS Chemical Health & Safety (dalam bahasa Inggris). 30 (1): 21–28. doi:10.1021/acs.chas.2c00071. ISSN 1871-5532.
- ^ a b Laidler, Keith J.; Cornish-Bowden, Athel (1997). ""Elizabeth Fulhame and the discovery of catalysis: 100 years before Buchner" (PDF). Dalam Cornish-Bowden, Athel. New beer in an old bottle : Eduard Buchner and the growth of biochemical knowledge. Valencia: Universitat de Valencia. hlm. 123–126. ISBN 9788437033280. Diarsipkan dari versi asli (PDF) tanggal 23 Januari 2015. Diakses tanggal 17 Juni 2023.
- ^ a b Rayner-Canham, Marelene; Rayner-Canham, Geoffrey William (2001). Women in Chemistry: Their Changing Roles from Alchemical Times to the Mid-Twentieth Century
 . American Chemical Society. ISBN 978-0-8412-3522-9.
. American Chemical Society. ISBN 978-0-8412-3522-9.
- ^ "Genie in a Bottle". Universitas Minnesota. 2 Maret 2005. Diarsipkan dari versi asli tanggal 5 April 2008.
- ^ a b Laidler, K.J. dan Meiser, J.H. (1982) Physical Chemistry, Benjamin/Cummings, hlm. 425. ISBN 0-618-12341-5.
- ^ Laidler, Keith J.; Meiser, John H. (1982). Physical Chemistry. Benjamin/Cummings. hlm. 424–425. ISBN 0-8053-5682-7.
- ^ Atkins, Peter; de Paula, Julio (2006). Atkins' Physical Chemistry (edisi ke-8). W.H.Freeman. hlm. 839. ISBN 0-7167-8759-8.
- ^ a b Steinfeld, Jeffrey I.; Francisco, Joseph S.; Hase, William L. (1999). Chemical Kinetics and Dynamics (edisi ke-2). Prentice Hall. hlm. 147–150. ISBN 0-13-737123-3.
Konsentrasi katalis [C] muncul dalam ekspresi laju, tetapi tidak dalam rasio kesetimbangan.
- ^ Jacoby, Mitch (16 Februari 2009). "Making Water Step by Step". Chemical & Engineering News. hlm. 10.
- ^ Matthiesen J, Wendt S, Hansen JØ, Madsen GK, Lira E, Galliker P, Vestergaard EK, Schaub R, Laegsgaard E, Hammer B, Besenbacher F (2009). "Observation of All the Intermediate Steps of a Chemical Reaction on an Oxide Surface by Scanning Tunneling Microscopy". ACS Nano. 3 (3): 517–26. CiteSeerX 10.1.1.711.974
 . doi:10.1021/nn8008245. ISSN 1520-605X. PMID 19309169.
. doi:10.1021/nn8008245. ISSN 1520-605X. PMID 19309169.
- ^ Robertson, A.J.B. (1970) Catalysis of Gas Reactions by Metals. Logos Press, London.
- ^ Shafiq, Iqrash; Shafique, Sumeer; Akhter, Parveen; Yang, Wenshu; Hussain, Murid (23 Juni 2020). "Recent developments in alumina supported hydrodesulfurization catalysts for the production of sulfur-free refinery products: A technical review". Catalysis Reviews. 64: 1–86. doi:10.1080/01614940.2020.1780824
 . ISSN 0161-4940.
. ISSN 0161-4940.
- ^ a b Housecroft, Catherine E.; Sharpe, Alan G. (2005). Inorganic Chemistry (edisi ke-2). Pearson Prentice-Hall. hlm. 805. ISBN 0130-39913-2.
- ^ a b Knözinger, Helmut dan Kochloefl, Karl (2002) "Heterogeneous Catalysis and Solid Catalysts" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a05_313
- ^ "17.6: Catalysts and Catalysis". Chemistry LibreTexts (dalam bahasa Inggris). 26 Februari 2016. Diakses tanggal 17 Juni 2023.
- ^ "Chemistry of Vanadium". Chemistry LibreTexts (dalam bahasa Inggris). 3 Oktober 2013. Diakses tanggal 17 Juni 2023.
- ^ Chadha, Utkarsh; Selvaraj, Senthil Kumaran; Ashokan, Hridya; Hariharan, Sai P.; Mathew Paul, V.; Venkatarangan, Vishal; Paramasivam, Velmurugan (8 Februari 2022). "Complex Nanomaterials in Catalysis for Chemically Significant Applications: From Synthesis and Hydrocarbon Processing to Renewable Energy Applications". Advances in Materials Science and Engineering (dalam bahasa Inggris). 2022: e1552334. doi:10.1155/2022/1552334
 . ISSN 1687-8434.
. ISSN 1687-8434.
- ^ Wei, Hui; Wang, Erkang (21 Juni 2013). "Nanomaterials with enzyme-like characteristics (nanozymes): next-generation artificial enzymes". Chemical Society Reviews (dalam bahasa Inggris). 42 (14): 6060–93. doi:10.1039/C3CS35486E. ISSN 1460-4744. PMID 23740388.
- ^ Behr, Arno (2002) "Organometallic Compounds and Homogeneous Catalysis" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a18_215
- ^ Elschenbroich, C. (2006) Organometallics. Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ "The Nobel Prize in Chemistry 2021". NobelPrize.org.
- ^ Melchiorre, Paolo (2022). "Introduction: Photochemical Catalytic Processes". Chemical Reviews. 122 (2): 1483–1484. doi:10.1021/acs.chemrev.1c00993. PMID 35078320 Periksa nilai
|pmid=(bantuan). - ^ Nelson, D.L. and Cox, M.M. (2000) Lehninger, Principles of Biochemistry Ed. ke-3. Worth Publishing: New York. ISBN 1-57259-153-6.
- ^ Catalytic Antibodies Simply Explained. Documentroot.com (6 Maret 2010). Diakses tanggal 18 Juni 2023.
- ^ Solovev, Alexander A.; Sanchez, Samuel; Mei, Yongfeng; Schmidt, Oliver G. (2011). "Tunable catalytic tubular micro-pumps operating at low concentrations of hydrogen peroxide" (PDF). Physical Chemistry Chemical Physics. 13 (21): 10131–35. Bibcode:2011PCCP...1310131S. doi:10.1039/C1CP20542K. PMID 21505711. Diarsipkan dari versi asli (PDF) tanggal 28 Maret 2019.
- ^ "Recognizing the Best in Innovation: Breakthrough Catalyst". R&D Magazine, September 2005, hlm. 20.
- ^ 1.4.3 Industrial Process Efficiency Diarsipkan 17 Mei 2008 di Wayback Machine.. climatetechnology.gov
- ^ Smil, Vaclav (2004). Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production (edisi ke-1). Cambridge, MA: MIT. ISBN 9780262693134.
- ^ Dub, Pavel A.; Gordon, John C. (2018). "The role of the metal-bound N–H functionality in Noyori-type molecular catalysts". Nature Reviews Chemistry. 2 (12): 396–408. doi:10.1038/s41570-018-0049-z.
- ^ Clark, Jim (Oktober 2013). "Types of catalysis". Chemguide.
- ^ Mamuaja 2017, hlm. 22.
- ^ Gustian, Asdim, dan Maryanti 2016, hlm. 1.
- ^ Gustian, Asdim, dan Maryanti 2016, hlm. 3.
- ^ Gustian, Asdim, dan Maryanti 2016, hlm. 8.
- ^ Susanti dan Fibriana 2017, hlm. 3.
- ^ Susanti dan Fibriana 2017, hlm. 2.
- ^ Setiabudi, A., Hardian, R., dan Muzakir, A., (2012). Karakterisasi Material: Prinsip dan Aplikasinya dalam Penelitian Kimia. Bandung: UPI Press. hlm. 74. ISBN 979-978-435-2.
- ^ Bård Lindström and Lars J. Petterson (2003) "A brief history of catalysis" Cattech, 7 (4) : 130–38.
- ^ Berzelius, J.J. (1835) Årsberättelsen om framsteg i fysik och kemi [Laporan tahunan kemajuan fisika dan kimia]. Stockholm, Sweden: Royal Swedish Academy of Sciences. Setelah mengulas penelitian Eilhard Mitscherlich mengenai pembentukan eter, Berzelius membuat istilah katalys (katalisis) di halaman 245:
Asli: Jag skall derföre, för att begagna en i kemien välkänd härledning, kalla den kroppars katalytiska kraft, sönderdelning genom denna kraft katalys, likasom vi med ordet analys beteckna åtskiljandet af kroppars beståndsdelar medelst den vanliga kemiska frändskapen.
Terjemahan: Oleh karena itu, saya akan menggunakan derivasi terkenal dalam kimia, menyebut badan katalitis yaitu, zat gaya katalitis dan penguraian benda lain oleh katalisis gaya ini, seperti yang kita artikan dengan analisis kata pemisahan konstituen dari tubuh oleh afinitas kimia biasa.
- ^ Mitscherlich, E. (1834). "Ueber die Aetherbildung" [Pada pembentukan eter]. Annalen der Physik und Chemie. 31 (18): 273–82. Bibcode:1834AnP...107..273M. doi:10.1002/andp.18341071802.
- ^ Döbereiner (1822). "Glühendes Verbrennen des Alkohols durch verschiedene erhitzte Metalle und Metalloxyde" [Pembakaran pijar alkohol oleh berbagai logam dan oksida logam yang dipanaskan]. Journal für Chemie und Physik. 34: 91–92.
- ^ Döbereiner (1823). "Neu entdeckte merkwürdige Eigenschaften des Platinsuboxyds, des oxydirten Schwefel-Platins und des metallischen Platinstaubes" [Sifat luar biasa yang baru ditemukan dari platina suboksida, platina sulfida teroksidasi, dan debu platina metalik]. Journal für Chemie und Physik. 38: 321–26.
- ^ Davy, Humphry (1817). "Some new experiments and observations on the combustion of gaseous mixtures, with an account of a method of preserving a continued light in mixtures of inflammable gases and air without flame". Philosophical Transactions of the Royal Society of London. 107: 77–85. doi:10.1098/rstl.1817.0009
 .
.
- ^ Roberts, M.W. (2000). "Birth of the catalytic concept (1800–1900)". Catalysis Letters. 67 (1): 1–4. doi:10.1023/A:1016622806065.
- ^ Nicholas, Christopher P. (21 Agustus 2018). "Dehydration, Dienes, High Octane, and High Pressures: Contributions from Vladimir Nikolaevich Ipatieff, a Father of Catalysis". ACS Catalysis. 8 (9): 8531–39. doi:10.1021/acscatal.8b02310
 .
.
- ^ Dhara SS; Umare SS (2018). A Textbook of Engineering Chemistry. India: S. Chand Publishing. hlm. 66. ISBN 9789352830688.
- ^ a b Laidler, K.J. (1978) Physical Chemistry with Biological Applications, Benjamin/Cummings. hlm. 415–17. ISBN 0-8053-5680-0.
- ^ (2016) "Palladium Catalyst for Partial Reduction of Acetylenes". Org. Synth.; Coll. Vol. 5: 880.
- ^ Jencks, W.P. (1969) Catalysis in Chemistry and Enzymology McGraw-Hill, New York. ISBN 0-07-032305-4
- ^ Bender, Myron L; Komiyama, Makoto dan Bergeron, Raymond J (1984) The Bioorganic Chemistry of Enzymatic Catalysis Wiley-Interscience, Hoboken, A.S. ISBN 0-471-05991-9
- IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (2006–) "catalyst".
- Gustian, I., Asdim, dan Maryanti, E. (2016). Pengantar Sintesis dan Karakterisasi Membran Sel Bahan Bakar Berbasiskan Polimer (PDF). Bengkulu: Badan Penerbitan Fakultas Pertanian Universitas Bengkulu. ISBN 978-602-9071-19-1. Diarsipkan dari versi asli (PDF) tanggal 27 Januari 2021. Diakses tanggal 18 Juni 2023.
- Mamuaja, Christine F. (2017). Lipida (PDF). Manado: Unsrat Press. ISBN 978-979-3660- 81-3.
- Susanti, R., dan Fibriana, F. (2017). Teknologi Enzim (PDF). Yogyakarta: Penerbit ANDI. ISBN 978-979-29-6276-5. Diarsipkan dari versi asli (PDF) tanggal 21 September 2018. Diakses tanggal 18 Juni 2023.
- Widi, Restu Kartiko (2018). Pemanfaatan Material Anorganik: Pengenalan dan Beberapa Inovasi di Bidang Penelitian (PDF). Yogyakarta: Deepublish. ISBN 978-602-475-528-7.
Pranala luar
[sunting | sunting sumber]- (Inggris) Science Aid: Katalisis Halaman untuk sains tingkat SMA
- (Inggris) W.A. Presentasi Herrmann Technische Universität
- (Inggris) Katalis Alumit, Laboratorium Kameyama-Sakurai, Jepang
- (Inggris) Kimia Anorganik dan Gugus Katalisis, Universitas Utrecht, Belanda
- (Inggris) Pusat Kimia Permukaan dan Katalisis
- (Inggris) Gugus Karbon & Katalis, Universitas Concepcion, Chili
- (Inggris) Pusat Pengaktifan Teknologi Baru Melalui Katalisis, Pusat Inovasi Kimia NSF, AS
- (Inggris) "Gelembung menghidupkan katalis kimia", majalah Science News daring, 6 April 2009.

