Alkohol: Perbedaan antara revisi
Membalikkan revisi 14082781 oleh 182.1.44.68 (bicara) Tag: Pembatalan |
|||
| Baris 13: | Baris 13: | ||
=== Rumus kimia umum === |
=== Rumus kimia umum === |
||
Rumus kimia umum alkohol adalah '''C<sub>n</sub>H<sub>2n+2</sub> |
Rumus kimia umum alkohol adalah '''C<sub>n</sub>H<sub>2n+2</sub>O''' |
||
== Penggunaan == |
== Penggunaan == |
||
Revisi per 3 Desember 2018 14.42


Alkohol sering dipakai untuk menyebut etanol, yang juga disebut grain alcohol; dan kadang untuk minuman yang mengandung alkohol. Hal ini disebabkan karena memang etanol yang digunakan sebagai bahan dasar pada minuman tersebut, bukan metanol, atau grup alkohol lainnya. Begitu juga dengan alkohol yang digunakan dalam dunia farmasi. Alkohol yang dimaksudkan adalah etanol. Sebenarnya alkohol dalam ilmu kimia memiliki pengertian yang lebih luas lagi.
Dalam kimia, alkohol (atau alkanol) adalah istilah yang umum untuk senyawa organik apa pun yang memiliki gugus hidroksil (-OH) yang terikat pada atom karbon, yang ia sendiri terikat pada atom hidrogen dan/atau atom karbon lain.
Struktur
Gugus fungsional alkohol adalah gugus hidroksil yang terikat pada karbon hibridisasi sp3. Ada tiga jenis utama alkohol - 'primer', 'sekunder, dan 'tersier'. Nama-nama ini merujuk pada jumlah karbon yang terikat pada karbon C-OH. Alkohol primer paling sederhana adalah metanol. Alkohol sekunder yang paling sederhana adalah 2-propanol, dan alkohol tersier paling sederhana adalah 2-metil-2-propanol.
Rumus kimia umum
Rumus kimia umum alkohol adalah CnH2n+2O
Penggunaan
Pengawet
Alkohol juga dapat digunakan sebagai pengawet untuk hewan koleksi (yang ukurannya kecil).
Otomotif
Alkohol dapat digunakan sebagai bahan bakar otomotif. Etanol dan metanol dapat dibuat untuk membakar lebih bersih dibanding bensin atau diesel. Alkohol dapat digunakan sebagai antibeku pada radiator. Untuk menambah penampilan mesin pembakaran dalam, metanol dapat disuntikan kedalam mesin Turbocharger dan Supercharger. Ini akan mendinginkan masuknya udara kedalam pipa masuk, menyediakan masuknya udara yang lebih padat.
Nama-nama untuk alkohol
Nama sistematik
Dalam sistem tatanama IUPAC, nama-nama senyawa alkana kehilangan akhiran "e" dan diganti dengan "ol", contohnya metana menjadi metanol dan etana menjadi etanol.[1] Ketika dibutuhkan, posisi dari gugus hidroksil dapat diketahui dari nomor di antara nama alkana dan "ol": 1-propanol untuk CH3CH2CH2OH, 2-propanol untuk CH3CH(OH)CH3. Jika ada gugus fungsi yang lebih tinggi (seperti aldehida, keton, atau asam karboksilat, maka awalannya adalah "hidroksi",[1] contohnya: 1-hidroksi-2-propanon (CH3COCH2OH).[2]

Penggunaan tatanama IUPAC dipakai di publikasi-publikasi ilmiah dan diperlukan identifikasi detail terhadap substansi tersebut. Pada konteks lainnya, alkohol biasanya disebut dengan gugus alkil ditambah dengan kata "alkohol", misalnya metil alkohol, etil alkohol. Propil alkohol dapat disebut n-propil alkohol atau isopropil alkohol, tergantung dari di mana gugus fungsinya berikatan, berikatan pada karbon pertama atau kedua pada rantai propana.
Alkohol dapat dikelompokkan menjadi alohol primer, alkohol sekunder, dan alkohol tersier, tergantung dari berapa banyak atom karbon lain yang berikatan dengan atom karbon yang juga mengikat gugus hidroksil. Alkohol primer mempunyai rumus umum RCH2OH; alkohol sekunder rumus umumnya RR'CHOH; dan alkohol tersier rumus umumnya RR'R"COH, di mana R, R', dan R" melambangkan gugus alkil. Etanol dan n-propil alkohol adalah contoh alkohol primer; isopropil alkohol adalah contoh alkohol sekunder. Penggunaan awalan sek- (atau s-) dan tert- (atau t-), biasanya ditulis dalam huruf miring, dapat digunakan sebelum nama gugus alkil untuk membedakan alkohol sekunder dan alkohol tersier dari alkohol primer. Contohnya, isopropil alkohol juga dapat disebut sek-propil alkohol, dan alkohol tersier (CH3)3COH, atau 2-metil-2-propanol juga dapat disebut dengan tert-butil alkohol atau tert-butanol.
Nama umum/trivial/perdagangan
| Rumus kimia | Nama IUPAC | Nama umum |
| Alkohol monohidrat | ||
| CH3OH | Metanol | Alkohol kayu |
| C2H5OH | Etanol | Alkohol gandum |
| C3H7OH | Isopropil alkohol | Alkohol gosok |
| C5H11OH | Pentanol | Amil alkohol |
| C16H33OH | 1-Heksadekanol | Cetil alkohol |
| Alkohol polihidrat | ||
| C2H4(OH)2 | 1,2-etadienol | Etilen glikol |
| C3H5(OH)3 | 1,2,3-propatrienol | Gliserol |
| C4H6(OH)4 | 1,2,3,4-butatetraenol | Eritritol |
| C5H7(OH)5 | 1,2,3,4,5-pentapentanol | Xylitol |
| C6H8(OH)6 | 1,2,3,4,5,6-heksaheksanol | Mannitol, Sorbitol |
| C7H9(OH)7 | 1,2,3,4,5,6,7-heptaheptanol | Volemitol |
| Alkohol alifatik tidak tersaturasi | ||
| C3H5OH | Prop-2-ene-1-ol | Alil alkohol |
| C10H17OH | 3,7-Dimethylocta-2,6-dien-1-ol | Geraniol |
| C3H3OH | Prop-2-in-1-ol | Propargil alkohol |
| Alkohol alisiklik | ||
| C6H6(OH)6 | Cyclohexane-1,2,3,4,5,6-geksol | Inositol |
| C10H19OH | 2 - (2-propyl)-5-methyl-cyclohexane-1-ol | Mentol |
Keasaman
Alkohol adalah asam lemah, karena perbedaan keelektronegatifan antara Oksigen dan Hidrogen pada gugus hidroksil, yang memampukan Hidrogen lepas dengan mudah. Bila di dekat Karbon Hidroksi terdapat gugus penarik elektron seperti fenil atau halogen, maka keasaman meningkat. Sebaliknya, semakin banyak gugus pendorong elektron seperti rantai alkana, keasaman menurun.
Produksi
Pada industri, alkohol diproduksi dengan beberapa cara:
- Dengan fermentasi menggunakan glukosa yang diproduksi dari gula dari hidrolisis amilum. Fermentasi alkohol ini dibantu dengan khamir dan suhu dibawah 37 °C. Selain fermentasi glukosa, proses pembuatan alkohol juga dapat dibuat dengan mengkonversi aukrosa dengan enzim invertase menjadi glukosa dan fruktosa, setelah itu glukosa dikonversi lagi menjadi etanol dengan enzim zymase.
- Dengan hidrasi langsung menggunakan etilena (Hidrasi etilena)[3] atau alkana lain dari proses cracking dari minyak bumi yang didistilasi.
Sintesis laboratorium
Ada beberapa metode yang ada untuk mensintesis alkohol di laboratorium.
Substitusi
Alkil halida primer bereaksi dengan NaOH atau KOH akan menghasilkan alkohol primer. Reagen Grignard bereaksi dengan gugus karbonil akan menghasilkan alkohol sekunder dan alkohol tersier. Reaksi lainnya adalah reaksi Barbier dan reaksi Nozaki-Hiyama.
Reduksi
Aldehida atau keton dapat direduksi dengan natrium borohidrida atau litium aluminium hidrida. Reduksi lainnya oleh aluminiumisopropilat adalah reduksi Meerwein-Ponndorf-Verley. Hidrogenasi asimetris Noyori adalah reduksi asimetris β-keto-ester.
Aplikasi
Alkohol memiliki berbagai macam penggunaan di seluruh dunia. Alkohol digunakan untuk minuman beralkohol, bahan bakar, dan kegunaan sains, kedokteran, dan industri.
Minuman beralkohol
Minuman beralkohol biasanya mengandung etanol 5% sampai 40% volume, telah diproduksi dan dikonsumsi sejak zaman pra-sejarah.
Antibeku
Campuran 50% v (berdasarkan volume) etilen glikol dalam air pada umumnya digunakan untuk antibeku.
Antiseptik
Etanol dapat digunakan sebagai antiseptik untuk membersihkan kulit sebelum disuntik, terkadang bersama dengan iodin. Sabun berbasis etanol banyak digunakan di restoran dan tidak membutuhkan pengering karena amat mudah menguap. Gel berbasis alkohol juga umum digunakan sebagai hand sanitizer.
Bahan bakar
Beberapa senyawa alkohol, seperti etanol dan metanol, digunakan sebagai bahan bakar.
Pelarut
Gugus hidroksil (-OH), yang terdapat pada alkohol, bersifat polar dan hidrofilik tetapi rantai karbonnya bersifat non-polar sehingga hidrofobik. Molekulnya secara umum menjadi nonpolar dan semakin tak larut dalam air ketika rantai karbonnya menjadi semakin panjang.[5]
Alkohol dipakai di industri sebagai pelarut atau reagen. Etanol digunakan sebagai pelarut pada obat-obatan, dan parfum karena sifatnya yang relatif tak beracun dan dapat larut pada substansi non polar.
Metanol dan etanol
Dua alkohol paling sederhana adalah metanol dan etanol (nama umumnya metil alkohol dan etil alkohol) yang strukturnya sebagai berikut:
H H H
| | |
H-C-O-H H-C-C-O-H
| | |
H H H
metanol etanol
Dalam peristilahan umum, "alkohol" biasanya adalah etanol atau grain alcohol. Etanol dapat dibuat dari fermentasi buah atau gandum dengan ragi. Etanol sangat umum digunakan, dan telah dibuat oleh manusia selama ribuan tahun. Etanol adalah salah satu obat rekreasi (obat yang digunakan untuk bersenang-senang) yang paling tua dan paling banyak digunakan di dunia. Dengan meminum alkohol cukup banyak, orang bisa mabuk. Semua alkohol bersifat toksik (beracun), tetapi etanol tidak terlalu beracun karena tubuh dapat menguraikannya dengan cepat.
- isopropil alkohol (sec-propil alcohol, propan-2-ol, 2-propanol) H3C-CH(OH)-CH3, atau alkohol gosok
- etilena glikol (etana-1,2-diol) HO-CH2-CH2-OH, yang merupakan komponen utama dalam antifreeze
- gliserin (atau gliserol, propana-1,2,3-triol) HO-CH2-CH(OH)-CH2-OH yang terikat dalam minyak dan lemak alami, yaitu trigliserida (triasilgliserol)
- Fenol adalah alkohol yang gugus hidroksilnya terikat pada cincin benzena
Alkohol digunakan secara luas dalam industri dan sains sebagai pereaksi, pelarut, dan bahan bakar. Ada lagi alkohol yang digunakan secara bebas, yaitu yang dikenal di masyarakat sebagai spirtus. Awalnya alkohol digunakan secara bebas sebagai bahan bakar. Namun untuk mencegah penyalahgunaannya untuk makanan atau minuman, maka alkohol tersebut didenaturasi. denaturated alcohol disebut juga methylated spirit, karena itulah maka alkohol tersebut dikenal dengan nama spirtus.
Sifat racun
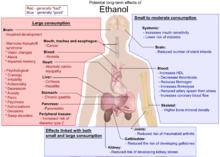
Etanol pada minuman beralkohol telah dikonsumsi manusia sejak zaman prasejarah dengan berbagai tujuan kegunaan yang berbeda-beda. Konsumsi alkohol dalam jumlah besar akan menyebabkan seseorang teler atau mabuk. Jika minuman beralkohol dikonsumsi terus-menerus dalam jumlah berlebihan, maka dapat menyebabkan kegagalan pernapasan akut dan kematian. Karena etanol dapat menghilangkan kesadaran, manusia yang mengkonsumsinya dapat melakukan perbuatan buruk yang tidak disadari.[6]
Referensi
- ^ a b William Reusch. "Alcohols". VirtualText of Organic Chemistry. Diakses tanggal 2007-09-14.
- ^ Organic chemistry IUPAC nomenclature. Alcohols Rule C-201. http://www.acdlabs.com/iupac/nomenclature/79/r79_202.htm
- ^ Lodgsdon J.E. (1994). "Ethanol". Dalam Kroschwitz J.I. Encyclopedia of Chemical Technology. 9 (edisi ke-4th). New York: John Wiley & Sons. hlm. 820. ISBN 0-471-52677-0.
- ^ "Global Status Report on Alcohol 2004" (PDF). Diakses tanggal 2010-11-28.
- ^ Alcohols, Phenols, Thiols, and Ethers
- ^ Robert S. Gable (2004). "Comparison of acute lethal toxicity of commonly abused psychoactive substances" (PDF). Addiction. 99 (6): 686–696. doi:10.1111/j.1360-0443.2004.00744.x. PMID 15139867. Diarsipkan dari versi asli (reprint) tanggal 2006-08-10.
