Mamalia
| Mamalia
| |
|---|---|
| Mammalia | |
| Taksonomi | |
| Galat Lua: callParserFunction: function "Template" was not found. | |
| Kelas | Mammalia Linnaeus, 1758 |
| Subgrup yang masih hidup | |
Binatang menyusui atau mamalia (dari bahasa Latin mamma, 'payudara' ) adalah kelas hewan vertebrata yang dicirikan oleh adanya kelenjar susu (yang pada hewan betina menghasilkan susu sebagai sumber makanan anaknya), neokorteks, rambut, dan tiga tulang di telinga tengah. Karakteristik-karakteristik ini membedakan mereka dari reptil dan burung, yang divergensi genetiknya terjadi pada periode Karbon, lebih dari 300 juta tahun yang lalu. Sekitar 6.400 spesies mamalia yang masih sintas (bertahan hingga kini) telah dideskripsikan. Ordo terbesar dalam mamalia adalah Rodentia (hewan pengerat), Chiroptera (kelelawar), dan Eulipotyphla (landak susu, tikus tanah, celurut, dan sebagainya). Tiga ordo terbesar berikutnya adalah Primata (termasuk manusia, kera, monyet, dan lain-lain), Artiodactyla (hewan berkuku genap, termasuk Cetacea), dan Carnivora (kucing, anjing, anjing laut, dan lainnya).
Dalam kladistika, yang mencerminkan sejarah evolusi, mamalia adalah satu-satunya anggota Synapsida yang masih tersisa. Synapsida dan Sauropsida (reptil dan burung) dimasukkah dalam klad Amniota yang lebih besar. Leluhur mamalia Synapsida awal adalah pelycosauria sphenacodontia, kelompok yang juga mencakup Dimetrodon nonmamalia. Pada akhir periode Karbon sekitar 300 juta tahun yang lalu, mamalia bercabang dari garis Sauropsida yang mengarah ke reptil dan burung masa kini. Garis keturunan yang mengikuti kelompok batang sphenacodontia terpecah menjadi beberapa kelompok Synapsida nonmamalia yang beragam—kadang-kadang salah disebut sebagai reptil mirip mamalia—sebelum memunculkan Therapsida pada periode Permian Awal. Mamalia berasal dari Cynodontia, kelompok Therapsida tingkat lanjut, pada kala Trias Akhir. Ordo mamalia modern muncul pada periode Paleogen dan Neogen dari era Senozoikum setelah kepunahan dinosaurus nonunggas. Sejak 66 juta tahun yang lalu, mamalia telah menjadi kelompok hewan darat yang dominan hingga saat ini.
Tipe dasar tubuh mamalia adalah berkaki empat dan kebanyakan mamalia menggunakan keempat ekstremitas mereka untuk pergerakan darat. Namun, sejumlah mamalia memiliki ekstremitas yang beradaptasi untuk kehidupan di laut, di udara, di pohon, di bawah tanah, atau untuk berjalan dengan dua kaki. Ukuran tubuh mamalia berkisar dari kelelawar berhidung babi Kitti yang besarnya 30–40 mm (1,2–1,6 inci) hingga paus biru yang besarnya 30 m (98 kaki)—mungkin hewan terbesar yang pernah hidup. Umur maksimum mamalia bervariasi dari dua tahun pada celurut sampai 211 tahun pada paus kepala busur. Semua mamalia modern melahirkan anak, kecuali lima spesies Monotremata yang merupakan mamalia bertelur. Placentalia merupakan kelompok mamalia yang banyak spesiesnya. Mereka memiliki plasenta untuk memberi makan janin selama masa gestasi.
Mayoritas mamalia merupakan makhluk yang cerdas, dan sebagian mamalia memiliki otak yang besar, kesadaran diri, dan mampu menggunakan alat. Mamalia dapat berkomunikasi dan bersuara dengan beberapa cara, termasuk menghasilkan ultrasonik, menandai aroma, memberi sinyal alarm, menyanyi, dan menggunakan ekolokasi. Mamalia dapat mengatur diri mereka sendiri ke dalam kelompok fisi-fusi, harem, dan hierarki, tetapi mereka juga bisa soliter dan teritorial. Kebanyakan mamalia merupakan poligini, tetapi beberapa mamalia dapat menjadi monogami atau poliandri.
Domestikasi berbagai jenis mamalia oleh manusia memainkan peran utama dalam Revolusi Neolitikum, yang menjadikan manusia mengubah sistem berburu dan meramu menjadi bertani untuk mendapatkan sumber makanan utama. Hal ini menyebabkan restrukturisasi besar masyarakat manusia dari nomaden ke menetap dan membentuk lebih banyak kerja sama di antara kelompok yang lebih besar dan selanjutnya menjadi semakin besar, hingga akhirnya mengembangkan peradaban. Mamalia domestik menyediakan tenaga untuk transportasi dan pertanian, menjadi sumber makanan (daging dan produk susu), serta dimanfaatkan rambut dan kulitnya. Mamalia juga diburu dan dilombakan dalam olahraga, serta digunakan sebagai organisme model dalam sains. Mamalia telah digambarkan dalam seni sejak zaman Paleolitikum dan muncul dalam sastra, film, mitologi, dan agama. Penurunan jumlah dan kepunahan banyak mamalia didorong oleh perburuan liar, perusakan habitat, dan terutama deforestasi.
Klasifikasi

Klasifikasi mamalia telah melalui beberapa revisi sejak Carolus Linnaeus pertama kali mendefinisikan kelas ini. Saat ini, tidak ada sistem klasifikasi yang diterima secara universal. McKenna & Bell (1997) serta Wilson & Reader (2005) memberikan ringkasan terbaru yang bermanfaat.[1] George Simpson (1945)[2] menyediakan sistematika asal-usul dan hubungan mamalia yang telah diajarkan secara universal hingga akhir abad ke-20. Namun, sejak 1945, sejumlah besar informasi baru dan lebih rinci ditemukan secara bertahap: Catatan paleontologi melalui fosil telah dikalibrasi ulang dan pada tahun-tahun berikutnya ada banyak perdebatan dan kemajuan mengenai dasar-dasar teoretis dari sistematika itu sendiri, yang sebagian muncul karena konsep baru yang disebut kladistika. Meskipun temuan dari lapangan dan laboratorium semakin membuat klasifikasi Simpson ketinggalan zaman, tetapi usulannya tetap menjadi yang paling mendekati klasifikasi resmi mamalia, meskipun ada banyak masalah yang telah diketahui.[3]
Sebagian besar mamalia tergolong dalam kelompok mamalia berplasenta, termasuk enam ordo yang memiliki paling banyak spesies. Tiga ordo yang paling kaya akan spesies adalah Rodentia: mencit, tikus, landak, biwara, kapibara, dan mamalia lain yang mengerat; Chiroptera: kelelawar; dan Eulipotyphla: celurut, tikus tanah, dan solenodon. Tiga ordo terbesar berikutnya, tergantung pada skema klasifikasi biologis yang digunakan, adalah Primata: kera, monyet, dan lemur; Cetartiodactyla: paus dan hewan berkuku genap; dan Carnivora yang meliputi kucing, anjing, musang, beruang, anjing laut, dan sejenisnya.[4]
Menurut Mammal Species of the World (MSW), 5.416 spesies mamalia diidentifikasi pada tahun 2006, yang dikelompokkan ke dalam 1.229 genus, 153 famili, dan 29 ordo.[4] Pada tahun 2008, Uni Internasional untuk Konservasi Alam (IUCN) menyelesaikan Penilaian Mamalia Global selama lima tahun untuk menyusun daftar merah IUCN, yang memuat 5.488 spesies.[5] Menurut penelitian yang diterbitkan dalam Journal of Mammalogy pada tahun 2018, jumlah spesies mamalia yang diakui adalah 6.495, termasuk 96 yang baru saja punah.[6]
Definisi
Kata "mamalia" adalah istilah modern yang diambil dari nama ilmiah “Mammalia” yang diciptakan oleh Carolus Linnaeus pada tahun 1758. Kata ini berasal dari bahasa Latin mamma ("puting"). Dalam sebuah publikasi tahun 1988 yang berpengaruh, Timothy Rowe mendefinisikan Mammalia secara filogenetik sebagai kelompok mahkota dari mamalia, sebuah klad yang terdiri dari leluhur bersama paling terkini dari Monotremata hidup (ekidna dan platipus) dan mamalia Theria (marsupialia dan plasentalia), serta semua keturunan dari leluhur tersebut.[7] Karena leluhur ini hidup pada periode Jura, definisi Rowe mengecualikan semua hewan dari periode sebelumnya, Trias, meskipun terdapat fakta bahwa fosil Trias pada ordo Haramiyida telah digolongkan sebagai Mammalia sejak pertengahan abad ke-19.[8]
Jika Mammalia dianggap sebagai kelompok mahkota, asal-usulnya dapat diperkirakan secara kasar sebagai kemunculan hewan pertama yang diketahui berhubungan lebih dekat dengan beberapa mamalia yang masih sintas (bertahan hingga kini) dibandingkan hewan yang lain. Genus Ambondro lebih dekat kekerabatannya dengan monotremata dibandingkan mamalia Theria, sementara genus Amphilestes dan Amphitherium lebih dekat kekerabatannya dengan Theria; karena fosil dari ketiga genus tersebut berumur sekitar 167 juta tahun yang lalu pada kala Jura Tengah, ini adalah perkiraan yang masuk akal untuk kemunculan kelompok mahkota.[9]
Dalam buku yang terbit pada tahun 2005, T.S. Kemp memberikan definisi yang lebih tradisional: "Synapsida yang memiliki artikulasi rahang dentale-skuamosa dan oklusi antara geraham atas dan bawah dengan komponen transversal untuk bergerak" atau dalam pandangan Kemp, klad yang berasal dari leluhur terakhir Sinoconodon dan mamalia sintas.[10] Synapsida paling awal yang memenuhi definisi Kemp adalah Tikitherium, dari 225 juta tahun silam, sehingga kemunculan mamalia dalam pengertian yang lebih luas ini dapat disimpulkan pada Trias Akhir.[11][12]
Klasifikasi McKenna/Bell
Pada tahun 1997, pengelompokan mamalia direvisi secara komprehensif oleh Malcolm C. McKenna dan Susan K. Bell, yang menghasilkan klasifikasi McKenna/Bell. Keduanya bekerja sama sebagai ahli paleontologi di Museum Sejarah Alam Amerika. McKenna mewarisi proyek dari Simpson, sedangkan Bell membangun sistem hierarki yang benar-benar baru, yang mencakup taksa sintas dan punah, yang mencerminkan silsilah historis Mammalia.[3] Buku mereka tahun 1997, Klasifikasi Mamalia di atas Tingkat Spesies,[13] adalah karya komprehensif tentang sistematika, hubungan, dan kemunculan semua taksa mamalia, baik sintas dan punah, hingga peringkat genus, meskipun data genetik molekuler menantang beberapa pengelompokan tingkat yang lebih tinggi.
Pada daftar di bawah ini, kelompok yang telah punah diberi tanda dagger (†).
Kelas Mammalia
- Subkelas Prototheria: monotremata: ekidna dan platipus
- Subkelas Theriiformes: mamalia yang melahirkan dan kerabat prasejarahnya
- Infrakelas †Allotheria: multituberkulata
- Infrakelas †Eutriconodonta: eutrikonodon
- Infrakelas Holotheria: mamalia modern yang melahirkan dan kerabat prasejarahnya
- Superlegion †Kuehneotheria
- Superkohort Theria: mamalia yang melahirkan
- Kohort Marsupialia: marsupialia
- Magnordo Australidelphia: marsupialia Australia dan monito del monte
- Magnordo Ameridelphia: marsupialia Dunia Baru yang sekarang dianggap parafili, dengan celurut oposum lebih dekat kepada australidelfian.[14]
- Kohort Placentalia: mamalia berplasenta
- Magnordo Xenarthra: xenarthra
- Magnordo Epitheria: epitheria
- Superordo †Leptictida
- Superordo Preptotheria
- Grandordo Anagalida: lagomorpha, rodensia, dan celurut gajah
- Grandordo Ferae: karnivora, tenggiling, †kreodon, dan kerabatnya
- Grandordo Lipotyphla: insektivor
- Grandordo Archonta: kelelawar, primata, kubung, dan tupai
- Grandordo Ungulata: ungulata
- Ordo Tubulidentata incertae sedis: babi tanah
- Mirordo Eparctocyona: †condylarth, paus, dan artiodaktila (ungulata berkuku genap)
- Mirordo †Meridiungulata: ungulata Amerika Selatan
- Mirordo Altungulata: perisodaktila (ungulata berkuku ganjil), gajah, lembu laut, dan hyrax
- Kohort Marsupialia: marsupialia
Ordo mamalia
Menurut MSW,[15] Sistem Informasi Taksonomi Terpadu (ITIS),[16] dan Catalogue of Life,[17] mamalia terdiri atas 29 ordo, yaitu:
- Afrosoricida
- Artiodactyla
- Carnivora
- Cetacea
- Chiroptera
- Cingulata
- Dasyuromorphia
- Dermoptera
- Didelphimorphia
- Diprotodontia
- Erinaceomorpha
- Hyracoidea
- Lagomorpha
- Macroscelidea
- Microbiotheria
- Monotremata
- Notoryctemorphia
- Paucituberculata
- Peramelemorphia
- Perissodactyla
- Pholidota
- Pilosa
- Primates
- Proboscidea
- Rodentia
- Scandentia
- Sirenia
- Soricomorpha
- Tubulidentata
Klasifikasi molekuler mamalia berplasenta
Pada awal abad ke-21, studi molekuler berdasarkan analisis DNA menunjukkan hubungan baru di antara keluarga mamalia. Sebagian besar temuan ini telah divalidasi secara independen oleh data ada/tidaknya retrotransposon.[18]Sistem klasifikasi berdasarkan studi molekuler mengungkapkan tiga kelompok utama atau garis keturunan dari mamalia berplasenta, yaitu Afrotheria, Xenarthra, dan Boreoeutheria, yang bercabang pada Periode Kapur. Hubungan antara ketiga garis keturunan ini kontroversial, dan ada tiga hipotesis yang diajukan sehubungan dengan kelompok mana yang bersifat basal. Hipotesis-hipotesis tersebut adalah Atlantogenata (Boreoeutheria sebagai basal), Epitheria (Xenarthra sebagai basal) dan Exafroplacentalia (Afrotheria sebagai basal).[19] Boreoeutheria sendiri mengandung dua garis keturunan utama, yaitu Euarchontoglires dan Laurasiatheria.
Perkiraan waktu divergensi antara ketiga kelompok mamalia berplasenta ini berkisar antara 105 hingga 120 juta tahun yang lalu, tergantung pada jenis DNA yang digunakan (seperti DNA inti atau DNA mitokondria)[20] dan berbagai interpretasi data paleogeografis.[19]
| Mammalia |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Kladogram di atas didasarkan pada Tarver dkk. (2016).[21]
Anatomi
Karakteristik khusus
Spesies mamalia hidup dapat diidentifikasi dengan adanya kelenjar keringat, termasuk kelenjar yang terspesialisasi untuk memproduksi susu untuk memberi makan anaknya.[22] Dalam mengklasifikasikan fosil, karakteristik lain harus digunakan karena kelenjar jaringan lunak dan banyak karakteristik lainnya tidak terlihat dalam fosil.[23]
Banyak karakteristik yang dimiliki oleh semua mamalia hidup, termasuk di antara para anggota mamalia paling awal, seperti:
- Sendi rahang – Tulang dentale (tulang rahang bawah, yang membawa gigi) dan tulang skuamosa bertemu untuk membentuk sendi. Pada kebanyakan Gnathostomata, termasuk Therapsida, sendi terdiri dari tulang artikular (tulang kecil di belakang rahang bawah) dan tulang kuadrata (tulang kecil di belakang rahang atas).[24]
- Telinga tengah – Pada mamalia kelompok mahkota, suara dibawa dari gendang telinga oleh tiga tulang yang terangkai, yakni tulang martil, tulang landasan, dan tulang sanggurdi. Secara evolusi, tulang martil dan tulang landasan berasal dari tulang artikular dan tulang kuadrata yang membentuk sendi rahang pada Therapsida awal.[25]
- Penggantian gigi – Gigi dapat berganti satu kali (difiodon) atau tidak sama sekali (monofiodon; seperti pada paus bergigi dan tikus).[26] Gajah, lembu laut, dan kanguru terus-menerus menumbuhkan gigi baru sepanjang hidupnya (polifiodon).[27]
- Enamel prismatik – Lapisan enamel pada permukaan gigi terdiri dari prisma, struktur padat seperti batang yang memanjang dari dentin ke permukaan gigi.[28]
- Kondilus oksipitalis – Dua tonjolan bulat (seperti kenop) di dasar tengkorak yang masuk ke vertebra leher paling atas; kebanyakan tetrapoda lain hanya memiliki satu kenop seperti itu.[29]
Untuk sebagian besar kasus, karakteristik-karakteristik ini tidak ada pada leluhur mamalia pada Periode Trias.[30] Hampir semua mamalia memiliki tulang epipubis, kecuali mamalia berplasenta modern.[31]
Dimorfisme seksual

Secara umum, mamalia jantan lebih besar dari betina. Kebanyakan ordo pada mamalia juga menunjukkan dimorfisme seksual yang bias jantan, meskipun beberapa ordo tidak menunjukkan bias apa pun atau secara signifikan bias betina (Lagomorpha). Perbedaan ukuran tubuh hewan jantan dan betina akan semakin besar apabila ukuran tubuh hewan jantan semakin besar (aturan Rensch), yang menunjukkan bahwa ada tekanan seleksi secara paralel pada ukuran tubuh jantan dan betina. Dimorfisme yang bias jantan berhubungan dengan seleksi seksual pada hewan jantan, yakni melalui kompetisi di antara para pejantan untuk mendapatkan betina. Ada korelasi positif antara tingkat seleksi seksual, yang diindikasikan oleh sistem perkawinan, dengan tingkat dimorfisme ukuran yang bias jantan. Tekanan seleksi paralel pada massa tubuh betina juga diidentifikasi, bahwa usia penyapihan secara signifikan lebih tinggi pada spesies yang lebih poligini, bahkan ketika massa tubuh telah dikoreksi. Selain itu, tingkat reproduksi yang semakin rendah pada betina yang lebih besar menunjukkan bahwa seleksi fekunditas memilih betina yang lebih kecil. Meskipun pola-pola ini berlaku di seluruh mamalia secara keseluruhan, ada variasi yang cukup besar di seluruh ordo.[32]
Sistem biologis

Mayoritas mamalia memiliki tujuh vertebra serviks (tulang leher). Pengecualiannya adalah lembu laut dan kungkang berkuku dua yang memiliki enam tulang leher dan kungkang berkuku tiga yang memiliki sembilan tulang leher.[33] Semua otak mamalia memiliki neokorteks, wilayah otak yang unik untuk mamalia.[34] Otak mamalia berplasenta memiliki korpus kalosum, tidak seperti monotremata dan marsupialia.[35]
Paru-paru mamalia bersifat seperti spons dan sarang lebah. Pernapasan didukung oleh diafragma, yang memisahkan rongga dada dari rongga perut dan membentuk kubah cembung ke dada. Kontraksi diafragma akan meratakan kubah sehingga meningkatkan volume rongga paru-paru. Udara masuk melalui rongga mulut dan hidung, lalu berjalan melalui laring, trakea, kemudian bronkus, dan memperluas alveolus. Relaksasi diafragma memiliki efek sebaliknya, mengurangi volume rongga paru-paru sehingga udara terdorong keluar dari paru-paru. Ketika mamalia beraktivitas fisik, dinding perut berkontraksi dan meningkatkan tekanan pada diafragma, yang memaksa udara keluar lebih cepat dan lebih kuat. Sangkar rusuk mampu mengembang dan mengempis melalui aksi otot-otot pernapasan lainnya. Akibatnya, udara diisap ke dalam atau dikeluarkan dari paru-paru, selalu mengikuti gradien tekanannya.[36][37] Karena kemiripannya dengan ubub, jenis paru-paru ini dikenal sebagai paru-paru ubub.[37]
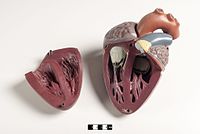
Jantung mamalia memiliki empat ruang, yakni dua serambi di bagian atas sebagai ruang penerima dan dua bilik di bagian bawah sebagai ruang pengeluaran.[38] Jantung memiliki empat katup yang memisahkan biliknya dan memastikan darah mengalir ke arah yang benar (mencegah aliran balik). Setelah pertukaran gas di kapiler paru (pembuluh darah di paru-paru), darah yang kaya oksigen kembali ke serambi kiri melalui salah satu dari empat vena paru. Darah mengalir hampir terus-menerus kembali ke serambi, yang bertindak sebagai ruang penerima, dan dari sini darah mengalir melalui lubang ke bilik kiri. Sebagian besar darah mengalir secara pasif ke jantung saat serambi dan bilik berelaksasi, tetapi menjelang akhir diastol (periode relaksasi bilik), serambi kiri akan berkontraksi dan memompa darah ke dalam bilik. Seperti otot lainnya, jantung juga membutuhkan nutrisi dan oksigen yang ditemukan dalam darah, dan disuplai oleh arteri koroner.[39]

Sistem integumen (kulit) terdiri dari tiga lapisan: epidermis, dermis, dan hipodermis. Tebal epidermis biasanya 10 sampai 30 sel; fungsi utamanya adalah untuk memberikan lapisan kedap air. Sel-sel terluarnya terus-menerus hilang, sedangkan sel-sel paling bawahnya terus membelah dan mendorong ke atas. Lapisan tengah, dermis, 15 sampai 40 kali lebih tebal dari epidermis. Dermis terdiri dari banyak komponen, seperti struktur tulang dan pembuluh darah. Hipodermis terdiri dari jaringan adiposa, yang menyimpan lipid dan menyediakan bantalan dan insulasi. Ketebalan lapisan ini sangat bervariasi antara satu spesies dengan spesies lainnya;[40] mamalia laut membutuhkan hipodermis tebal untuk insulasi, dan paus sikat memiliki lemak paling tebal (20 inci atau 51 cm).[41] Meskipun hewan lain memiliki fitur seperti misai, bulu, seta, atau silia, tidak ada hewan selain mamalia yang memiliki rambut. Ini adalah karakteristik definitif dari kelas mamalia, meskipun beberapa mamalia memiliki rambut yang sangat sedikit.[40]
Herbivor telah mengembangkan beragam struktur fisik untuk memfasilitasi mereka mengonsumsi tumbuhan. Untuk memecah jaringan tumbuhan utuh, mamalia telah mengembangkan struktur gigi yang mencerminkan preferensi makan mereka. Sebagai contoh, frugivor (hewan yang terutama memakan buah) dan herbivor yang memakan dedaunan lunak memiliki gigi bermahkota rendah yang khusus untuk menggiling dedaunan dan biji. Herbivor yang cenderung memakan rumput keras yang kaya silika memiliki gigi bermahkota tinggi yang mampu menggiling jaringan tumbuhan yang keras dan tidak cepat rusak seperti gigi bermahkota rendah.[42] Kebanyakan mamalia karnivor memiliki gigi karnasial (yang panjangnya bervariasi tergantung pada makanannya), taring yang panjang, dan pola penggantian gigi yang serupa.[43]
Lambung hewan berkuku genap (Artiodactyla) terbagi menjadi empat bagian: rumen, retikulum, omasum, dan abomasum (hanya ruminansia yang memiliki rumen). Setelah bahan tumbuhan ditelan, mereka dicampur dengan air liur di dalam rumen dan retikulum, lalu dipisahkan menjadi bahan padat dan cair. Padatan menyatu untuk membentuk bolus (atau mamahan) dan kemudian diregurgitasikan. Ketika bolus masuk ke mulut, cairannya diperas dengan lidah dan ditelan lagi. Makanan yang dicerna masuk ke rumen dan retikulum, tempat mikroorganisme selulolitik (bakteri, protozoa, dan fungi) menghasilkan selulase, enzim yang diperlukan untuk memecah selulosa pada tumbuhan.[44] Berbeda dengan ruminansia, hewan berkuku ganjil (Perissodactyla) menyimpan makanan yang telah dicerna dan telah meninggalkan lambung dalam sekum yang membesar, tempat makanan tersebut difermentasi oleh bakteri.[45] Dibandingkan dengan sistem pencernaan herbivor yang rumit, Carnivora memiliki lambung sederhana yang beradaptasi terutama untuk mencerna daging. Sekum mereka tidak ada atau pendek dan sederhana, dan usus besar mereka tidak berkantong atau tidak jauh lebih lebar dari usus kecil.[46]

Sistem ekskresi mamalia melibatkan banyak komponen. Seperti kebanyakan hewan darat lainnya, mamalia tergolong ureotelik, mengubah amonia menjadi urea di hati sebagai bagian dari siklus urea.[47] Bilirubin, produk limbah yang dihasilkan oleh sel-sel darah dibawa melalui empedu dan urine dengan bantuan enzim yang dihasilkan oleh hati.[48] Melintasnya bilirubin via empedu menuju usus menjadikan tinja mamalia berwarna cokelat.[49] Ginjal mamalia mempunyai sifat khusus, misalnya ada pelvis ginjal dan piramid ginjal, serta korteks dan medula yang dapat dibedakan dengan jelas karena terdapat lengkung Henle yang memanjang. Hanya ginjal mamalia yang berbentuk seperti kacang, meskipun ada beberapa variasi, misalnya ginjal retikulat berlobus banyak pada anjing laut, setasea, dan beruang.[50][51] Sebagian besar mamalia berplasenta dewasa tidak memiliki sisa kloaka sama sekali. Pada embrio, kloaka embrionik terbagi menjadi bagian posterior yang menjadi bagian dari anus dan bagian anterior yang menjadi struktur berbeda, tergantung pada jenis kelamin individu tersebut: pada betina, bagian ini menjadi vestibula (ruang depan) yang membentuk uretra dan vagina, sedangkan pada jantan, bagian ini membentuk keseluruhan uretra kavernosa.[51] Meskipun demikian, Tenrecidae, Chrysochloridae, dan sejumlah celurut tetap mempertahankan kloaka ketika dewasa.[52] Saluran kelamin marsupialia terpisah dari anus, tetapi sisa kloaka asli tetap ada di bagian luar tubuh.[51] Monotremata, yang berasal dari kata bahasa Yunani "lubang tunggal", memiliki kloaka sejati.[53]
Produksi suara

Seperti pada semua tetrapoda lainnya, mamalia memiliki laring yang dapat membuka dan menutup dengan cepat untuk menghasilkan suara, serta sebuah saluran vokal supralaringeal yang menyaring suara ini. Paru-paru dan otot-otot di sekitarnya menyediakan aliran udara dan tekanan yang diperlukan untuk berfonasi (artikulasi). Laring mengendalikan tinggi nada dan volume suara, tetapi kekuatan paru-paru untuk menghembuskan napas juga berkontribusi pada volume suara. Mamalia yang lebih primitif, seperti landak semut, hanya dapat mendesis karena suaranya diperoleh hanya dengan menghembuskan napas melalui laring yang tertutup sebagian. Mamalia lain berfonasi menggunakan pita suara. Pergerakan atau ketegangan pita suara dapat menghasilkan banyak suara seperti mendengkur dan menjerit. Mamalia dapat mengubah posisi laring, yang memungkinkan mereka bernapas melalui hidung dan menelan melalui mulut, serta membentuk suara mulut dan suara hidung; suara hidung, seperti rengekan anjing, pada umumnya lembut, sedangkan suara mulut, seperti gonggongan anjing, umumnya bervolume keras.[54]
Beberapa mamalia memiliki laring yang besar sehingga nada suaranya rendah, seperti kelelawar kepala palu (Hypsignathus monstrosus) yang laringnya dapat memenuhi seluruh rongga dada sampai mendorong paru-paru, jantung, dan trakea ke rongga perut.[55] Bantalan vokal yang besar juga dapat menurunkan nada, seperti pada auman kucing besar bernada rendah.[56] Produksi infrasonik dimungkinkan pada beberapa mamalia seperti gajah afrika (Loxodonta spp.) dan paus balin.[57][58] Mamalia kecil dengan laring kecil memiliki kemampuan untuk menghasilkan ultrasonik, yang dapat dideteksi dengan modifikasi pada telinga tengah dan koklea. Ultrasonik tidak terdengar oleh burung dan reptil, yang mungkin penting selama Era Mesozoikum, ketika burung dan reptil menjadi predator dominan. Saluran suara pribadi ini digunakan oleh beberapa hewan pengerat, misalnya, komunikasi ibu-ke-anak, dan oleh kelelawar saat melakukan ekolokasi. Paus bergigi juga menggunakan ekolokasi menggunakan melon yang cara kerjanya berbeda. Beberapa primata memiliki kantong udara yang menempel pada laring dan dapat berfungsi untuk menurunkan resonansi atau meningkatkan volume suara.[54]
Sistem produksi vokal dikendalikan oleh inti saraf kranial di otak dan disuplai oleh saraf laring rekuren dan saraf laring superior, yang merupakan cabang dari saraf vagus. Sistem vokal disuplai oleh saraf hipoglossus dan saraf fasialis. Stimulasi listrik dari wilayah periaqueductal gray (PEG) pada otak tengah mamalia menimbulkan vokalisasi. Kemampuan untuk mempelajari vokalisasi baru hanya dicontohkan pada manusia, anjing laut, setasea, gajah, dan mungkin kelelawar; pada manusia, kemampuan ini merupakan hasil dari hubungan langsung antara korteks motorik yang mengontrol gerakan dan neuron motorik di sumsum tulang belakang.[54]
Rambut

Fungsi utama rambut mamalia adalah termoregulasi. Fungsi lainnya yaitu untuk perlindungan, alat sensoris, antiair, dan kamuflase.[59] Ada berbagai jenis rambut yang masing-masing memiliki tujuan yang berbeda:[40]
- Rambut definitif – yang dapat dilepaskan setelah mencapai panjang tertentu
- Vibrissae – rambut sensorik, paling sering berupa misai
- Pelage – rambut pelindung, rambut bagian bawah, dan rambut bertugi
- Rambut duri – rambut pelindung kaku yang digunakan untuk pertahanan (seperti pada landak)
- Rambut kejur – rambut panjang yang biasanya digunakan dalam sinyal visual (seperti surai singa)
- Vellus – sering disebut "rambut halus" yang melindungi mamalia yang baru lahir
- Wol – panjang, lembut, dan sering kali keriting
Termoregulasi
Panjang rambut bukan merupakan faktor penentu dalam termoregulasi: misalnya, beberapa mamalia tropis seperti kungkang memiliki panjang rambut yang sama dengan beberapa mamalia Arktik, tetapi dengan insulasi yang lebih sedikit; sebaliknya, mamalia tropis lainnya dengan rambut pendek memiliki nilai insulasi yang sama dengan mamalia Arktik. Kepadatan rambut dapat meningkatkan nilai insulasi hewan, dan mamalia Arktik memiliki rambut yang lebat; sebagai contoh, muskox memiliki rambut pelindung yang panjangnya 30 cm (12 in.) serta rambut bawah yang lebat, yang membentuk mantel kedap udara dan memungkinkan mereka untuk bertahan hidup pada suhu 40 °C (−40 °F).[40] Beberapa mamalia gurun, seperti unta, menggunakan rambut lebat untuk mencegah panas matahari mencapai kulit mereka sehingga mereka tetap merasa sejuk; suhu rambut unta dapat mencapai 70 °C (158 °F) pada musim panas, tetapi kulitnya tetap pada suhu 40 °C (104 °F).[40] Sebaliknya. mamalia akuatik menjebak udara di rambut mereka untuk melindungi panas dengan menjaga kulit tetap kering.[40]
Warna

Mantel mamalia memiliki beragam warna karena berbagai alasan. Tekanan selektif yang utama di antaranya kamuflase, seleksi seksual, komunikasi, dan termoregulasi. Warna rambut dan kulit mamalia terutama ditentukan oleh jenis dan jumlah melanin; eumelanin untuk warna coklat dan hitam, serta feomelanin untuk berbagai warna kekuningan hingga kemerahan, sehingga memberi mamalia warna tanah.[60][61] Beberapa mamalia memiliki warna yang lebih cerah; monyet dukun memiliki tonjolan biru cerah di moncongnya yang dihasilkan oleh difraksi serat kolagen wajah.[62] Banyak kungkang tampak hijau karena rambutnya mengandung alga hijau, yang mungkin merupakan hubungan simbiosis yang memberi kamuflase bagi kungkang.[63]
Kamuflase memberi pengaruh kuat pada sejumlah besar mamalia karena membantu menyembunyikan individu dari predator atau pemangsa.[64] Pada mamalia Arktik dan subarktik seperti rubah arktik (Alopex lagopus), lemming berkerah (Dicrostonyx groenlandicus), cerpelai ekor pendek (Mustela erminea), dan terwelu sepatu salju (Lepus americanus), perubahan warna musiman antara cokelat pada musim panas dan putih pada musim dingin sebagian besar didorong oleh kamuflase.[65] Beberapa mamalia arboreal, terutama primata dan marsupialia, memiliki warna kulit ungu, hijau, atau biru di bagian-bagian tubuh mereka, yang memberikan beberapa keuntungan berbeda di sebagian besar habitat arboreal karena evolusi konvergen.[62]
Aposematisme, atau memperingatkan pemangsa, adalah penjelasan yang paling mungkin dari rambut hitam-putih dari banyak mamalia yang mampu mempertahankan diri, seperti pada sigung yang berbau busuk dan ratel yang kuat dan agresif.[66] Warna mantel terkadang dimorfik secara seksual, seperti pada banyak spesies primata.[67] Perbedaan warna mantel hewan jantan dan betina dapat menunjukkan tingkat nutrisi dan hormon, yang penting dalam seleksi pasangan.[68] Warna mantel dapat memengaruhi kemampuan menahan panas, tergantung pada seberapa banyak cahaya yang dipantulkan. Mamalia dengan mantel berwarna lebih gelap dapat menyerap lebih banyak panas dari radiasi matahari, dan tetap hangat, sedangkan beberapa mamalia yang lebih kecil, seperti vole, memiliki rambut yang lebih gelap pada musim dingin. Rambut mamalia Arktik yang putih dan tidak berpigmen, seperti beruang kutub, mungkin memantulkan lebih banyak radiasi matahari langsung ke kulit.[40][59] Garis hitam-putih yang mempesona pada zebra tampaknya memberikan perlindungan dari gigitan lalat.[69]
Sistem reproduksi

Mamalia sepenuhnya bersifat gonokorik (hewan yang dilahirkan dengan alat kelamin jantan atau betina; tidak hermafrodit).[70] Pada plasentalia jantan, penis digunakan untuk buang air kecil dan kopulasi. Tergantung pada spesiesnya, ereksi dapat dipicu oleh aliran darah ke jaringan spons yang vaskular atau oleh aksi otot. Penis mungkin berada di dalam kulup saat tidak ereksi, dan beberapa plasentalia juga memiliki tulang penis (baculum).[71] Marsupialia biasanya memiliki penis bercabang,[72] sedangkan penis ekidna umumnya memiliki empat kepala, tetapi hanya dua yang berfungsi.[73] Testis sebagian besar mamalia turun ke dalam skrotum yang biasanya berada di belakang penis, tetapi pada marsupialia sering kali di bagian depan. Mamalia betina umumnya memiliki klitoris, labia mayor dan labia minor di bagian luar, sedangkan sistem internalnya mengandung pasangan tuba fallopi, 1–2 rahim, 1–2 serviks, dan vagina. Marsupialia memiliki dua vagina lateral dan vagina medial. "Vagina" monotremata lebih baik dipahami sebagai "sinus urogenital". Sistem uterus mamalia berplasenta dapat bervariasi antara dupleks dengan dua uterus dan serviks yang membuka ke arah vagina, bipartit dengan dua tanduk rahim dan serviks tunggal yang terhubung ke vagina, bikornuata yang terdiri dari dua tanduk rahim yang terhubung secara distal tetapi terpisah secara medial menciptakan bentuk Y, dan simpleks yang memiliki satu rahim.[74][75][40]

Kondisi reproduksi mamalia leluhur adalah melahirkan dengan anak yang relatif belum berkembang, baik melalui vivipar langsung atau dalam waktu singkat sebagai telur bercangkang lunak. Cara reproduksi ini kemungkinan besar terjadi karena batang tubuh mereka tidak dapat mengembang karena adanya tulang epipubis. Gaya reproduksi ini pertama kali ditunjukkan oleh genus Kayentatherium, yang menghasilkan perinata yang belum berkembang, tetapi dengan jumlah anak yang jauh lebih banyak dibandingkan mamalia modern mana pun, yaitu sebanyak 38 spesimen.[76] Sebagian besar mamalia modern merupakan vivipar, melahirkan anak-anak. Namun, lima spesies monotremata, yakni para platipus, dan empat spesies ekidna, bereproduksi dengan cara bertelur. Monotremata memiliki sistem penentuan jenis kelamin yang berbeda dari kebanyakan mamalia lainnya.[77] Secara khusus, kromosom seks platipus lebih mirip dengan ayam dibandingkan mamalia Theria.[78]
Mamalia vivipar berada di subkelas Theria; mereka masih yang hidup saat ini berada di infrakelas Marsupialia dan Placentalia. Marsupialia memiliki periode kehamilan yang pendek, biasanya lebih pendek dari siklus estrusnya dan melahirkan bayi baru lahir yang belum berkembang dan kemudian mengalami perkembangan lebih lanjut; pada banyak spesies, perkembangan ini terjadi di dalam kantong yang terletak di bagian depan perut induk. Ini adalah kondisi plesiomorfik di antara mamalia vivipar; keberadaan tulang epipubis pada semua mamalia nonplasenta mencegah perluasan batang tubuh yang diperlukan untuk kehamilan penuh.[31] Bahkan Eutheria nonplasenta mungkin bereproduksi dengan cara ini.[79] Plasentalia melahirkan bayi yang relatif lengkap dan berkembang, biasanya setelah periode kehamilan yang lama.[80] Kelompok ini mendapatkan namanya dari plasenta, struktur yang menghubungkan janin yang sedang berkembang dengan dinding rahim untuk memungkinkan penyerapan nutrisi.[81] Pada mamalia berplasenta, tulang epipubis benar-benar hilang atau diubah menjadi baculum. Hal ini memungkinkan batang tubuh untuk dapat berkembang sehingga janin lahir dalam kondisi yang telah berkembang.[76]
Kelenjar susu mamalia terspesialisasi untuk menghasilkan susu, sumber utama nutrisi untuk bayi baru lahir. Monotremata bercabang lebih awal dari mamalia lain sehingga tidak memiliki puting susu sebagaimana yang dimiliki oleh kebanyakan mamalia, tetapi mereka tetap memiliki kelenjar susu. Anak-anak mamalia menjilati susu dari payudara yang terletak di perut induknya.[82] Dibandingkan dengan mamalia berplasenta, susu hewan berkantong sangat berbeda, baik dalam laju produksi maupun komposisi nutrisi, karena bayi mereka lahir dengan kondisi yang belum terlalu berkembang. Selain itu, kelenjar susu memiliki lebih banyak otonomi yang memungkinkan mereka untuk menyuplai susu secara terpisah untuk bayi pada tahap perkembangan yang berbeda.[83] Laktosa adalah gula utama dalam susu mamalia berplasenta, sedangkan susu monotremata dan berkantung didominasi oleh oligosakarida.[84] Penyapihan adalah proses ketika anak mamalia menjadi kurang tergantung pada susu induk mereka dan lebih bergantung pada makanan padat.[85]
Berdarah panas
Hampir semua mamalia bersifat endoterm ("berdarah panas"). Sebagian besar mamalia juga memiliki rambut untuk membantu mereka tetap hangat. Seperti burung, mamalia dapat mencari makan atau berburu dalam cuaca dan iklim yang terlalu dingin bagi reptil dan serangga yang ektoterm ("berdarah dingin"). Endotermi membutuhkan banyak energi dari makanan sehingga mamalia makan lebih banyak makanan per unit berat badan dibandingkan kebanyakan reptil.[86] Mamalia kecil insektivor makan dalam jumlah yang luar biasa jika menilik ukuran tubuhnya. Tikus-tanah telanjang merupakan pengecualian yang langka karena menghasilkan sedikit panas metabolik sehingga secara operasional dianggap sebagai poikiloterm.[87] Burung juga bersifat endoterm sehingga endoterm bukanlah sifat khusus pada mamalia.[88]
Umur spesies
Di antara mamalia, umur maksimum spesies sangat bervariasi (misalnya celurut berumur dua tahun, sedangkan paus kepala busur tertua tercatat 211 tahun).[89] Meskipun hal yang mendasari perbedaan umur ini masih belum pasti, banyak penelitian menunjukkan bahwa kemampuan untuk memperbaiki kerusakan DNA merupakan penentu umur mamalia yang penting. Dalam studi tahun 1974 oleh Hart dan Setlow,[90] ditemukan bahwa kemampuan perbaikan eksisi DNA meningkat secara sistematis seiring dengan umur spesies di antara tujuh spesies mamalia. Umur spesies berkorelasi kuat dengan kapasitas untuk mengenali kerusakan unting ganda DNA serta tingkat protein perbaikan DNA, Ku80.[89] Dalam studi sel dari 16 spesies mamalia, gen-gen yang digunakan dalam perbaikan DNA diregulasi ke atas pada spesies yang berumur lebih panjang.[91] Tingkat enzim perbaikan DNA, polimerase ribosa poli ADP, dalam sel berkorelasi dengan umur spesies dalam penelitian terhadap 13 spesies mamalia. Tiga studi tambahan dari berbagai spesies mamalia juga melaporkan korelasi antara umur spesies dan kemampuan perbaikan DNA.[92][93][94]
Lokomosi
Terestrial

Kebanyakan vertebrata—amfibi, reptil, dan beberapa mamalia seperti manusia dan beruang—tergolong plantigrad atau bertelapak datar yang berjalan dengan seluruh bagian bawah kaki menapak tanah. Banyak mamalia, seperti kucing dan anjing, tergolong digitigrad atau berjalan di atas jari-jari kaki mereka. Hal ini memungkinkan langkah kaki mereka semakin panjang sehingga hewan tersebut berlari lebih kencang. Meskipun demikian, mamalia digitigrad juga mahir dalam bergerak dengan tenang.[95]
Beberapa hewan seperti kuda termasuk unuligrad atau berjalan dengan ujung jari kaki mereka. Cara berjalan ini semakin meningkatkan panjang langkah mereka dan kecepatan mereka.[96] Beberapa jenis mamalia dalam kelompok kera besar juga diketahui berjalan di atas buku-buku jari mereka, setidaknya dengan kaki depan mereka. Tenggiling raksasa[97] dan platipus [98] juga berjalan dengan buku-buku jarinya. Beberapa mamalia merupakan bipedal yang hanya menggunakan dua ekstremitas untuk bergerak, yang dapat dilihat, misalnya, pada manusia dan kera besar. Spesies bipedal memiliki bidang penglihatan yang lebih besar dibandingkan hewan berkaki empat, menghemat lebih banyak energi, dan memiliki kemampuan untuk memanipulasi objek dengan tangan mereka, yang membantu dalam mencari makan. Alih-alih berjalan, beberapa bipedal melompat, seperti kanguru dan tikus kanguru.[99][100]
Mamalia menunjukkan berbagai macam gaya lenggok, yaitu urutan pergerakan ektremitas mereka untuk melakukan lokomosi. Gaya lenggok dapat dikelompokkan menjadi beberapa kategori sesuai dengan pola urutan pergerakannya. Untuk hewan berkaki empat, ada tiga kategori utama: gaya lenggok berjalan, gaya lenggok berlari, dan gaya lenggok melompat.[101] Berjalan adalah gaya lenggok yang paling umum. Beberapa kaki berada di tanah pada waktu tertentu, dan gaya ini ditemukan pada hampir semua hewan berkaki. Seekor hewan dianggap berlari ketika pada beberapa titik dalam langkahnya, semua kaki terangkat dari tanah pada momen suspensi.[102] Hewan akan menggunakan gaya lenggok yang berbeda untuk kecepatan, medan, dan situasi yang berbeda. Misalnya, kuda menunjukkan empat gaya lenggok alami. Gaya lenggok kuda yang paling lambat adalah berjalan, kemudian ada tiga gaya yang lebih cepat, dari yang paling lambat hingga yang paling cepat, adalah trot, canter, dan gallop. Hewan juga mungkin memiliki gaya lenggok yang tidak biasa yang digunakan sesekali, seperti untuk bergerak ke samping atau ke belakang. Sebagai contoh, gaya lenggok utama manusia adalah berjalan dan berlari secara bipedal, tetapi kadang-kadang mereka menggunakan beberapa gaya lenggok lainnya, seperti merangkak dengan empat kaki di ruang yang sempit.[102]
Arboreal

Hewan arboreal sering kali memiliki ekstremitas panjang yang membantu mereka melintasi celah, menggapai buah atau benda lainnya, menguji kekuatan dahan di depan mereka, dan dalam beberapa kasus, untuk brakiasi (berayun di antara pepohonan).[103] Banyak spesies arboreal, seperti landak pohon, tenggiling sutra, monyet laba-laba, dan posum, menggunakan ekor prehensil untuk memegang dahan. Pada monyet laba-laba, ujung ekornya memiliki tambalan atau bantalan perekat yang membantu meningkatkan friksi. Cakar dapat digunakan untuk berinteraksi dengan benda kasar dan mengubah arah pergerakan hewan. Inilah yang memungkinkan bajing memanjat batang pohon yang begitu besar. Namun, cakar dapat mengganggu kemampuan hewan untuk menangkap cabang yang sangat kecil karena cakar tersebut dapat melingkar terlalu jauh dan menusuk tangan hewan itu sendiri. Primata mencengkeram dengan memanfaatkan friksi dan mengandalkan ujung jari yang tidak berambut. Meremas cabang pohon dengan ujung-ujung jari menghasilkan gaya gesek yang menahan tangan hewan ke cabang tersebut. Namun, jenis pegangan ini bergantung pada sudut gaya gesekan dan diameter cabang pohon; cabang yang lebih besar mengakibatkan berkurangnya kemampuan menggenggam. Untuk mengendalikan lokomosi ke arah bawah, terutama saat menuruni cabang pohon berdiameter besar, beberapa hewan arboreal seperti bajing memiliki sendi pergelangan kaki yang sangat fleksibel, yang memungkinkan kaki berotasi menjadi postur 'terbalik'. Hal ini memungkinkan cakar mengait ke permukaan kulit kayu yang kasar dan melawan gaya gravitasi. Ukuran tubuh yang kecil memberi banyak manfaat bagi spesies arboreal, seperti meningkatkan ukuran relatif cabang pohon terhadap hewan, pusat massa yang lebih rendah, peningkatan stabilitas, massa yang lebih ringan (yang memungkinkan hewan bergerak pada cabang yang lebih kecil), dan kemampuan untuk bergerak melalui habitat yang berantakan.[103] Ukuran tubuh berkaitan dengan massa tubuh, sehingga memengaruhi hewan yang meluncur seperti wupih sirsik.[104] Beberapa spesies primata, kelelawar, dan semua spesies kungkang mencapai stabilitas pasif dengan menggantung di bawah cabang pohon.[103]
Aerial
Kelelawar adalah satu-satunya mamalia yang benar-benar bisa terbang. Mereka terbang di udara dengan kecepatan konstan dengan menggerakkan sayapnya ke atas dan ke bawah (biasanya dengan gerakan maju-mundur juga). Saat kelelawar sedang bergerak, ada aliran udara yang relatif terhadap tubuhnya, yang dikombinasikan dengan kecepatan sayap, menghasilkan aliran udara yang lebih cepat bergerak di atas sayap. Hal ini menghasilkan vektor gaya angkat yang mengarah ke depan dan ke atas, serta vektor gaya hambat yang mengarah ke belakang dan ke atas. Komponen ke atas ini melawan gravitasi, menjaga tubuh tetap di udara, sedangkan komponen ke depan memberikan dorongan untuk melawan gaya tarik, baik dari sayap maupun dari tubuh secara keseluruhan.[105]
Sayap kelelawar jauh lebih tipis dan terdiri dari lebih banyak tulang dibandingkan sayap burung, yang memungkinkan kelelawar untuk bermanuver lebih akurat dan terbang dengan lebih banyak daya angkat dan sedikit hambatan.[106][107] Dengan melipat sayap ke arah tubuh mereka pada gerakan ke atas, mereka menggunakan energi 35% lebih sedikit selama penerbangan dibandingkan burung.[108] Selaput sayap kelelawar halus dan mudah robek; namun, jaringan selaput tersebut dapat tumbuh kembali sehingga robekan kecil dapat sembuh dengan cepat.[109] Permukaan sayap mereka dilengkapi dengan reseptor peka sentuhan pada tonjolan kecil yang disebut sel Merkel, yang juga ditemukan di ujung jari manusia. Pada kelelawar, area sensitif ini berbeda karena setiap tonjolan memiliki rambut kecil di tengahnya sehingga menjadi lebih sensitif dan memungkinkan kelelawar mendeteksi dan mengumpulkan informasi tentang udara yang mengalir di atas sayapnya, serta terbang lebih efisien dengan mengubah bentuk sayapnya.[110]
Fosorial dan subterania
Fosorial (dari bahasa Latin fossor, yang berarti 'penggali') adalah hewan yang beradaptasi untuk menggali, yang hidup terutama, tetapi tidak hanya, di bawah tanah. Beberapa contohnya adalah badger dan tikus-tanah telanjang. Banyak spesies hewan pengerat juga dianggap fosorial karena hampir sepanjang hari mereka hidup di liang. Spesies yang hidup secara eksklusif di bawah tanah disebut subterania, sementara spesies yang beradaptasi secara terbatas pada gaya hidup fosorial disebut subfosorial. Beberapa organisme bersifat fosorial untuk membantu pengaturan suhu, sementara yang lain menggunakan habitat bawah tanah untuk melindungi diri dari pemangsa atau untuk menyimpan makanan.[111]
Mamalia fosorial memiliki tubuh fusiformis, paling tebal di bagian bahu dan semakin meruncing di ekor dan hidung. Mereka tidak dapat melihat di liang gelap dan sebagian besar di antara mereka memiliki mata yang terdegenerasi, tetapi degenerasi bervariasi di antara spesies; famili Geomyidae, misalnya, hanya bersifat semifosorial dan memiliki mata yang sangat kecil tetapi fungsional. Sementara itu, mata tikus tanah marsupialia yang sepenuhnya fosorial mengalami degenerasi dan tidak berguna, tikus tanah talpa memiliki mata vestigial, sedangkan tikus tanah emas tanjung memiliki lapisan kulit yang menutupi mata. Kelopak telinga mereka juga sangat kecil atau tidak ada. Mamalia yang benar-benar fosorial memiliki kaki yang pendek dan kokoh karena kekuatan lebih penting daripada kecepatan bagi mamalia yang menggali, tetapi mamalia semifosorial memiliki kaki kursorial yang teradaptasi untuk berlari. Kaki depannya lebar dan memiliki cakar yang kuat untuk membantu mengendurkan tanah saat menggali liang, sementara kaki belakangnya memiliki anyaman, serta cakar, yang membantu membuang tanah yang terlepas ke belakang. Kebanyakan dari mereka memiliki gigi seri yang besar untuk mencegah tanah beterbangan masuk ke dalam mulut.[112] Banyak mamalia fosorial seperti tikus, landak, dan tikus tanah diklasifikasikan dalam ordo Insectivora yang sekarang sudah tak digunakan.[113]
Akuatik
Mamalia yang sepenuhnya hidup di air, Cetacea dan Sirenia, tidak mempunyai kaki, tetapi memiliki sirip ekor untuk mendorong tubuh mereka di dalam air. Kaki sirip mereka bergerak terus-menerus. Paus berenang dengan menggerakkan sirip ekor dan tubuh bagian belakangnya ke atas dan ke bawah untuk mendorong diri mereka melalui gerakan vertikal, sementara kaki sirip terutama digunakan sebagai kemudi. Anatomi kerangka paus memungkinkan mereka untuk menjadi perenang yang cepat. Sebagian besar spesies paus memiliki sirip punggung untuk mencegah mereka terbalik di dalam air.[114][115] Sirip ekor Sirenia dinaikkan ke atas dan ke bawah dengan gerakan panjang untuk menggerakkan tubuhnya ke depan, dan dapat diputar untuk berbalik. Kaki depan mereka berupa sirip seperti dayung yang membantu berputar dan melambat.[116]
Mamalia semiakuatik, seperti anjing laut, memiliki dua pasang kaki sirip, yaitu kaki sirip depan dan kaki sirip belakang. Siku dan pergelangan kaki mereka berada di dalam tubuh.[117][118] Ada beberapa adaptasi anjing laut untuk mengurangi gaya hambat. Selain tubuhnya yang ramping, mereka memiliki jejaring fasikulus otot yang halus di kulit mereka, yang dapat meningkatkan aliran laminar sehingga mereka lebih mudah menyelinap di dalam air. Mereka juga tidak memiliki otot erektor rambut sehingga rambut mereka dapat direbahkan saat berenang.[119] Mereka mengandalkan kaki sirip depan mereka untuk melakukan lokomosi, seperti yang dilakukan oleh penguin dan penyu.[120] Anjing laut tidak terus-menerus menggerakkan kaki sirip depannya; mereka meluncur di antara setiap gerakan.[118] Dibandingkan dengan karnivora terestrial, ekstremitas depan anjing laut lebih pendek sehingga memberi keuntungan mekanis yang lebih besar pada otot-otot lokomotor di sendi bahu dan siku;[117] kaki sirip belakangnya berfungsi sebagai penyeimbang.[119] Beberapa contoh mamalia semiakuatik lainnya adalah biwara, kuda nil, berang-berang, dan platipus.[121] Kuda nil adalah mamalia semiakuatik yang sangat besar. Tubuh mereka yang berbentuk seperti tong memiliki struktur kerangka graviportal,[122] dan disesuaikan untuk membawa badan mereka yang sangat berat dan besar, sedangkan tubuh mereka memiliki kepadatan relatif yang memungkinkan mereka untuk tenggelam dan bergerak di sepanjang dasar sungai.[123]
Perilaku
Komunikasi dan vokalisasi

Banyak mamalia berkomunikasi dengan cara bersuara. Komunikasi vokal memiliki banyak tujuan, misalnya dalam ritual perkawinan, sebagai sinyal peringatan,[125] untuk menunjukkan sumber makanan, dan untuk tujuan sosial. Hewan jantan sering berteriak, seperti auman singa dan rusa merah, selama ritual perkawinan untuk mengusir pejantan lain dan untuk menarik perhatian hewan betina.[126] Vokalisasi paus bungkuk mungkin merupakan sinyal bagi betina,[127] yang memiliki dialek-dialek yang berbeda di berbagai wilayah lautan.[128] Vokalisasi sosial mencakup panggilan teritorial oleh owa dan penggunaan frekuensi pada kelelawar Phyllostomus hastatus untuk membedakan kelompok-kelompok mereka.[129] Monyet vervet memberi sinyal peringatan yang berbeda untuk masing-masing, setidaknya empat, pemangsa yang berbeda, dan reaksi monyet lain bervariasi sesuai dengan panggilan peringatan tersebut. Misalnya, jika peringatan memberi sinyal akan keberadaan ular piton, para monyet akan memanjat pohon, sedangkan peringatan terhadap elang mendorong para monyet mencari tempat persembunyian di tanah.[124] Anjing padang rumput juga memiliki panggilan kompleks yang memberi informasi tentang jenis, ukuran, dan kecepatan pemangsa yang mendekat.[130] Gajah berkomunikasi secara sosial dengan berbagai suara, termasuk mendengus, berteriak, berterompet, mengaum, dan bergemuruh. Beberapa panggilan gemuruh tergolong infrasonik, di bawah jangkauan pendengaran manusia, dan dapat didengar oleh gajah-gajah lain hingga 9,7 km jauhnya pada sekitar waktu matahari terbit dan terbenam.[131]
Mamalia memberi sinyal dengan berbagai cara. Banyak dari mereka yang memberikan sinyal antipredator visual, seperti ketika rusa dan gazel melompat dengan empat kaki, secara terang-terangan menunjukkan kondisi bugar dan kemampuan mereka untuk melarikan diri,[132][133] atau ketika rusa berekor putih dan mamalia lainnya mengibaskan ekor mereka dengan mencolok saat menyadari dan menginformasikan kepada pemangsa bahwa pemangsa tersebut telah terdeteksi.[134] Banyak mamalia menggunakan penanda aroma, yang kadang-kadang dapat membantu mempertahankan wilayah, tetapi mungkin dengan berbagai fungsi, baik di dalam maupun di antara spesies.[135][136][137] Kelelawar mikro dan paus bergigi, termasuk lumba-lumba samudera, mengeluarkan suara baik secara sosial maupun dengan ekolokasi.[138][139][140]
Pakan
Perlu energi yang banyak untuk mempertahankan suhu tubuh agar konstan. Oleh karenanya, mamalia membutuhkan makanan yang bergizi dan berlimpah. Meskipun mamalia paling awal mungkin merupakan pemangsa, spesies-spesies yang muncul belakangan telah beradaptasi untuk memenuhi kebutuhan diet mereka dengan berbagai cara. Beberapa mamalia memakan hewan lain sehingga mereka disebut karnivor (juga mencakup pemakan serangga atau insektivor). Mamalia lainnya memakan tumbuhan, yang mengandung karbohidrat kompleks seperti selulosa, dan disebut sebagai herbivor. Ada beberapa subtipe diet herbivor, seperti granivor (pemakan biji), folivor (pemakan daun), frugivor (pemakan buah), nektarivor (pemakan nektar), gumivor (pemakan gom), dan fungivor (pemakan fungi). Saluran pencernaan herbivor merupakan tempat bakteri memfermentasi zat-zat kompleks tersebut dan membuatnya dapat dicerna, yang berlangsung baik di lambung ganda maupun di sekum yang besar.[44] Beberapa mamalia merupakan koprofag atau memakan tinjanya sendiri untuk menyerap nutrisi yang tidak dicerna ketika ia pertama kali mengonsumsi makanan tersebut.[40] Omnivor memakan baik hewan maupun tumbuhan. Mamalia karnivor memiliki saluran pencernaan yang sederhana karena protein, lipid, dan mineral dalam daging tidak memerlukan sistem pencernaan yang kompleks. Pengecualian untuk ini misalnya paus balin yang juga memiliki flora usus di lambung gandanya, seperti yang dimiliki oleh herbivor terestrial.[141]
Ukuran tubuh hewan juga merupakan salah satu faktor dalam menentukan jenis makanan mereka (aturan Allen). Karena mamalia bertubuh kecil memiliki rasio yang tinggi antara luas permukaan tubuh yang kehilangan panas dengan volume yang menghasilkan panas, mereka cenderung memiliki kebutuhan energi dan laju metabolisme yang tinggi. Sebagian besar mamalia yang beratnya kurang dari sekitar 18 ons (510 g; 1,1 pon) merupakan pemakan serangga karena mereka tidak dapat menjalankan proses pencernaan herbivor yang lambat dan kompleks. Di sisi lain, hewan yang lebih besar menghasilkan lebih banyak panas dan kehilangan lebih sedikit panas. Oleh karena itu, mereka dapat menolerir proses pengumpulan makanan yang lebih lambat (seperti karnivor yang memakan vertebrata yang bertubuh lebih besar) atau proses pencernaan yang lebih lambat (seperti pada herbivor).[142] Lebih jauh, mamalia yang beratnya lebih dari 18 ons (510 g; 1,1 pon) biasanya tidak dapat mengumpulkan cukup serangga selama jam bangun mereka untuk memenuhi kebutuhan energi. Satu-satunya mamalia pemakan serangga bertubuh besar adalah mamalia yang memakan koloni serangga yang besar (semut atau rayap).[143]
Beberapa mamalia tergolong omnivor dan menunjukkan berbagai tingkatan dalam sifat karnivor dan herbivor, yang umumnya lebih condong ke satu tipe dibandingkan yang lain. Karena tumbuhan dan daging dicerna dengan cara berbeda, ada preferensi untuk menjadi pemakan salah satunya, seperti pada beruang yang beberapa spesiesnya sebagian besar karnivor dan spesies yang lain sebagian besar herbivor.[145] Mereka dikelompokkan menjadi tiga kategori: mesokarnivor (50–70% daging dalam dietnya), hiperkarnivor (diet daging: 70% ke atas), dan hipokarnivor (diet daging: 50% ke bawah). Gigi hipokarnivor terdiri dari gigi karnasial segitiga yang tumpul untuk menggiling makanan. Hiperkarnivor memiliki gigi berbentuk kerucut dan karnasial tajam untuk menyayat daging, dan dalam beberapa kasus, rahang yang kuat untuk menghancurkan tulang, seperti dalam pada hiena, yang memungkinkan mereka untuk mengonsumsi tulang; beberapa kelompok mamalia yang telah punah, terutama Machairodontinae, memiliki taring berbentuk pedang.[144]
Beberapa mamalia yang secara fisiologis merupakan karnivor mengonsumsi materi tumbuhan, sementara beberapa herbivor mengonsumsi daging. Dari aspek perilaku, hal ini akan membuat mereka omnivor, tetapi dari sudut pandang fisiologis, ini mungkin karena zoofarmakognosi. Secara fisiologis, hewan harus mampu memperoleh energi dan nutrisi dari materi asal tumbuhan dan hewan untuk dianggap sebagai omnivor.[146] Sebagai contoh, beberapa hewan berkuku seperti jerapah, unta, dan sapi, tercatat menggerogoti tulang untuk mengonsumsi mineral dan nutrisi tertentu.[147] Selain itu, kucing, yang umumnya dianggap sebagai karnivor obligat, kadang-kadang makan rumput untuk memuntahkan bahan yang tidak dapat dicerna (seperti bola rambut), membantu produksi hemoglobin, dan sebagai pencahar.[148]
Ketika tidak tersedia makanan yang cukup di suatu lingkungan, banyak mamalia menekan metabolisme dan menghemat energi mereka dalam proses yang dikenal sebagai hibernasi.[149] Pada periode sebelum hibernasi, mamalia bertubuh besar, seperti beruang, menjadi polifag untuk meningkatkan simpanan lemak, sedangkan mamalia yang lebih kecil lebih suka mengumpulkan dan menyimpan makanan.[150] Perlambatan metabolisme disertai dengan penurunan detak jantung dan pernapasan, serta penurunan suhu internal yang dalam beberapa kasus dapat berada di sekitar suhu lingkungan. Misalnya, suhu internal bajing tanah arktik yang sedang berhibernasi bisa turun hingga −2.9 °C (26,8 °F), tetapi kepala dan lehernya selalu berada di atas 0 °C (32 °F).[151] Beberapa mamalia yang hidup di lingkungan panas melakukan estivasi pada kondisi kering atau panas yang ekstrem, misalnya lemur kerdil ekor gemuk (Cheirogaleus medius).[152]
Kecerdasan
Pada mamalia yang cerdas, seperti primata, otak besar relatif lebih besar daripada bagian otak lainnya. Kecerdasan itu sendiri tidak mudah didefinisikan, tetapi indikasi kecerdasan meliputi kemampuan untuk belajar serta fleksibilitas perilaku. Tikus, misalnya, dianggap sangat cerdas karena mereka dapat belajar dan mengerjakan tugas baru, sebuah kemampuan yang mungkin penting ketika mereka pertama kali menjajah habitat baru. Pada beberapa mamalia, pengumpulan makanan tampaknya terkait dengan kecerdasan: rusa yang memakan tumbuhan memiliki otak yang lebih kecil dibandingkan kucing, yang harus berpikir untuk mengakali mangsanya.[143]

Penggunaan perkakas pada hewan dapat menunjukkan tingkat pembelajaran dan kognisi yang berbeda. Berang-berang laut secara rutin menggunakan batu sebagai bagian penting dari perilaku mencari makannya (untuk menghancurkan abalon atau memecahkan dan membuka cangkang), dengan beberapa populasi berang-berang laut menghabiskan 21% waktunya untuk membuat perkakas.[153] Penggunaan perkakas yang lain, seperti simpanse yang menggunakan ranting untuk "memancing" rayap, mungkin berkembang setelah melihat orang lain menggunakan perkakas dan bahkan mungkin menjadi contoh nyata dari pengajaran hewan.[154] Perkakas bahkan dapat digunakan dalam memecahkan teka-teki saat hewan tersebut tampaknya mengalami "momen eureka".[155] Mamalia lain yang tidak menggunakan perkakas, seperti anjing, juga dapat mengalami momen eureka.[156]
Ukuran otak pernah dianggap sebagai indikator utama kecerdasan hewan. Karena sebagian besar otak digunakan untuk mempertahankan fungsi tubuh, rasio massa otak terhadap massa tubuh yang semakin besar dapat meningkatkan jumlah massa otak untuk tugas-tugas kognitif yang lebih kompleks. Analisis alometrik menunjukkan bahwa skala ukuran otak mamalia kira-kira 2⁄3 atau 3⁄4 eksponen massa tubuh. Perbandingan ukuran otak hewan tertentu dengan ukuran otak yang diharapkan berdasarkan analisis alometrik tersebut menghasilkan kecerdasan ensefalisasi yang dapat digunakan sebagai indikasi lain dari kecerdasan hewan.[157] Paus sperma memiliki massa otak terbesar dari semua hewan di Bumi, yakni rata-rata 8.000 sentimeter kubik (490 in3) dan 7,8 kilogram (17 pon) pada paus jantan dewasa.[158]
Kesadaran diri tampaknya menjadi tanda akan adanya pemikiran abstrak. Kesadaran diri, meskipun tidak terdefinisi dengan baik, diyakini sebagai awal bagi proses yang lebih maju seperti penalaran metakognitif. Metode tradisional untuk mengukur kesadaran diri adalah uji cermin, yang menentukan apakah seekor hewan memiliki kemampuan untuk mengenali diri sendiri.[159] Mamalia yang telah lulus uji cermin di antaranya gajah asia (ada yang lulus, ada yang tidak);[160] simpanse;[161] bonobo;[162] orangutan;[163] manusia, sejak 18 bulan (tahap cermin);[164] lumba-lumba hidung botol,[a][165] paus pembunuh;[166] dan paus pembunuh palsu.[166]
Struktur sosial

Eusosialitas adalah bentuk tertinggi dari organisasi sosial. Di dalamnya terdapat generasi yang tumpang tindih dan pembagian kerja yang jelas, seperti kelompok yang bertanggung jawab untuk reproduksi dan kelompok yang merawat keturunan secara kooperatif. Perilaku eusosial biasanya ditunjukkan oleh serangga, seperti lebah, semut, dan rayap. Namun, hal ini juga ditunjukkan pada dua spesies hewan pengerat, yakni tikus mol telanjang[167] dan tikus mol damaraland.[168]
Prasosialitas adalah ketika hewan-hewan menunjukkan lebih dari sekadar interaksi seksual di antara spesies yang sama, tetapi tidak memenuhi kualifikasi sebagai eusosial. Artinya, hewan prasosial dapat menampilkan kehidupan komunal, perawatan keturunan secara kooperatif, atau pembagian kerja reproduktif secara primitif, tetapi mereka tidak menampilkan ketiga-tiganya yang menjadi karakteristik penting hewan eusosial. Manusia dan beberapa spesies Callitrichidae (marmoset dan tamarin) tergolong unik di kalangan primata dalam derajat kepedulian kooperatif mereka terhadap keturunannya.[169] Psikolog Amerika Serikat Harry Harlow mengadakan percobaan dengan monyet rhesus, primata prasosial, pada tahun 1958 yang menunjukkan bahwa pertemuan sosial diperlukan agar monyet-monyet muda berkembang, baik secara mental maupun seksual.[170]
Kelompok fisi-fusi adalah kelompok sosial yang sering mengalami perubahan jumlah dan komposisi. Hewan-hewannya membentuk kelompok sosial permanen yang disebut "kelompok induk" yang terdiri dari semua anggota dari suatu komunitas, tetapi jumlahnya sering kali bervariasi untuk melacak perubahan di lingkungan mereka. Dalam kelompok fisi-fusi, kelompok induk dapat berpisah (fisi) menjadi individu atau subkelompok yang stabil dan lebih kecil untuk beradaptasi dengan keadaan lingkungan atau sosial. Sebagai contoh, sejumlah pejantan mungkin memisahkan diri dari kelompok utama untuk berburu atau mencari makan pada siang hari, tetapi pada malam hari mereka dapat kembali bergabung (fusi) kepada kelompok utama untuk berbagi makanan dan mengambil bagian dalam kegiatan lain. Banyak mamalia menunjukkan hal ini, seperti primata (misalnya orang utan dan monyet laba-laba),[171] gajah,[172] hiena tutul,[173] singa,[174] dan lumba-lumba.[175]
Hewan soliter mempertahankan wilayah dan menghindari interaksi sosial dengan sesama spesiesnya, kecuali selama musim kawin. Hal ini dilakukan untuk menghindari persaingan sumber daya karena dua individu dari spesies yang sama akan menempati relung yang sama, serta untuk mencegah menipisnya makanan.[176] Saat mencari makan, seekor hewan soliter juga tidak terlalu mencolok bagi pemangsa atau mangsanya.[177]

Dalam sebuah hierarki, individu bersifat dominan atau submisif (tunduk). Hierarki despotik adalah kondisi ketika satu individu dominan sementara yang lain tunduk, seperti pada serigala dan lemur,[178] dan urutan kekuasaan adalah peringkat linier bagi individu yang menempatkan individu teratas dan individu terbawah. Urutan kekuasaan juga dapat diberi peringkat berdasarkan jenis kelamin, ketika individu terendah dari suatu jenis kelamin memiliki peringkat yang lebih tinggi daripada individu teratas dari jenis kelamin lainnya, seperti pada hiena.[179] Individu yang dominan, atau alfa, memiliki peluang keberhasilan reproduksi yang tinggi, terutama di dalam harem ketika satu atau beberapa pejantan (pejantan residen) memiliki hak kawin eksklusif terhadap betina-betina dalam suatu kelompok.[180] Pejantan nonresiden juga dapat diterima di dalam harem, tetapi pada beberapa spesies, seperti kelelawar vampir biasa, mungkin lebih ketat.[181]
Beberapa jenis mamalia benar-benar monogami, artinya mereka berpasangan seumur hidup dan tidak memiliki pasangan lain (bahkan setelah kematian pasangan aslinya), seperti serigala, biwara eurasia, dan berang-berang.[182][183] Ada tiga jenis poligami pada hewan: salah satu atau beberapa pejantan dominan memiliki hak kawin (poligini), beberapa pejantan yang dikawini oleh betina (poliandri), atau beberapa pejantan memiliki hubungan eksklusif dengan banyak betina (poliginanri). Perkawinan poligini jauh lebih umum terjadi, yang jika mengecualikan perkawinan lek, diperkirakan terjadi pada 90% mamalia.[184] Perkawinan lek terjadi ketika para pejantan berkumpul di sekitar hewan-hewan betina dan mencoba menarik perhatian mereka dengan berbagai peragaan dan vokalisasi, seperti anjing laut pelabuhan.[185]
Semua mamalia tingkat tinggi (tidak termasuk monotremata) memiliki dua bentuk adaptasi utama dalam merawat keturunan, yaitu melahirkan anak hidup dan menyusui. Hal ini membuka pilihan yang luas dalam cara merawat keturunan. Mereka mungkin membangun sarang dan menggali liang untuk membesarkan anak-anak mereka atau memberi makan dan menjaga mereka yang sering kali dilakukan dalam jangka waktu yang lama. Banyak mamalia yang tergolong seleksi-K dan menginvestasikan lebih banyak waktu dan energi kepada anak-anak mereka dibandingkan hewan yang tergolong seleksi-r. Ketika dua hewan kawin, mereka berdua memiliki keinginan yang sama akan keberhasilan keturunannya, meskipun sering kali dalam bentuk yang berbeda secara ekstrem. Mamalia betina menunjukkan beberapa tingkat agresi keibuan, yang mungkin ditargetkan terhadap betina lain dari spesies yang sama atau terhadap anak betina lain; namun, beberapa mamalia mungkin menjadi "bibi" bagi bayi betina lain dan merawat mereka. Mamalia pejantan mungkin berperan dalam membesarkan anak, seperti pada Tenrecidae, tetapi hal ini bervariasi antara spesies satu dan yang lain, bahkan dalam genus yang sama. Misalnya, beruk (Macaca nemestrina) tidak berpartisipasi dalam pengasuhan anak, sedangkan makaka jepang jantan (M. fuscata) melakukannya.[186]
Lihat pula
Catatan
Referensi
- ^ Vaughan TA, Ryan JM, Czaplewski NJ (2013). "Classification of Mammals". Mammalogy (edisi ke-6). Jones and Bartlett Learning. ISBN 978-1-284-03209-3.
- ^ Simpson GG (1945). "Principles of classification, and a classification of mammals". American Museum of Natural History. 85.
- ^ a b Szalay FS (1999). "Classification of mammals above the species level: Review". Journal of Vertebrate Paleontology. 19 (1): 191–195. doi:10.1080/02724634.1999.10011133. JSTOR 4523980.
- ^ a b Wilson, D. E.; Reeder, D. M., ed. (2005). "Preface and introductory material". Mammal Species of the World: A Taxonomic and Geographic Reference (edisi ke-3rd). Johns Hopkins University Press. hlm. xxvi. ISBN 978-0-8018-8221-0. OCLC 62265494.
- ^ "Mammals". The IUCN Red List of Threatened Species. International Union for Conservation of Nature (IUCN). April 2010. Diakses tanggal 23 August 2016.
- ^ Burgin CJ, Colella JP, Kahn PL, Upham NS (1 February 2018). "How many species of mammals are there?". Journal of Mammalogy. 99 (1): 1–14. doi:10.1093/jmammal/gyx147
 .
.
- ^ Rowe T (1988). "Definition, diagnosis, and origin of Mammalia" (PDF). Journal of Vertebrate Paleontology. 8 (3): 241–264. doi:10.1080/02724634.1988.10011708.
- ^ Lyell C (1871). The Student's Elements of Geology. London, UK: John Murray. hlm. 347. ISBN 978-1-345-18248-4.
- ^ Cifelli RL, Davis BM (December 2003). "Paleontology. Marsupial origins". Science. 302 (5652): 1899–900. doi:10.1126/science.1092272. PMID 14671280.
- ^ Kemp TS (2005). The Origin and Evolution of Mammals (PDF). United Kingdom: Oxford University Press. hlm. 3. ISBN 978-0-19-850760-4. OCLC 232311794.
- ^ Datta PM (2005). "Earliest mammal with transversely expanded upper molar from the Late Triassic (Carnian) Tiki Formation, South Rewa Gondwana Basin, India". Journal of Vertebrate Paleontology. 25 (1): 200–207. doi:10.1671/0272-4634(2005)025[0200:EMWTEU]2.0.CO;2.
- ^ Luo ZX, Martin T (2007). "Analysis of Molar Structure and Phylogeny of Docodont Genera" (PDF). Bulletin of Carnegie Museum of Natural History. 39: 27–47. doi:10.2992/0145-9058(2007)39[27:AOMSAP]2.0.CO;2. Diarsipkan dari versi asli (PDF) tanggal 3 March 2016. Diakses tanggal 8 April 2013.
- ^ McKenna MC, Bell SG (1997). Classification of Mammals above the Species Level. New York, NY: Columbia University Press. ISBN 978-0-231-11013-6. OCLC 37345734.
- ^ Nilsson MA, Churakov G, Sommer M, Tran NV, Zemann A, Brosius J, Schmitz J (July 2010). "Tracking marsupial evolution using archaic genomic retroposon insertions". PLOS Biology. 8 (7): e1000436. doi:10.1371/journal.pbio.1000436. PMC 2910653
 . PMID 20668664.
. PMID 20668664.
- ^ "Mammal Species of the World". departments.bucknell.edu. Diakses tanggal 21 Desember 2019.
- ^ "Mammalia". ITIS. Diakses tanggal 21 Desember 2019.
- ^ "Catalogue of Life: 2019 Annual Checklist". Catalogue of Life. Diakses tanggal 21 Desember 2019.
- ^ Kriegs JO, Churakov G, Kiefmann M, Jordan U, Brosius J, Schmitz J (April 2006). "Retroposed elements as archives for the evolutionary history of placental mammals". PLOS Biology. 4 (4): e91. doi:10.1371/journal.pbio.0040091. PMC 1395351
 . PMID 16515367.
. PMID 16515367.
- ^ a b Nishihara H, Maruyama S, Okada N (March 2009). "Retroposon analysis and recent geological data suggest near-simultaneous divergence of the three superorders of mammals". Proceedings of the National Academy of Sciences of the United States of America. 106 (13): 5235–40. Bibcode:2009PNAS..106.5235N. doi:10.1073/pnas.0809297106
 . PMC 2655268
. PMC 2655268  . PMID 19286970.
. PMID 19286970.
- ^ Springer MS, Murphy WJ, Eizirik E, O'Brien SJ (February 2003). "Placental mammal diversification and the Cretaceous-Tertiary boundary". Proceedings of the National Academy of Sciences of the United States of America. 100 (3): 1056–61. Bibcode:2003PNAS..100.1056S. doi:10.1073/pnas.0334222100
 . PMC 298725
. PMC 298725  . PMID 12552136.
. PMID 12552136.
- ^ Tarver JE, Dos Reis M, Mirarab S, Moran RJ, Parker S, O'Reilly JE, et al. (January 2016). "The Interrelationships of Placental Mammals and the Limits of Phylogenetic Inference". Genome Biology and Evolution. 8 (2): 330–44. doi:10.1093/gbe/evv261. hdl:1983/64d6e437-3320-480d-a16c-2e5b2e6b61d4. PMC 4779606
 . PMID 26733575.
. PMID 26733575.
- ^ Romer SA, Parsons TS (1977). The Vertebrate Body. Philadelphia: Holt-Saunders International. hlm. 129–145. ISBN 978-0-03-910284-5. OCLC 60007175.
- ^ Purves WK, Sadava DE, Orians GH, Helle HC (2001). Life: The Science of Biology (edisi ke-6). New York: Sinauer Associates, Inc. hlm. 593. ISBN 978-0-7167-3873-2. OCLC 874883911.
- ^ Rose KD (2006). The Beginning of the Age of Mammals. Baltimore: Johns Hopkins University Press. hlm. 82–83. ISBN 978-0-8018-8472-6. OCLC 646769601.
- ^ Anthwal N, Joshi L, Tucker AS (January 2013). "Evolution of the mammalian middle ear and jaw: adaptations and novel structures". Journal of Anatomy. 222 (1): 147–60. doi:10.1111/j.1469-7580.2012.01526.x. PMC 3552421
 . PMID 22686855.
. PMID 22686855.
- ^ van Nievelt AF, Smith KK (2005). "To replace or not to replace: the significance of reduced functional tooth replacement in marsupial and placental mammals". Paleobiology. 31 (2): 324–346. doi:10.1666/0094-8373(2005)031[0324:trontr]2.0.co;2.
- ^ Libertini G, Ferrara N (April 2016). "Aging of perennial cells and organ parts according to the programmed aging paradigm". Age. 38 (2): 35. doi:10.1007/s11357-016-9895-0. PMC 5005898
 . PMID 26957493.
. PMID 26957493.
- ^ Mao F, Wang Y, Meng J (2015). "A Systematic Study on Tooth Enamel Microstructures of Lambdopsalis bulla (Multituberculate, Mammalia)--Implications for Multituberculate Biology and Phylogeny". PLOS ONE. 10 (5): e0128243. Bibcode:2015PLoSO..1028243M. doi:10.1371/journal.pone.0128243
 . PMC 4447277
. PMC 4447277  . PMID 26020958.
. PMID 26020958.
- ^ Osborn HF (1900). "Origin of the Mammalia, III. Occipital Condyles of Reptilian Tripartite Type". The American Naturalist. 34 (408): 943–947. doi:10.1086/277821
 . JSTOR 2453526.
. JSTOR 2453526.
- ^ Crompton AW, Jenkins Jr FA (1973). "Mammals from Reptiles: A Review of Mammalian Origins". Annual Review of Earth and Planetary Sciences. 1: 131–155. Bibcode:1973AREPS...1..131C. doi:10.1146/annurev.ea.01.050173.001023.
- ^ a b Power ML, Schulkin J (2013). The Evolution Of The Human Placenta. Baltimore: Johns Hopkins University Press. hlm. 1890–1891. ISBN 978-1-4214-0643-5. OCLC 940749490.
- ^ Lindenfors P, Gittleman JL, Jones KE (2007). Sex, Size and Gender Roles: Evolutionary Studies of Sexual Size Dimorphism. Oxford: Oxford University Press. hlm. 16–26. ISBN 978-0-19-920878-4.
- ^ Dierauf LA, Gulland FM (2001). CRC Handbook of Marine Mammal Medicine: Health, Disease, and Rehabilitation (edisi ke-2). Boca Raton: CRC Press. hlm. 154. ISBN 978-1-4200-4163-7. OCLC 166505919.
- ^ Lui JH, Hansen DV, Kriegstein AR (July 2011). "Development and evolution of the human neocortex". Cell. 146 (1): 18–36. doi:10.1016/j.cell.2011.06.030. PMC 3610574
 . PMID 21729779.
. PMID 21729779.
- ^ Keeler CE (June 1933). "Absence of the Corpus Callosum as a Mendelizing Character in the House Mouse". Proceedings of the National Academy of Sciences of the United States of America. 19 (6): 609–11. Bibcode:1933PNAS...19..609K. doi:10.1073/pnas.19.6.609
 . JSTOR 86284. PMC 1086100
. JSTOR 86284. PMC 1086100  . PMID 16587795.
. PMID 16587795.
- ^ Levitzky MG (2013). "Mechanics of Breathing". Pulmonary physiology (edisi ke-8). New York: McGraw-Hill Medical. ISBN 978-0-07-179313-1. OCLC 940633137.
- ^ a b Umesh KB (2011). "Pulmonary Anatomy and Physiology". Handbook of Mechanical Ventilation (edisi ke-1). New Delhi: Jaypee Brothers Medical Publishing. hlm. 12. ISBN 978-93-80704-74-6. OCLC 945076700.
- ^ Standring S, Borley NR (2008). Gray's anatomy: the anatomical basis of clinical practice (edisi ke-40). London: Churchill Livingstone. hlm. 960–962. ISBN 978-0-8089-2371-8. OCLC 213447727.
- ^ Betts JF, Desaix P, Johnson E, Johnson JE, Korol O, Kruse D, et al. (2013). Anatomy & physiology. Houston: Rice University Press. hlm. 787–846. ISBN 978-1-938168-13-0. OCLC 898069394.
- ^ a b c d e f g h i Feldhamer GA, Drickamer LC, Vessey SH, Merritt JF, Krajewski C (2007). Mammalogy: Adaptation, Diversity, Ecology (edisi ke-3). Baltimore: Johns Hopkins University Press. ISBN 978-0-8018-8695-9. OCLC 124031907.
- ^ Tinker SW (1988). Whales of the World. Brill Archive. hlm. 51. ISBN 978-0-935848-47-2.
- ^ Romer AS (1959). The vertebrate story
 (edisi ke-4). Chicago: University of Chicago Press. ISBN 978-0-226-72490-4.
(edisi ke-4). Chicago: University of Chicago Press. ISBN 978-0-226-72490-4.
- ^ de Muizon C, Lange-Badré B (1997). "Carnivorous dental adaptations in tribosphenic mammals and phylogenetic reconstruction". Lethaia. 30 (4): 353–366. doi:10.1111/j.1502-3931.1997.tb00481.x.
- ^ a b Langer P (July 1984). "Comparative anatomy of the stomach in mammalian herbivores". Quarterly Journal of Experimental Physiology. 69 (3): 615–25. doi:10.1113/expphysiol.1984.sp002848. PMID 6473699.
- ^ Vaughan TA, Ryan JM, Czaplewski NJ (2011). "Perissodactyla". Mammalogy (edisi ke-5). Jones and Bartlett. hlm. 322. ISBN 978-0-7637-6299-5. OCLC 437300511.
- ^ Flower WH, Lydekker R (1946). An Introduction to the Study of Mammals Living and Extinct. London: Adam and Charles Black. hlm. 496. ISBN 978-1-110-76857-8.
- ^ Sreekumar S (2010). Basic Physiology. PHI Learning Pvt. Ltd. hlm. 180–181. ISBN 978-81-203-4107-4.
- ^ Cheifetz AS (2010). Oxford American Handbook of Gastroenterology and Hepatology. Oxford: Oxford University Press, US. hlm. 165. ISBN 978-0-19-983012-1.
- ^ Kuntz E (2008). Hepatology: Textbook and Atlas. Germany: Springer. hlm. 38. ISBN 978-3-540-76838-8.
- ^ Ortiz RM (June 2001). "Osmoregulation in marine mammals". The Journal of Experimental Biology. 204 (Pt 11): 1831–44. doi:10.1242/jeb.204.11.1831. PMID 11441026.
- ^ a b c Roman AS, Parsons TS (1977). The Vertebrate Body. Philadelphia: Holt-Saunders International. hlm. 396–399. ISBN 978-0-03-910284-5.
- ^ Biological Reviews – Cambridge Journals
- ^ Dawkins R, Wong Y (2016). The Ancestor's Tale: A Pilgrimage to the Dawn of Evolution (edisi ke-2nd). Boston: Mariner Books. hlm. 281. ISBN 978-0-544-85993-7.
- ^ a b c Fitch WT (2006). "Production of Vocalizations in Mammals" (PDF). Dalam Brown K. Encyclopedia of Language and Linguistics. Oxford: Elsevier. hlm. 115–121.
- ^ Langevin P, Barclay RM (1990). "Hypsignathus monstrosus". Mammalian Species. 357 (357): 1–4. doi:10.2307/3504110. JSTOR 3504110.
- ^ Weissengruber GE, Forstenpointner G, Peters G, Kübber-Heiss A, Fitch WT (September 2002). "Hyoid apparatus and pharynx in the lion (Panthera leo), jaguar (Panthera onca), tiger (Panthera tigris), cheetah (Acinonyxjubatus) and domestic cat (Felis silvestris f. catus)". Journal of Anatomy. 201 (3): 195–209. doi:10.1046/j.1469-7580.2002.00088.x. PMC 1570911
 . PMID 12363272.
. PMID 12363272.
- ^ Stoeger AS, Heilmann G, Zeppelzauer M, Ganswindt A, Hensman S, Charlton BD (2012). "Visualizing sound emission of elephant vocalizations: evidence for two rumble production types". PLOS ONE. 7 (11): e48907. Bibcode:2012PLoSO...748907S. doi:10.1371/journal.pone.0048907
 . PMC 3498347
. PMC 3498347  . PMID 23155427.
. PMID 23155427.
- ^ Clark CW (2004). "Baleen whale infrasonic sounds: Natural variability and function". Journal of the Acoustical Society of America. 115 (5): 2554. Bibcode:2004ASAJ..115.2554C. doi:10.1121/1.4783845.
- ^ a b Dawson TJ, Webster KN, Maloney SK (February 2014). "The fur of mammals in exposed environments; do crypsis and thermal needs necessarily conflict? The polar bear and marsupial koala compared". Journal of Comparative Physiology B. 184 (2): 273–84. doi:10.1007/s00360-013-0794-8. PMID 24366474.
- ^ Slominski A, Tobin DJ, Shibahara S, Wortsman J (October 2004). "Melanin pigmentation in mammalian skin and its hormonal regulation". Physiological Reviews. 84 (4): 1155–228. doi:10.1152/physrev.00044.2003. PMID 15383650.
- ^ Hilton Jr B (1996). "South Carolina Wildlife". Animal Colors. Hilton Pond Center. 43 (4): 10–15. Diakses tanggal 26 November 2011.
- ^ a b Prum RO, Torres RH (May 2004). "Structural colouration of mammalian skin: convergent evolution of coherently scattering dermal collagen arrays" (PDF). The Journal of Experimental Biology. 207 (Pt 12): 2157–72. doi:10.1242/jeb.00989. hdl:1808/1599. PMID 15143148.
- ^ Suutari M, Majaneva M, Fewer DP, Voirin B, Aiello A, Friedl T, et al. (March 2010). "Molecular evidence for a diverse green algal community growing in the hair of sloths and a specific association with Trichophilus welckeri (Chlorophyta, Ulvophyceae)". BMC Evolutionary Biology. 10 (86): 86. doi:10.1186/1471-2148-10-86. PMC 2858742
 . PMID 20353556.
. PMID 20353556.
- ^ Caro T (2005). "The Adaptive Significance of Coloration in Mammals". BioScience. 55 (2): 125–136. doi:10.1641/0006-3568(2005)055[0125:tasoci]2.0.co;2
 .
.
- ^ Mills LS, Zimova M, Oyler J, Running S, Abatzoglou JT, Lukacs PM (April 2013). "Camouflage mismatch in seasonal coat color due to decreased snow duration". Proceedings of the National Academy of Sciences of the United States of America. 110 (18): 7360–5. Bibcode:2013PNAS..110.7360M. doi:10.1073/pnas.1222724110
 . PMC 3645584
. PMC 3645584  . PMID 23589881.
. PMID 23589881.
- ^ Caro T (February 2009). "Contrasting coloration in terrestrial mammals". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 364 (1516): 537–48. doi:10.1098/rstb.2008.0221. PMC 2674080
 . PMID 18990666.
. PMID 18990666.
- ^ Plavcan JM (2001). "Sexual dimorphism in primate evolution". American Journal of Physical Anthropology. Suppl 33 (33): 25–53. doi:10.1002/ajpa.10011. PMID 11786990.
- ^ Bradley BJ, Gerald MS, Widdig A, Mundy NI (2012). "Coat Color Variation and Pigmentation Gene Expression in Rhesus Macaques (Macaca Mulatta)" (PDF). Journal of Mammalian Evolution. 20 (3): 263–270. doi:10.1007/s10914-012-9212-3. Diarsipkan dari versi asli (PDF) tanggal 2015-09-24.
- ^ Caro T, Izzo A, Reiner RC, Walker H, Stankowich T (April 2014). "The function of zebra stripes". Nature Communications. 5: 3535. Bibcode:2014NatCo...5.3535C. doi:10.1038/ncomms4535
 . PMID 24691390.
. PMID 24691390.
- ^ Kobayashi K, Kitano T, Iwao Y, Kondo M (2018-06-01). Reproductive and Developmental Strategies: The Continuity of Life (dalam bahasa Inggris). Springer. hlm. 290. ISBN 978-4-431-56609-0.
- ^ Lombardi J (30 November 1998). Comparative Vertebrate Reproduction. Springer Science & Business Media. ISBN 978-0-7923-8336-9.
- ^ Tyndale-Biscoe H, Renfree M (30 January 1987). Reproductive Physiology of Marsupials. Cambridge University Press. ISBN 978-0-521-33792-2.
- ^ Johnston SD, Smith B, Pyne M, Stenzel D, Holt WV (2007). "One‐Sided Ejaculation of Echidna Sperm Bundles" (PDF). The American Naturalist. 170 (6): E162–E164. doi:10.1086/522847. PMID 18171162.
- ^ Maxwell KE (2013). The Sex Imperative: An Evolutionary Tale of Sexual Survival. Springer. hlm. 112–113. ISBN 978-1-4899-5988-1.
- ^ Vaughan TA, Ryan JP, Czaplewski NJ (2011). Mammalogy. Jones & Bartlett Publishers. hlm. 387. ISBN 978-0-03-025034-7.
- ^ a b Hoffman EA, Rowe TB (September 2018). "Jurassic stem-mammal perinates and the origin of mammalian reproduction and growth". Nature. 561 (7721): 104–108. Bibcode:2018Natur.561..104H. doi:10.1038/s41586-018-0441-3. PMID 30158701.
- ^ Wallis MC, Waters PD, Delbridge ML, Kirby PJ, Pask AJ, Grützner F, et al. (2007). "Sex determination in platypus and echidna: autosomal location of SOX3 confirms the absence of SRY from monotremes". Chromosome Research. 15 (8): 949–59. doi:10.1007/s10577-007-1185-3. PMID 18185981.
- ^ Marshall Graves JA (2008). "Weird animal genomes and the evolution of vertebrate sex and sex chromosomes" (PDF). Annual Review of Genetics. 42: 565–86. doi:10.1146/annurev.genet.42.110807.091714. PMID 18983263. Diarsipkan dari versi asli (PDF) tanggal 2012-09-04.
- ^ Kesalahan pengutipan: Tag
<ref>tidak sah; tidak ditemukan teks untuk ref bernamaEpipubic bones in eutherian mammals - ^ Sally M (2005). "Mammal Behavior and Lifestyle". Mammals. Chicago: Raintree. hlm. 6. ISBN 978-1-4109-1050-9. OCLC 53476660.
- ^ Verma PS, Pandey BP (2013). ISC Biology Book I for Class XI. New Delhi: S. Chand and Company. hlm. 288. ISBN 978-81-219-2557-0.
- ^ Oftedal OT (July 2002). "The mammary gland and its origin during synapsid evolution". Journal of Mammary Gland Biology and Neoplasia. 7 (3): 225–52. doi:10.1023/a:1022896515287. PMID 12751889.
- ^ Krockenberger A (2006). "Lactation". Dalam Dickman CR, Armati PJ, Hume ID. Marsupials. hlm. 109. ISBN 978-1-139-45742-2.
- ^ Schulkin J, Power ML (2016). Milk: The Biology of Lactation. Johns Hopkins University Press. hlm. 66. ISBN 978-1-4214-2042-4.
- ^ Thompson KV, Baker AJ, Baker AM (2010). "Paternal Care and Behavioral Development in Captive Mammals". Dalam Kleiman DG, Thompson KV, Baer CK. Wild Mammals in Captivity Principles and Techniques for Zoo Management (edisi ke-2nd). University of Chicago Press. hlm. 374. ISBN 978-0-226-44011-8.
- ^ Campbell NA, Reece JB (2002). Biology (edisi ke-6th). Benjamin Cummings. hlm. 845. ISBN 978-0-8053-6624-2. OCLC 47521441.
- ^ Buffenstein R, Yahav S (1991). "Is the naked mole-rat Hererocephalus glaber an endothermic yet poikilothermic mammal?". Journal of Thermal Biology. 16 (4): 227–232. doi:10.1016/0306-4565(91)90030-6.
- ^ Schmidt-Nielsen K, Duke JB (1997). "Temperature Effects". Animal Physiology: Adaptation and Environment (edisi ke-5). Cambridge. hlm. 218. ISBN 978-0-521-57098-5. OCLC 35744403.
- ^ a b Lorenzini A, Johnson FB, Oliver A, Tresini M, Smith JS, Hdeib M, et al. (2009). "Significant correlation of species longevity with DNA double strand break recognition but not with telomere length". Mechanisms of Ageing and Development. 130 (11–12): 784–92. doi:10.1016/j.mad.2009.10.004. PMC 2799038
 . PMID 19896964.
. PMID 19896964.
- ^ Hart RW, Setlow RB (June 1974). "Correlation between deoxyribonucleic acid excision-repair and life-span in a number of mammalian species". Proceedings of the National Academy of Sciences of the United States of America. 71 (6): 2169–73. Bibcode:1974PNAS...71.2169H. doi:10.1073/pnas.71.6.2169
 . PMC 388412
. PMC 388412  . PMID 4526202.
. PMID 4526202.
- ^ Ma S, Upneja A, Galecki A, Tsai YM, Burant CF, Raskind S, et al. (November 2016). "Cell culture-based profiling across mammals reveals DNA repair and metabolism as determinants of species longevity". eLife. 5. doi:10.7554/eLife.19130. PMC 5148604
 . PMID 27874830.
. PMID 27874830.
- ^ Francis AA, Lee WH, Regan JD (June 1981). "The relationship of DNA excision repair of ultraviolet-induced lesions to the maximum life span of mammals". Mechanisms of Ageing and Development. 16 (2): 181–9. doi:10.1016/0047-6374(81)90094-4. PMID 7266079.
- ^ Treton JA, Courtois Y (March 1982). "Correlation between DNA excision repair and mammalian lifespan in lens epithelial cells". Cell Biology International Reports. 6 (3): 253–60. doi:10.1016/0309-1651(82)90077-7. PMID 7060140.
- ^ Maslansky CJ, Williams GM (February 1985). "Ultraviolet light-induced DNA repair synthesis in hepatocytes from species of differing longevities". Mechanisms of Ageing and Development. 29 (2): 191–203. doi:10.1016/0047-6374(85)90018-1. PMID 3974310.
- ^ "Leg and feet". Avian Skeletal Adaptations. Diarsipkan dari versi asli tanggal 2008-04-04. Diakses tanggal 3 August 2008.
- ^ Walker WF, Homberger DG (1998). Anatomy and Dissection of the Fetal Pig (edisi ke-5). New York: W. H. Freeman and Company. hlm. 3. ISBN 978-0-7167-2637-1. OCLC 40576267.
- ^ Orr CM (November 2005). "Knuckle-walking anteater: a convergence test of adaptation for purported knuckle-walking features of African Hominidae". American Journal of Physical Anthropology. 128 (3): 639–58. doi:10.1002/ajpa.20192. PMID 15861420.
- ^ Fish FE, Frappell PB, Baudinette RV, MacFarlane PM (February 2001). "Energetics of terrestrial locomotion of the platypus Ornithorhynchus anatinus" (PDF). The Journal of Experimental Biology. 204 (Pt 4): 797–803. doi:10.1242/jeb.204.4.797. hdl:2440/12192. PMID 11171362.
- ^ Dhingra P (2004). "Comparative Bipedalism – How the Rest of the Animal Kingdom Walks on two legs". Anthropological Science. 131 (231).
- ^ Alexander RM (May 2004). "Bipedal animals, and their differences from humans". Journal of Anatomy. 204 (5): 321–30. doi:10.1111/j.0021-8782.2004.00289.x. PMC 1571302
 . PMID 15198697.
. PMID 15198697.
- ^ Roberts TD (1995). Understanding Balance: The Mechanics of Posture and Locomotion. San Diego: Nelson Thornes. hlm. 211. ISBN 978-1-56593-416-0. OCLC 33167785.
- ^ a b Dagg AI (1973). "Gaits in Mammals". Mammal Review. 3 (4): 135–154. doi:10.1111/j.1365-2907.1973.tb00179.x.
- ^ a b c Cartmill M (1985). "Climbing". Dalam Hildebrand M, Bramble DM, Liem KF, Wake DB. Functional Vertebrate Morphology. Cambridge: Belknap Press. hlm. 73–88. ISBN 978-0-674-32775-7. OCLC 11114191.
- ^ Vernes K (2001). "Gliding Performance of the Northern Flying Squirrel (Glaucomys sabrinus) in Mature Mixed Forest of Eastern Canada". Journal of Mammalogy. 82 (4): 1026–1033. doi:10.1644/1545-1542(2001)082<1026:GPOTNF>2.0.CO;2.
- ^ Barba LA (October 2011). "Bats – the only flying mammals". Bio-Aerial Locomotion. Diakses tanggal 20 May 2016.
- ^ "Bats In Flight Reveal Unexpected Aerodynamics". ScienceDaily. 2007. Diakses tanggal July 12, 2016.
- ^ Hedenström A, Johansson LC (March 2015). "Bat flight: aerodynamics, kinematics and flight morphology" (PDF). The Journal of Experimental Biology. 218 (Pt 5): 653–63. doi:10.1242/jeb.031203. PMID 25740899.
- ^ "Bats save energy by drawing in wings on upstroke". ScienceDaily. 2012. Diakses tanggal July 12, 2016.
- ^ Karen T (2008). Hanging with Bats: Ecobats, Vampires, and Movie Stars. Albuquerque: University of New Mexico Press. hlm. 14. ISBN 978-0-8263-4403-8. OCLC 191258477.
- ^ Sterbing-D'Angelo S, Chadha M, Chiu C, Falk B, Xian W, Barcelo J, et al. (July 2011). "Bat wing sensors support flight control". Proceedings of the National Academy of Sciences of the United States of America. 108 (27): 11291–6. Bibcode:2011PNAS..10811291S. doi:10.1073/pnas.1018740108
 . PMC 3131348
. PMC 3131348  . PMID 21690408.
. PMID 21690408.
- ^ Damiani, R, 2003, Earliest evidence of cynodont burrowing, The Royal Society Publishing, Volume 270, Issue 1525
- ^ Shimer HW (1903). "Adaptations to Aquatic, Arboreal, Fossorial and Cursorial Habits in Mammals. III. Fossorial Adaptations". The American Naturalist. 37 (444): 819–825. doi:10.1086/278368. JSTOR 2455381.
- ^ Stanhope MJ, Waddell VG, Madsen O, de Jong W, Hedges SB, Cleven GC, et al. (August 1998). "Molecular evidence for multiple origins of Insectivora and for a new order of endemic African insectivore mammals". Proceedings of the National Academy of Sciences of the United States of America. 95 (17): 9967–72. Bibcode:1998PNAS...95.9967S. doi:10.1073/pnas.95.17.9967
 . PMC 21445
. PMC 21445  . PMID 9707584.
. PMID 9707584.
- ^ Perry DA (1949). "The anatomical basis of swimming in Whales". Journal of Zoology. 119 (1): 49–60. doi:10.1111/j.1096-3642.1949.tb00866.x.
- ^ Fish FE, Hui CA (1991). "Dolphin swimming – a review" (PDF). Mammal Review. 21 (4): 181–195. doi:10.1111/j.1365-2907.1991.tb00292.x. Diarsipkan dari versi asli (PDF) tanggal 2006-08-29.
- ^ Marsh H (1989). "Chapter 57: Dugongidae" (PDF). Fauna of Australia. 1. Canberra: Australian Government Publications. ISBN 978-0-644-06056-1. OCLC 27492815. Diarsipkan dari versi asli (PDF) tanggal 2013-05-11.
- ^ a b Berta A (April 2012). "Pinniped Diversity: Evolution and Adaptations". Return to the Sea: The Life and Evolutionary Times of Marine Mammals. University of California Press. hlm. 62–64. ISBN 978-0-520-27057-2.
- ^ a b Fish FE, Hurley J, Costa DP (February 2003). "Maneuverability by the sea lion Zalophus californianus: turning performance of an unstable body design". The Journal of Experimental Biology. 206 (Pt 4): 667–74. doi:10.1242/jeb.00144
 . PMID 12517984.
. PMID 12517984.
- ^ a b Riedman M (1990). The Pinnipeds: Seals, Sea Lions, and Walruses
 . University of California Press. ISBN 978-0-520-06497-3. OCLC 19511610.
. University of California Press. ISBN 978-0-520-06497-3. OCLC 19511610.
- ^ Fish FE (1996). "Transitions from drag-based to lift-based propulsion in mammalian swimming". Integrative and Comparative Biology. 36 (6): 628–641. doi:10.1093/icb/36.6.628
 .
.
- ^ Fish FE (2000). "Biomechanics and energetics in aquatic and semiaquatic mammals: platypus to whale" (PDF). Physiological and Biochemical Zoology. 73 (6): 683–98. CiteSeerX 10.1.1.734.1217
 . doi:10.1086/318108. PMID 11121343. Diarsipkan dari versi asli (PDF) tanggal 2016-08-04.
. doi:10.1086/318108. PMID 11121343. Diarsipkan dari versi asli (PDF) tanggal 2016-08-04.
- ^ Eltringham SK (1999). "Anatomy and Physiology". The Hippos. London: T & AD Poyser Ltd. hlm. 8. ISBN 978-0-85661-131-5. OCLC 42274422.
- ^ "Hippopotamus Hippopotamus amphibius". National Geographic. Diarsipkan dari versi asli tanggal 2014-11-25. Diakses tanggal 30 April 2016.
- ^ a b Seyfarth RM, Cheney DL, Marler P (1980). "Vervet Monkey Alarm Calls: Semantic communication in a Free-Ranging Primate". Animal Behaviour. 28 (4): 1070–1094. doi:10.1016/S0003-3472(80)80097-2.
- ^ Zuberbühler K (2001). "Predator-specific alarm calls in Campbell's monkeys, Cercopithecus campbelli". Behavioral Ecology and Sociobiology. 50 (5): 414–442. doi:10.1007/s002650100383. JSTOR 4601985.
- ^ Slabbekoorn H, Smith TB (April 2002). "Bird song, ecology and speciation". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 357 (1420): 493–503. doi:10.1098/rstb.2001.1056. PMC 1692962
 . PMID 12028787.
. PMID 12028787.
- ^ Bannister JL (2008). "Baleen Whales (Mysticetes)". Dalam Perrin WF, Würsig B, Thewissen JG. Encyclopedia of Marine Mammals (edisi ke-2nd). Academic Press. hlm. 80–89. ISBN 978-0-12-373553-9.
- ^ Scott N (2002). "Creatures of Culture? Making the Case for Cultural Systems in Whales and Dolphins". BioScience. 52 (1): 9–14. doi:10.1641/0006-3568(2002)052[0009:COCMTC]2.0.CO;2.
- ^ Boughman JW (February 1998). "Vocal learning by greater spear-nosed bats". Proceedings. Biological Sciences. 265 (1392): 227–33. doi:10.1098/rspb.1998.0286. PMC 1688873
 . PMID 9493408.
. PMID 9493408.
- ^ "Prairie dogs' language decoded by scientists". CBC News. 21 June 2013. Diakses tanggal 20 May 2015.
- ^ Mayell H (3 March 2004). "Elephants Call Long-Distance After-Hours". National Geographic. Diakses tanggal 15 November 2016.
- ^ Smith JM, Harper D (2003). Animal Signals. Oxford Series in Ecology and Evolution. Oxford University Press. hlm. 61–63. ISBN 978-0-19-852684-1. OCLC 54460090.
- ^ FitzGibbon CD, Fanshawe JH (1988). "Stotting in Thomson's gazelles: an honest signal of condition" (PDF). Behavioral Ecology and Sociobiology. 23 (2): 69–74. doi:10.1007/bf00299889. Diarsipkan dari versi asli (PDF) tanggal 2014-02-25.
- ^ Bildstein KL (May 1983). "Why White-Tailed Deer Flag Their Tails". The American Naturalist. 121 (5): 709–715. doi:10.1086/284096. JSTOR 2460873.
- ^ Gosling LM (January 1982). "A reassessment of the function of scent marking in territories". Zeitschrift für Tierpsychologie. 60 (2): 89–118. doi:10.1111/j.1439-0310.1982.tb00492.x.
- ^ Zala SM, Potts WK, Penn DJ (March 2004). "Scent-marking displays provide honest signals of health and infection". Behavioral Ecology. 15 (2): 338–44. doi:10.1093/beheco/arh022. hdl:10.1093/beheco/arh022
 .
.
- ^ Johnson RP (August 1973). "Scent Marking in Mammals". Animal Behaviour. 21 (3): 521–535. doi:10.1016/S0003-3472(73)80012-0.
- ^ Schevill WE, McBride AF (1956). "Evidence for echolocation by cetaceans". Deep-Sea Research. 3 (2): 153–154. Bibcode:1956DSR.....3..153S. doi:10.1016/0146-6313(56)90096-x.
- ^ Wilson W, Moss C (2004). Thomas J, ed. Echolocation in Bats and Dolphins. Chicago University Press. hlm. 22. ISBN 978-0-226-79599-7. OCLC 50143737.
- ^ Au WW (1993). The Sonar of Dolphins. Springer-Verlag. ISBN 978-3-540-97835-0. OCLC 26158593.
- ^ Sanders JG, Beichman AC, Roman J, Scott JJ, Emerson D, McCarthy JJ, Girguis PR (September 2015). "Baleen whales host a unique gut microbiome with similarities to both carnivores and herbivores". Nature Communications. 6: 8285. Bibcode:2015NatCo...6.8285S. doi:10.1038/ncomms9285. PMC 4595633
 . PMID 26393325.
. PMID 26393325.
- ^ Speaksman JR (1996). "Energetics and the evolution of body size in small terrestrial mammals" (PDF). Symposia of the Zoological Society of London (69): 69–81.
- ^ a b Wilson DE, Burnie D, ed. (2001). Animal: The Definitive Visual Guide to the World's Wildlife (edisi ke-1st). DK Publishing. hlm. 86–89. ISBN 978-0-7894-7764-4. OCLC 46422124.
- ^ a b Van Valkenburgh B (July 2007). "Deja vu: the evolution of feeding morphologies in the Carnivora". Integrative and Comparative Biology. 47 (1): 147–63. doi:10.1093/icb/icm016
 . PMID 21672827.
. PMID 21672827.
- ^ Sacco T, van Valkenburgh B (2004). "Ecomorphological indicators of feeding behaviour in the bears (Carnivora: Ursidae)". Journal of Zoology. 263 (1): 41–54. doi:10.1017/S0952836904004856.
- ^ Singer MS, Bernays EA (2003). "Understanding omnivory needs a behavioral perspective". Ecology. 84 (10): 2532–2537. doi:10.1890/02-0397.
- ^ Hutson JM, Burke CC, Haynes G (2013-12-01). "Osteophagia and bone modifications by giraffe and other large ungulates". Journal of Archaeological Science. 40 (12): 4139–4149. doi:10.1016/j.jas.2013.06.004.
- ^ "Why Do Cats Eat Grass?". Pet MD. Diakses tanggal 13 January 2017.
- ^ Geiser F (2004). "Metabolic rate and body temperature reduction during hibernation and daily torpor". Annual Review of Physiology. 66: 239–74. doi:10.1146/annurev.physiol.66.032102.115105. PMID 14977403.
- ^ Humphries MM, Thomas DW, Kramer DL (2003). "The role of energy availability in Mammalian hibernation: a cost-benefit approach". Physiological and Biochemical Zoology. 76 (2): 165–79. doi:10.1086/367950. PMID 12794670.
- ^ Barnes BM (June 1989). "Freeze avoidance in a mammal: body temperatures below 0 degree C in an Arctic hibernator". Science. 244 (4912): 1593–5. Bibcode:1989Sci...244.1593B. doi:10.1126/science.2740905. PMID 2740905.
- ^ Fritz G (2010). "Aestivation in Mammals and Birds". Dalam Navas CA, Carvalho JE. Aestivation: Molecular and Physiological Aspects. Progress in Molecular and Subcellular Biology. 49. Springer-Verlag. hlm. 95–113. doi:10.1007/978-3-642-02421-4. ISBN 978-3-642-02420-7.
- ^ Mann J, Patterson EM (November 2013). "Tool use by aquatic animals". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 368 (1630): 20120424. doi:10.1098/rstb.2012.0424. PMC 4027413
 . PMID 24101631.
. PMID 24101631.
- ^ Raffaele P (2011). Among the Great Apes: Adventures on the Trail of Our Closest Relatives. New York: Harper. hlm. 83. ISBN 978-0-06-167184-5. OCLC 674694369.
- ^ Köhler W (1925). The Mentality of Apes. Liveright. ISBN 978-0-87140-108-3. OCLC 2000769.
- ^ McGowan RT, Rehn T, Norling Y, Keeling LJ (May 2014). "Positive affect and learning: exploring the "Eureka Effect" in dogs". Animal Cognition. 17 (3): 577–87. doi:10.1007/s10071-013-0688-x. PMID 24096703.
- ^ Karbowski J (May 2007). "Global and regional brain metabolic scaling and its functional consequences". BMC Biology. 5 (18): 18. arXiv:0705.2913
 . Bibcode:2007arXiv0705.2913K. doi:10.1186/1741-7007-5-18. PMC 1884139
. Bibcode:2007arXiv0705.2913K. doi:10.1186/1741-7007-5-18. PMC 1884139  . PMID 17488526.
. PMID 17488526.
- ^ Marino L (June 2007). "Cetacean brains: how aquatic are they?". Anatomical Record. 290 (6): 694–700. doi:10.1002/ar.20530. PMID 17516433.
- ^ Gallop GG (January 1970). "Chimpanzees: self-recognition". Science. 167 (3914): 86–7. Bibcode:1970Sci...167...86G. doi:10.1126/science.167.3914.86. PMID 4982211.
- ^ Plotnik JM, de Waal FB, Reiss D (November 2006). "Self-recognition in an Asian elephant" (PDF). Proceedings of the National Academy of Sciences of the United States of America. 103 (45): 17053–7. Bibcode:2006PNAS..10317053P. doi:10.1073/pnas.0608062103
 . PMC 1636577
. PMC 1636577  . PMID 17075063.
. PMID 17075063.
- ^ Robert S (1986). "Ontogeny of mirror behavior in two species of great apes". American Journal of Primatology. 10 (2): 109–117. doi:10.1002/ajp.1350100202. PMID 31979488.
- ^ Walraven V, van Elsacker L, Verheyen R (1995). "Reactions of a group of pygmy chimpanzees (Pan paniscus) to their mirror images: evidence of self-recognition". Primates. 36: 145–150. doi:10.1007/bf02381922.
- ^ Leakey R (1994). "The Origin of the Mind". The Origin Of Humankind. New York: BasicBooks. hlm. 150. ISBN 978-0-465-05313-1. OCLC 30739453.
- ^ Archer J (1992). Ethology and Human Development. Rowman & Littlefield. hlm. 215–218. ISBN 978-0-389-20996-6. OCLC 25874476.
- ^ a b Marten K, Psarakos S (1995). "Evidence of self-awareness in the bottlenose dolphin (Tursiops truncatus)". Dalam Parker ST, Mitchell R, Boccia M. Self-awareness in Animals and Humans: Developmental Perspectives. Cambridge: Cambridge University Press. hlm. 361–379. ISBN 978-0-521-44108-7. OCLC 28180680.
- ^ a b Delfour F, Marten K (April 2001). "Mirror image processing in three marine mammal species: killer whales (Orcinus orca), false killer whales (Pseudorca crassidens) and California sea lions (Zalophus californianus)". Behavioural Processes. 53 (3): 181–190. doi:10.1016/s0376-6357(01)00134-6. PMID 11334706.
- ^ Jarvis JU (May 1981). "Eusociality in a mammal: cooperative breeding in naked mole-rat colonies". Science. 212 (4494): 571–3. Bibcode:1981Sci...212..571J. doi:10.1126/science.7209555. JSTOR 1686202. PMID 7209555.
- ^ Jacobs DS, Bennett NC, Jarvis JU, Crowe TM (1991). "The colony structure and dominance hierarchy of the Damaraland mole-rat, Cryptomys damarensis (Rodentia: Bathyergidae) from Namibia". Journal of Zoology. 224 (4): 553–576. doi:10.1111/j.1469-7998.1991.tb03785.x.
- ^ Hardy SB (2009). Mothers and Others: The Evolutionary Origins of Mutual Understanding. Boston: Belknap Press of Harvard University Press. hlm. 92–93.
- ^ Harlow HF, Suomi SJ (July 1971). "Social recovery by isolation-reared monkeys". Proceedings of the National Academy of Sciences of the United States of America. 68 (7): 1534–8. Bibcode:1971PNAS...68.1534H. doi:10.1073/pnas.68.7.1534
 . PMC 389234
. PMC 389234  . PMID 5283943.
. PMID 5283943.
- ^ van Schaik CP (January 1999). "The socioecology of fission-fusion sociality in Orangutans". Primates; Journal of Primatology. 40 (1): 69–86. doi:10.1007/BF02557703. PMID 23179533.
- ^ Archie EA, Moss CJ, Alberts SC (March 2006). "The ties that bind: genetic relatedness predicts the fission and fusion of social groups in wild African elephants". Proceedings. Biological Sciences. 273 (1586): 513–22. doi:10.1098/rspb.2005.3361. PMC 1560064
 . PMID 16537121.
. PMID 16537121.
- ^ Smith JE, Memenis SK, Holekamp KE (2007). "Rank-related partner choice in the fission–fusion society of the spotted hyena (Crocuta crocuta)" (PDF). Behavioral Ecology and Sociobiology. 61 (5): 753–765. doi:10.1007/s00265-006-0305-y. Diarsipkan dari versi asli (PDF) tanggal 2014-04-25.
- ^ Matoba T, Kutsukake N, Hasegawa T (2013). Hayward M, ed. "Head rubbing and licking reinforce social bonds in a group of captive African lions, Panthera leo". PLOS ONE. 8 (9): e73044. Bibcode:2013PLoSO...873044M. doi:10.1371/journal.pone.0073044
 . PMC 3762833
. PMC 3762833  . PMID 24023806.
. PMID 24023806.
- ^ Krützen M, Barré LM, Connor RC, Mann J, Sherwin WB (July 2004). "'O father: where art thou?'--Paternity assessment in an open fission-fusion society of wild bottlenose dolphins (Tursiops sp.) in Shark Bay, Western Australia". Molecular Ecology. 13 (7): 1975–90. doi:10.1111/j.1365-294X.2004.02192.x. PMID 15189218.
- ^ Martin C (1991). The Rainforests of West Africa: Ecology – Threats – Conservation (edisi ke-1). Springer. doi:10.1007/978-3-0348-7726-8. ISBN 978-3-0348-7726-8.
- ^ le Roux A, Cherry MI, Gygax L (5 May 2009). "Vigilance behaviour and fitness consequences: comparing a solitary foraging and an obligate group-foraging mammal". Behavioral Ecology and Sociobiology. 63 (8): 1097–1107. doi:10.1007/s00265-009-0762-1.
- ^ Palagi E, Norscia I (2015). Samonds KE, ed. "The Season for Peace: Reconciliation in a Despotic Species (Lemur catta)". PLOS ONE. 10 (11): e0142150. Bibcode:2015PLoSO..1042150P. doi:10.1371/journal.pone.0142150
 . PMC 4646466
. PMC 4646466  . PMID 26569400.
. PMID 26569400.
- ^ East ML, Hofer H (2000). "Male spotted hyenas (Crocuta crocuta) queue for status in social groups dominated by females". Behavioral Ecology. 12 (15): 558–568. doi:10.1093/beheco/12.5.558
 .
.
- ^ Samuels A, Silk JB, Rodman P (1984). "Changes in the dominance rank and reproductive behavior of male bonnet macaques (Macaca radiate)". Animal Behaviour. 32 (4): 994–1003. doi:10.1016/s0003-3472(84)80212-2.
- ^ Delpietro HA, Russo RG (2002). "Observations of the common vampire bat (Desmodus rotundus) and the hairy-legged vampire bat (Diphylla ecaudata) in captivity". Mammalian Biology. 67 (2): 65–78. doi:10.1078/1616-5047-00011.
- ^ Kleiman DG (March 1977). "Monogamy in mammals". The Quarterly Review of Biology. 52 (1): 39–69. doi:10.1086/409721. PMID 857268.
- ^ Holland B, Rice WR (February 1998). "Perspective: Chase-Away Sexual Selection: Antagonistic Seduction Versus Resistance" (PDF). Evolution; International Journal of Organic Evolution. 52 (1): 1–7. doi:10.2307/2410914. JSTOR 2410914. PMID 28568154. Diarsipkan dari versi asli (PDF) tanggal 2019-06-08. Diakses tanggal 2016-07-08.
- ^ Clutton-Brock TH (May 1989). "Mammalian mating systems". Proceedings of the Royal Society of London. Series B, Biological Sciences. 236 (1285): 339–72. Bibcode:1989RSPSB.236..339C. doi:10.1098/rspb.1989.0027. PMID 2567517.
- ^ Boness DJ, Bowen D, Buhleier BM, Marshall GJ (2006). "Mating tactics and mating system of an aquatic-mating pinniped: the harbor seal, Phoca vitulina". Behavioral Ecology and Sociobiology. 61: 119–130. doi:10.1007/s00265-006-0242-9.
- ^ Klopfer PH (1981). "Origins of Parental Care". Dalam Gubernick DJ. Parental Care in Mammals. New York: Plenum Press. ISBN 978-1-4613-3150-6. OCLC 913709574.