Metabolisme: Perbedaan antara revisi
Tidak ada ringkasan suntingan |
|||
| Baris 1: | Baris 1: | ||
[[Berkas:Metabolism. |
[[Berkas:Metabolism-en.svg|jmpl|Tampilan metabolisme seluler yang disederhanakan.]] |
||
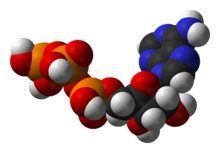
[[Berkas:ATP-3D-vdW.png|jmpl|ka|Struktur [[adenosin trifosfat]] (ATP), zat antara utama dalam metabolisme energi.]] |
[[Berkas:ATP-3D-vdW.png|jmpl|ka|Struktur [[adenosin trifosfat]] (ATP), zat antara utama dalam metabolisme energi.]] |
||
Revisi per 8 Juli 2024 13.43

Metabolisme (bahasa Yunani: μεταβολισμος, metabolismos, 'perubahan') adalah seluruh reaksi biokimia yang bertujuan untuk mempertahankan kehidupan pada suatu organisme. Proses ini memungkinkan organisme untuk tumbuh, bereproduksi, mempertahankan struktur, dan merespons lingkungannya. Metabolisme juga dapat diartikan sebagai semua reaksi kimia yang terjadi pada organisme hidup, di antaranya pencernaan dan perpindahan zat di dalam sel dan di antara sel yang berbeda. Di dalam sel, reaksi kimia terjadi secara berantai sehingga produk yang dihasilkan oleh suatu reaksi akan memasuki reaksi lain. Reaksi-reaksi yang saling terhubung ini disebut metabolisme perantara atau metabolisme intermediat dan setiap reaksinya dikatalisis oleh enzim.
Secara umum, metabolisme memiliki dua arah lintasan reaksi kimia organik, yaitu katabolisme (reaksi untuk menghasilkan energi dengan cara mengurai senyawa organik), seperti pemecahan glukosa menjadi asam piruvat oleh proses respirasi seluler dan anabolisme (reaksi yang memerlukan energi untuk menyusun [sintesis] senyawa organik seperti protein, karbohidrat, lipid, dan asam nukleat dari molekul-molekul yang diperlukan).[1] Tiga tujuan utama metabolisme yaitu mengonversi makanan menjadi energi untuk menjalankan proses pada tingkat seluler, mengonversi makanan menjadi bahan baku penyusun protein, lipid, asam nukleat, dan beberapa jenis karbohidrat, serta mengeliminasi zat sisa metabolisme.
Reaksi kimia pada proses metabolisme terbagi atas beberapa lintasan metabolik yang mengubah suatu senyawa menjadi senyawa yang berbeda melalui beberapa tahapan. Tiap tahapan dalam lintasan difasilitasi dengan enzim yang bersifat spesifik. Fungsi enzim sangat penting pada metabolisme karena membantu organisme menjalankan reaksi yang dinginkan karena reaksi ini membutuhkan energi dan tidak terjadi secara otomatis. Enzim memasangkan reaksi yang difasilitasinya dengan reaksi spontan yang menghasilkan energi sehingga enzim berfungsi sebagai katalis yang mempercepat terjadinya reaksi sekaligus mengatur laju reaksi metabolik. Reaksi kimia dalam metabolisme muncul sebagai respons atas perubahan lingkungan sel atau sinyal dari sel lain.
Pada setiap proses dalam metabolisme, reaksi kimia juga melibatkan sejumlah substrat yang bereaksi dengan enzim sebagai katalis pada jenjang-jenjang reaksi guna menghasilkan senyawa intermediat, yang menjadi substrat pada jenjang reaksi berikutnya. Keseluruhan pereaksi kimia yang terlibat pada suatu jenjang reaksi disebut metabolom. Semua ini dipelajari pada suatu cabang ilmu biologi yang disebut metabolomika. Laju metabolisme basal suatu organisme adalah ukuran jumlah energi yang dikonsumsi oleh semua reaksi kimia yang terjadi.
Sistem metabolisme suatu organisme menentukan senyawa mana yang merupakan nutrisi dan senyawa mana yang beracun bagi tubuh. Sebagai contoh, beberapa jenis prokariota memakai hidrogen sulfida sebagai nutrien walaupun gas ini bersifat racun bagi hewan. Namun, terdapat ciri khusus dari metabolisme yang umumnya ditemukan pada hampir seluruh spesies yang berbeda, seperti gugus asam karboksilat yang diketahui merupakan sebagai zat antara pada siklus asam sitrat pada semua organisme yang diketahui manusia. Senyawa ini juga ditemukan pada spesies yang sangat berbeda struktur biologisnya, seperti bakteri uniseluler Eschirichia coli dan organisme multiseluler berukuran besar seperti gajah. Kesamaan yang terdapat pada lintasan metabolisme ini mungkin terjadi akibat keberadaan senyawa-senyawa tersebut pada awal sejarah evolusi dan retensi kemunculan mereka yang tinggi pada beragam jenis hewan karena efikasi yang ditimbulkan. Metabolisme sel kanker sangat berbeda dengan sel normal dan perbedaanya ini dapat digunakan sebagai intervensi terapeutik pada penyakit kanker.
Sejarah
Etimologi
Terminologi metabolisme diturunkan dari bahasa Prancis "métabolisme" atau bahasa Yunani Kuno μεταβολή – "Metabole" yang dialihbahasakan menjadi "sebuah perubahan" yang diturunkan dari kata μεταβάλλ – "Metaballein" yang dialihbahasakan menjadi "untuk mengubah".[2]
Filsafat Yunani

Buku karya dari Aristoteles berjudul De Partibus Animalium menjelaskan cukup detail tentang pandangannya terhadap metabolisme yang digambarkan dengan sebuah model diagram alir terbuka. Dia mempercayai bahwa pada setiap langkah di dalam proses saat materi dari makanan ditransformasikan, panas keluar sebagai elemen klasik dari api dan materi residu dieksresikan sebagai urine, empedu, atau tinja.[3]
Ilmu kedokteran oleh ilmuwan Islam
Ibnu al-Nafis menjelaskan metabolisme pada abad ke-13 dengan menyatakan, "Baik tubuh dan bagian-bagiannya berada dalam kondisi penguraian dan pemberian nutrisi secara berkesinambungan sehingga mereka mengalami perubahan permanen yang tidak dapat dihindari."[4]
Eksperimen awal

Eksperimen terkontrol terhadap metabolisme pada manusia pertama kali diterbitkan oleh Santorio Santorio pada tahun 1614 di dalam bukunya, Ars de statica medecina yang membuatnya terkenal di Eropa. Dia mendeskripsikan rangkaian percobaan yang dilakukannya, yang melibatkan penimbangan dirinya sendiri pada sebuah kursi yang digantung pada sebuah timbangan besar (lihat gambar) sebelum dan sesudah makan, tidur, bekerja, berhubungan seksual, berpuasa makan atau minum, dan buang air besar. Dia menemukan bahwa bagian terbesar makanan yang dimakannya hilang dari tubuh melalui perspiratio insensibilis (mungkin dapat diterjemahkan sebagai "keringatan yang tidak tampak").[5]
Pada studi awal, mekanisme proses metabolisme tidak dapat diidentifikasi dan dipercaya bahwa energi vital menggerakkan kehidupan.[6] Pada abad ke-19, Louis Pasteur mengambil kesimpulan bahwa fermentasi mengkatalisis senyawa di dalam sel khamir yang dia sebut "fermen" ketika dia mempelajari proses fermentasi gula menjadi alkohol oleh khamir. Dia menulis bahwa "fermentasi alkohol merupakan suatu kondisi yang berkorelasi dengan kehidupan dan pengaturan oleh sel khamir, bukan kematian atau pembusukan sel tersebut".[7] Penemuan ini selaras dengan publikasi Friedrich Wöhler pada tahun 1828 dalam karya tulisnya tentang sintesis kimiawi urea, yang dikenal sebagai senyawa organik pertama yang dipersiapkan dari prekursor anorganik lengkap. Penelitian ini membuktikan bahwa senyawa organik dan reaksi kimia yang ditemukan di dalam sel tidak berbeda secara prinsip dengan reaksi kimiawi yang berlangsung di tempat lain.[8]
Penemuan enzim pada awal abad ke-20 oleh Eduard Buchner yang memisahkan studi reaksi kimiawi metabolisme dari studi sel biologis lain menjadi awal mula dari biokimia.[9] Pengetahuan biokimia berkembang pesat selama awal abad ke-20. Salah satu ahli biokimia modern yang paling terkemuka ialah Hans Krebs yang memberikan kontibusi besar kepada studi metabolisme. Dia menemukan siklus urea dan kemudian bekerja sama dengan Hans Kornberg menemukan siklus asam sitrat dan siklus glioksilat.[10] Penelitian biokimia modern telah berkembang dengan pesat setelah penemuan kromatografi pada tahun 1904,[11] difraksi sinar-X, spektroskopi resonansi magnet inti, pelabelan isotop, mikroskop elektron, dan simulasi dinamika molekular.
Senyawa biokimia kunci
Sebagian besar struktur yang menyusun hewan, tumbuhan, dan mikroorganisme tersusun atas empat gugus molekul dasar: asam amino, karbohidrat, asam nukleat, dan lipid. Karena keempatnya sangat vital bagi kehidupan, reaksi metabolik bertujuan untuk membentuk molekul-molekul tersebut selama proses penyusunan sel dan jaringan, atau menguraikan dan menggunakan mereka untuk mendapatkan energi melalui proses pencernaan. Senyawa-senyawa biokimia ini dapat digabungkan untuk membentuk polimer seperti DNA dan protein yang merupakan makromolekul esensial bagi kehidupan.[12]
| Jenis molekul | Nama monomer | Nama polimer | Contoh bentuk polimer |
|---|---|---|---|
| Asam amino | Asam amino | Protein (tersusun atas polipeptida) | Protein serat dan protein globular |
| Karbohidrat | Monosakarida | Polisakarida | Amilum, glikogen, dan selulosa |
| Asam nukleat | Nukleotida | Polinukleotida | DNA dan RNA |
Asam amino dan protein
Protein terdiri dari rangkaian asam amino yang disusun menjadi sebuah rantai yang disatukan oleh ikatan peptida. Sebagian besar protein berfungsi sebagai enzim yang dapat mengkatalisis reaksi kimia pada proses metabolisme. Protein-protein lainnya memiliki fungsi struktural atau mekanik seperti sebagai penyusun sitoskeleton, suatu sistem perancah yang berfungsi untuk mempertahankan bentuk sel.[13] Beberapa fungsi protein yang lain di antaranya memproduksi cahaya pada kunang-kunang, membantu transpor oksigen dalam darah, serta menjadi komponen penyusun keratin.[14] Asam amino berkontribusi dalam proses metabolisme energi seluler sebagai penyedia sumber karbon untuk memulai siklus asam sitrat, terutama ketika sumber energi utama seperti glukosa menipis atau ketika sel mengalami represi katabolit kembali, misalnya akibat stres metabolik.[15]
Lipid

Lipid adalah gugus senyawa biokimia yang paling beragam. Fungsi struktural utamanya adalah sebagai bagian dari membran biologis, baik sebagai membran internal (misalnya membran pada retikulum endoplasma), membran eksternal (seperti membran sel), atau sebagai sumber energi dan tempat penyimpanan energi.[16] Lipid didefinisikan sebagai molekul biologis yang bersifat hidrofobik atau amfifilik, tetapi dapat terlarut pada pelarut lipid, seperti eter, benzena, aseton, atau kloroform.[17] Lipid adalah gugus besar senyawa yang mengandung asam lemak dan gliserol; gliserol yang melekat pada asam lemak ester dikenal dengan nama triasilgliserida[18] Selain itu, terdapat banyak variasi bentuk lipid yang lain, misalnya sfingosina yang merupakan rantai utama sfingomielin dan gugus hidrofilik seperti fosfat yang ada pada fosfolipid. Steroid merupakan salah satu kelompok utama dari lipid.[19]
Karbohidrat

Karbohidrat adalah senyawa aldehida dan keton dengan banyak gugus hidroksil yang menempel dalam bentuk rantai lurus atau cincin. Karbohidrat adalah molekul biologis paling berlimpah dan memiliki banyak fungsi, seperti tempat penyimpanan atau transpor energi (amilum dan glikogen) dan juga merupakan komponen penyusun dari suatu senyawa pada organisme (selulosa pada tumbuhan dan kitin pada hewan).[20] Unit paling sederhana dari karbohidrat dikenal dengan nama monosakarida. Terdapat tiga jenis monosakarida, yaitu galaktosa, fruktosa dan senyawa yang paling penting bagi organisme, yaitu glukosa. Monosakarida akan saling terikat dengan monoskarida lain dan membentuk polisakarida dalam pelbagai bentuk yang tak terhitung jumlahnya.[21]
Nukleotida
Dua jenis asam nukleat, yaitu DNA dan RNA merupakan polimer dari nukleotida. Tiap nukleotida disusun atas fosfat yang menempel pada gugus gula ribosa atau deoksiribosa yang menempel pada basa nitrogen. Asam nukleat memiliki fungsi penting sebagai media penyimpanan dan penggunaan informasi genetik yang akan dinterpretasi melalui proses transkripsi dan translasi dalam proses biosintesis protein.[22] Informasi genetik yang terkandung di dalam asam nukleat dilindungi oleh mekanisme perbaikan DNA dan diperbanyak pada proses replikasi DNA. Banyak virus memiliki genom RNA, seperti HIV, yang menggunakan proses transkripsi balik untuk membuat templat DNA dari genom virus RNA-nya.[23] Molekul RNA yang berada di dalam ribozim, seperti spliseosom atau ribosom, bekerja mirip dengan enzim yang mampu mengkatalisis reaksi kimia. Nukleosida adalah penyusun nukleotida yang merupakan basa nukleotida yang menempel pada gula ribosa. Basa nukleotida memiliki bentuk cincin heterosiklik yang mengandung nitrogen yang diklasifisikasikan menjadi dua macam, yaitu purina atau pirimidina. Nukleotida juga dapat berfungsi sebagai koenzim pada reaksi transfer gugus metabolis.[24]
Koenzim

Metabolisme melibatkan banyak reaksi kimia, tetapi sebagian besar reaksi tersebut dikategorikan ke dalam jenis reaksi sederhana yang melibatkan perpindahan gugus fungsional suatu atom serta ikatannya di dalam suatu molekul.[25] Kimia sederhana ini memungkinkan pengunaaan kelompok senyawa intermediat untuk membawa gugus senyawa kimia ini berpindah di antara reaksi-reaksi yang berbeda.[26] Kelompok senyawa intermediat yang berfungsi untuk memindahkan gugus tersebut dikenal dengan nama koenzim. Tiap kelompok reaksi dikendalikan oleh suatu koenzim tertentu, yang menjadi substrat untuk kelompok enzim yang memproduksinya sekaligus enzim yang memakainya. Koenzim ini terus-menerus dibuat, dipakai, dan didaur ulang.[27]

Salah satu koenzim utama yang ada di dalam tubuh ialah ATP (adenosina trifosfat) yang merupakan sumber energi universal di dalam sel. Jenis nukleotida ini digunakan untuk memindahkan energi kimiawi di antara reaksi-reaksi kimia yang berbeda. Hanya ada sedikit ATP di dalam tubuh, tetapi ATP terus-menerus diregenerasi sehingga tubuh manusia dapat menggunakan ATP dengan jumlah yang setara dengan berat badan tubuhnya.[27][28] ATP bertindak sebagai jembatan penghubung katabolisme dan anabolisme. Katabolisme menguraikan molekul dan katabolisme menyatukannya kembali. Reaksi katabolisme menghasilkan ATP dan reaksi anabolis memakainya. ATP juga berfungsi sebagai pembawa gugus fosfat dalam reaksi fosforilasi.[29]
Vitamin merupakan senyawa organik yang dibutuhkan dalam jumlah sedikit dan tidak dapat diproduksi oleh sel di dalam tubuh manusia. Pada nutrisi manusia, vitamin berfungsi sebagai koenzim, setelah mengalami modifikasi. Misalnya, vitamin larut air akan mengalami fosforilasi dan berpasangan dengan nukleotida ketika dipakai oleh sel.[30] Nikotinamida adenina dinukleotida (NAD+) adalah senyawa turunan vitamin B3 (niasin) yang merupakan koenzim penting yang bertindak sebagai reseptor molekul hidrogen. Ratusan jenis enzim dehidrogenase melepas elektron dari substrat dan mereduksi NAD+ menjadi NADH. Koenzim yang telah direduksi ini kemudian menjadi substrat bagi enzim reduktase di dalam sel untuk mereduksi substrat.[31] Nikotinamida adenina dinukleotida eksis dalam bentuk yang saling berhubungan di dalam sel, yaitu NADH dan NADPH. Bentuk NAD+/NADH lebih penting pada reaksi katabolis, sedangkan NADP+/NADPH dipakai pada reaksi anabolik.[32]
Mineral dan kofaktor

Senyawa anorganik memiliki peran penting pada proses metabolisme. Beberapa senyawa berada dalam jumlah yang berlimpah (natrium dan kalium), sedangkan senyawa yang lain hanya berfungsi dalam konsentrasi yang kecil di dalam tubuh. Sekitar 99% berat badan pada manusia terdiri dari karbon, nitrogen, kalsium, natrium, kalium, klorin, hidrogen, oksigen, dan fosfor. Senyawa organik penyusun tubuh, seperti lipid, protein, dan karbohidrat mengandung sebagian besar karbon dan nitrogen sebagai salah satu penyusunnya. Sebagian besar molekul oksigen dan hidrogen berada dalam bentuk air di dalam tubuh.[33]
Senyawa anorganik berfungsi sebagai elektrolit di dalam tubuh. Elektrolit penting dalam tubuh terdiri atas enam elektrolit, yaitu iodin, kalium, klorida, bikarbonat, fosfat, dan kalsium. Gradien konsentrasi ion yang stabil pada membran sel diperlukan untuk mempertahankan tekanan osmotik dan pH.[34] Ion memiliki fungsi penting pada otot dan saraf sebagai potensial aksi di dalam jaringan yang dihasilkan oleh pertukaran ion antara cairan ektraseluler dan cairan di dalam sel, yaitu sitosol.[35] Elektrolit keluar masuk melalui protein di dalam membran sel yang disebut saluran ion. Contohnya, yaitu pada proses kontraksi otot yang ditentukan oleh perpindahan kalsium, iodin, dan kalium melalui saluran ion di dalam membran sel dan tubulus T[36]
Logam transisi biasanya terdapat dalam bentuk unsur kelumit di dalam organisme. Seng dan besi adalah unsur paling berlimpah dari kategori tersebut.[37] Logam-logam ini berfungsi sebagai kofaktor pada beberapa jenis protein yang bersifat esensial untuk aktivitas enzim katalase dan protein pembawa protein, yaitu hemoglobin.[38] Kofaktor logam terikat dengan situs spesifik di dalam protein, meskipun akan berubah seiring proses katalisis. Zat ini akan kembali menjadi bentuk semula pada akhir reaksi katalisis. Mikronutrien logam masuk ke dalam organisme dengan menggunakan transporter spesifik dan terikat dengan protein penyimpanan, seperti feritin dan metalotionein ketika tidak digunakan.[39][40]
Katabolisme
Katabolisme adalah serangkaian reaksi pada proses metabolisme yang menguraikan molekul-molekul besar. Reaksi-reaksi yang dimaksud ialah mengurai dan mengoksidasi molekul makanan. Tujuan dari reaksi katabolik adalah untuk menyediakan energi dan komponen yang dibutuhkan oleh reaksi anabolik untuk rangka menyusun molekul.[41] Keadaan alamiah suatu reaksi katabolis berbeda-beda tergantung organismenya. Organisme-organisme tersebut dapat diklasifikasikan berdasarkan sumber energi dan karbon (pengelompokan sumber nutrisi primer) yang dapat dilihat pada tabel dibawah. Molekul organik digunakan sebagai sumber energi oleh kelompok organotrof, sedangkan litotrof menggunakan molekul anorganik sebagai substratnya. Fototrof menangkap sinar matahari sebagai sumber energi kimiawi.[42] Walaupun begitu, seluruh bentuk reaksi metabolisme yang berbeda bergantung pada reaksi redoks yang melibatkan transfer elektron dari donor molekul yang telah tereduksi, seperti molekul organik, air, amonia, hidrogen sulfida atau ion fero terhadap molekul aseptor, yaitu oksigen, nitrat, atau sulfat.[43]
Klasifikasi organisme berdasarkan metabolismenya[44]
| Sumber Energi | cahaya matahari | foto- | -trof | ||
| molekul yang belum terbentuk | kemo- | ||||
| Donor elektron | Senyawa organik | organo- | |||
| Senyawa anorganik | lito- | ||||
| Carbon source | Senyawa organik | hetero- | |||
| Senyawa anorganik | auto- | ||||
Pada umumnya, reaksi katabolis pada hewan dapat dibedakan menjadi tiga tahap utama. Pertama, makromolekul seperti protein, polisakarida, dan lipid dicerna menjadi komponen yang lebih kecil di luar sel. Selanjutnya, molekul-molekul kecil ini diambil oleh sel untuk dikonversi menjadi molekul yang lebih kecil lagi yang biasanya dalam bentuk asetil koenzim A (Asetil-KoA) yang menghasilkan energi. Akhirnya, gugus asetil pada KoA dioksidasi oleh air dan karbondioksida melalui proses siklus asam sitrat dan rantai transpor elektron yang menghasilkan energi yang telah tersimpan dengan cara mereduksi nikotinamida adenina dinukleotida (NAD+) menjadi NADH.[45]
Pencernaan

Makromolekul, seperti pati, selulosa atau protein tidak dapat langung masuk ke dalam sel sehingga harus diurai menjadi ukuran lebih kecil untuk dapat digunakan dalam reaksi metabolisme di dalam sel. Beberapa kelompok enzim berbeda berfungsi mencerna polimer-polimer tersebut. Enzim-enzim pencernaan tersebut ialah protease yang mencerna protein menjadi asam amino , sekaligus kelompok enzim glikosida hidrolase yang mencerna polisakarida menjadi gula yang lebih sederhana, yaitu monosakarida.[46]
Mikroorganisme menghasilkan enzim pencernaan ke sekelilingnya,[47][48] sedangkan hewan menghasilkan enzim dari sel spesifik di dalam usus, termasuk di antaranya lambung dan pankreas serta kelenjar saliva.[49] Asam amino dikeluarkan oleh enzim ekstraseluler, lalu dipompa ke dalam sel oleh protein transpor aktif.[50][51]
Katabolisme karbohidrat
Glikolisis
Glikolisis adalah proses metabolisme yang mengubah glukosa menjadi piruvat, menghasilkan dua mol ATP, dua mol NADH, dan dua mol asam piruvat per mol glukosa.[52] Glikolisis dimulai dengan pengambilan glukosa ekstraseluler dan pengolahan glukosa intraseluler berikutnya dalam sitosol untuk akhirnya menghasilkan piruvat bersama dengan berbagai produk lainnya yang akan dikonversi menjadi ATP sebagai sumber energi.[53] Asam piruvat merupakan senyawa intermediat pada beberapa lintasan metabolis. Mayoritasnya dipakai dalam keadaan aerobik untuk dikonversi menjadi asetil-KoA dalam proses glikolisis yang selanjutkan dipakai dalam siklus asam sitrat. Meskipun sebagian besar ATP dihasilkan dari siklus asam sitrat tetapi NADH merupakan produk terpenting. NADH diproduksi melalui oksidasi asetil-Koa menggunakan bahan baku NAD+Proses oksidasi ini mengeluarkan karbondioksida sebagai zat sisanya.[54] Dalam kondisi anaerobik, piruvat direduksi menjadi laktat oleh laktat dehidrogenase. Dengan adanya oksigen, mitokondria dapat sepenuhnya mengoksidasi piruvat dan NADH dari glikolisis, menghasilkan hingga 36 mol ATP per mol glukosa menggunakan fosforilasi oksidatif.[55]
Lintasan pentosa fosfat
Lintasan pentosa fosfat atau lintasan fosfoglukonat adalah lintasan alternatif penguraian glukosa yang terjadi di sitosol dan menyediakan beberapa tujuan utama yang mendukung proliferasi dan kelangsungan hidup sel. Pertama, dan yang paling terkenal, lintasan pentosa fosfat memungkinkan pengalihan senyawa antara dari lintasan glikolitik menuju produksi prekursor nukleotida dan asam amino yang diperlukan untuk pertumbuhan dan proliferasi sel. lintasan ini melibatkan cabang nonoksidatif dari lintasan pentosa fosfat. Fungsi kunci kedua dari lintasan pentosa fosfat yaitu menghasilkan reduksi ekuivalen NADPH, yang memiliki peran penting dalam pemeliharaan lingkungan redoks seluler yang menguntungkan dan juga diperlukan untuk sintesis asam lemak. lintasan ini melibatkan cabang oksidatif dari cabang pentosa fosfat.[56]
Glikogenolisis
Glikogen adalah bentuk penyimpanan polimer dari senyawa glukosa. Glikogenolisis yaitu proses pemecahan glikogen yang terjadi di sel otot dan sel hati dalam merespons hormon epinefrin dan glukagon. Pada kondisi kelaparan atau bahaya, tubuh membutuhkan glukosa dalam jumlah yang tinggi. Kondisi ini menyebabkan sel alfa pankreas akan merilis glukagon, sementara itu kelenjar adrenal akan merilis epinefrin. Di dalam hati, glukagon dan epinefrin berikatan pada GPCR yang berbeda, namun keduanya berinteraksi dan mengaktifkan subunit protein alfa Gs yang sama. Karena itu, kedua hormon menghasilkan respons metabolisme yang sama, yaitu aktivasi adenilat siklase dan peningkatan level cAMP.[57]
Glikogenolisis melibatkan proses pembuangan residu glukosa dari satu ujung polimer dengan reaksi fosforolisis, yang dikatalisis oleh glikogen fosforilase (GP) untuk menghasilkan glukosa-1-fosfat. Glukosa-1-fosfat selanjutnya dikonversi menjadi glukosa-6-fosfat. Proses ini terjadi baik di sel otot maupun sel hati. Pada sel otot, glukosa-6-fosfat masuk ke dalam siklus glikolisis dan dimetabolisme mejadi ATP yang digunakan untuk kontraksi otot. Sedangkan di sel hati, glukosa-6-fosfat diubah menjadi glukosa. Kondisi ini disebabkan oleh enzim bernama fosfatase yang ada di sel hati . Enzim ini mampu menghidrolisis glukosa-6-fosfat menjadi glukosa sehingga di hati, penyimpanan glikogen diuraikan menjadi glukosa, lalu dengan cepat dikeluarkan ke darah, lalu disebar ke jaringan lain, seperti otot dan otak, untuk memberi makan sel-sel tersebut.[57]
Kinase protein A (PKA) aktif mendorong konversi glikogen menjadi glukosa-1-fosfat melalui dua cara yaitu menghambat sintesis glikogen dan menstimulasi degradasi glikogen. Untuk cara pertama, PKA memfosforilasi enzim penting dalam sintesis glikogen yaitu glikogen sintase (GS), di mana jika enzim ini difosforilasi (diberi fosfat) membuat enzim tidak aktif. Untuk cara kedua, PKA memfosforilasi enzim perantara penting, yaitu glikogen fosforilase kinase (GPK). Bedanya dengan enzim GS, fosforilasi justru membuat GPK aktif. GPK yang aktif ini kemudian memfosforilasi enzim berikutnya yaitu glikogen fosforilase (GP) pada residu serin14 yang selanjutnya memecah glikogen menjadi glukosa-1-fosfat.[57]
Katabolisme lipid
Oksidasi asam lemak
lintasan oksidasi asam lemak memungkinkan konversi asam lemak yang ada di mitokondria menjadi banyak produk yang selanjutnya dapat digunakan sel untuk menghasilkan energi, termasuk asetil-KoA, NADH dan FADH2. Langkah awal oksidasi asam lemak adalah 'aktivasi' asam lemak dalam sitosol melalui reaksi yang diperantarai enzim dengan ATP untuk akhirnya menghasilkan asam lemak asil-KoA. Mekanisme oksidasi asam lemak selanjutnya tergantung pada panjang ekor alifatik dalam asam lemak.[56]
Asam lemak rantai pendek, yang didefinisikan memiliki kurang dari enam karbon di ekor alifatik bisa berdifusi masuk ke mitokondria secara pasif. Pertama-tama, asam lemak rantai panjang dan sedang harus dalam kondisi terkonjugasi ke karnitina melalui karnitina palmitoiltransferase I (CPT1). Setelah ini, asam lemak rantai panjang terkonjugasi karnitina kemudian dipindahkan ke mitokondria di mana ia diubah kembali menjadi asam lemak asil-KoA melalui penghilangan karnitina oleh karnitina palmitoil transferase II (CPT2). Pada tahap ini, β-oksidasi asam lemak asil-CoA dimulai, menghasilkan sejumlah besar asetil-KoA, NADH dan FADH2 yang selanjutnya digunakan dalam siklus TCA dan rantai transpor elektron untuk menghasilkan ATP.[56]
CPT1 A bertindak sebagai langkah regulator utama dalam reaksi oksidasi asam lemak, karena membatasi laju yang dihambat oleh zat intermediat sintesis lipid malonil-KoA, sehingga mencegah reaksi oksidasi lipid ketika sel secara aktif mensintesis lipid. Secara keseluruhan, oksidasi asam lemak dapat memungkinkan produksi ATP dalam jumlah yang luar biasa. Reaksi oksidasi β lengkap dari molekul palmitat tunggal (asam lemak utama dalam sel mamalia) yang memiliki potensi untuk menghasilkan lebih dari 100 molekul ATP.[56]
Pemecahan kolesterol
Pada orang dewasa, banyak jaringan mampu menyintesis kolesterol. Produk hewani merupakan sumber kolesterol, sedangkan tumbuhan tidak memiliki kolesterol. Namun, membran pada sel tumbuhan mengandung fitosterol, yang secara struktural mirip dengan kolesterol dan berguna dalam pengobatan diet hiperkolesterolemia karena mereka berkompetisi saat penyerapan kolesterol. Hati dan usus merupakan situs kuantitatif yang paling penting untuk metabolisme kolesterol pada manusia, meskipun sejumlah kecil kolesterol juga hilang melalui siklus pergantian kulit.[58]
Katabolisme asam amino
Metabolisme asam amino memiliki beberapa peran penting dalam beberapa aspek biologis pada sel. Bermacam-macam jenis asam amino berperan dalam lintasan metabolis yang beragam yang menggunakannya sebagai substrat. Asam amino digunakan dalam proses sintesis protein dan biomolekul lainnya atau dioksidasi menjadi urea dan karbondioksida sebagai sumber energi. Glutamina dapat berperan aktif dalam proliferasi sel sebagai sumber alternatif pada siklus asam sitrat yang berfungsi untuk mendukung produksi ATP atau sumber sitrat pada reaksi sintesis asam lemak. Asam amino lainnya, seperti arginina dan triptofan dimetabolisasi melalu lintasan yang berbeda untuk mendukung proliferasi sel dan pertumbuhan anabolis.[56][59]
lintasan oksidasi gugus asam amino dimulai dengan melepaskan gugus amina oleh enzim transaminase. Gugus amina masuk ke dalam siklus urea yang meninggalkan rangka karbon yang telah dideaminasi dalam bentuk asam keto. Beberapa asam keto menjadi intermediat di dalam siklus asam sitrat, seperti deaminasi glutamat menjadi bentuk alfa-ketoglutarat. Asam amino glukogenik dapat dikonversi menjadi glukosa dalam proses glukoneogenesis.[60]
Transformasi energi
Fosforilasi oksidatif

Pada reaksi fosforilasi oksidatif, elektron dilepas dari molekul organik seperti NADH dan FADH2, lalu dipindahkan ke oksigen dan energi yang dihasilkan akan digunakan untuk membuat ATP.[12] Reaksi ini berlangsung pada eukariota melalui protein berantai di dalam membran di mitokondria yang disebut dengan nama rantai transpor elektron, sedangkan pada prokariota, protein-protein ini ditemukan pada membran dalam.[61] Protein-protein ini menggunakan energi yang dikeluarkan dari elektron yang lewat yang
berasal dari molekul yang tereduksi, seperti NADH ke dalam oksigen untuk memompa proton melewati membran.[62]
Proton yang dipompa keluar dari mitokondria menciptakan perbedaan konsentrasi melewati membran yang menghasilkan gaya gerak proton.[63] Gaya ini menggerakkan proton kembali ke dalam mitokondria melalui basa sebuah enzim yang disebut dengan ATP Sintase. Aliran proton membuat tangkai subunit berotasi sehingga menyebabkan situs aktif domain sintase berubah bentuk dan memosforilasi adenosina difosfat menjadi ATP [27]
Energi dari senyawa anorganik
Kemolitotrof adalah jenis metabolisme yang ditemukan pada prokariota yang menggunakan energi yang didapatkan dari proses oksidasi senyawa anorganik. Organisme ini dapat menggunakan hidrogen,[64] senyawa belerang yang tereduksi (sulfida, hidrogen sulfida dan tiosulfat),[65] besi (II) oksida[66] atau amoniak[67] sebagai sumber energi dengan mengoksidasi senyawa tersebut dengan elektron aseptor, seperti oksigen atau nitrit.[68] Proses mikrobial ini penting bagi daur biogeokimia , seperti asetogenesis, nitrifikasi dan denitrifikasi sekaligus berfungsi penting untuk kesuburan tanah [69][70]
Energi dari cahaya
Energi yang berasal dari sinar matahari ditangkap oleh tumbuhan, sianobakteri, bakteri ungu,chlorobi dan beberapa jenis protista. Proses ini dipasangkan dengan konversi karbondioksida menjadi senyawa organik sebagai bagian proses fotosintesis. Penangkapan energi dan fiksasi karbon bisa beroperasi secara terpisah pada prokariota , sedangkan bakteri ungu fdan chlorobi bisa menggunakan sinar matahari sebagai sumber energi , ketika menukar reaksi di antara reaksi fiksasi karbon atau fermentasi senyawa organik.[71][72]
Pada banyak organisme, penangkapan energi sinar matahari memilik prinsip yang sama dengan fosforilasi oksidatif yang melibatkan penyimpanan energi sebagai gradien konsentrasi proton. Gaya gerak proton ini lah yang akan menggerakan sintesis ATP[73].Elektron yang dibutuhkan untuk menggerakan rantai transpor elektron berasal dari protein yang mengumpulkan cahaya yang disebut pusat reaksi fotosintesis. Kelompok pusat reaksi ini dibagi menjadi dua tipe tergantung sifat pigmen fotosintesisnya di mana bakteri hanya memiliki satu tipe, sedangkan tumbuhan dan sianobakteri punya dua[74]
Pada tumbuhan, alga, dan sianobakteri, fotosistem II menggunakan energi cahaya untuk melepaskan elektron dari molekul air dan melepaskan oksigen sebagai zat sisa. Lalu, elektron masuk ke dalam kompleks sitokrom b6f yang menggunakan energi tersebut untuk memompa proten melewati membran tilakoid yang ada di dalam membran kloroplas. .[75] Proton ini kembali melalui membran untuk menggerakan ATP sintase seperti sebelumnya.Elektron masuk melalui fotosistem I dan bisa juga digunakan untuk mereduksi koenzim NADP+[76] Koenzim ini dapat digunakan di dalam siklus Calvin atau didaur ulang untuk menghasilkan ATP selanjutnya.
Anabolisme
Anabolisme adalah sekelompok proses reaksi metabolis yang menggunakan energi yang dihasilkan dari proses katabolisme untuk menyintesis molekul kompleks. Pada umumnya, molekul kompleks terdiri dari struktur seluler yang disusun secara bertahap dari prekursor yang kecil dan sederhana. Anabolisme melibatkan tiga tahap dasar. Pertama, sintesis prekursor, seperti asam amino, monosakarida dan isoprenoid, dan nukleotida. Tahap kedua ialah aktivasi bentuk reaktif menggunakan energi yang berasal dari ATP. Tahap ketiga ialah penyusunan prekursor menjadi molekul yang lebih kompleks, seperti protein, polisakarida , lipid, dan asam nukleat.[77]
Anabolism di dalam organisme dapat berbeda tergantung bahan baku konstruksi molekul yang terjadi di dalam sel organisme tersebut. Autotrof seperti tanaman dapat menyusun molekul organik kompleks di dalam sel seperti polisakarida dan protein hanya dari molekul sederhana seperti karbondioksida dan air. Sedangkan, Heterotrof membutuhkan senyawa yang lebih kompleks dibandingkan autotrof, seperti monosakarida dan asam amino untuk menghasilkan molekul yang lebih kompleks. Organisme ini dapat diklasifikasikan lebih jauh dengan berdasarkan sumber energi , yaitu fotoautotrof and fotoheterotrof yang mendapatkan energi dari cahaya, sedangkan kemoautotrof dan kemoheterotrof mendapatkan energi dari reaksi oksidasi senyawa anorganik.[77]
Fiksasi karbon

perbFotosintesis adalah reaksi sintesis karbohidrat dari cahaya dan karbondioksida. Pada tanaman, sianobakteri dan alga, fotosintesis oksigenik menguraikan molekul air,dengan oksigen sebagai zat sisa.Proses ini menggunakan ATP dan NADPH yang diproduksi oleh pusat reaksi fotosintesis untuk mengonversi CO2 menjadi gliserat-3-fosfat yang akan dikonversi menjadi glukosa. Reaksi fiksasi karbon ini akan dibantu oleh enzim Rubisco sebagai bagian siklus Calvin[78] Ada tiga tipe fotosintesis yang terjadi pada tanaman, yaitu fiksasi karbon C3, C4 dan Fotosintesis CAM. Perbedaan ketiga tipe tanaman dapat dibedakan dari lintasan masuknya karbondioksida ke dalam siklus Calvin.Tanaman C3 memiksasi CO2 secara langsung, sedangkan C4 dan CAM memasukkan CO2 ke dalam senyawa lain terlebih dahulu sebagai bentuk adaptasi terhadap sinar matahari yang menyengat atau kondisi kering atau kurang air.[79]
Pada prokariota fotosintetik, mekanisme fiksasi karbon lebih beragam. Fiksasi dapat terjadi dengan beberapa reaksi seperti, siklus Calvin, siklus Krebs terbalik,[80] atau karboksilasi asetil-KoA [81].[82] Prokariota kemoautotrof juga memiksasi melalui siklus Calvin tetapi menggunakan energi dari senyawa anorganik untuk menggerakkan reaksi.[83]
Karbohidrat and glikan
Pada proses anabolisme karbohidrat, asam organik sederhana dapat dikonversi menjadi monosakarida seperti glukosa, dan dapat disusun menjadi polisakarida seperti pati. Produksi glukosa dapat dilakukan menggunakan bahan baku asam piruvat, asam laktat, gliserol, gliserat-3-fosfat dan asam amino dalam reaksi yang disebut glukoneogenesis. Glukoneogenesis mengonversi asam piruvat menjadi glukosa-6-fosfat melalui serangkaian senyawa intermediat yang ada juga di dalam reaksi glikolisis[53]
Meskipun begitu, lintasan ini tidak sama dengan reaksi glikolisis yang berlangsung secara terbalik karena beberapa langkah dalam reaksi ini dikatalisis oleh enzim non-glikolitik. Kondisi ini penting untuk memungkinkan pembentukan dan penguraian glukosa berjalan dalam siklus yang berbeda dan mencegah terjadinya kedua lintasan berjalan secara bersamaan di dalam sebuah siklus yang sia-sia.[84][85] Dalam keadaan berlimpah, glukosa dapat dikoversi menjadi glikogen melalui reaksi yang disebut glikogenesis sebagai bentuk penyimpanan energi selain lemak yang biasanya digunakan untuk mempertahankan glukosa di dalam darah[86]
Polisakarida dan glikan tersusun dengan penambahan secara bertahap suatu monosakarida oleh reaksi glikosiltransferase dari gula pendonor aktif fosfat, seperti uridina difosfat glukosa (UDP-Glc) terhadap suatu gugus hidroksil aseptor pada polisakarida yang diinginkan. Selama gugus hidroksil pada cincin subtrat dapat menjadi aseptor, polisakarida yang diproduksi akan memiliki cabang struktur yang lurus atau bercabang.[87] Polisakarida yang terbentuk dapat memiliki fungsi pada bentuk aslinya atau dapat dipindahkan ke lipid atau protein menggunakan enzim oligasakariltransferase[88][89]
Sintesis lipid
biLintasan sintesis asam lemak memungkinkan sel untuk menghasilkan lipid yang diperlukan untuk pertumbuhan sel dan proliferasi dari prekursor yang berasal dari lintasan metabolisme intrinsik lainnya. Aktivitas lintasan sintesis asam lemak sangat terkait dengan pensinyalan mTOR, yang telah terbukti mendorong sintesis asam lemak melalui regulasi banyak enzim utama yang bertanggung jawab untuk sintesis lipid de novo, termasuk SREBP (protein pengikat elemen pengatur sterol), FASN (asam lemak sintase) dan ACC (asetil-KoA karboksilase) yang diinduksi oleh SREBP.[56] Enzim pada proses biosintesis asam lemak dibagi menjadi dua kelompok. Pada fungi dan hewan, seluruh reaksi asam lemak sintase dilakukan oleh satu jenis protein tunggal multifungsi yang mengandung semua pusat reaksi di dalamnya yang disebut FAS I. Plastid tumbuhan, bakteri dan parasit memiliki sistem terpisah yang setiap komponennya disandi oleh gen berbeda yang menghasilkan suatu protein unik yang mengkatalisis satu langkah di dalam lintasan tersebut yang diberi nama FAS II.[90][91]
Sintesis asam lemak menggunakan produk yang berasal dari beberapa lintasan metabolisme lainnya, terutama glikolisis, siklus TCA, dan lintasan pentosa fosfat. Untuk sintesis asam lemak rantai lurus, asam sitrat yang berasal dari siklus TCA dapat diekspor dari mitokondria ke sitosol melalui pembawa sitrat, di mana ATP sitrat liase mengubahnya menjadi asetil-koA, bersama dengan oksaloasetat. Asetil-KoA yang berasal dari proses ini kemudian dapat dikarboksilasi oleh ACC untuk menghasilkan malonil-KoA. Selanjutnya, FASN bertindak dalam cara yang tergantung pada NADPH untuk memperpanjang rantai asam lemak yang baru terbentuk sampai produk seperti asam palmitat disintesis. Asam lemak dengan panjang rantai alternatif dapat disintesis menggunakan asam palmitat sebagai substrat untuk pemanjangan, sementara reaksi desaturasi dapat dilakukan untuk menghasilkan asam lemak tak jenuh.[56] Sintesis asam lemak rantai cabang berbeda dengan sintesis asam lemak lurus, yaitu membutuhkan asam amino rantai cabang seperti valin dan leusin sebagai substrat untuk perpanjangan. Lebih lanjut, asam lemak dapat dikondensasikan dengan gliserol produk dari glikolisis untuk menghasilkan banyak kemungkinan kombinasi triasilgliserol dan fosfolipid, yang merupakan komponen kunci dari banyak struktur seluler.[56]
Selain asam lemak, proses anabolisme juga terjadi pada mamalia juga yang menggunakan gliserol dalam bentuk G-3-P yang dihasilkan dari reaksi fosforilasi gliserol oleh gliserol kinase atau reduksi dihidroksiaseton fosfat menggunakan enzim gliseraldehida 3-fosfat dehidrogenase. Dihidroksiasaseton fosfat dapat diturunkan dari senyawa glukosa atau piruvat. Pada kondisi normal, trigliserida atau gliserol-3-fosfat dihasilkan dari proses glikolisis dengan prekursor glukosa. Akantetapi, ketika konsentrasi glukosa menurun di dalam sitosol, gliserol dihasilkan dari proses reaksi gliseroneogenesis. Reaksi ini menggunakan asam piruvat, asam laktat, alanina, dan anion dari siklus asam sitrat sebagai prekursor pengganti. Fosfoenolpiruvat karboksikinase (PEPC-K) adalah enzim regulator utama yang berfungsi sebagai katalisator reaksi dekarboksilasi oksaloasetat menjadi fosfoenolpiruvat .[92]
Terpena adalah kelompok lipid ,seperti karotenoid yang membentuk kelompok terbesar produk alami dari tumbuhan.[93] Senyawa ini disusun atas susunan dan modifikasi unit isoprena yang diberikan oleh prekursor reaktif isopentenil pirofosfat dan dimetilalil pirofosfat [94] Prekursor ini dapat disusun dengan dua cara. Pada hewan dan arkea, lintasan mevalonat menghasilkan senyawa ini dari asetil KoA,[95] sedangkan pada tumbuhan dan bakteri, piruvat dan (G-3-P) digunakan sebagai substrat pada lintasan nonmevalonat .[94][96] Salah satu reaksi penting yang mengunakan donor isoprena aktif ini adalah biosintesis sterol. Reaksi ini menyatukan unit isoprena untuk menyusun skualena, lalu dilipat dan membentuk kelompok cincin yang menyusun lanosterol[97] Lanosterol bisa dikonversi menjadi sterol lainnya, seperti kolesterol dan ergosterol [97][98]
Fosfatidilkolin merupakan kelompok fosfolipid yang disintesis melalui lintasan sitidin 5-difosfat (CDP)-kolin yang memfosforilasi kolin i menjadi fosfokolin oleh kolin kinase kemudian dikonversi menjadi CDP-kolin oleh CPT:fosfokolin sitidiltransferase. Selanjutnya, CDP-kolin dikombinasikan dengan diasilgliserol oleh dua enzim yang terintegrasi ke retikulum endoplasma: CDP-kolin:1,2-diasilgliserol kolinfosfotransferase (CPT) dan CDP-kolin: 1,2-diasilgliserol kolin/etanolamin fosfotransferase (CEPT). lintasan CDP-kolin terdapat di semua sel mamalia berinti. Namun, di hati, hingga 30% fosfatidilkolin dihasilkan oleh konversi fosfatidletanolamin menjadi fosfatidilkolin oleh fosfatidiletanolamin N-metiltransferase (PEMT).[99] Selain sintesis fosfatidlkolin, fosfatidiletanolamin juga merupakan golongan fosfolipdid yang disintesis makhluk hidup melalui dua lintasan utama: lintasan CDP-etanolamin di retikulum endoplasma dan lintasan fosfatidilserin dekarboksilase (PSD) di mitokondria. lintasan CDP-etanolamin mirip dengan sintesis fosfatidilkolin. Fosfoetanolamin diubah menjadi CDP-etanolamin oleh CTP:fosfoetanolamin sitidiltransferase kemudian ditambahkan ke diasilgliserol oleh CEPT untuk membentuk fosfatidiletanolamin. lintasan PSD terjadi secara eksklusif di mitokondria, di mana fosfatidilserin didekarboksilasi oleh PSD untuk membentuk fosfatidiletanolamin. Sintesis fosfatidilserin, yang dikendalikan oleh dua sintase fosfatidilserin, merupakan langkah pembatas laju untuk sintesis fosfatidiletanolamin pada lintasan PSD.[99]

Protein
Organisme memiliki kemampuan berbeda untuk mensintesis 20 jenis asam amino. Sebagian besar bakteri dan tumbuhan mampu semua jenis 20 asam amino. Namun, mamamalia hanya mampu mensintesis 11 asam amino nonesensial, sedangkan 9 asam amino esensial lainnya didapatkan dari makanan.[100] Beberapa parasit sederhana, seperti bakteri Mycoplasma pneumoniae, tidak mempunyai kemampuan untuk mensintesis seluruh asam amino dan mengambil asam amino langsung dari inangnya.[101] Seluruh asam amino disintesis dari senyawa intermediat di dalam proses reaksi glikolisis, siklus asam sitrat atau lintasan pentosa fosfar, Nitrogen disediakan oleh asam glutamat dan glutamina. Sintesis asam amino non esensial bergantung pada pembentuk asam alfa-keto yang sesuai yang akan ditransaminasi untuk membentuk asam amino.[102]
Asam amino disusun menjadi protein yang disatukan bersama menjadi sebuah rantai ikatan peptida. Tiap protein yang berbeda memiliki sekuens yang unik dari residu asam amino yang merupakan struktur primernya . Asam amino dapat disambungkan dalam sekuens yang beragam untuk membentuk banyak variasi protein. Protein disusun dari asam amino yang diaktivasi oleh penempelan olem molekul Transfer RNA melalui ikatan ester.Prekursor aminoasil-tRNA dihasilkan oleh sebuah reaksi yang menggunakan ATP yang dilakukan oleh enzim sintetase aminoasll-tRNA [103] Selanjutnya, aminoasil-tRNA ini menjadi substrat untuk ribosom yang menyatukan asam amino menjadi rantai protein memanjang menggunakan sekuens yang ada di dalam MRNA.[104][105]
Sintesis nukleotida dan penghematan
Nukleotida disusun dari asam amino, karbondioksida dan asam format di lintasan yang membutuhkan energi metabolis dalam jumlah besar.[106][107] Karena itu, sebagian besar organisme mempunyai sistem yang efisien untuk menghemat nukleotida yang belum terbentuk.[106][107][108]Purina disintesis menjadi nukleosida ( basa yang melekat kepada ribosa)[109] Adenina dan guanina disusun dari prekursor nukleosida inosina monofosfat yang disintesis menggunakan atom dari asam amino glisina, glutamina dan asam aspartat serta asam format yang dipindahkan dari koenzim tetrahidrofolat. Sedangkan, pirimidina disintesis dari basa orotat yang dibentuk dari glutamina dan asam aspartat.[110]
Xenobiotika dan metabolisme redoks
Seluruh organisme secara konstan terpapar oleh senyawa yang mereka tidak bisa gunakan sebagai nutrisi dan dapat berbahaya, jika berakumulasi di dalam sel karena tidak memiliki fungsi metabolis. Senyawa yang berpotensi membahayakan ini disebut xenobiotik.[111] Xenobiotik, seperti obat sintetis, racun alami, dan antibiotik didetokfisikasi oleh serangkaian enzim metabolis.Pada manusia,termasuk di antaranya sitokrom P450 oksidase,[112][113] UDP-glukuronosiltransferase,[114] and glutation S-transferase.[115] Sistem ini terbagi menjadi tiga langkah. Langkah pertama ialah mengoksidasi xenobiotik (fase I) dan mengonjungasi gugus berbahan dasar air terhadap molekul (fase II). Xenobiotik larut air yang telah temodikasi dapat dipompa keluar dari sel dan organisme multiseluler akan mencerna lebih jauh, sebelum senyawa tersebut dieskresikan (fase III). Pada ilmu ekologi, reaksi ini sangat penting dalam proses biodegradasi polutan oleh mikrob dan bioremediasi lahan yang terkontaminasi serta tumpahan minyak.[116] Banyak reaksi mikrob yang juga ada pada organisme multiseluler. Akan tetapi, dikarenakan diversitas jenis mikrob, organisme ini dapat menangani xenobiotik dalam jangkauan yang lebih luas dibandingkan dengan organisme multiseluler. Organisme ini juga dapat mendegradasi polutan organik persisten seperti senyawa organoklorida.[117]
Masalah serupa untuk xenobiotik terjadi untuk organisme aerobik adalah stres oksidatif.[118] Stres oksidatif dimulai dengan reaksi fosforilasi oksidatif dan pembentukan ikatan disulfida selama pelipatan protein yang menghasilkan spesi oksigen reaktif, seperti hidrogen peroksida [119] Oksidan yang bersifat merusak ini dihilangkan oleh metabolit antioksidan seperti glutation dan enzim katalase dan peroksidase.[120][121]
Termodinamika organisme
Organisme hidup harus mematuhi hukum termodinamika yang mengatur perpindahan panas dan usaha. Hukum termodinamika kedua menyatakan bahwa di dalam sistem tertutup, jumlah entropi tidak dapat berkurang. Walaupun kompleksitas organisme hidup terlihat berkontradiksi terhadap hukum tersebut, kehidupan hanya terjadi karena seluruh organisme merupakan sistem terbuka yang menukar materi dan energi ke lingkungannya. Jadi, sistem kehidupan tidak berada di dalam kesetimbangan, tetapi berada di dalam sistem disipatif yang mempertahankan keadaan kompleksitas tinggi yang menyebabkan peningkatan entropi sekitar.[122] Metabolisme mencapai kondisi ini dengan memasangkan reaksi katabolisme yang spontan dengan reaksi nonspontan dari anabolisme. Pada terminologi termodinamika, metabolisme mempertahankan keteraturan dengan menciptakan ketidakteraturan.[123]
Regulasi dan kontrol
Karena lingkungan sebagian besar organisme terus berubah, reaksi metabolisme harus diatur dengan baik untuk mempertahankan serangkaian kondisi konstan dalam sel. Kondisi ini disebut homeostasis.[124][125] Ada dua konsep yang saling berhubungan dekat dan harus dimengerti untuk memahami bagaimana lintasan metabolisme dapat dikontrol. Pertama, regulasi suatu enzim di dalam lintasan dilihat dari bagaimana aktivitasnya meningkat dan berkurang sebagai respons terhadap sinyal. Kedua, seberapa besar efek perubahan aktivitas yang dilakukan oleh enzim mempunyai pengaruh pada keseluruhan lintasan yang terjadi (jumlah fluks yang terjadi pada lintasan)[126] Misalnya, ketika suatu enzim menunjukkan perubahan yang besar pada suatu aktivitas, tetapi perubahan ini hanya mempunyai efek yang kecil pada fluks yang ada di lintasan metabolisme, maka enzim ini tidak terlibat sebagai kontrol lintasan.[127]

Ada beberapa tingkatan dari regulasi metabolisme. Pada regulasi intrinsik, lintasan metabolisme meregulasi dirinya sendiri sebagai respons terhadap perubahan jumlah substrat atau produk. Misalnya, berkurangnya jumlah produk akan meningkatkan flux yang ada di lintasan sebagai kompensasi.[126] Jenis regulasi ini sering melibatkan regulasi alosterik dari beberapa enzim yang ada di lintasan.[128] Kontrol ekstrinsi melibatkan suatu sel yang ada di dalam organisme multiseluler yang mengubah metabolismenya sebagai respons terhadap sinyal dari sel lain, Sinyal ini biasanya dalam bentuk pengirim pesan larut air, seperti hormon dan faktor pertumbuhan yang dapat dideteksi oleh reseptor spesifik yang ada di permukaan sel.[129] Sinyal ini akan ditransmisikan ke dalam sel oleh sistem penghantar kedua yang biasanya melibatkan reaksi fosforilasi protein.[130]
Suatu contoh yang dapat menggambarkan kontrol ekstrinsik ialah regulasi metabolisme glukosa oleh hormon insulin.[131] Insulin dihasilkan sebagai respons dari kenaikan konsentrasi gula darah. Melekatnya hormon pada reseptor insulin mengaktifkan kinase protein secara berurutan yang menyebabkan sel mengambil glukosa dan mengonversinya menjadi bentuk simpanan glukosa, seperti asam lemak dan glikogen.[132] Metabolisme glikogen dikontrol oleh aktivitas enzim fosforilase yang menguraikan glikogen dan enzim glikogen sintase yang mensintesisnya, Enzim ini diregulasi di dalam sebuah proses timbal balik dengan reaksi fosforilasi yang menghambat glikogen sintase, tetapi mengaktifkan fosforilase. Insulin menyebabkan sintesis glikogen dengan mengaktifkan protein fosfatase dan menganghasilkan penurunan fosfforilasi enzim ini.[133]
Evolusi

Lintasan metabolisme utama yang telah dijelaskan di atas, seperti glikolisis dan siklus asam sitrat ada pada seluruh tiga domain makhluk hidup dan juga ada pada leluhur universal terakhir.[134][135] Sel leluhur universal merupakan prokariota dan mungkin merupakan suatu metanogen yang memiliki metabolisme asam amino, nukleotida, karbohidrat, dan lipid yang ekstensif.[136][137] Retensi keberadaan lintasan purba pada evolusi makhluk hidup setelahnya mungkin merupakan hasil dari reaksi yang memiliki solusi optimum untuk masalah metabolisme tertentu dengan lintasan, seperti glikolisis dan siklus asam sitrat yang menghasilkan produk akhir dengan efisiensi yang tinggi dan dengan langkah dalam jumlah minimum.[138][139] Lintasan metabolisme berbasis enzim pertama mungkin merupakan bagian dari metabolisme nukleotida purina, sedangkan lintasan metabolisme sebelumnya merupakan bagian dari dunia RNA purba.[140]
Banyak model yang diusulkan untuk menjelaskan bagaimana lintasan metabolisme baru berevolusi. Model ini termasuk penambahan secara berurutan enzim baru kepada lintasan purba yang pendek, duplikasi, lalu menyebarkan ke seluruh lintasan sekaligus memasukkan enzim yang telah ada dan menyusunnya menjadi lintasan reaksi yang baru.[141] Kepentingan relatif dari mekanisme ini masih belum jelas, tetapi studi genomika menunjukkan bahwa enzim yang ada di dalam lintasan kemungkinan mempunyai leluhur yang sama. Mekanisme ini menyatakan kemungkinan bahwa banyak lintasan berevolusi secara tahap demi tahap dengan fungsi baru yang diciptakan oleh tahap yang sebelumnya ada di dalam lintasan.[142][143] Sebuah model alternatif berasal dari studi tentang jejak evolusi struktur protein di dalam jaringan metabolisme . Studi ini menyatakan kemungkinan bahwa enzim perlahan bergabung dengan meminjam enzim dengan fungsi yang sama pada jalur metabolisme yang berbeda (ada di dalam basis data MANET)[144] Proses bergabungnya enzim ini menghasilkan sebuah mosaik enzim evolusioner.[145] Kemungkinan ketiga ialah sebagian metabolisme mungkin ada sebagai 'modul' yang dapat digunakan kembali di dalam lintasan berbeda dan melakukan fungsi yang sama pada molekul berbeda[146]
Evolusi juga dapat menyebabkan hilangnya fungsi metabolisme. Sebagai contoh, beberapa proses metabolisme pada parasit yang tidak esensial untuk bertahan hidup menjadi hilang sehingga kebutuhan asam amino, nukleotida, dan karbohidrat mereka ambil dari inang.[147][148] Kondisi yang sama juga dapat dilihat pada organisme endosimbiotik.[149]
Investigasi dan manipulasi

Secara klasik, metabolisme dipelajari dengan pendekatan reduksionis yang berfokus pada lintasan metabolisme tunggal. Pendekatan ini menggunakan pelacak radioaktif pada tingkat organisme, jaringan, atau sel. Lintasan metabolisme dari prekursor hingga produk akhir didefinisikan dengan mengidentifikasi berbagai senyawa intermediat dan produk yang memiliki label senyawa radioaktif.[150] Enzim-enzim yang mengatalisis reaksi-reaksi kimia dimurnikan sehingga kinetika dan responsnya terhadap inhibitor dapat dipelajari. Pendekatan paralel juga dilakukan untuk mengidentifikasi molekul-molekul kecil di dalam sel dan jaringan; serangkaian molekul lengkap ini dikenal dengan nama metabolom. Meskipun dapat memberikan gambaran yang baik tentang struktur dan lintasan metabolisme sederhana, studi ini tidak memadai ketika diterapkan pada sistem yang lebih kompleks, seperti metabolisme pada sebuah sel lengkap.[151]
Kompleksitas jejaring metabolisme di dalam sel yang mengandung ribuan enzim berbeda dapat dilihat pada ilustrasi yang menampilkan reaksi 43 protein dan 40 metabolit: urutan genom pada gambar tersebut mengandung hingga 26.000 gen.[152] Data genomika seperti ini dapat digunakan untuk mengonstruksi kembali jejaring reaksi biokimia yang lengkap dan menghasilkan model matematika yang lebih komprehensif untuk menjelaskan dan memprediksi bagaimana reaksi ini bekerja.[153] Model ini ampuh ketika digunakan untuk mengintegrasikan data lintasan dan metabolit yang didapatkan melalui metode klasik dengan data ekspresi gen yang didapatkan dari studi proteomika serta DNA microarray[154] Dengan teknik ini, model metabolisme manusia dapat dibentuk yang selanjutnya mengarahkan penemuan obat dan penelitian biokimia.[155] Model ini juga digunakan dalam analisis jejaring untuk mengklasifikasikan penyakit manusia menjadi kelompok-kelompok berdasarkan kesamaan protein dan metabolit mereka.[156][157]
Jejaring metabolisme bakteri adalah contoh yang sangat baik dari organisasi dasi kupu-kupu,[158][159][160] suatu proses yang masukannya adalah berbagai nutrien yang sangat beragam dan keluarannya adalah berbagai produk dan makromolekul kompleks yang sangat bervariasi meskipun prosesnya hanya melibatkan senyawa intermediat yang jenisnya relatif sedikit. Rekayasa metabolisme merupakan penerapan teknologi paling utama dari informasi ini. Organisme seperti khamir, tumbuhan, dan bakteri direkayasa genetiknya agar mereka lebih berguna dalam proses bioteknologi dan produksi obat-obatan seperti antibotik atau produksi bahan kimia industri seperti etilena glikol dan asam sikimat.[161][162][163]
Lihat pula
Referensi
- ^ (Inggris) "Overview of Metabolism". ElmHurst College. Diakses tanggal 12 Juni 2023.
- ^ "metabolism (n.)". Online Etymology Dictionary (dalam bahasa Inggris). Diakses tanggal 12 Juni 2023.
- ^ Leroi, Armand Marie. (2014). The lagoon : how Aristotle invented science. New York: Bloomsbury. hlm. 400–401. ISBN 978-0-698-17039-1. OCLC 883341616. Diarsipkan dari versi asli tanggal 2020-07-06. Diakses tanggal 2020-07-24.
- ^ Fernie, Alisdair R.; Pichersky, Eran (2015). "Focus Issue on Metabolism: Metabolites, Metabolites Everywhere". Plant Physiology. 169 (3): 1421–1423. doi:10.1104/pp.15.01499. ISSN 1532-2548. PMC 4634105
 . PMID 26531677.
. PMID 26531677.
- ^ Eknoyan, Garabed (1999). "Santorio Sanctorius (1561–1636) – Founding Father of Metabolic Balance Studies". American Journal of Nephrology (dalam bahasa english). 19 (2): 226–233. doi:10.1159/000013455. ISSN 0250-8095. PMID 10213823.
- ^ William HA (1904). Modern Development of the Chemical and Biological Sciences. A History of Science: in Five Volumes. IV. New York: Harper and Brothers. hlm. 184–185.
- ^ Manchester, Keith L. (Desemer 1995). "Louis Pasteur (1822–1895) — chance and the prepared mind". Trends in Biotechnology (dalam bahasa Inggris). 13 (12): 511–515. doi:10.1016/S0167-7799(00)89014-9. ISSN 0167-7799. Diarsipkan dari versi asli tanggal 2018-11-07. Diakses tanggal 2020-07-28.
- ^ Kinne-Saffran, E.; Kinne, R. K. H. (1999). "Vitalism and Synthesis of Urea". American Journal of Nephrology (dalam bahasa english). 19 (2): 290–294. doi:10.1159/000013463. ISSN 0250-8095. PMID 10213830.
- ^ Barnett, James A.; Lichtenthaler, Frieder W. (2001). "A history of research on yeasts 3: Emil Fischer, Eduard Buchner and their contemporaries, 1880–1900". Yeast (dalam bahasa Inggris). 18 (4): 363–388. doi:10.1002/1097-0061(20010315)18:43.0.CO;2-R. ISSN 1097-0061. Diarsipkan dari versi asli tanggal 2021-02-06. Diakses tanggal 2020-07-28.
- ^ Chawla R (2017). Textbook of Medical Biochemistry (edisi ke-2). New Delhi: Wolters Kluwer India. hlm. 4. ISBN 9789351298250.
- ^ Stone, David (4 Juli 2020). "Chromatography Resources Technique, Theory, and Instrumentation". Analytical Science Resources Instrumentation, Theory, Tutorials, and Virtual Tours. Diakses tanggal 12 Juni 2023.
- ^ a b Cooper, Geoffrey M. (2000). "The Molecular Composition of Cells". The Cell: A Molecular Approach. 2nd edition (dalam bahasa Inggris). Diarsipkan dari versi asli tanggal 2020-08-27. Diakses tanggal 2020-06-25.
- ^ Michie, Katharine A.; Löwe, Jan (2006-06). "Dynamic Filaments of the Bacterial Cytoskeleton". Annual Review of Biochemistry (dalam bahasa Inggris). 75 (1): 467–492. doi:10.1146/annurev.biochem.75.103004.142452. ISSN 0066-4154. Diarsipkan dari versi asli tanggal 2020-02-06. Diakses tanggal 2020-06-06.
- ^ Nelson & Cox 2017, hlm. 187.
- ^ Hothersall, John S.; Ahmed, Aamir (2013-02-04). "Metabolic Fate of the Increased Yeast Amino Acid Uptake Subsequent to Catabolite Derepression". Journal of Amino Acids (dalam bahasa Inggris). doi:10.1155/2013/461901. PMC 3575661
 . PMID 23431419. Diarsipkan dari versi asli tanggal 2020-06-06. Diakses tanggal 2020-06-06.
. PMID 23431419. Diarsipkan dari versi asli tanggal 2020-06-06. Diakses tanggal 2020-06-06.
- ^ Nelson & Cox 2017, hlm. 225.
- ^ Attwood T K, Campbell P N, Parish J H, Smith A D, Stirling J L, Vella F (2006). Oxford dictionary of biochemistry and molecular biology. Cammack, Richard, Ph. D. (edisi ke-Rev. ed). Oxford: Oxford University Press. hlm. 388. ISBN 978-0-19-852917-0. OCLC 65467611.
- ^ "Lipid nomenclature Lip-1 & Lip-2". www.qmul.ac.uk. Diarsipkan dari versi asli tanggal 2020-06-06. Diakses tanggal 2020-06-06.
- ^ Berg JM, Tymoczko, JL, Gatto GJ Jr , Stryer L. (8 April 2015). Biochemistry (edisi ke-8). New York: W. H. Freeman. hlm. 362. ISBN 978-1-4641-2610-9. OCLC 913469736. Diarsipkan dari versi asli tanggal 2019-09-15. Diakses tanggal 2020-06-06.
- ^ Nelson & Cox 2017, hlm. 324-336.
- ^ Raman, Rahul; Raguram, S.; Venkataraman, Ganesh; Paulson, James C.; Sasisekharan, Ram (21 Oktober 2005). "Glycomics: an integrated systems approach to structure-function relationships of glycans". Nature Methods (dalam bahasa Inggris). 2 (11): 817–824. doi:10.1038/nmeth807. ISSN 1548-7105. Diarsipkan dari versi asli tanggal 2022-07-18. Diakses tanggal 2020-06-06.
- ^ Nelson & Cox 2017, hlm. 717-752.
- ^ Sierra, Saleta; Kupfer, Bernd; Kaiser, Rolf (2005-12-01). "Basics of the virology of HIV-1 and its replication". Journal of Clinical Virology. Focus on HIV (dalam bahasa Inggris). 34 (4): 233–244. doi:10.1016/j.jcv.2005.09.004. ISSN 1386-6532. Diarsipkan dari versi asli tanggal 2016-02-25. Diakses tanggal 2020-06-08.
- ^ Wimmer M, Rose I (1978). "Mechanisms of enzyme-catalyzed group transfer reactions". Annu Rev Biochem. 47: 1031–78. doi:10.1146/annurev.bi.47.070178.005123. PMID 354490.
- ^ Mitchell, Peter (Maret 1979). "Compartmentation and Communication in Living Systems. Ligand Conduction: a General Catalytic Principle in Chemical, Osmotic and Chemiosmotic Reaction Systems". European Journal of Biochemistry (dalam bahasa Inggris). 95 (1): 1–20. doi:10.1111/j.1432-1033.1979.tb12934.x. ISSN 1432-1033. Diarsipkan dari versi asli tanggal 2020-10-30. Diakses tanggal 2020-06-09.
- ^ Wimmer, Mary J.; Rose, Irwin A. (1 Juni 1978). "Mechanisms of Enzyme-Catalyzed Group Transfer Reactions". Annual Review of Biochemistry. 47 (1): 1031–1078. doi:10.1146/annurev.bi.47.070178.005123. ISSN 0066-4154. Diarsipkan dari versi asli tanggal 2022-07-18. Diakses tanggal 2020-06-09.
- ^ a b c Dimroth P, von Ballmoos C, Meier T (March 2006). "Catalytic and mechanical cycles in F-ATP synthases: Fourth in the Cycles Review Series". EMBO Rep. 7 (3): 276–82. doi:10.1038/sj.embor.7400646. PMC 1456893
 . PMID 16607397.
. PMID 16607397.
- ^ Dimroth, Peter; von Ballmoos, Christoph; Meier, T (1 Maret 2006). "Catalytic and mechanical cycles in F-ATP synthases". EMBO reports. 7 (3): 276–282. doi:10.1038/sj.embor.7400646. ISSN 1469-221X. PMC 1456893
 . PMID 16607397. Diarsipkan dari versi asli tanggal 2020-06-09. Diakses tanggal 2020-06-09.
. PMID 16607397. Diarsipkan dari versi asli tanggal 2020-06-09. Diakses tanggal 2020-06-09.
- ^ Bonora, Massimo; Patergnani, Simone; Rimessi, Alessandro; De Marchi, Elena; Suski, Jan M.; Bononi, Angela; Giorgi, Carlotta; Marchi, Saverio; Missiroli, Sonia (12 September 2012). "ATP synthesis and storage". Purinergic Signalling (dalam bahasa Inggris). 8 (3): 343–357. doi:10.1007/s11302-012-9305-8. ISSN 1573-9538. PMC 3360099
 . PMID 22528680.
. PMID 22528680.
- ^ Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert (2002). "Vitamins Are Often Precursors to Coenzymes". Biochemistry. 5th edition (dalam bahasa Inggris). Diarsipkan dari versi asli tanggal 2020-12-15. Diakses tanggal 2020-06-09.
- ^ Pollak, Nadine; Dölle, Christian; Ziegler, Mathias (1 Maret 2007). "The power to reduce: pyridine nucleotides – small molecules with a multitude of functions". Biochemical Journal (dalam bahasa Inggris). 402 (2): 205–218. doi:10.1042/BJ20061638. ISSN 0264-6021. PMC 1798440
 . PMID 17295611. Diarsipkan dari versi asli tanggal 2022-06-15. Diakses tanggal 2020-06-09.
. PMID 17295611. Diarsipkan dari versi asli tanggal 2022-06-15. Diakses tanggal 2020-06-09.
- ^ Fatih, Yildiz (2009). Advances in food biochemistry. Boca Raton: CRC Press. hlm. 228. ISBN 978-1-4200-0769-5. OCLC 607553259.
- ^ Heymsfield, S. B.; Waki, M.; Kehayias, J.; Lichtman, S.; Dilmanian, F. A.; Kamen, Y.; Wang, J.; Pierson, R. N. (1991-08-01). "Chemical and elemental analysis of humans in vivo using improved body composition models". American Journal of Physiology-Endocrinology and Metabolism (dalam bahasa Inggris). 261 (2): E190–E198. doi:10.1152/ajpendo.1991.261.2.E190. ISSN 0193-1849.
- ^ "ELECTROLYTE BALANCE". opentextbc. Diarsipkan dari versi asli tanggal 2020-06-02. Diakses tanggal 23 June 2020.
- ^ Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (2000). "The Action Potential and Conduction of Electric Impulses". Molecular Cell Biology. 4th edition (dalam bahasa Inggris). Diarsipkan dari versi asli tanggal 2020-05-30. Diakses tanggal 2020-06-23 – via NCBI.
- ^ Dulhunty, A. F. (2006). "EXCITATION–CONTRACTION COUPLING FROM THE 1950s INTO THE NEW MILLENNIUM". Clinical and Experimental Pharmacology and Physiology (dalam bahasa Inggris). 33 (9): 763–772. doi:10.1111/j.1440-1681.2006.04441.x. ISSN 1440-1681. Diarsipkan dari versi asli tanggal 2021-07-01. Diakses tanggal 2020-06-23.
- ^ Quiroz & Antonio 2018, hlm. 151.
- ^ Craig & Leonard 2019, hlm. 190-196.
- ^ Cousins, Robert J.; Liuzzi, Juan P.; Lichten, Louis A. (2006-08-25). "Mammalian Zinc Transport, Trafficking, and Signals". Journal of Biological Chemistry (dalam bahasa Inggris). 281 (34): 24085–24089. doi:10.1074/jbc.R600011200. ISSN 0021-9258.
- ^ Dunn, Louise L.; Rahmanto, Yohan Suryo; Richardson, Des R. (2007-02-01). "Iron uptake and metabolism in the new millennium". Trends in Cell Biology (dalam bahasa Inggris). 17 (2): 93–100. doi:10.1016/j.tcb.2006.12.003. Diarsipkan dari versi asli tanggal 2020-06-27. Diakses tanggal 2020-06-24.
- ^ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). "How Cells Obtain Energy from Food". Molecular Biology of the Cell. 4th edition (dalam bahasa Inggris). Diarsipkan dari versi asli tanggal 2021-07-05. Diakses tanggal 2020-06-25 – via NCBI.
- ^ Raven, Ja (2009-09-03). "Contributions of anoxygenic and oxygenic phototrophy and chemolithotrophy to carbon and oxygen fluxes in aquatic environments". Aquatic Microbial Ecology (dalam bahasa Inggris). 56: 177–192. doi:10.3354/ame01315. ISSN 0948-3055. Diarsipkan dari versi asli tanggal 2020-06-25. Diakses tanggal 2020-06-25.
- ^ "Electron Source - an overview | ScienceDirect Topics". www.sciencedirect.com. Diarsipkan dari versi asli tanggal 2020-06-25. Diakses tanggal 2020-06-25.
- ^ Madigan, Michael T., Martinko, John M (2006). Brock Mikrobiologie (edisi ke-11., überarb. Aufl). München: Pearson Studium. hlm. 604,621. ISBN 3-8273-7187-2. OCLC 162303067. Diarsipkan dari versi asli tanggal 2020-06-25. Diakses tanggal 2020-06-25.
- ^ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). "How Cells Obtain Energy from Food". Molecular Biology of the Cell. 4th edition (dalam bahasa Inggris). Diarsipkan dari versi asli tanggal 2021-07-05. Diakses tanggal 2020-06-25.
- ^ Demirel, Yaşar, (2016). Energy : production, conversion, storage, conservation, and coupling (edisi ke-Second edition). Cham: Springer. hlm. 431. ISBN 978-3-319-29650-0. OCLC 945435943. Diarsipkan dari versi asli tanggal 2020-08-31. Diakses tanggal 2020-06-26.
- ^ Häse, C. C.; Finkelstein, R. A. (1993-12-01). "Bacterial extracellular zinc-containing metalloproteases". Microbiology and Molecular Biology Reviews (dalam bahasa Inggris). 57 (4): 823–837. doi:10.1128/mmbr.57.4.823-837.1993. ISSN 1092-2172. PMID 8302217. Diarsipkan dari versi asli tanggal 2020-06-27. Diakses tanggal 2020-06-26.
- ^ Gupta, R.; Gupta, N.; Rathi, P. (2004-06-01). "Bacterial lipases: an overview of production, purification and biochemical properties". Applied Microbiology and Biotechnology (dalam bahasa Inggris). 64 (6): 763–781. doi:10.1007/s00253-004-1568-8. ISSN 1432-0614.
- ^ Hoyle, Terence (1997-12-11). "The digestive system: linking theory and practice". British Journal of Nursing (dalam bahasa Inggris). 6 (22): 1285–1291. doi:10.12968/bjon.1997.6.22.1285. ISSN 0966-0461.
- ^ Souba, Wiley W.; Pacitti, Anthony J. (1992-11-01). "Review: How Amino Acids Get Into Cells: Mechanisms, Models, Menus, and Mediators". Journal of Parenteral and Enteral Nutrition (dalam bahasa Inggris). 16 (6): 569–578. doi:10.1177/0148607192016006569. ISSN 1941-2444. Diarsipkan dari versi asli tanggal 2020-06-28. Diakses tanggal 2020-06-26.
- ^ Barrett, Michael P; Walmsleyt, Adrian R; Gould, Gwyn W (1999-08-01). "Structure and function of facultative sugar transporters". Current Opinion in Cell Biology (dalam bahasa Inggris). 11 (4): 496–502. doi:10.1016/S0955-0674(99)80072-6. ISSN 0955-0674. Diarsipkan dari versi asli tanggal 2015-09-24. Diakses tanggal 2020-06-26.
- ^ "Glycolysis Summary". chemistry.elmhurst.edu. Diarsipkan dari versi asli tanggal 2020-06-24. Diakses tanggal 2020-06-27.
- ^ a b Bouché, Clara; Serdy, Shanti; Kahn, C. Ronald; Goldfine, Allison B. (2004-10-01). "The Cellular Fate of Glucose and Its Relevance in Type 2 Diabetes". Endocrine Reviews (dalam bahasa Inggris). 25 (5): 807–830. doi:10.1210/er.2003-0026. ISSN 0163-769X. Diarsipkan dari versi asli tanggal 2020-06-30. Diakses tanggal 2020-06-27.
- ^ Alfarouk, Khalid O.; Verduzco, Daniel; Rauch, Cyril; Muddathir, Abdel Khalig; Bashir, Adil H. H.; Elhassan, Gamal O.; Ibrahim, Muntaser E.; Orozco, Julian David Polo; Cardone, Rosa Angela (2014-12-18). "Glycolysis, tumor metabolism, cancer growth and dissemination. A new pH-based etiopathogenic perspective and therapeutic approach to an old cancer question". Oncoscience (dalam bahasa Inggris). 1 (12): 777. doi:10.18632/oncoscience.109. ISSN 2331-4737. PMC 4303887
 . PMID 25621294.
. PMID 25621294.
- ^ Salway, J. G. (2004). Metabolism at a glance (edisi ke-3rd ed). Malden, Mass.: Blackwell Pub. hlm. 20–21. ISBN 1-4051-0716-2. OCLC 53178315.
- ^ a b c d e f g h O'Neill, Luke A. J.; Kishton, Rigel J.; Rathmell, Jeff (09 2016). "A guide to immunometabolism for immunologists". Nature Reviews. Immunology. 16 (9): 553–565. doi:10.1038/nri.2016.70. ISSN 1474-1741. PMC 5001910
 . PMID 27396447. Diarsipkan dari versi asli tanggal 2019-02-01. Diakses tanggal 2019-02-01.
. PMID 27396447. Diarsipkan dari versi asli tanggal 2019-02-01. Diakses tanggal 2019-02-01.
- ^ a b c Lodish, Harvey; Berk, Arnold; Kaiser, Chris A.; Krieger, Monty; Bretscher, Anthony; Ploegh, HIddle; Amon, Angelika (2016). Molecular cell biology (edisi ke-Eighth edition). New York: WH Freeman and Company. hlm. 705. ISBN 9781464183393. OCLC 949909675.
- ^ Shlomo,, Melmed,; S.,, Polonsky, Kenneth; Reed,, Larsen, P.; Henry,, Kronenberg,. Williams textbook of endocrinology (edisi ke-Thirteenth edition). Philadelphia, PA. ISBN 0323341578. OCLC 932080537.p1664
- ^ Sakami, W; Harrington, H (1963-06). "Amino Acid Metabolism". Annual Review of Biochemistry (dalam bahasa Inggris). 32 (1): 355–398. doi:10.1146/annurev.bi.32.070163.002035. ISSN 0066-4154. Diarsipkan dari versi asli tanggal 2021-03-08. Diakses tanggal 2020-06-30.
- ^ Brosnan, John T. (2000-04-01). "Glutamate, at the Interface between Amino Acid and Carbohydrate Metabolism". The Journal of Nutrition (dalam bahasa Inggris). 130 (4): 988S–990S. doi:10.1093/jn/130.4.988S. ISSN 0022-3166. Diarsipkan dari versi asli tanggal 2010-11-06. Diakses tanggal 2020-06-30.
- ^ "Eukaryotic Cells | Learn Science at Scitable". www.nature.com. Diarsipkan dari versi asli tanggal 2020-08-06. Diakses tanggal 2020-07-01.
- ^ Schultz, Brian E.; Chan, Sunney I. (2001-06-01). "Structures and Proton-Pumping Strategies of Mitochondrial Respiratory Enzymes". Annual Review of Biophysics and Biomolecular Structure. 30 (1): 23–65. doi:10.1146/annurev.biophys.30.1.23. ISSN 1056-8700. Diarsipkan dari versi asli tanggal 2022-07-19. Diakses tanggal 2020-07-01.
- ^ Capaldi R, Aggeler R (2002). "Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor". Trends Biochem Sci. 27 (3): 154–60. doi:10.1016/S0968-0004(01)02051-5. PMID 11893513.
- ^ Friedrich, B.; Schwartz, E. (1993-10-01). "Molecular biology of hydrogen utilization in aerobic chemolithotrophs". Annual Review of Microbiology. 47 (1): 351–383. doi:10.1146/annurev.mi.47.100193.002031. ISSN 0066-4227. Diarsipkan dari versi asli tanggal 2022-07-19. Diakses tanggal 2020-07-02.
- ^ Friedrich, Cornelius G. (-01-01 1997). Poole, R. K., ed. Advances in Microbial Physiology (dalam bahasa Inggris). 39. Academic Press. hlm. 235–289. doi:10.1016/s0065-2911(08)60018-1. ISBN 978-0-12-027739-1. ISSN 0065-2911. Diarsipkan dari versi asli tanggal 2015-09-24. Diakses tanggal 2020-07-02.
- ^ Weber, Karrie A.; Achenbach, Laurie A.; Coates, John D. (01-10-2006). "Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction". Nature Reviews Microbiology (dalam bahasa Inggris). 4 (10): 752–764. doi:10.1038/nrmicro1490. ISSN 1740-1526. Diarsipkan dari versi asli tanggal 2021-03-08. Diakses tanggal 2020-07-02.
- ^ Jetten, Mike S.M.; Strous, Marc; van de Pas-Schoonen, Katinka T.; Schalk, Jos; van Dongen, Udo G.J.M.; van de Graaf, Astrid A.; Logemann, Susanne; Muyzer, Gerard; van Loosdrecht, Mark C.M. (1998-12-01). "The anaerobic oxidation of ammonium". FEMS Microbiology Reviews (dalam bahasa Inggris). 22 (5): 421–437. doi:10.1111/j.1574-6976.1998.tb00379.x. ISSN 1574-6976. Diarsipkan dari versi asli tanggal 2021-12-31. Diakses tanggal 2020-07-02.
- ^ Simon, Jörg (2002-08-01). "Enzymology and bioenergetics of respiratory nitrite ammonification". FEMS Microbiology Reviews (dalam bahasa Inggris). 26 (3): 285–309. doi:10.1111/j.1574-6976.2002.tb00616.x. ISSN 1574-6976. Diarsipkan dari versi asli tanggal 2021-10-19. Diakses tanggal 2020-07-02.
- ^ Barea, José-Miguel; Pozo, María José; Azcón, Rosario; Azcón-Aguilar, Concepción (2005-07-01). "Microbial co-operation in the rhizosphere". Journal of Experimental Botany (dalam bahasa Inggris). 56 (417): 1761–1778. doi:10.1093/jxb/eri197. ISSN 1460-2431. Diarsipkan dari versi asli tanggal 2021-12-31. Diakses tanggal 2020-07-02.
- ^ Conrad, R (1996-12-01). "Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO)". Microbiological reviews (dalam bahasa Inggris). 60 (4): 609–640. doi:10.1128/MMBR.60.4.609-640.1996. ISSN 0146-0749. Diarsipkan dari versi asli tanggal 2020-07-02. Diakses tanggal 2020-07-02.
- ^ van der Meer, Marcel T. J.; Schouten, Stefan; Bateson, Mary M.; Nübel, Ulrich; Wieland, Andrea; Kühl, Michael; de Leeuw, Jan W.; Sinninghe Damsté, Jaap S.; Ward, David M. (2005-07). "Diel Variations in Carbon Metabolism by Green Nonsulfur-Like Bacteria in Alkaline Siliceous Hot Spring Microbial Mats from Yellowstone National Park". Applied and Environmental Microbiology (dalam bahasa Inggris). 71 (7): 3978–3986. doi:10.1128/AEM.71.7.3978-3986.2005. ISSN 0099-2240. PMC 1168979
 . PMID 16000812. Diarsipkan dari versi asli tanggal 2020-07-04. Diakses tanggal 2020-07-03.
. PMID 16000812. Diarsipkan dari versi asli tanggal 2020-07-04. Diakses tanggal 2020-07-03.
- ^ Tichi, Mary A.; Tabita, F. Robert (2001-11-01). "Interactive Control of Rhodobactercapsulatus Redox-Balancing Systems during Phototrophic Metabolism". Journal of Bacteriology (dalam bahasa Inggris). 183 (21): 6344–6354. doi:10.1128/JB.183.21.6344-6354.2001. ISSN 1098-5530. PMC 100130
 . PMID 11591679. Diarsipkan dari versi asli tanggal 2021-03-08. Diakses tanggal 2020-07-03.
. PMID 11591679. Diarsipkan dari versi asli tanggal 2021-03-08. Diakses tanggal 2020-07-03.
- ^ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). "Energy Conversion: Mitochondria and Chloroplasts". Molecular Biology of the Cell. 4th edition (dalam bahasa Inggris). Diarsipkan dari versi asli tanggal 2020-12-15. Diakses tanggal 2020-07-03.
- ^ Allen, J. P.; Williams, J. C. (08-12-1998). "Photosynthetic reaction centers". FEBS Letters (dalam bahasa Inggris). 438 (1-2): 5–9. doi:10.1016/S0014-5793(98)01245-9. ISSN 1873-3468. Diarsipkan dari versi asli tanggal 2022-04-11. Diakses tanggal 2020-07-03.
- ^ Nelson, Nathan; Ben-Shem, Adam (2004-12-01). "The complex architecture of oxygenic photosynthesis". Nature Reviews Molecular Cell Biology (dalam bahasa Inggris). 5 (12): 971–982. doi:10.1038/nrm1525. ISSN 1471-0072. Diarsipkan dari versi asli tanggal 2021-03-08. Diakses tanggal 2020-07-03.
- ^ Munekage, Yuri; Hashimoto, Mihoko; Miyake, Chikahiro; Tomizawa, Ken-Ichi; Endo, Tsuyoshi; Tasaka, Masao; Shikanai, Toshiharu (2004-06). "Cyclic electron flow around photosystem I is essential for photosynthesis". Nature (dalam bahasa Inggris). 429 (6991): 579–582. doi:10.1038/nature02598. ISSN 0028-0836. Diarsipkan dari versi asli tanggal 2022-08-03. Diakses tanggal 2020-07-03.
- ^ a b Mandal, Ananya (2009-11-26). "What is Anabolism?". News-Medical.net (dalam bahasa Inggris). Diarsipkan dari versi asli tanggal 2020-07-05. Diakses tanggal 2020-07-04.
- ^ Miziorko, H M; Lorimer, G H (1983-06). "Ribulose-1,5-Bisphosphate Carboxylase-Oxygenase". Annual Review of Biochemistry (dalam bahasa Inggris). 52 (1): 507–535. doi:10.1146/annurev.bi.52.070183.002451. ISSN 0066-4154. Diarsipkan dari versi asli tanggal 2021-03-08. Diakses tanggal 2020-07-07.
- ^ Dodd, Antony N.; Borland, Anne M.; Haslam, Richard P.; Griffiths, Howard; Maxwell, Kate (2002-04-01). "Crassulacean acid metabolism: plastic, fantastic". Journal of Experimental Botany (dalam bahasa Inggris). 53 (369): 569–580. doi:10.1093/jexbot/53.369.569. ISSN 0022-0957. Diarsipkan dari versi asli tanggal 2020-07-07. Diakses tanggal 2020-07-07.
- ^ Hügler, Michael; Wirsen, Carl O.; Fuchs, Georg; Taylor, Craig D.; Sievert, Stefan M. (2005-05-01). "Evidence for Autotrophic CO2 Fixation via the Reductive Tricarboxylic Acid Cycle by Members of the ε Subdivision of Proteobacteria". Journal of Bacteriology (dalam bahasa Inggris). 187 (9): 3020–3027. doi:10.1128/JB.187.9.3020-3027.2005. ISSN 0021-9193. PMC 1082812
 . PMID 15838028. Diarsipkan dari versi asli tanggal 2020-09-21. Diakses tanggal 2020-07-07.
. PMID 15838028. Diarsipkan dari versi asli tanggal 2020-09-21. Diakses tanggal 2020-07-07.
- ^ Strauss, Gerhard; Fuchs, Georg (1993-08). "Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle". European Journal of Biochemistry (dalam bahasa Inggris). 215 (3): 633–643. doi:10.1111/j.1432-1033.1993.tb18074.x. ISSN 0014-2956.
- ^ Wood, Harland G. (1991-02). "Life with CO or CO 2 and H 2 as a source of carbon and energy". The FASEB Journal (dalam bahasa Inggris). 5 (2): 156–163. doi:10.1096/fasebj.5.2.1900793. ISSN 0892-6638.
- ^ Shively, Jessup M.; van Keulen, Geertje; Meijer, Wim G. (1998-10). "SOMETHING FROM ALMOST NOTHING: Carbon Dioxide Fixation in Chemoautotrophs". Annual Review of Microbiology (dalam bahasa Inggris). 52 (1): 191–230. doi:10.1146/annurev.micro.52.1.191. ISSN 0066-4227. Diarsipkan dari versi asli tanggal 2021-06-07. Diakses tanggal 2020-07-07.
- ^ "Design of glycolysis". Philosophical Transactions of the Royal Society of London. B, Biological Sciences (dalam bahasa Inggris). 293 (1063): 5–22. 1981-06-26. doi:10.1098/rstb.1981.0056. ISSN 0080-4622. Diarsipkan dari versi asli tanggal 2019-10-26. Diakses tanggal 2020-07-08.
- ^ Pilkis, S. J.; El-Maghrabi, M. R.; Claus, T. H. (1990-06-01). "Fructose-2,6-Bisphosphate in Control of Hepatic Gluconeogenesis: From Metabolites to Molecular Genetics". Diabetes Care (dalam bahasa Inggris). 13 (6): 582–599. doi:10.2337/diacare.13.6.582. ISSN 0149-5992. Diarsipkan dari versi asli tanggal 2022-08-16. Diakses tanggal 2020-07-08.
- ^ Evans, Rhys D.; Heather, Lisa C. (2016-06). "Metabolic pathways and abnormalities". Surgery (Oxford). 34 (6): 266–272. doi:10.1016/j.mpsur.2016.03.010. ISSN 0263-9319.
- ^ Freeze, Hudson H.; Hart, Gerald W.; Schnaar, Ronald L. (2015). Varki, Ajit; Cummings, Richard D.; Esko, Jeffrey D.; Stanley, Pamela; Hart, Gerald W.; Aebi, Markus; Darvill, Alan G.; Kinoshita, Taroh; Packer, Nicolle H., ed. Essentials of Glycobiology (edisi ke-3). Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press. PMID 28876856. Diarsipkan dari versi asli tanggal 2022-02-24. Diakses tanggal 2020-07-08.
- ^ Opdenakker, Ghislain; Rudd, Pauline M.; Ponting, Christopher P.; Dwek, Raymond A. (1993-11). "Concepts and principles of glycobiology". The FASEB Journal (dalam bahasa Inggris). 7 (14): 1330–1337. doi:10.1096/fasebj.7.14.8224606. ISSN 0892-6638.
- ^ McConville, Malcolm J.; Menon, Anant K. (2000-01). "Recent developments in the cell biology and biochemistry of glycosylphosphatidylinositol lipids (Review)". Molecular Membrane Biology (dalam bahasa Inggris). 17 (1): 1–16. doi:10.1080/096876800294443. ISSN 0968-7688.
- ^ White, Stephen W.; Zheng, Jie; Zhang, Yong-Mei; Rock, Charles O. (2005-06). "THE STRUCTURAL BIOLOGY OF TYPE II FATTY ACID BIOSYNTHESIS". Annual Review of Biochemistry (dalam bahasa Inggris). 74 (1): 791–831. doi:10.1146/annurev.biochem.74.082803.133524. ISSN 0066-4154. Diarsipkan dari versi asli tanggal 2020-07-11. Diakses tanggal 2020-07-10.
- ^ Ohlrogge, John B.; Jaworski, Jan G. (1997-06). "REGULATION OF FATTY ACID SYNTHESIS". Annual Review of Plant Physiology and Plant Molecular Biology (dalam bahasa Inggris). 48 (1): 109–136. doi:10.1146/annurev.arplant.48.1.109. ISSN 1040-2519. Diarsipkan dari versi asli tanggal 2020-05-02. Diakses tanggal 2020-07-10.
- ^ Nye CK; Hanson, Richard W.; Kalhan, Satish C. (2008-10-10). "Glyceroneogenesis Is the Dominant Pathway for Triglyceride Glycerol Synthesis in Vivo in the Rat". Journal of Biological Chemistry (dalam bahasa Inggris). 283 (41): 27565–27574. doi:10.1074/jbc.M804393200. ISSN 0021-9258. PMC 2562054
 . PMID 18662986.
. PMID 18662986.
- ^ Dubey, Vinod Shanker; Bhalla, Ritu; Luthra, Rajesh (2003-09). "An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants" (PDF). Journal of Biosciences (dalam bahasa Inggris). 28 (5): 637–646. doi:10.1007/BF02703339. ISSN 0250-5991. Archived from the original on 2007-04-15. Diakses tanggal 2020-07-11.
- ^ a b Kuzuyama, Tomohisa; Seto, Haruo (2003-03-25). "Diversity of the biosynthesis of the isoprene units". Natural Product Reports. 20 (2): 171–183. doi:10.1039/b109860h.
- ^ Grochowski, Laura L.; Xu, Huimin; White, Robert H. (2006-05-01). "Methanocaldococcus jannaschii Uses a Modified Mevalonate Pathway for Biosynthesis of Isopentenyl Diphosphate". Journal of Bacteriology (dalam bahasa Inggris). 188 (9): 3192–3198. doi:10.1128/JB.188.9.3192-3198.2006. ISSN 0021-9193. PMC 1447442
 . PMID 16621811. Diarsipkan dari versi asli tanggal 2020-07-12. Diakses tanggal 2020-07-11.
. PMID 16621811. Diarsipkan dari versi asli tanggal 2020-07-12. Diakses tanggal 2020-07-11.
- ^ Lichtenthaler, Hartmut K. (1999-06-01). "The 1-deoxy-d-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants". Annual Review of Plant Physiology and Plant Molecular Biology. 50 (1): 47–65. doi:10.1146/annurev.arplant.50.1.47. ISSN 1040-2519. Diarsipkan dari versi asli tanggal 2021-07-15. Diakses tanggal 2020-07-11.
- ^ a b Schroepfer, G J (1981-06-01). "Sterol Biosynthesis". Annual Review of Biochemistry. 50 (1): 585–621. doi:10.1146/annurev.bi.50.070181.003101. ISSN 0066-4154. Diarsipkan dari versi asli tanggal 2020-07-11. Diakses tanggal 2020-07-11.
- ^ Lees, N. D.; Skaggs, B.; Kirsch, D. R.; Bard, M. (1995-03). "Cloning of the late genes in the ergosterol biosynthetic pathway ofSaccharomyces cerevisiae—A review". Lipids (dalam bahasa Inggris). 30 (3): 221–226. doi:10.1007/BF02537824. ISSN 0024-4201.
- ^ a b Yang, Qin; Vijayakumar, Archana; Kahn, Barbara B. (2018-10). "Metabolites as regulators of insulin sensitivity and metabolism". Nature Reviews. Molecular Cell Biology. 19 (10): 654–672. doi:10.1038/s41580-018-0044-8. ISSN 1471-0080. PMID 30104701. Diarsipkan dari versi asli tanggal 2019-02-01. Diakses tanggal 2019-02-01.
- ^ Nelson DL, Cox MM (2005). Lehninger principles of biochemistry (edisi ke-4). New York: W.H. Freeman and Company. hlm. 841. ISBN 0-7167-4339-6. OCLC 55476414.
- ^ Himmelreich, R.; Hilbert, H.; Plagens, H.; Pirkl, E.; Li, B.-C.; Herrmann, R. (1996-11-01). "Complete Sequence Analysis of the Genome of the Bacterium Mycoplasma Pneumoniae". Nucleic Acids Research (dalam bahasa Inggris). 24 (22): 4420–4449. doi:10.1093/nar/24.22.4420. ISSN 0305-1048. PMC 146264
 . PMID 8948633. Diarsipkan dari versi asli tanggal 2021-12-31. Diakses tanggal 2020-07-13.
. PMID 8948633. Diarsipkan dari versi asli tanggal 2021-12-31. Diakses tanggal 2020-07-13.
- ^ Guyton, AC, Hall JE (2006). Textbook of medical physiology (PDF) (edisi ke-11th ed). Philadelphia: Elsevier Saunders. hlm. 855. ISBN 0-7216-0240-1. OCLC 56661571. Diarsipkan dari versi asli (PDF) tanggal 2020-07-14. Diakses tanggal 2020-07-13.
- ^ Ibba M, Söll D (2001-05-01). "The renaissance of aminoacyl-tRNA synthesis". EMBO reports. 2 (5): 382–387. doi:10.1093/embo-reports/kve095. ISSN 1469-221X. PMC 1083889
 . PMID 11375928. Diarsipkan dari versi asli tanggal 2020-07-13. Diakses tanggal 2020-07-13.
. PMID 11375928. Diarsipkan dari versi asli tanggal 2020-07-13. Diakses tanggal 2020-07-13.
- ^ Lengyel, P.; Söll, D. (1969-06-01). "Mechanism of protein biosynthesis". Microbiology and Molecular Biology Reviews (dalam bahasa Inggris). 33 (2): 264–301. doi:10.1128/mmbr.33.2.264-301.1969. ISSN 1092-2172. PMID 4896351. Diarsipkan dari versi asli tanggal 2020-07-14. Diakses tanggal 2020-07-13.
- ^ Lengyel P, Söll D (June 1969). "Mechanism of protein biosynthesis". Bacteriological Reviews. 33 (2): 264–301. doi:10.1128/MMBR.33.2.264-301.1969. PMC 378322
 . PMID 4896351.
. PMID 4896351.
- ^ a b Rudolph, Frederick B. (1994-01-01). "The Biochemistry and Physiology of Nucleotides". The Journal of Nutrition (dalam bahasa Inggris). 124 (suppl_1): 124S–127S. doi:10.1093/jn/124.suppl_1.124S. ISSN 0022-3166. Diarsipkan dari versi asli tanggal 2021-03-08. Diakses tanggal 2020-07-14.
- ^ a b Zrenner, Rita; Stitt, Mark; Sonnewald, Uwe; Boldt, Ralf (Mei 2005). "Pyrimidine and purine biosynthesis and degradation in plants". Annual Review of Plant Biology. 57 (1): 805–836. doi:10.1146/annurev.arplant.57.032905.105421. ISSN 1543-5008. Diarsipkan dari versi asli tanggal 2021-03-08. Diakses tanggal 2020-07-14.
- ^ Stasolla, Claudio; Katahira, Riko; Thorpe, Trevor A.; Ashihara, Hiroshi (January 2003). "Purine and pyrimidine nucleotide metabolism in higher plants". Journal of Plant Physiology (dalam bahasa Inggris). 160 (11): 1271–1295. doi:10.1078/0176-1617-01169. ISSN 0176-1617. Diarsipkan dari versi asli tanggal 2020-07-14. Diakses tanggal 2020-07-14.
- ^ Davies, Oluwafemi; Mendes, Pedro; Smallbone, Kieran; Malys, Naglis (April 2012). "Characterisation of multiple substrate-specific (d)ITP/(d)XTPase and modelling of deaminated purine nucleotide metabolism". BMB Reports. 45 (4): 259–264. doi:10.5483/BMBRep.2012.45.4.259. ISSN 1976-670X. Diarsipkan dari versi asli tanggal 2020-07-15. Diakses tanggal 2020-07-14.
- ^ Smith, Janet L (Desember 1995). "Enzymes of nucleotide synthesis". Current Opinion in Structural Biology (dalam bahasa Inggris). 5 (6): 752–757. doi:10.1016/0959-440X(95)80007-7. ISSN 0959-440X. Diarsipkan dari versi asli tanggal 2015-09-24. Diakses tanggal 2020-07-14.
- ^ Testa, Bernard; Krämer, Stefanie D. (Oktober 2006). "The Biochemistry of Drug Metabolism – An Introduction". Chemistry & Biodiversity (dalam bahasa Inggris). 3 (10): 1053–1101. doi:10.1002/cbdv.200690111. ISSN 1612-1880. Diarsipkan dari versi asli tanggal 2020-07-16. Diakses tanggal 2020-07-16.
- ^ Danielson, P. B. (Desember 2002). "The Cytochrome P450 Superfamily: Biochemistry, Evolution and Drug Metabolism in Humans". Current Drug Metabolism (dalam bahasa Inggris). doi:10.2174/1389200023337054. Diarsipkan dari versi asli tanggal 2020-07-19. Diakses tanggal 2020-07-16.
- ^ Danielson PB (December 2002). "The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans". Current Drug Metabolism. 3 (6): 561–97. doi:10.2174/1389200023337054. PMID 12369887.
- ^ King, C. D.; Rios, G. R.; Tephly, M. D. Green and T. R. (Agustus 2000). "UDP-Glucuronosyltransferases". Current Drug Metabolism (dalam bahasa Inggris). doi:10.2174/1389200003339171. Diarsipkan dari versi asli tanggal 2020-07-16. Diakses tanggal 2020-07-16.
- ^ Sheehan, D.; Meade, G.; Foley, V. M.; Dowd, C. A. (November 2001). "Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily". The Biochemical Journal. 360 (Pt 1): 1–16. doi:10.1042/0264-6021:3600001. ISSN 0264-6021. PMC 1222196
 . PMID 11695986. Diarsipkan dari versi asli tanggal 2020-06-29. Diakses tanggal 2020-07-16.
. PMID 11695986. Diarsipkan dari versi asli tanggal 2020-06-29. Diakses tanggal 2020-07-16.
- ^ Galvão, Teca Calcagno; Mohn, William W.; Lorenzo, Víctor de (Oktober 2005). "Exploring the microbial biodegradation and biotransformation gene pool". Trends in Biotechnology (dalam bahasa English). 23 (10): 497–506. doi:10.1016/j.tibtech.2005.08.002. ISSN 0167-7799. PMID 16125262. Diarsipkan dari versi asli tanggal 2013-10-14. Diakses tanggal 2020-07-16.
- ^ Janssen, Dick B.; Dinkla, Inez J. T.; Poelarends, Gerrit J.; Terpstra, Peter (2005). "Bacterial degradation of xenobiotic compounds: evolution and distribution of novel enzyme activities". Environmental Microbiology (dalam bahasa Inggris). 7 (12): 1868–1882. doi:10.1111/j.1462-2920.2005.00966.x. ISSN 1462-2920. Diarsipkan dari versi asli tanggal 2022-04-11. Diakses tanggal 2020-07-16.
- ^ Rice-Evans, C.; Halliwell, B.; Lunt, G. G.; Davies, Kelvin J. A. (November 1995). "Oxidative stress: the paradox of aerobic life". Biochemical Society Symposia (dalam bahasa Inggris). 61: 1–31. doi:10.1042/bss0610001. ISSN 0067-8694. Diarsipkan dari versi asli tanggal 2020-07-17. Diakses tanggal 2020-07-16.
- ^ Tu, Benjamin P.; Weissman, Jonathan S. (Februari 2004). "Oxidative protein folding in eukaryotes". The Journal of Cell Biology. 164 (3): 341–346. doi:10.1083/jcb.200311055. ISSN 0021-9525. PMC 2172237
 . PMID 14757749. Diarsipkan dari versi asli tanggal 2021-03-08. Diakses tanggal 2020-07-16.
. PMID 14757749. Diarsipkan dari versi asli tanggal 2021-03-08. Diakses tanggal 2020-07-16.
- ^ Sies, H (Maret 1997). "Oxidative stress: oxidants and antioxidants". Experimental Physiology (dalam bahasa Inggris). 82 (2): 291–295. doi:10.1113/expphysiol.1997.sp004024.
- ^ Vertuani S; Manfredini S; Angusti A (Mei 2004). "The Antioxidants and Pro-Antioxidants Network: An Overview". Current Pharmaceutical Design (dalam bahasa Inggris). doi:10.2174/1381612043384655. Diarsipkan dari versi asli tanggal 2020-07-16. Diakses tanggal 2020-07-16.
- ^ von Stockar, U.; Liu, J. -S. (Agustus 1998). "Does microbial life always feed on negative entropy? Thermodynamic analysis of microbial growth". Biochimica et Biophysica Acta (BBA) - Bioenergetics (dalam bahasa Inggris). 1412 (3): 191–211. doi:10.1016/S0005-2728(99)00065-1. ISSN 0005-2728. Diarsipkan dari versi asli tanggal 2020-07-18. Diakses tanggal 2020-07-17.
- ^ Demirel, Y.; Sandler, S. I. (2002-06-19). "Thermodynamics and bioenergetics". Biophysical Chemistry (dalam bahasa Inggris). 97 (2): 87–111. doi:10.1016/S0301-4622(02)00069-8. ISSN 0301-4622. Diarsipkan dari versi asli tanggal 2015-09-24. Diakses tanggal 2020-07-17.
- ^ Albert R (2005). "Scale-free networks in cell biology". J Cell Sci. 118 (Pt 21): 4947–57. arXiv:q-bio/0510054
 . doi:10.1242/jcs.02714. PMID 16254242. Diarsipkan dari versi asli tanggal 2007-04-12. Diakses tanggal 2023-03-09.
. doi:10.1242/jcs.02714. PMID 16254242. Diarsipkan dari versi asli tanggal 2007-04-12. Diakses tanggal 2023-03-09.
- ^ Brand M (1997). "Regulation analysis of energy metabolism". J Exp Biol. 200 (Pt 2): 193–202. PMID 9050227. Diarsipkan dari versi asli tanggal 2007-03-29. Diakses tanggal 2019-01-31.
- ^ a b Salter, M.; Knowles, R. G.; Pogson, C. I. (1994). "Metabolic control". Essays in Biochemistry. 28: 1–12. ISSN 0071-1365. PMID 7925313. Diarsipkan dari versi asli tanggal 2020-07-19. Diakses tanggal 2020-07-18.
- ^ Westerhoff, Hans V.; Groen, Albert K.; Wanders, Ronald J. A. (January 1984). "Modern theories of metabolic control and their applicationsReview". Bioscience Reports (dalam bahasa Inggris). 4 (1): 1–22. doi:10.1007/BF01120819. ISSN 0144-8463. Diarsipkan dari versi asli tanggal 2020-07-19. Diakses tanggal 2020-07-18.
- ^ Fell DA, Thomas S (October 1995). "Physiological control of metabolic flux: the requirement for multisite modulation". The Biochemical Journal. 311 ( Pt 1) (Pt 1): 35–9. doi:10.1042/bj3110035. PMC 1136115
 . PMID 7575476.
. PMID 7575476.
- ^ Hendrickson WA (November 2005). "Transduction of biochemical signals across cell membranes". Quarterly Reviews of Biophysics. 38 (4): 321–30. doi:10.1017/S0033583506004136. PMID 16600054.
- ^ Cohen, Philip (Desember 2000). "The regulation of protein function by multisite phosphorylation – a 25 year update". Trends in Biochemical Sciences (dalam bahasa English). 25 (12): 596–601. doi:10.1016/S0968-0004(00)01712-6. ISSN 0968-0004. PMID 11116185. Diarsipkan dari versi asli tanggal 2013-10-12. Diakses tanggal 2020-07-18.
- ^ Lienhard, G. E.; Slot, J. W.; James, D. E.; Mueckler, M. M. (1992-01). "How cells absorb glucose". Scientific American. 266 (1): 86–91. doi:10.1038/scientificamerican0192-86. ISSN 0036-8733. PMID 1734513. Diarsipkan dari versi asli tanggal 2020-07-16. Diakses tanggal 2020-07-18.
- ^ Roach, Peter J. (Maret 2002). "Glycogen and its metabolism". Current Molecular Medicine. 2 (2): 101–120. doi:10.2174/1566524024605761. ISSN 1566-5240. PMID 11949930. Diarsipkan dari versi asli tanggal 2020-07-18. Diakses tanggal 2020-07-18.
- ^ Newgard, C. B.; Brady, M. J.; O'Doherty, R. M.; Saltiel, A. R. (Desember 2000). "Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1". Diabetes (dalam bahasa Inggris). 49 (12): 1967–1977. doi:10.2337/diabetes.49.12.1967. ISSN 0012-1797. PMID 11117996. Diarsipkan dari versi asli tanggal 2020-07-19. Diakses tanggal 2020-07-18.
- ^ Smith, Eric; Morowitz, Harold J. (September 2004). "Universality in intermediary metabolism". Proceedings of the National Academy of Sciences (dalam bahasa Inggris). 101 (36): 13168–13173. doi:10.1073/pnas.0404922101. ISSN 0027-8424. PMC 516543
 . PMID 15340153. Diarsipkan dari versi asli tanggal 2020-12-04. Diakses tanggal 2020-07-20.
. PMID 15340153. Diarsipkan dari versi asli tanggal 2020-12-04. Diakses tanggal 2020-07-20.
- ^ Romano, AH; Conway, T (Juli 1996). "Evolution of carbohydrate metabolic pathways". Research in Microbiology (dalam bahasa Inggris). 147 (6): 448–455. doi:10.1016/0923-2508(96)83998-2. ISSN 0923-2508. Diarsipkan dari versi asli tanggal 2020-11-01. Diakses tanggal 2020-07-20.
- ^ Koch, Arthur L. (Januari 1998). Poole, R. K., ed. Advances in Microbial Physiology. Advances in Microbial Physiology (dalam bahasa Inggris). 40. Academic Press. hlm. 353–399. doi:10.1016/s0065-2911(08)60135-6. Diarsipkan dari versi asli tanggal 2015-09-24. Diakses tanggal 2020-07-20.
- ^ Ouzounis, Christos; Kyrpides, Nikos (Juli 1996). "The emergence of major cellular processes in evolution". FEBS Letters (dalam bahasa Inggris). 390 (2): 119–123. doi:10.1016/0014-5793(96)00631-X. ISSN 1873-3468. Diarsipkan dari versi asli tanggal 2021-03-02. Diakses tanggal 2020-07-20.
- ^ Ebenhöh, Oliver; Heinrich, Reinhart (January 2001). "Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems". Bulletin of Mathematical Biology (dalam bahasa Inggris). 63 (1): 21–55. doi:10.1006/bulm.2000.0197. ISSN 1522-9602.
- ^ Meléndez-Hevia, Enrique; Waddell, Thomas G.; Cascante, Marta (September 1996). "The puzzle of the Krebs citric acid cycle: Assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution". Journal of Molecular Evolution (dalam bahasa Inggris). 43 (3): 293–303. doi:10.1007/BF02338838. ISSN 1432-1432.
- ^ Caetano-Anollés, Gustavo; Kim, Hee Shin; Mittenthal, Jay E. (2007-05-29). "The origin of modern metabolic networks inferred from phylogenomic analysis of protein architecture". Proceedings of the National Academy of Sciences (dalam bahasa Inggris). 104 (22): 9358–9363. doi:10.1073/pnas.0701214104. ISSN 0027-8424. PMC 1890499
 . PMID 17517598. Diarsipkan dari versi asli tanggal 2020-12-06. Diakses tanggal 2020-07-20.
. PMID 17517598. Diarsipkan dari versi asli tanggal 2020-12-06. Diakses tanggal 2020-07-20.
- ^ Schmidt, Steffen; Sunyaev, Shamil; Bork, Peer; Dandekar, Thomas (Juni 2003). "Metabolites: a helping hand for pathway evolution?". Trends in Biochemical Sciences (dalam bahasa English). 28 (6): 336–341. doi:10.1016/S0968-0004(03)00114-2. ISSN 0968-0004. Diarsipkan dari versi asli tanggal 2013-10-13. Diakses tanggal 2020-07-20.
- ^ Light, Sara; Kraulis, Per (February 2004). "Network analysis of metabolic enzyme evolution in Escherichia coli". BMC Bioinformatics. 5 (1): 15. doi:10.1186/1471-2105-5-15. ISSN 1471-2105. PMC 394313
 . PMID 15113413.
. PMID 15113413.
- ^ Alves, Rui; Chaleil, Raphael A. G; Sternberg, Michael J. E (Juli 2002). "Evolution of Enzymes in Metabolism: A Network Perspective". Journal of Molecular Biology (dalam bahasa Inggris). 320 (4): 751–770. doi:10.1016/S0022-2836(02)00546-6. ISSN 0022-2836. Diarsipkan dari versi asli tanggal 2015-09-24. Diakses tanggal 2020-07-20.
- ^ Kim, Hee Shin; Mittenthal, Jay E.; Caetano-Anollés, Gustavo (2006-07-19). "MANET: tracing evolution of protein architecture in metabolic networks". BMC Bioinformatics. 7 (1): 351. doi:10.1186/1471-2105-7-351. ISSN 1471-2105. PMC 1559654
 . PMID 16854231.
. PMID 16854231.
- ^ Teichmann, Sarah A.; Rison, Stuart C. G.; Thornton, Janet M.; Riley, Monica; Gough, Julian; Chothia, Cyrus (2001-12-01). "Small-molecule metabolism: an enzyme mosaic". Trends in Biotechnology (dalam bahasa English). 19 (12): 482–486. doi:10.1016/S0167-7799(01)01813-3. ISSN 0167-7799. PMID 11711174.
- ^ Spirin, Victor; Gelfand, Mikhail S.; Mironov, Andrey A.; Mirny, Leonid A. (2006-06-06). "A metabolic network in the evolutionary context: Multiscale structure and modularity". Proceedings of the National Academy of Sciences (dalam bahasa Inggris). 103 (23): 8774–8779. doi:10.1073/pnas.0510258103. ISSN 0027-8424. PMC 1482654
 . PMID 16731630. Diarsipkan dari versi asli tanggal 2020-12-05. Diakses tanggal 2020-07-20.
. PMID 16731630. Diarsipkan dari versi asli tanggal 2020-12-05. Diakses tanggal 2020-07-20.
- ^ Lawrence, Jeffrey G (Desember 2005). "Common themes in the genome strategies of pathogens". Current Opinion in Genetics & Development. Genomes and evolution (dalam bahasa Inggris). 15 (6): 584–588. doi:10.1016/j.gde.2005.09.007. ISSN 0959-437X.
- ^ Wernegreen, Jennifer J (Desember 2005). "For better or worse: genomic consequences of intracellular mutualism and parasitism". Current Opinion in Genetics & Development. Genomes and evolution (dalam bahasa Inggris). 15 (6): 572–583. doi:10.1016/j.gde.2005.09.013. ISSN 0959-437X. Diarsipkan dari versi asli tanggal 2015-09-24. Diakses tanggal 2020-07-20.
- ^ Pál, Csaba; Papp, Balázs; Lercher, Martin J.; Csermely, Péter; Oliver, Stephen G.; Hurst, Laurence D. (2006-03). "Chance and necessity in the evolution of minimal metabolic networks". Nature (dalam bahasa Inggris). 440 (7084): 667–670. doi:10.1038/nature04568. ISSN 1476-4687. Diarsipkan dari versi asli tanggal 2021-02-12. Diakses tanggal 2020-07-20.
- ^ Rennie, Michael J. (November 1999). "An introduction to the use of tracers in nutrition and metabolism". Proceedings of the Nutrition Society (dalam bahasa Inggris). 58 (4): 935–944. doi:10.1017/S002966519900124X. ISSN 1475-2719. Diarsipkan dari versi asli tanggal 2020-08-31. Diakses tanggal 2020-07-22.
- ^ Phair, Robert D. (1997-12). "Development of kinetic models in the nonlinear world of molecular cell biology". Metabolism. 46 (12): 1489–1495. doi:10.1016/s0026-0495(97)90154-2. ISSN 0026-0495.
- ^ Sterck, Lieven; Rombauts, Stephane; Vandepoele, Klaas; Rouzé, Pierre; Van de Peer, Yves (April 2007). "How many genes are there in plants (… and why are they there)?". Current Opinion in Plant Biology. Genome Studies and Molecular Genetics / Edited by Stefan Jansson and Edward S Buckler (dalam bahasa Inggris). 10 (2): 199–203. doi:10.1016/j.pbi.2007.01.004. ISSN 1369-5266. Diarsipkan dari versi asli tanggal 2020-07-22. Diakses tanggal 2020-07-22.
- ^ Borodina, Irina; Nielsen, Jens (June 2005). "From genomes to in silico cells via metabolic networks". Current Opinion in Biotechnology. Environmental biotechnology/Systems biology (dalam bahasa Inggris). 16 (3): 350–355. doi:10.1016/j.copbio.2005.04.008. ISSN 0958-1669.
- ^ Gianchandani EP, Brautigan DL, Papin JA (May 2006). "Systems analyses characterize integrated functions of biochemical networks". Trends in Biochemical Sciences. 31 (5): 284–91. doi:10.1016/j.tibs.2006.03.007. PMID 16616498.
- ^ Duarte, Natalie C.; Becker, Scott A.; Jamshidi, Neema; Thiele, Ines; Mo, Monica L.; Vo, Thuy D.; Srivas, Rohith; Palsson, Bernhard Ø (Februari 2007). "Global reconstruction of the human metabolic network based on genomic and bibliomic data". Proceedings of the National Academy of Sciences (dalam bahasa Inggris). 104 (6): 1777–1782. doi:10.1073/pnas.0610772104. ISSN 0027-8424. PMC 1794290
 . PMID 17267599. Diarsipkan dari versi asli tanggal 2020-07-01. Diakses tanggal 2020-07-22.
. PMID 17267599. Diarsipkan dari versi asli tanggal 2020-07-01. Diakses tanggal 2020-07-22.
- ^ Goh, Kwang-Il; Cusick, Michael E.; Valle, David; Childs, Barton; Vidal, Marc; Barabási, Albert-László (Mei 2007). "The human disease network". Proceedings of the National Academy of Sciences (dalam bahasa Inggris). 104 (21): 8685–8690. doi:10.1073/pnas.0701361104. ISSN 0027-8424. PMC 1885563
 . PMID 17502601. Diarsipkan dari versi asli tanggal 2020-07-22. Diakses tanggal 2020-07-22.
. PMID 17502601. Diarsipkan dari versi asli tanggal 2020-07-22. Diakses tanggal 2020-07-22.
- ^ Lee, D.- S.; Park, J.; Kay, K. A.; Christakis, N. A.; Oltvai, Z. N.; Barabasi, A.- L. (Juli 2008). "The implications of human metabolic network topology for disease comorbidity". Proceedings of the National Academy of Sciences (dalam bahasa Inggris). 105 (29): 9880–9885. doi:10.1073/pnas.0802208105. ISSN 0027-8424. PMC 2481357
 . PMID 18599447.
. PMID 18599447.
- ^ Csete, Marie; Doyle, John (September 2004). "Bow ties, metabolism and disease". Trends in Biotechnology (dalam bahasa English). 22 (9): 446–450. doi:10.1016/j.tibtech.2004.07.007. ISSN 0167-7799. PMID 15331224. Diarsipkan dari versi asli tanggal 2013-10-14. Diakses tanggal 2020-07-22.
- ^ Zhao, Jing; Yu, Hong; Luo, Jian-Hua; Cao, Zhi-Wei; Li, Yi-Xue (Agustus 2006). "Hierarchical modularity of nested bow-ties in metabolic networks". BMC Bioinformatics. 7 (1): 386. doi:10.1186/1471-2105-7-386. ISSN 1471-2105. PMC 1560398
 . PMID 16916470.
. PMID 16916470.
- ^ Ma, Hong-Wu; Zeng, An-Ping (Juli 2003). "The connectivity structure, giant strong component and centrality of metabolic networks". Bioinformatics (dalam bahasa Inggris). 19 (11): 1423–1430. doi:10.1093/bioinformatics/btg177. ISSN 1367-4803. Diarsipkan dari versi asli tanggal 2020-07-22. Diakses tanggal 2020-07-22.
- ^ Thykaer, Jette; Nielsen, Jens (Januari 2003). "Metabolic engineering of β-lactam production". Metabolic Engineering (dalam bahasa Inggris). 5 (1): 56–69. doi:10.1016/S1096-7176(03)00003-X. ISSN 1096-7176.
- ^ González-Pajuelo, María; Meynial-Salles, Isabelle; Mendes, Filipa; Andrade, Jose Carlos; Vasconcelos, Isabel; Soucaille, Philippe (September 2005). "Metabolic engineering of Clostridium acetobutylicum for the industrial production of 1,3-propanediol from glycerol". Metabolic Engineering (dalam bahasa Inggris). 7 (5): 329–336. doi:10.1016/j.ymben.2005.06.001. ISSN 1096-7176.
- ^ Krämer, Marco; Bongaerts, Johannes; Bovenberg, Roel; Kremer, Susanne; Müller, Ulrike; Orf, Sonja; Wubbolts, Marcel; Raeven, Leon (October 2003). "Metabolic engineering for microbial production of shikimic acid". Metabolic Engineering (dalam bahasa Inggris). 5 (4): 277–283. doi:10.1016/j.ymben.2003.09.001. ISSN 1096-7176. Diarsipkan dari versi asli tanggal 2011-08-28. Diakses tanggal 2020-07-22.
Bacaan lebih lanjut
- Aryulina, Diah (2007). Biologi 3 SMA dan MA Untuk Kelas XII. Jakarta: Esis/Erlangga. ISBN 974-734-551-3. (Indonesia)
Pranala luar
- (Inggris) Eksperimen-eksperimen Santorio Santorio
- (Inggris) Interactive Flow Chart of the Major Metabolic Pathways Diarsipkan 2006-02-18 di Wayback Machine.

