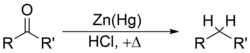Alkana: Perbedaan antara revisi
k Robot: Replacing image Alkanschmelzundsiedepunkt.png with Alkanschmelzundsiedepunkt.svg |
Tidak ada ringkasan suntingan |
||
| (33 revisi perantara oleh 27 pengguna tidak ditampilkan) | |||
| Baris 1: | Baris 1: | ||
{{Distinguish|Alkena|Alkuna}} |
{{Distinguish|Alkena|Alkuna}} |
||
[[Berkas:Methane-2D-stereo.svg| |
[[Berkas:Methane-2D-stereo.svg|ka|jmpl|Struktur kimia dari [[metana]], alkana yang paling sederhana]] |
||
'''Alkana''' (juga disebut dengan ''parafin'') adalah [[senyawa kimia]] [[hidrokarbon]] [[Hidrokarbon jenuh|jenuh]] asiklis. Alkana termasuk senyawa [[alifatik]]. Dengan kata lain, alkana adalah sebuah rantai [[karbon]] panjang dengan ikatan-ikatan tunggal. Rumus umum untuk alkana adalah C<sub>n</sub>H<sub>2n+2</sub>. Alkana yang paling sederhana adalah [[metana]] dengan rumus CH<sub>4</sub>. Tidak ada batasan berapa karbon yang dapat terikat bersama. Beberapa jenis [[minyak]] dan [[wax]] adalah contoh alkana dengan atom jumlah atom karbon yang besar, bisa lebih dari 10 atom karbon. |
'''Alkana''' (juga disebut dengan ''parafin'') adalah [[senyawa kimia]] [[hidrokarbon]] [[Hidrokarbon jenuh|jenuh]] asiklis. Alkana termasuk senyawa [[alifatik]]. Dengan kata lain, alkana adalah sebuah rantai [[karbon]] panjang dengan ikatan-ikatan tunggal. Rumus umum untuk alkana adalah C<sub>n</sub>H<sub>2n+2</sub>. Alkana yang paling sederhana adalah [[metana]] dengan rumus CH<sub>4</sub><ref>{{Cite book|last=Rengga|first=Wara Dyah Pita|last2=Putri|first2=Rr Dewi Artanti|url=https://books.google.co.id/books?hl=id&lr=&id=xwhHEAAAQBAJ&oi=fnd&pg=PA1&dq=asetaldehida+adalah+sebuah+senyawa+organik+dari+kelompok+aldehida,&ots=0F-_SNTkAj&sig=7XRztewb6p02KUImrtMSX1_-wPI&redir_esc=y#v=onepage&q&f=false|title=Kimia Organik I: Gugus Fungsi dalam Monomer|publisher=Perkumpulan Rumah Cemerlang Indonesia|isbn=978-623-6478-43-1|language=id}}</ref>. Tidak ada batasan berapa karbon yang dapat terikat bersama. Beberapa jenis [[minyak]] dan [[wax]] adalah contoh alkana dengan atom jumlah atom karbon yang besar, bisa lebih dari 10 atom karbon. |
||
Setiap atom karbon mempunyai 4 ikatan (baik [[ikatan karbon-hidrogen|ikatan C-H]] atau [[ikatan karbon-karbon|ikatan C-C]]), dan setiap atom hidrogen mesti berikatan dengan atom karbon (ikatan H-C). Sebuah kumpulan dari atom karbon yang terangkai disebut juga dengan [[rumus kerangka]]. Secara umum, jumlah atom karbon digunakan untuk mengukur berapa besar ukuran alkana tersebut (contohnya: C<sub>2</sub>-alkana). |
Setiap atom karbon mempunyai 4 ikatan (baik [[ikatan karbon-hidrogen|ikatan C-H]] atau [[ikatan karbon-karbon|ikatan C-C]]), dan setiap [[atom hidrogen]] mesti berikatan dengan atom karbon (ikatan H-C). Sebuah kumpulan dari atom karbon yang terangkai disebut juga dengan [[rumus kerangka]]. Secara umum, jumlah atom karbon digunakan untuk mengukur berapa besar ukuran alkana tersebut (contohnya: C<sub>2</sub>-alkana). |
||
Gugus alkil, biasanya disingkat dengan simbol R, adalah [[gugus fungsional]], yang seperti alkana, terdiri dari ikatan karbon tunggal dan atom hidrogen, contohnya adalah [[metil]] atau [[gugus etil]]. |
Gugus alkil, biasanya disingkat dengan simbol R, adalah [[gugus fungsional]], yang seperti alkana, terdiri dari ikatan karbon tunggal dan atom hidrogen, contohnya adalah [[metil]] atau [[gugus etil]]. |
||
Alkana bersifat tidak terlalu reaktif dan mempunyai [[aktivitas biologi]] sedikit. |
Alkana bersifat tidak terlalu reaktif dan mempunyai [[aktivitas biologi]] sedikit. |
||
== Klasifikasi struktur == |
== Klasifikasi struktur == |
||
| Baris 17: | Baris 17: | ||
* [[Senyawa siklik|siklik]] (rumus umum {{chem|C|''n''|H|2''n''}}, ''n'' > 2), ujung-ujung kerangka karbonnya bertemu sehingga membentuk suatu siklus. |
* [[Senyawa siklik|siklik]] (rumus umum {{chem|C|''n''|H|2''n''}}, ''n'' > 2), ujung-ujung kerangka karbonnya bertemu sehingga membentuk suatu siklus. |
||
Menurut definisi dari [[International Union of Pure and Applied Chemistry|IUPAC]], 2 golongan pertama di atas dinamakan alkana, sedangkan golongan yang ketiga disebut dengan [[sikloalkana]].<ref>{{GoldBookRef | title=alkanes | file = A00222 | date = 1995}}</ref> Hidrokarbon tersaturasi juga dapat membentuk gabungan ketiga macam rantai diatas, misalnya linear dengan siklik membentuk polisiklik. Senyawa seperti ini masih disebut dengan alkana (walaupun tidak mempunyai rumus umum), sepanjang tetap berupa [[senyawa rantai terbuka|asiklik]] (tidak seperti siklus). |
Menurut definisi dari [[International Union of Pure and Applied Chemistry|IUPAC]], 2 golongan pertama di atas dinamakan alkana, sedangkan golongan yang ketiga disebut dengan [[sikloalkana]].<ref>{{GoldBookRef | title=alkanes | file = A00222 | date = 1995}}</ref> Hidrokarbon tersaturasi juga dapat membentuk gabungan ketiga macam rantai diatas, misalnya linear dengan siklik membentuk polisiklik. Senyawa seperti ini masih disebut dengan alkana (walaupun tidak mempunyai rumus umum), sepanjang tetap berupa [[senyawa rantai terbuka|asiklik]] (tidak seperti siklus). |
||
== Keisomeran == |
== Keisomeran == |
||
[[Berkas:Saturated C4 hydrocarbons ball-and-stick.png| |
[[Berkas:Saturated C4 hydrocarbons ball-and-stick.png|jmpl|ka| C<sub>4</sub>-alkana dan -sikloalkana yang berbeda-beda (kiri ke kanan): [[n-butana|''n''-butana]] dan [[isobutana]] adalah 2 isomer C<sub>4</sub>H<sub>10</sub>; [[siklobutana]] dan [[metilsiklopropana]] adalah 2 isomer C<sub>4</sub>H<sub>8</sub>.<br /> Bisiklo[1.1.0]butana (C<sub>4</sub>H<sub>6</sub>) tidak mempunyai isomer; [[tetrahedrana]] (tidak terlihat) (C<sub>4</sub>H<sub>4</sub>) juga tidak mempunyai isomer.]] |
||
Alkana dengan 3 atom karbon atau lebih dapat disusun dengan banyak macam cara, membentuk [[isomer struktur]] yang berbeda-beda. Sebuah isomer, sebagai sebuah bagian, mirip dengan [[anagram]] kimia, |
Alkana dengan 3 atom karbon atau lebih dapat disusun dengan banyak macam cara, membentuk [[isomer struktur]] yang berbeda-beda. Sebuah isomer, sebagai sebuah bagian, mirip dengan [[anagram]] kimia, tetapi berbeda dengan anagram, isomer dapat berisi jumlah komponen dan atom yang berbeda-beda, sehingga sebuah [[senyawa kimia]] dapat disusun berbeda-beda strukturnya membentuk kombinasi dan permutasi yang beraneka ragam. Isomer paling sederhana dari sebuah alkana adalah ketika atom karbonnya terpasang pada rantai tunggal tanpa ada cabang. Isomer ini disebut dengan ''n''-isomer (''n'' untuk "normal", penulisannya kadang-kadang tidak dibutuhkan). Meskipun begitu, rantai karbon dapat juga bercabang di banyak letak. Kemungkinan jumlah isomer akan meningkat tajam ketika jumlah atom karbonnya semakin besar.Contohnya: |
||
* C<sub>1</sub>: tidak memiliki isomer: [[metana]] |
* C<sub>1</sub>: tidak memiliki isomer: [[metana]] |
||
* C<sub>2</sub>: tidak memiliki isomer: [[etana]] |
* C<sub>2</sub>: tidak memiliki isomer: [[etana]] |
||
| Baris 35: | Baris 35: | ||
== Tata nama == |
== Tata nama == |
||
{{Main|Tata nama organik}} |
{{Main|Tata nama organik}} |
||
Tata nama IUPAC untuk alkana didasarkan dari identifikasi rantai hidrokarbon. Rantai hidrokarbon tersaturasi, tidak bercabang maka dinamai sistematis dengan akhiran "-ana".<ref>{{cite book |
Tata nama IUPAC untuk alkana didasarkan dari identifikasi rantai hidrokarbon. Rantai hidrokarbon tersaturasi, tidak bercabang maka dinamai sistematis dengan akhiran "-ana".<ref>{{cite book|url = http://www.acdlabs.com/iupac/nomenclature/93/r93_184.htm|accessdate = 12 February 2007|chapter = R-2.2.1: Hydrocarbons|author = IUPAC, Commission on Nomenclature of Organic Chemistry|title = A Guide to IUPAC Nomenclature of Organic Compounds (Recommendations 1993)|year = 1993|publisher = Blackwell Scientific|isbn = 0632034882}}</ref> |
||
=== Rantai karbon lurus === |
=== Rantai karbon lurus === |
||
Alkana rantai karbon lurus biasanya |
Alkana rantai karbon lurus biasanya dikenali dengan awalan ''n-'' (singkatan dari ''normal'') ketika tidak ada [[isomer]]. Meskipun tidak diwajibkan, tetapi penamaan ini penting karena alkana rantai lurus dan rantai bercabang memiliki sifat yang berbeda. Misalnya [[heksana|''n''-heksana]] atau 2- atau 3-metilpentana. |
||
Anggota dari rantai lurus ini adalah: |
Anggota dari rantai lurus ini adalah: |
||
* [[Metana]], CH<sub>4</sub> - 1 karbon dan 4 hidrogen |
* [[Metana]], CH<sub>4</sub> - 1 karbon dan 4 hidrogen |
||
* [[Etana]], C<sub>2</sub>H<sub>6</sub> - 2 karbon dan 6 hidrogen |
* [[Etana]], C<sub>2</sub>H<sub>6</sub> - 2 karbon dan 6 hidrogen |
||
* [[Propana]], C<sub>3</sub>H<sub>8</sub> - 3 karbon dan 8 hidrogen |
* [[Propana]], C<sub>3</sub>H<sub>8</sub> - 3 karbon dan 8 hidrogen |
||
* [[Butana]], C<sub>4</sub>H<sub>10</sub> - 4 karbon dan 10 hidrogen |
* [[Butana]], C<sub>4</sub>H<sub>10</sub> - 4 karbon dan 10 hidrogen |
||
* [[ |
* [[Pentana]], C<sub>5</sub>H<sub>12</sub> - 5 karbon dan 12 hidrogen |
||
* [[ |
* [[Heksana]], C<sub>6</sub>H<sub>14</sub> - 6 carbon dan 14 hidrogen |
||
Mulai dengan jumlah karbon mulai dari lima diberi nama dengan imbuhan jumlah yang ditentukan [[IUPAC]] diakhiri dengan -ana. Contohnya antara lain adalah [[pentana]], [[heksana]], [[heptana]], dan [[oktana]]. |
Mulai dengan jumlah karbon mulai dari lima diberi nama dengan imbuhan jumlah yang ditentukan [[IUPAC]] diakhiri dengan -ana. Contohnya antara lain adalah [[pentana]], [[heksana]], [[heptana]], dan [[oktana]]. |
||
=== Rantai karbon bercabang === |
=== Rantai karbon bercabang === |
||
[[Berkas:Isopentane-numbered-3D-balls.png| |
[[Berkas:Isopentane-numbered-3D-balls.png|jmpl|ka|Model dari [[isopentana]] (nama umum) atau 2-metilbutana (nama sistematik IUPAC)]] |
||
Untuk memberi nama alkana dengan rantai bercabang digunakan langkah-langkah berikut: |
Untuk memberi nama alkana dengan rantai bercabang digunakan langkah-langkah berikut: |
||
| Baris 69: | Baris 69: | ||
|- |
|- |
||
! Struktur |
! Struktur |
||
| [[Berkas:Pentane-2D-Skeletal.svg|120px]] || [[Berkas:Isopentane-2D-skeletal. |
| [[Berkas:Pentane-2D-Skeletal.svg|120px]] || [[Berkas:Isopentane-2D-skeletal.svg|90px]] || [[Berkas:Neopentane-2D-skeletal.png|70px]] |
||
|} |
|} |
||
| Baris 75: | Baris 75: | ||
{{Main|Sikloalkana}} |
{{Main|Sikloalkana}} |
||
Sikloalkana adalah hidrokarbon yang seperti alkana, |
Sikloalkana adalah hidrokarbon yang seperti alkana, tetapi rantai karbonnya membentuk cincin. |
||
Sikloalkana sederhana mempunyai awalan "siklo-" untuk membendakannya dari alkana. Penamaan sikloalkana dilihat dari berapa banyak atom karbon yang dikandungnya, misalnya [[siklopentana]] (C<sub>5</sub>H<sub>10</sub>) adalah sikloalkana dengan 5 atom karbon seperti [[pentana]](C<sub>5</sub>H<sub>12</sub>), hanya saja pada siklopentana kelima atom karbonnya membentuk cincin. Hal yang sama berlaku untuk [[propana]] dan [[siklopropana]], [[butana]] dan [[siklobutana]], dll. |
Sikloalkana sederhana mempunyai awalan "siklo-" untuk membendakannya dari alkana. Penamaan sikloalkana dilihat dari berapa banyak atom karbon yang dikandungnya, misalnya [[siklopentana]] (C<sub>5</sub>H<sub>10</sub>) adalah sikloalkana dengan 5 atom karbon seperti [[pentana]](C<sub>5</sub>H<sub>12</sub>), hanya saja pada siklopentana kelima atom karbonnya membentuk cincin. Hal yang sama berlaku untuk [[propana]] dan [[siklopropana]], [[butana]] dan [[siklobutana]], dll. |
||
Sikloalkana substitusi dinamai mirip dengan alkana substitusi - cincin sikloalkananya tetap ada, dan substituennya dinamai sesuai dengan posisi mereka pada cincin tersebut, pemberian nomornya mengikuti [[aturan Cahn-Ingold-Prelog]].<ref name = reusch-nom>{{cite web | author = William Reusch | work = Virtual Textbook of Organic Chemistry | title = Nomenclature - Alkanes | url = http://www.cem.msu.edu/~reusch/VirtualText/nomen1.htm}}</ref> |
Sikloalkana substitusi dinamai mirip dengan alkana substitusi - cincin sikloalkananya tetap ada, dan substituennya dinamai sesuai dengan posisi mereka pada cincin tersebut, pemberian nomornya mengikuti [[aturan Cahn-Ingold-Prelog]].<ref name = reusch-nom>{{cite web | author = William Reusch | work = Virtual Textbook of Organic Chemistry | title = Nomenclature - Alkanes | url = http://www.cem.msu.edu/~reusch/VirtualText/nomen1.htm | access-date = 2012-03-04 | archive-date = 2010-04-30 | archive-url = https://web.archive.org/web/20100430191541/http://www.cem.msu.edu/~reusch/VirtualText/nomen1.htm | dead-url = yes }}</ref> |
||
=== Nama-nama trivial === |
=== Nama-nama trivial === |
||
Nama trivial (non-IUPAC) dari alkana adalah "[[parafin]]." Nama trivial dari senyawa-senyawa ini biasanya diambil dari artefak-artefak sejarah. Nama trivial digunakan sebelum ada nama sistematik, dan sampai saat ini masih digunakan karena penggunaannya familier di industri. |
Nama trivial (non-IUPAC) dari alkana adalah "[[parafin]]." Nama trivial dari senyawa-senyawa ini biasanya diambil dari artefak-artefak sejarah. Nama trivial digunakan sebelum ada nama sistematik, dan sampai saat ini masih digunakan karena penggunaannya familier di industri. |
||
Dapat hampir dipastikan kalau nama [[parafin]] diambil dari industri petrokimia. Alkana rantai bercabang disebut ''[[isoparafin]]''. Penggunaan kata "paraffin" untuk sebutan secara umum dan |
Dapat hampir dipastikan kalau nama [[parafin]] diambil dari industri petrokimia. Alkana rantai bercabang disebut ''[[isoparafin]]''. Penggunaan kata "paraffin" untuk sebutan secara umum dan sering kali tidak membedakan antara senyawa murni dan campuran [[isomer]] dengan [[rumus kimia]] yang sama. |
||
Beberapa nama ini dipertahankan oleh [[IUPAC]] |
Beberapa nama ini dipertahankan oleh [[IUPAC]] |
||
* [[Isobutana]] untuk 2-metilpropana |
* [[Isobutana]] untuk 2-metilpropana |
||
* [[Isopentana]] untuk 2-metilbutana |
* [[Isopentana]] untuk 2-metilbutana |
||
* [[Isooktana]] untuk 2,2,4-trimetilpentana |
* [[Isooktana]] untuk 2,2,4-trimetilpentana |
||
* [[Neopentana]] untuk 2,2-dimetilpropana |
* [[Neopentana]] untuk 2,2-dimetilpropana |
||
== Ciri-ciri fisik == |
|||
=== Tabel alkana === |
|||
{| class="wikitable" |
|||
|'''Alkana''' |
|||
|'''Rumus''' |
|||
|'''Titik didih [°C]''' |
|||
|'''Titik lebur [°C]''' |
|||
|'''Massa jenis [g·cm<sup>3</sup>] (20 °C''') |
|||
|- |
|||
|[[Metana]] |
|||
|CH<sub>4</sub> |
|||
| -162 |
|||
| -183 |
|||
| gas |
|||
|- |
|||
|[[Etana]] |
|||
|C<sub>2</sub>H<sub>6</sub> |
|||
| -89 |
|||
| -172 |
|||
| gas |
|||
|- |
|||
|[[Propana]] |
|||
|C<sub>3</sub>H<sub>8</sub> |
|||
| -42 |
|||
| -188 |
|||
| gas |
|||
|- |
|||
|[[Butana]] |
|||
|C<sub>4</sub>H<sub>10</sub> |
|||
| 0 |
|||
| -138 |
|||
| gas |
|||
|- |
|||
|[[Pentana]] |
|||
|C<sub>5</sub>H<sub>12</sub> |
|||
| 36 |
|||
| -130 |
|||
| 0.626 (cairan) |
|||
|- |
|||
|[[Heksana]] |
|||
|C<sub>6</sub>H<sub>14</sub> |
|||
| 69 |
|||
| -95 |
|||
| 0.659 (cairan) |
|||
|- |
|||
|[[Heptana]] |
|||
|C<sub>7</sub>H<sub>16</sub> |
|||
| 98 |
|||
| -91 |
|||
| 0.684 (cairan) |
|||
|- |
|||
|[[Oktana]] |
|||
|C<sub>8</sub>H<sub>18</sub> |
|||
| 126 |
|||
| -57 |
|||
| 0.703 (cairan) |
|||
|- |
|||
|[[Nonana]] |
|||
|C<sub>9</sub>H<sub>20</sub> |
|||
| 151 |
|||
| -54 |
|||
| 0.718 (cairan) |
|||
|- |
|||
|[[Dekana]] |
|||
|C<sub>10</sub>H<sub>22</sub> |
|||
| 174 |
|||
| -30 |
|||
| 0.730 (cairan) |
|||
|- |
|||
|[[Undekana]] |
|||
|C<sub>11</sub>H<sub>24</sub> |
|||
| 196 |
|||
| -26 |
|||
| 0.740 (cairan) |
|||
|- |
|||
|[[Dodekana]] |
|||
|C<sub>12</sub>H<sub>26</sub> |
|||
| 216 |
|||
| -10 |
|||
| 0.749 (cairan) |
|||
|- |
|||
|[[Ikosana]] |
|||
|C<sub>20</sub>H<sub>42</sub> |
|||
| 343 |
|||
| 37 |
|||
| padat |
|||
|- |
|||
|[[Triakontana]] |
|||
|C<sub>30</sub>H<sub>62</sub> |
|||
| 450 |
|||
| 66 |
|||
| padat |
|||
|- |
|||
|[[Tetrakontana]] |
|||
|C<sub>40</sub>H<sub>82</sub> |
|||
| 525 |
|||
| 82 |
|||
| padat |
|||
|- |
|||
|[[Pentakontana]] |
|||
|C<sub>50</sub>H<sub>102</sub> |
|||
| 575 |
|||
| 91 |
|||
| padat |
|||
|- |
|||
|[[Heksakontana]] |
|||
|C<sub>60</sub>H<sub>122</sub> |
|||
| 625 |
|||
| 100 |
|||
| padat |
|||
|} |
|||
=== Titik didih === |
|||
[[Berkas:Alkanschmelzundsiedepunkt.svg|right|thumb|300px|Titik lebur (biru) dan titik didih (pink) pada 14 suku pertama ''n''-alkana, dalam satuan °C.]] |
|||
Senyawa alkana mengalami [[gaya van der Waals]] di antara molekul-molekulnya. Semakin besar gaya van der Waals di antara molekul-molekulnya, maka semakin tinggi titik didihnya.<ref name=m&b>{{cite book|title = Organic Chemistry | author = R. T. Morrison, R. N. Boyd | isbn = 0-13-643669-2 | publisher = Prentice Hall | location = New Jersey | edition = 6th|year = 1992}}</ref> |
|||
Ada penentu lain untuk menentukan berapa kekuatan gaya van der Waals: |
|||
* jumlah elektron yang mengelilingi molekul, yang jumlahnya akan meningkat seiring dengan berat molekul alkana |
|||
* luas permukaan molekul |
|||
Dengan [[temperatur dan tekanan standar]], senyawa alkana dari CH<sub>4</sub> sampai C<sub>4</sub>H<sub>10</sub> berwujud gas; C<sub>5</sub>H<sub>12</sub> sampai C<sub>17</sub>H<sub>36</sub> berwujud cairan; dan C<sub>18</sub>H<sub>38</sub> ke atas berwujud padat. Karena titik didih alkana ditentukan oleh beratnya, maka bukanlah suatu hal yang aneh kalau titik didih alkana berbanding lurus dengan [[massa molekul]]nya. Titik didih alkana akan meningkat kira-kira 20–30 °C untuk setiap 1 atom karbon yang ditambahkan pada rantainya.<ref name = m&b/> |
|||
Alkana rantai lurus akan memiliki titik didih yang lebih tinggi daripada alkana rantai bercabang karena luas permukaan kontaknya lebih besar, maka gaya van der Waals antar molekul juga lebih besar. Contohnya adalah [[isobutana]] (2-metilpropana) yang titik didihnya -12 °C, dengan [[n-butana]] (butana), yang titik didihnya 0 °C. Contoh lainnya adalah 2,2-dimetilbutana yang bertitik didih 50 °C dan 2,3-dimetilbutana bertitik didih 58 °C.<ref name = m&b/> Hal ini disebabkan karena 2 molekul 2,3-dimetilbutana dapat saling berikatan lebih baik daripada 2,2 dimetilbutana yang berbentuk salib. |
|||
=== Konduktivitas dan kelarutan === |
|||
Alkana tidak menghasilkan [[listrik]] dan tidak dapat [[Permitivitas statis relatif|dipolarisasi]] oleh [[medan listrik]]. Untuk alasan ini mengapa alkana tidak membentuk [[ikatan hidrogen]] dan tidak dapat bercampur dengan pelarut polar seperti air. |
|||
Kelarutan alkana pada pelarut nonpolar lumayan baik, ciri-ciri yang dikenal dengan nama [[lipofilisitas]]. |
|||
Massa jenis alkana akan bertambah seiring dengan bertambahnya jumlah atom karbon, tapi tetap akan lebih rendah dari massa jenis air. Maka, alkana akan berada di lapisan atas jika dicampur dengan air. |
|||
== Sifat-sifat kimia == |
== Sifat-sifat kimia == |
||
Secara umum, alkana adalah senyawa yang reaktivitasnya rendah, karena ikatan C antar atomnya relatif stabil dan tidak mudah dipisahkan. Tidak seperti kebanyakan senyawa organik lainnya, senyawa ini tidak memiliki [[gugus fungsional]]. |
Secara umum, alkana adalah senyawa yang reaktivitasnya rendah, karena ikatan C antar atomnya relatif stabil dan tidak mudah dipisahkan. Tidak seperti kebanyakan [[senyawa organik]] lainnya, senyawa ini tidak memiliki [[gugus fungsional]]. |
||
Senyawa alkana bereaksi sangat lemah dengan senyawa polar atau senyawa ion lainnya. [[Konstanta disosiasi asam]] (pK<sub>a</sub>) dari semua alkana nilainya diatas 60, yang berarti sulit untuk bereaksi dengan asam maupun basa (lihat [[karbanion]]). Pada [[minyak bumi]], molekul-molekul alkana yang terkandung di dalamnya tidak mengalami perubahan sifat sama sekali selama jutaan tahun. |
Senyawa alkana bereaksi sangat lemah dengan senyawa polar atau senyawa ion lainnya. [[Konstanta disosiasi asam]] (pK<sub>a</sub>) dari semua alkana nilainya diatas 60, yang berarti sulit untuk bereaksi dengan asam maupun basa (lihat [[karbanion]]). Pada [[minyak bumi]], molekul-molekul alkana yang terkandung di dalamnya tidak mengalami perubahan sifat sama sekali selama jutaan tahun. |
||
=== Reaksi dengan oksigen (reaksi pembakaran) === |
=== Reaksi dengan oksigen (reaksi pembakaran) === |
||
Semua alkana dapat bereaksi dengan [[oksigen]] pada reaksi [[pembakaran]], meskipun pada alkana-alkana suku tinggi reaksi akan semakin sulit untuk dilakukan seiring dengan jumlah atom karbon yang bertambah. Rumus umum pembakaran adalah: |
Semua alkana dapat bereaksi dengan [[oksigen]] pada reaksi [[pembakaran]], meskipun pada alkana-alkana suku tinggi reaksi akan semakin sulit untuk dilakukan seiring dengan jumlah atom karbon yang bertambah. Rumus umum pembakaran adalah: |
||
:C<sub>''n''</sub>H<sub>2''n''+2</sub> + (1.5''n''+0.5)O<sub>2</sub> → (''n''+1)H<sub>2</sub>O + ''n''CO<sub>2</sub> |
:C<sub>''n''</sub>H<sub>2''n''+2</sub> + (1.5''n''+0.5)O<sub>2</sub> → (''n''+1)H<sub>2</sub>O + ''n''CO<sub>2</sub> |
||
Ketika jumlah oksigen tidak cukup banyak, maka dapat juga membentuk [[karbon monoksida]], seperti pada reaksi berikut ini: |
Ketika jumlah oksigen tidak cukup banyak, maka dapat juga membentuk [[karbon monoksida]], seperti pada reaksi berikut ini: |
||
| Baris 246: | Baris 113: | ||
Reaksi ini sangat penting pada industri untuk menghalogenasi hidrokarbon. Ada 3 tahap: |
Reaksi ini sangat penting pada industri untuk menghalogenasi hidrokarbon. Ada 3 tahap: |
||
* '''Inisiasi''': radikal halogen terbentuk melalui [[homolisis]]. Biasanya, diperlukan energi dalam bentuk panas atau cahaya. |
* '''Inisiasi''': radikal halogen terbentuk melalui [[homolisis]]. Biasanya, diperlukan [[energi dalam]] bentuk panas atau cahaya. |
||
* '''Reaksi rantai''' atau '''Propagasi''': radikal halogen akan mengabstrak hidrogen dari alkana untuk membentuk radikal alkil. |
* '''Reaksi rantai''' atau '''Propagasi''': radikal halogen akan mengabstrak hidrogen dari alkana untuk membentuk radikal alkil. |
||
* '''Terminasi rantai''': tahap dimana radikal-radikal bergabung. |
* '''Terminasi rantai''': tahap dimana radikal-radikal bergabung. |
||
Hasil eksperimen menunjukkan bahwa semua reaksi halogenasi bisa menghasilkan semua campuran isomer yang berarti mengindikasikan atom hidrogen rentan terhadap reaksi. Atom hidrogen sekunder dan tersier biasanya akan tergantikan karena stablitas radikal bebas sekunder dan tersier lebih baik. Contoh dapat dilihat pada monobrominasi propana:<ref name |
Hasil eksperimen menunjukkan bahwa semua reaksi halogenasi bisa menghasilkan semua campuran isomer yang berarti mengindikasikan atom hidrogen rentan terhadap reaksi. Atom hidrogen sekunder dan tersier biasanya akan tergantikan karena stablitas radikal bebas sekunder dan tersier lebih baik. Contoh dapat dilihat pada monobrominasi propana:<ref name=m&b>{{cite book|title = Organic Chemistry |url = https://archive.org/details/organicchemistry0000morr |author1=R. T. Morrison |author2=R. N. Boyd | isbn = 978-0-13-643669-0 | publisher = Prentice Hall | location = New Jersey | edition = 6th|year = 1992}}</ref> |
||
[[ |
[[Berkas:Monobromination of propane.png|500px|pus|Monobrominasi [[propana]]]] |
||
=== Isomerisasi dan reformasi === |
=== Isomerisasi dan reformasi === |
||
| Baris 258: | Baris 125: | ||
=== ''Cracking'' === |
=== ''Cracking'' === |
||
{{Main|Cracking (kimia)}} |
{{Main|Cracking (kimia)}} |
||
''Cracking'' akan memecah molekul besar menjadi molekul-molekul yang lebih kecil. Reaksi ''cracking'' dapat dilakukan dengan metode pemanasan atau dengan katalis. Metode ''cracking'' dengan pemanasan akan melibatkan mekanisme [[homolisis|homolitik]] dengan pembentukan [[radikal bebas]]. |
''Cracking'' akan memecah molekul besar menjadi molekul-molekul yang lebih kecil. Reaksi ''cracking'' dapat dilakukan dengan metode pemanasan atau dengan katalis. Metode ''cracking'' dengan pemanasan akan melibatkan mekanisme [[homolisis|homolitik]] dengan pembentukan [[radikal bebas]]. Metode ''cracking'' dengan bantuan katalis biasanya melibatkan [[katalis]] [[asam]], prosesnya akan menyebabkan pemecahan ikatan [[heterolisis|heterolitik]] dengan menghasilkan [[ion]] yang muatannya berbeda. Ion yang dihasilkan biasanya berupa karbo[[kation]] dan [[anion]] [[hidrida]] yang tidak stabil. |
||
===Reaksi lainnya=== |
=== Reaksi lainnya === |
||
Alkana akan bereaksi dengan [[uap]] dengan bantuan [[katalis]] berupa [[nikel]]. Alkana juga dapat melalui proses [[klorosulfonasi]] dan [[nitrasi]] meskipun membutuhkan kondisi khusus. [[Fermentasi (biokimia)|Fermentasi]] alkana menjadi [[asam karboksilat]] juga dapat dilakukan dengan beberapa teknik khusus. Pada [[Reaksi reed]], [[sulfur dioksida]], [[klorin]] dan [[fotokimia|cahaya]] mengubah hidrokarbon menjadi [[asam sulfonat|sulfonil klorida]]. [[Abstraksi nukleofilik]] dapat digunakan untuk memisahkan alkana dari logam. Gugus alkil daris sebuah senyawa dapat dipindahkan ke senyawa lainnya dengan reaksi [[transmetalasi]]. |
Alkana akan bereaksi dengan [[uap]] dengan bantuan [[katalis]] berupa [[nikel]]. Alkana juga dapat melalui proses [[klorosulfonasi]] dan [[nitrasi]] meskipun membutuhkan kondisi khusus. [[Fermentasi (biokimia)|Fermentasi]] alkana menjadi [[asam karboksilat]] juga dapat dilakukan dengan beberapa teknik khusus. Pada [[Reaksi reed]], [[sulfur dioksida]], [[klorin]] dan [[fotokimia|cahaya]] mengubah hidrokarbon menjadi [[asam sulfonat|sulfonil klorida]]. [[Abstraksi nukleofilik]] dapat digunakan untuk memisahkan alkana dari logam. Gugus alkil daris sebuah senyawa dapat dipindahkan ke senyawa lainnya dengan reaksi [[transmetalasi]]. |
||
== Terdapat pada == |
== Terdapat pada == |
||
=== Alkana pada alam semesta === |
=== Alkana pada alam semesta === |
||
[[Berkas:Jupiter.jpg| |
[[Berkas:Jupiter.jpg|jmpl|ka|[[Metana]] dan [[etana]] adalah salah satu komponen kecil dari atmosfer [[Yupiter]].]] |
||
[[Berkas:Oil well.jpg| |
[[Berkas:Oil well.jpg|jmpl|ka|Ekstraksi dari minyak bumi, yang mengandung banyak komponen [[hidrokarbon]], termasuk alkana.]] |
||
Alkana adalah senyawa yang terdapat pada sebagian kecil dari atmosfer beberapa planet seperti [[Yupiter]] (0.1% metana, 0.0002% etana), [[Saturnus]] (0.2% metana, 0.0005% etana), [[Uranus]] (1.99% metana, 0.00025% etana) dan [[Neptunus]] (1.5% metana, 1.5 ppm etana). [[Titan (bulan)|Titan]] (1.6% metana), salah satu satelit dari Saturnus, telah diteliti oleh ''Huygens'' bahwa atmosfer Titan menurunkan hujan metana secara periodik ke permukaan bulan itu.<ref>[http://www.planetary.org/news/2005/huygens_science-results_0121.html Titan: Arizona in an Icebox?], Emily Lakdawalla, 21 January 2004, verified 28 March 2005</ref> Di Titan juga diketahui terdapat sebuah gunung yang menyemburkan gas metana, dan semburan gunung ini menyebabkan banyaknya metana pada atmosfer Titan. Selain itu, ditemukan oleh radar Cassini, terlihat juga ada beberapa danau metana/etana di kawasan kutub utara dari Titan. [[Metana]] dan [[etana]] juga diketahui terdapat pada bagian ekor dari komet [[Hyakutake]]. Analisis kimia menunjukkan bahwa kelimpahan etana dan metana hampir sama banyak, dan hal itu menunjukkan bahwa es metana dan etana ini terbentuk di antara ruang antar bintang. |
Alkana adalah senyawa yang terdapat pada sebagian kecil dari atmosfer beberapa planet seperti [[Yupiter]] (0.1% metana, 0.0002% etana), [[Saturnus]] (0.2% metana, 0.0005% etana), [[Uranus]] (1.99% metana, 0.00025% etana) dan [[Neptunus]] (1.5% metana, 1.5 ppm etana). [[Titan (bulan)|Titan]] (1.6% metana), salah satu satelit dari Saturnus, telah diteliti oleh ''Huygens'' bahwa atmosfer Titan menurunkan hujan metana secara periodik ke permukaan bulan itu.<ref>[https://web.archive.org/web/20050124004404/http://www.planetary.org/news/2005/huygens_science-results_0121.html Titan: Arizona in an Icebox?], Emily Lakdawalla, 21 January 2004, verified 28 March 2005</ref> Di Titan juga diketahui terdapat sebuah gunung yang menyemburkan gas metana, dan semburan gunung ini menyebabkan banyaknya metana pada atmosfer Titan. Selain itu, ditemukan oleh radar Cassini, terlihat juga ada beberapa danau metana/etana di kawasan kutub utara dari Titan. [[Metana]] dan [[etana]] juga diketahui terdapat pada bagian ekor dari komet [[Hyakutake]]. Analisis kimia menunjukkan bahwa kelimpahan etana dan metana hampir sama banyak, dan hal itu menunjukkan bahwa es metana dan etana ini terbentuk di antara ruang antar bintang.<ref name="science">{{cite journal | author=Mumma, M.J. | title=Detection of Abundant Ethane and Methane, Along with Carbon Monoxide and Water, in Comet C/1996 B2 Hyakutake: Evidence for Interstellar Origin | journal=Science | year=1996 | volume=272 | page=1310 | doi=10.1126/science.272.5266.1310 | pmid=8650540 | coauthors = Disanti, M.A., dello Russo, N., Fomenkova, M., Magee-Sauer, K., Kaminski, C.D., and D.X. Xie | issue=5266 | bibcode=1996Sci...272.1310M}}</ref> |
||
=== Alkana di bumi === |
=== Alkana di bumi === |
||
Gas metana (sekitar 0.0001% atau 1 ppm) ada di atmosfer bumi, diproduksi |
Gas metana (sekitar 0.0001% atau 1 ppm) ada di atmosfer bumi, diproduksi oleh organisme macam [[Archaea]] dan juga ditemukan pada kotoran sapi. |
||
Sumber alkana yang paling penting adalah pada [[gas alam]] dan [[minyak bumi]].<ref name=m&b/> Gas alam mengandung metana dan etana, dengan sedikit propana dan butana, sedangkan minyak bumi adalah campuran dari alkana cair dan [[hidrokarbon]] lainnya. Hidrokarbon ini terbentuk dari jasad renik dan tanaman (zooplankton dan fitoplankton) yang mati, kemudian terkubur di lautan, tertutup oleh sedimentasi, dan berubah setelah terkena panas dan tekanan tinggi selama jutaan tahun. Gas alam terbentuk dari reaksi di bawah ini: |
Sumber alkana yang paling penting adalah pada [[gas alam]] dan [[minyak bumi]].<ref name=m&b/> Gas alam mengandung metana dan etana, dengan sedikit propana dan butana, sedangkan minyak bumi adalah campuran dari alkana cair dan [[hidrokarbon]] lainnya. Hidrokarbon ini terbentuk dari jasad renik dan tanaman (zooplankton dan fitoplankton) yang mati, kemudian terkubur di lautan, tertutup oleh sedimentasi, dan berubah setelah terkena panas dan tekanan tinggi selama jutaan tahun. Gas alam terbentuk dari reaksi di bawah ini: |
||
| Baris 280: | Baris 147: | ||
Metana juga terdapat pada [[biogas]] yang diproduksi oleh hewan ternak. Biogas ini dapat menjadi [[sumber energi terbaharui]] di kemudian hari. |
Metana juga terdapat pada [[biogas]] yang diproduksi oleh hewan ternak. Biogas ini dapat menjadi [[sumber energi terbaharui]] di kemudian hari. |
||
Alkana hampir tidak dapat bercampur dengan air, jadi kandungannya dalam air laut bisa dikatakan amat sedikit. Meski begitu, pada tekanan yang tinggi dan suhu rendah (seperti di dasar laut), metana dapat mengkristal dengan air untuk membentuk padatan [[metana hidrat]]. Meskipun saat ini padatan ini masih belum bisa dieksploitasi secara komersial, |
Alkana hampir tidak dapat bercampur dengan air, jadi kandungannya dalam air laut bisa dikatakan amat sedikit. Meski begitu, pada tekanan yang tinggi dan suhu rendah (seperti di dasar laut), metana dapat mengkristal dengan air untuk membentuk padatan [[metana hidrat]]. Meskipun saat ini padatan ini masih belum bisa dieksploitasi secara komersial, tetapi energi pembakaran yang dihasilkan diperkirakan cukup besar. Maka dari itu, metana yang diekstraksi dari metana hidrat dapat dianggap sebagai bahan bakar masa depan. |
||
===Pada bidang biologi=== |
=== Pada bidang biologi === |
||
;Bakteria dan archaea |
;Bakteria dan archaea |
||
[[ |
[[Berkas:Rotbuntes Rind.jpg|jmpl|ka|[[Archaea]] [[Metanogen]]ik pada kotoran sapi ini menghasilkan [[metana]] yang terlepas ke atmosfer bumi.]] |
||
Beberapa jenis [[archaea]], misalnya [[metanogen]], memproduksi [[metana]] dalam jumlah besar ketika memetabolisme [[karbon dioksida]] atau senyawa organik lainnya. Energi dilepas ketika pengoksidasian [[hidrogen]]: |
Beberapa jenis [[archaea]], misalnya [[metanogen]], memproduksi [[metana]] dalam jumlah besar ketika memetabolisme [[karbon dioksida]] atau senyawa organik lainnya. Energi dilepas ketika pengoksidasian [[hidrogen]]: |
||
| Baris 292: | Baris 159: | ||
== Produksi == |
== Produksi == |
||
=== Pengilangan minyak === |
=== Pengilangan minyak === |
||
[[Berkas:ShellMartinez-refi.jpg| |
[[Berkas:ShellMartinez-refi.jpg|jmpl|ka|Sebuah [[pengilangan minyak]] di [[Martinez, California|Martinez]], [[California]].]] |
||
Seperti sudah dikatakan sebelumnya, sumber alkana yang paling penting adalah [[gas alam]] dan [[minyak bumi]].<ref name=m&b/> Alkana dipisahkan di tempat [[pengilangan minyak]] dengan teknik |
Seperti sudah dikatakan sebelumnya, sumber alkana yang paling penting adalah [[gas alam]] dan [[minyak bumi]].<ref name=m&b/> Alkana dipisahkan di tempat [[pengilangan minyak]] dengan teknik [[distilasi fraksi]] dan diproses menjadi bermacam-macam produk, misalnya bensin, diesel, dan avtur.. |
||
=== Fischer-Tropsch === |
=== Fischer-Tropsch === |
||
| Baris 310: | Baris 177: | ||
== Penggunaan == |
== Penggunaan == |
||
Penggunaan alkana sudah dapat diketahui dengan baik oleh manusia. Penggunaan alkana biasanya dikelompokkan berdasarkan jumlah atom karbonnya. Empat alkana pertama digunakan pada umumnya untuk keperluan memasak dan pemanasan, di beberapa negara juga sebagai sumber pembangkit listrik. [[Metana]] dan [[etana]] adalah komponen utama pada gas alam dan biasanya diangkut dalam bentuk cairan, dengan cara dikompresi terlebih dahulu dan gas didinginkan. |
Penggunaan alkana sudah dapat diketahui dengan baik oleh manusia. Penggunaan alkana biasanya dikelompokkan berdasarkan jumlah atom karbonnya. Empat alkana pertama digunakan pada umumnya untuk keperluan memasak dan pemanasan, di beberapa negara juga sebagai sumber pembangkit listrik. [[Metana]] dan [[etana]] adalah komponen utama pada gas alam dan biasanya diangkut dalam bentuk cairan, dengan cara dikompresi terlebih dahulu dan gas didinginkan. |
||
[[Propana]] dan [[butana]] dapat dicairkan dengan tekanan rendah. Propana dan butana umum dijumpai pada [[elpiji]] dan juga dipakai sebagai propelan (zat pendorong) pada [[semprotan aerosol]]. Butana juga ditemukan pada pemantik rokok cair. |
[[Propana]] dan [[butana]] dapat dicairkan dengan tekanan rendah. Propana dan butana umum dijumpai pada [[elpiji]] dan juga dipakai sebagai propelan (zat pendorong) pada [[semprotan aerosol]]. Butana juga ditemukan pada pemantik rokok cair. |
||
| Baris 316: | Baris 183: | ||
Dari [[pentana]] sampai [[oktana]] merupakan alkana yang berbentuk cairan. Alkana ini umum digunakan sebagai bahan bakar bensin untuk [[mesin pembakaran dalam|mesin mobil]]. Alkana rantai bercabang lebih diutamakan karena cenderung lebih tidak mudah tersulut daripada alkana rantai lurus. Bahan bakar yang mudah tersulut akan menimbulkan [[ketukan mesin|ketukan]] pada mesin yang dapat merusak mesin. Kualitas bahan bakar dapat diukur dengan [[bilangan oktan]] bahan bakar itu, dimana bilangan oktan ditentukan dari berapa persen kandungan [[2,2,4-trimetilpentana]] (''isooktana'') pada bahan bakar (bahan bakar yang bilangan oktannya 98 berarti mengandung 98% isooktana, sisanya adalah [[heptana]]). Selain digunakan untuk bahan bakar, alkana-alkana ini juga dipakai sebagai [[pelarut]] untuk senyawa nonpolar. |
Dari [[pentana]] sampai [[oktana]] merupakan alkana yang berbentuk cairan. Alkana ini umum digunakan sebagai bahan bakar bensin untuk [[mesin pembakaran dalam|mesin mobil]]. Alkana rantai bercabang lebih diutamakan karena cenderung lebih tidak mudah tersulut daripada alkana rantai lurus. Bahan bakar yang mudah tersulut akan menimbulkan [[ketukan mesin|ketukan]] pada mesin yang dapat merusak mesin. Kualitas bahan bakar dapat diukur dengan [[bilangan oktan]] bahan bakar itu, dimana bilangan oktan ditentukan dari berapa persen kandungan [[2,2,4-trimetilpentana]] (''isooktana'') pada bahan bakar (bahan bakar yang bilangan oktannya 98 berarti mengandung 98% isooktana, sisanya adalah [[heptana]]). Selain digunakan untuk bahan bakar, alkana-alkana ini juga dipakai sebagai [[pelarut]] untuk senyawa nonpolar. |
||
Alkana dari [[nonana]] sampai [[heksadekana]] (16 atom karbon) merupakan alkana berbentuk cairan dengan [[viskositas]] yang lebih tinggi, dan tidak digunakan pada bensin. Alkana jenis ini biasanya digunakan pada [[bahan bakar diesel]] dan [[bahan bakar penerbangan]]. Kualitas bahan bakar diesel diesel dapat ditentukan dengan besarnya [[bilangan cetana]] (cetana adalah nama lama untuk heksadekana). Alkana jenis ini mempunyai titik didih yang tinggi, dan akan menyebabkan masalah jika suhu udara terlalu rendah, karena bahan bakar akan semakin mengental sehingga sulit mengalir. |
Alkana dari [[nonana]] sampai [[heksadekana]] (16 atom karbon) merupakan alkana berbentuk cairan dengan [[viskositas]] yang lebih tinggi, dan tidak digunakan pada bensin. Alkana jenis ini biasanya digunakan pada [[bahan bakar diesel]] dan [[bahan bakar penerbangan]]. Kualitas bahan bakar diesel diesel dapat ditentukan dengan besarnya [[bilangan cetana]] (cetana adalah nama lama untuk heksadekana). Alkana jenis ini mempunyai titik didih yang tinggi, dan akan menyebabkan masalah jika suhu udara terlalu rendah, karena bahan bakar akan semakin mengental sehingga sulit mengalir. |
||
Alkana dari heksadekana kebelakang biasanya merupakan komponen pada [[minyak bakar]] dan [[pelumas]]. Beberapa jenis alkana ini juga digunakan sebagai zat anti korosif karena sifatnya yang hidrofobik. |
Alkana dari heksadekana kebelakang biasanya merupakan komponen pada [[minyak bakar]] dan [[pelumas]]. Beberapa jenis alkana ini juga digunakan sebagai zat anti korosif karena sifatnya yang hidrofobik. |
||
| Baris 327: | Baris 194: | ||
Ketika dilepaskan ke lingkungan, alkana tidak akan mengalami biodegradasi yang cepat, karena alkana tidak memiliki gugus fungsi (seperti [[hidroksil]] atau [[karbonil]]) yang diperlukan oleh banyak organisme untuk memetabolisme senyawa ini. |
Ketika dilepaskan ke lingkungan, alkana tidak akan mengalami biodegradasi yang cepat, karena alkana tidak memiliki gugus fungsi (seperti [[hidroksil]] atau [[karbonil]]) yang diperlukan oleh banyak organisme untuk memetabolisme senyawa ini. |
||
Meski begitu, ada beberapa bakteri yang dapat memetabolisme beberapa alkana dengan cara [[oksidasi|mengoksidasi]] atom karbon terminal. Hasilnya adalah [[alkohol]], yang dapat dioksidasi lagi menjadi [[aldehida]], dan dioksidasi lagi menjadi [[asam karboksilat]]. Hasil akhirnya yang berupa [[asam lemak]] dapat dimetabolisme melalui proses [[degradasi asam lemak]]. |
Meski begitu, ada beberapa bakteri yang dapat memetabolisme beberapa alkana dengan cara [[oksidasi|mengoksidasi]] atom karbon terminal. Hasilnya adalah [[alkohol]], yang dapat dioksidasi lagi menjadi [[aldehida]], dan dioksidasi lagi menjadi [[asam karboksilat]]. Hasil akhirnya yang berupa [[asam lemak]] dapat dimetabolisme melalui proses [[degradasi asam lemak]]. |
||
== Bahaya == |
== Bahaya == |
||
| Baris 345: | Baris 212: | ||
{{portalkimia}} |
{{portalkimia}} |
||
{{Commons|Homologous series of alkanes|Alkana}} |
{{Commons|Homologous series of alkanes|Alkana}} |
||
* [http://www.cem.msu.edu/~reusch/VirtualText/intro1.htm Virtual Textbook of Organic Chemistry] |
* [http://www.cem.msu.edu/~reusch/VirtualText/intro1.htm Virtual Textbook of Organic Chemistry] {{Webarchive|url=https://web.archive.org/web/20071029211245/http://www.cem.msu.edu/~reusch/VirtualText/intro1.htm |date=2007-10-29 }} |
||
{{Hidrokarbon}} |
|||
{{Templat:Gugus_fungsi}} |
|||
{{Alkana}} |
{{Alkana}} |
||
{{Gugus fungsi}} |
|||
{{CabangKimia}} |
|||
{{Authority control}} |
|||
[[Kategori:Alkana| ]] |
[[Kategori:Alkana| ]] |
||
[[Kategori:Senyawa organik]] |
[[Kategori:Senyawa organik]] |
||
[[Kategori:Hidrokarbon]] |
[[Kategori:Hidrokarbon]] |
||
[[Kategori:Gugus |
[[Kategori:Gugus fungsi]] |
||
[[Kategori:Senyawa karbon]] |
|||
{{Link FA|de}} |
|||
{{Link FA|sl}} |
|||
Revisi terkini sejak 9 Februari 2024 16.03

Alkana (juga disebut dengan parafin) adalah senyawa kimia hidrokarbon jenuh asiklis. Alkana termasuk senyawa alifatik. Dengan kata lain, alkana adalah sebuah rantai karbon panjang dengan ikatan-ikatan tunggal. Rumus umum untuk alkana adalah CnH2n+2. Alkana yang paling sederhana adalah metana dengan rumus CH4[1]. Tidak ada batasan berapa karbon yang dapat terikat bersama. Beberapa jenis minyak dan wax adalah contoh alkana dengan atom jumlah atom karbon yang besar, bisa lebih dari 10 atom karbon.
Setiap atom karbon mempunyai 4 ikatan (baik ikatan C-H atau ikatan C-C), dan setiap atom hidrogen mesti berikatan dengan atom karbon (ikatan H-C). Sebuah kumpulan dari atom karbon yang terangkai disebut juga dengan rumus kerangka. Secara umum, jumlah atom karbon digunakan untuk mengukur berapa besar ukuran alkana tersebut (contohnya: C2-alkana).
Gugus alkil, biasanya disingkat dengan simbol R, adalah gugus fungsional, yang seperti alkana, terdiri dari ikatan karbon tunggal dan atom hidrogen, contohnya adalah metil atau gugus etil.
Alkana bersifat tidak terlalu reaktif dan mempunyai aktivitas biologi sedikit.
Klasifikasi struktur[sunting | sunting sumber]
Hidorkarbon tersaturasi dapat berupa:
- lurus (rumus umum CnH2n + 2), kerangka karbon membentuk rantai lurus tanpa ada cabang
- bercabang (rumus umum CnH2n + 2, n > 3), kerangka karbon utamanya mempunyai cabang-cabang
- siklik (rumus umum CnH2n, n > 2), ujung-ujung kerangka karbonnya bertemu sehingga membentuk suatu siklus.
Menurut definisi dari IUPAC, 2 golongan pertama di atas dinamakan alkana, sedangkan golongan yang ketiga disebut dengan sikloalkana.[2] Hidrokarbon tersaturasi juga dapat membentuk gabungan ketiga macam rantai diatas, misalnya linear dengan siklik membentuk polisiklik. Senyawa seperti ini masih disebut dengan alkana (walaupun tidak mempunyai rumus umum), sepanjang tetap berupa asiklik (tidak seperti siklus).
Keisomeran[sunting | sunting sumber]
Bisiklo[1.1.0]butana (C4H6) tidak mempunyai isomer; tetrahedrana (tidak terlihat) (C4H4) juga tidak mempunyai isomer.
Alkana dengan 3 atom karbon atau lebih dapat disusun dengan banyak macam cara, membentuk isomer struktur yang berbeda-beda. Sebuah isomer, sebagai sebuah bagian, mirip dengan anagram kimia, tetapi berbeda dengan anagram, isomer dapat berisi jumlah komponen dan atom yang berbeda-beda, sehingga sebuah senyawa kimia dapat disusun berbeda-beda strukturnya membentuk kombinasi dan permutasi yang beraneka ragam. Isomer paling sederhana dari sebuah alkana adalah ketika atom karbonnya terpasang pada rantai tunggal tanpa ada cabang. Isomer ini disebut dengan n-isomer (n untuk "normal", penulisannya kadang-kadang tidak dibutuhkan). Meskipun begitu, rantai karbon dapat juga bercabang di banyak letak. Kemungkinan jumlah isomer akan meningkat tajam ketika jumlah atom karbonnya semakin besar.Contohnya:
- C1: tidak memiliki isomer: metana
- C2: tidak memiliki isomer: etana
- C3: tidak memiliki isomer: propana
- C4: 2 isomer: n-butana & isobutana
- C5: 3 isomer: pentana, isopentana, neopentana
- C6: 5 isomer: heksana, 2-Metilpentana, 3-Metilpentana, 2,3-Dimetilbutana & 2,2-Dimetilbutana
- C12: 355 isomer
- C32: 27.711.253.769 isomer
- C60: 22.158.734.535.770.411.074.184 isomer, banyak di antaranya tidak stabil.
Tata nama[sunting | sunting sumber]
Tata nama IUPAC untuk alkana didasarkan dari identifikasi rantai hidrokarbon. Rantai hidrokarbon tersaturasi, tidak bercabang maka dinamai sistematis dengan akhiran "-ana".[3]
Rantai karbon lurus[sunting | sunting sumber]
Alkana rantai karbon lurus biasanya dikenali dengan awalan n- (singkatan dari normal) ketika tidak ada isomer. Meskipun tidak diwajibkan, tetapi penamaan ini penting karena alkana rantai lurus dan rantai bercabang memiliki sifat yang berbeda. Misalnya n-heksana atau 2- atau 3-metilpentana.
Anggota dari rantai lurus ini adalah:
- Metana, CH4 - 1 karbon dan 4 hidrogen
- Etana, C2H6 - 2 karbon dan 6 hidrogen
- Propana, C3H8 - 3 karbon dan 8 hidrogen
- Butana, C4H10 - 4 karbon dan 10 hidrogen
- Pentana, C5H12 - 5 karbon dan 12 hidrogen
- Heksana, C6H14 - 6 carbon dan 14 hidrogen
Mulai dengan jumlah karbon mulai dari lima diberi nama dengan imbuhan jumlah yang ditentukan IUPAC diakhiri dengan -ana. Contohnya antara lain adalah pentana, heksana, heptana, dan oktana.
Rantai karbon bercabang[sunting | sunting sumber]
Untuk memberi nama alkana dengan rantai bercabang digunakan langkah-langkah berikut:
- Cari rantai atom karbon terpanjang
- Beri nomor pada rantai tersebut, dimulai dari ujung yang terdekat dengan cabang
- Beri nama pada cabang-cabangnya
Nama alkana dimulai dengan nomor letak cabang, nama cabang, dan nama rantai utama. Contohnya adalah 2,2,4-trimetilpentana yang disebut juga isooktana. Rantai terpanjangnya adalah pentana, dengan tiga buah cabang metil (trimetil) pada karbon nomor 2, 2, dan 4.
| Nama umum/trivial | n-pentana | isopentana | neopentana |
|---|---|---|---|
| Nama IUPAC | pentana | 2-metilbutana | 2,2-dimetilpentana |
| Struktur |  |
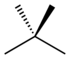
|
Alkana siklik[sunting | sunting sumber]
Sikloalkana adalah hidrokarbon yang seperti alkana, tetapi rantai karbonnya membentuk cincin.
Sikloalkana sederhana mempunyai awalan "siklo-" untuk membendakannya dari alkana. Penamaan sikloalkana dilihat dari berapa banyak atom karbon yang dikandungnya, misalnya siklopentana (C5H10) adalah sikloalkana dengan 5 atom karbon seperti pentana(C5H12), hanya saja pada siklopentana kelima atom karbonnya membentuk cincin. Hal yang sama berlaku untuk propana dan siklopropana, butana dan siklobutana, dll.
Sikloalkana substitusi dinamai mirip dengan alkana substitusi - cincin sikloalkananya tetap ada, dan substituennya dinamai sesuai dengan posisi mereka pada cincin tersebut, pemberian nomornya mengikuti aturan Cahn-Ingold-Prelog.[4]
Nama-nama trivial[sunting | sunting sumber]
Nama trivial (non-IUPAC) dari alkana adalah "parafin." Nama trivial dari senyawa-senyawa ini biasanya diambil dari artefak-artefak sejarah. Nama trivial digunakan sebelum ada nama sistematik, dan sampai saat ini masih digunakan karena penggunaannya familier di industri.
Dapat hampir dipastikan kalau nama parafin diambil dari industri petrokimia. Alkana rantai bercabang disebut isoparafin. Penggunaan kata "paraffin" untuk sebutan secara umum dan sering kali tidak membedakan antara senyawa murni dan campuran isomer dengan rumus kimia yang sama.
Beberapa nama ini dipertahankan oleh IUPAC
- Isobutana untuk 2-metilpropana
- Isopentana untuk 2-metilbutana
- Isooktana untuk 2,2,4-trimetilpentana
- Neopentana untuk 2,2-dimetilpropana
Sifat-sifat kimia[sunting | sunting sumber]
Secara umum, alkana adalah senyawa yang reaktivitasnya rendah, karena ikatan C antar atomnya relatif stabil dan tidak mudah dipisahkan. Tidak seperti kebanyakan senyawa organik lainnya, senyawa ini tidak memiliki gugus fungsional.
Senyawa alkana bereaksi sangat lemah dengan senyawa polar atau senyawa ion lainnya. Konstanta disosiasi asam (pKa) dari semua alkana nilainya diatas 60, yang berarti sulit untuk bereaksi dengan asam maupun basa (lihat karbanion). Pada minyak bumi, molekul-molekul alkana yang terkandung di dalamnya tidak mengalami perubahan sifat sama sekali selama jutaan tahun.
Reaksi dengan oksigen (reaksi pembakaran)[sunting | sunting sumber]
Semua alkana dapat bereaksi dengan oksigen pada reaksi pembakaran, meskipun pada alkana-alkana suku tinggi reaksi akan semakin sulit untuk dilakukan seiring dengan jumlah atom karbon yang bertambah. Rumus umum pembakaran adalah:
- CnH2n+2 + (1.5n+0.5)O2 → (n+1)H2O + nCO2
Ketika jumlah oksigen tidak cukup banyak, maka dapat juga membentuk karbon monoksida, seperti pada reaksi berikut ini:
Contoh reaksi, metana:
- 2CH4 + 3O2 → 2CO + 4H2O
- CH4 + 1.5O2 → CO + 2H2O
Reaksi dengan halogen[sunting | sunting sumber]
Reaksi antara alkana dengan halogen disebut dengan reaksi "halogenasi radikal bebas". Atom hidrogen pada alkana akan secara bertahap digantikan oleh atom-atom halogen. Radikal bebas adalah senyawa yang ikut berpartisipasi dalam reaksi, biasanya menjadi campuran pada produk. Reaksi halogenasi merupakan reaksi eksotermik dan dapat menimbulkan ledakan.
Reaksi ini sangat penting pada industri untuk menghalogenasi hidrokarbon. Ada 3 tahap:
- Inisiasi: radikal halogen terbentuk melalui homolisis. Biasanya, diperlukan energi dalam bentuk panas atau cahaya.
- Reaksi rantai atau Propagasi: radikal halogen akan mengabstrak hidrogen dari alkana untuk membentuk radikal alkil.
- Terminasi rantai: tahap dimana radikal-radikal bergabung.
Hasil eksperimen menunjukkan bahwa semua reaksi halogenasi bisa menghasilkan semua campuran isomer yang berarti mengindikasikan atom hidrogen rentan terhadap reaksi. Atom hidrogen sekunder dan tersier biasanya akan tergantikan karena stablitas radikal bebas sekunder dan tersier lebih baik. Contoh dapat dilihat pada monobrominasi propana:[5]

Isomerisasi dan reformasi[sunting | sunting sumber]
Isomerisasi dan reformasi ada proses pemanasan yang mengubah bentuk alkana rantai lurus dengan adanya katalis platinum. Pada isomerisasi, alkana rantai lurus menjadi alkana rantai bercabang. Pada reformasi, alkana rantai lurus berubah menjadi sikloalkana atau hidrokarbon aromatik, dengan hidrogen sebagai produk sampingan. Kedua proses ini akan meningkatkan bilangan oktan pada senyawa yang dihasilkan.
Cracking[sunting | sunting sumber]
Cracking akan memecah molekul besar menjadi molekul-molekul yang lebih kecil. Reaksi cracking dapat dilakukan dengan metode pemanasan atau dengan katalis. Metode cracking dengan pemanasan akan melibatkan mekanisme homolitik dengan pembentukan radikal bebas. Metode cracking dengan bantuan katalis biasanya melibatkan katalis asam, prosesnya akan menyebabkan pemecahan ikatan heterolitik dengan menghasilkan ion yang muatannya berbeda. Ion yang dihasilkan biasanya berupa karbokation dan anion hidrida yang tidak stabil.
Reaksi lainnya[sunting | sunting sumber]
Alkana akan bereaksi dengan uap dengan bantuan katalis berupa nikel. Alkana juga dapat melalui proses klorosulfonasi dan nitrasi meskipun membutuhkan kondisi khusus. Fermentasi alkana menjadi asam karboksilat juga dapat dilakukan dengan beberapa teknik khusus. Pada Reaksi reed, sulfur dioksida, klorin dan cahaya mengubah hidrokarbon menjadi sulfonil klorida. Abstraksi nukleofilik dapat digunakan untuk memisahkan alkana dari logam. Gugus alkil daris sebuah senyawa dapat dipindahkan ke senyawa lainnya dengan reaksi transmetalasi.
Terdapat pada[sunting | sunting sumber]
Alkana pada alam semesta[sunting | sunting sumber]


Alkana adalah senyawa yang terdapat pada sebagian kecil dari atmosfer beberapa planet seperti Yupiter (0.1% metana, 0.0002% etana), Saturnus (0.2% metana, 0.0005% etana), Uranus (1.99% metana, 0.00025% etana) dan Neptunus (1.5% metana, 1.5 ppm etana). Titan (1.6% metana), salah satu satelit dari Saturnus, telah diteliti oleh Huygens bahwa atmosfer Titan menurunkan hujan metana secara periodik ke permukaan bulan itu.[6] Di Titan juga diketahui terdapat sebuah gunung yang menyemburkan gas metana, dan semburan gunung ini menyebabkan banyaknya metana pada atmosfer Titan. Selain itu, ditemukan oleh radar Cassini, terlihat juga ada beberapa danau metana/etana di kawasan kutub utara dari Titan. Metana dan etana juga diketahui terdapat pada bagian ekor dari komet Hyakutake. Analisis kimia menunjukkan bahwa kelimpahan etana dan metana hampir sama banyak, dan hal itu menunjukkan bahwa es metana dan etana ini terbentuk di antara ruang antar bintang.[7]
Alkana di bumi[sunting | sunting sumber]
Gas metana (sekitar 0.0001% atau 1 ppm) ada di atmosfer bumi, diproduksi oleh organisme macam Archaea dan juga ditemukan pada kotoran sapi.
Sumber alkana yang paling penting adalah pada gas alam dan minyak bumi.[5] Gas alam mengandung metana dan etana, dengan sedikit propana dan butana, sedangkan minyak bumi adalah campuran dari alkana cair dan hidrokarbon lainnya. Hidrokarbon ini terbentuk dari jasad renik dan tanaman (zooplankton dan fitoplankton) yang mati, kemudian terkubur di lautan, tertutup oleh sedimentasi, dan berubah setelah terkena panas dan tekanan tinggi selama jutaan tahun. Gas alam terbentuk dari reaksi di bawah ini:
- C6H12O6 → 3CH4 + 3CO2
Alkana yang berwujud padat dikenal sebagai tar. Tar terbentuk ketika senyawa alkana lain yang lebih ringan menguap dari deposit/sumber hidrokarbon. Salah satu deposit alkana padat alam terbesar di dunia adalah danau aspal yang dikenal dengan nama Danau Pitch di Trinidad dan Tobago.
Metana juga terdapat pada biogas yang diproduksi oleh hewan ternak. Biogas ini dapat menjadi sumber energi terbaharui di kemudian hari.
Alkana hampir tidak dapat bercampur dengan air, jadi kandungannya dalam air laut bisa dikatakan amat sedikit. Meski begitu, pada tekanan yang tinggi dan suhu rendah (seperti di dasar laut), metana dapat mengkristal dengan air untuk membentuk padatan metana hidrat. Meskipun saat ini padatan ini masih belum bisa dieksploitasi secara komersial, tetapi energi pembakaran yang dihasilkan diperkirakan cukup besar. Maka dari itu, metana yang diekstraksi dari metana hidrat dapat dianggap sebagai bahan bakar masa depan.
Pada bidang biologi[sunting | sunting sumber]
- Bakteria dan archaea

Beberapa jenis archaea, misalnya metanogen, memproduksi metana dalam jumlah besar ketika memetabolisme karbon dioksida atau senyawa organik lainnya. Energi dilepas ketika pengoksidasian hidrogen:
- CO2 + 4H2 → CH4 + 2H2O
Produksi[sunting | sunting sumber]
Pengilangan minyak[sunting | sunting sumber]

Seperti sudah dikatakan sebelumnya, sumber alkana yang paling penting adalah gas alam dan minyak bumi.[5] Alkana dipisahkan di tempat pengilangan minyak dengan teknik distilasi fraksi dan diproses menjadi bermacam-macam produk, misalnya bensin, diesel, dan avtur..
Fischer-Tropsch[sunting | sunting sumber]
Proses Fischer-Tropsch adalah sebuah metode untuk mensintesis hidrokarbon cair, termasuk alkana, dari karbon dioksida dan hidrogen. Metode ini digunakan untuk memproduksi substitusi dari distilat minyak bumi.
Persiapan laboratorium[sunting | sunting sumber]
Sedikit sekali alkana yang dibuat dengan cara disintesis di laboratorium karena alkana biasanya dijual umum. Alkana juga merupakan senyawa yang non reaktif, baik secara biologi maupun kimia. Ketika alkana dibuat di laboratorium, biasanya alkana adalah produk samping dari reaksi. Sebagai contoh, penggunaan n-butillitium sebagai basa akan menghasilkan produk sampingan n-butana:
- C4H9Li + H2O → C4H10 + LiOH
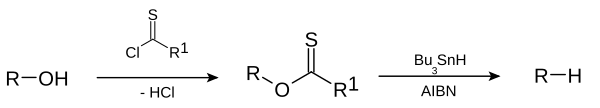
Alkana atau gugus alkil dapat dibuat dari alkil halida pada reaksi Corey-House-Posner-Whitesides. Deoksigenasi Barton-McCombie[8][9] akan memecah gugus hidroksil dari alkohol sehingga reaksinya akan berupa:
dan reduksi Clemmensen[10][11][12][13] akan memecah gugus karbonil dari aldehida dan keton untuk membentuk alkana atau senyawa dengan gugus alkil, misalnya:
Penggunaan[sunting | sunting sumber]
Penggunaan alkana sudah dapat diketahui dengan baik oleh manusia. Penggunaan alkana biasanya dikelompokkan berdasarkan jumlah atom karbonnya. Empat alkana pertama digunakan pada umumnya untuk keperluan memasak dan pemanasan, di beberapa negara juga sebagai sumber pembangkit listrik. Metana dan etana adalah komponen utama pada gas alam dan biasanya diangkut dalam bentuk cairan, dengan cara dikompresi terlebih dahulu dan gas didinginkan.
Propana dan butana dapat dicairkan dengan tekanan rendah. Propana dan butana umum dijumpai pada elpiji dan juga dipakai sebagai propelan (zat pendorong) pada semprotan aerosol. Butana juga ditemukan pada pemantik rokok cair.
Dari pentana sampai oktana merupakan alkana yang berbentuk cairan. Alkana ini umum digunakan sebagai bahan bakar bensin untuk mesin mobil. Alkana rantai bercabang lebih diutamakan karena cenderung lebih tidak mudah tersulut daripada alkana rantai lurus. Bahan bakar yang mudah tersulut akan menimbulkan ketukan pada mesin yang dapat merusak mesin. Kualitas bahan bakar dapat diukur dengan bilangan oktan bahan bakar itu, dimana bilangan oktan ditentukan dari berapa persen kandungan 2,2,4-trimetilpentana (isooktana) pada bahan bakar (bahan bakar yang bilangan oktannya 98 berarti mengandung 98% isooktana, sisanya adalah heptana). Selain digunakan untuk bahan bakar, alkana-alkana ini juga dipakai sebagai pelarut untuk senyawa nonpolar.
Alkana dari nonana sampai heksadekana (16 atom karbon) merupakan alkana berbentuk cairan dengan viskositas yang lebih tinggi, dan tidak digunakan pada bensin. Alkana jenis ini biasanya digunakan pada bahan bakar diesel dan bahan bakar penerbangan. Kualitas bahan bakar diesel diesel dapat ditentukan dengan besarnya bilangan cetana (cetana adalah nama lama untuk heksadekana). Alkana jenis ini mempunyai titik didih yang tinggi, dan akan menyebabkan masalah jika suhu udara terlalu rendah, karena bahan bakar akan semakin mengental sehingga sulit mengalir.
Alkana dari heksadekana kebelakang biasanya merupakan komponen pada minyak bakar dan pelumas. Beberapa jenis alkana ini juga digunakan sebagai zat anti korosif karena sifatnya yang hidrofobik.
Alkana dengan jumlah karbon 35 atau lebih ditemukan pada bitumen (aspal) yang dipakai untuk melapisi jalan. Selain itu, karena nilainya juga rendah, maka alkana-alkana jenis ini biasanya dipecah menjadi alkana yang lebih kecil dengan metode cracking.
Beberapa polimer sintetis seperti polietilena dan polipropilena adalah alkana yang terdiri dari ratusan atom karbon. Material-material ini umumnya dikenal sebagai plastik dan setiap tahunnya diproduksi milyaran kilogram di dunia.
Transformasi di lingkungan[sunting | sunting sumber]
Ketika dilepaskan ke lingkungan, alkana tidak akan mengalami biodegradasi yang cepat, karena alkana tidak memiliki gugus fungsi (seperti hidroksil atau karbonil) yang diperlukan oleh banyak organisme untuk memetabolisme senyawa ini.
Meski begitu, ada beberapa bakteri yang dapat memetabolisme beberapa alkana dengan cara mengoksidasi atom karbon terminal. Hasilnya adalah alkohol, yang dapat dioksidasi lagi menjadi aldehida, dan dioksidasi lagi menjadi asam karboksilat. Hasil akhirnya yang berupa asam lemak dapat dimetabolisme melalui proses degradasi asam lemak.
Bahaya[sunting | sunting sumber]
Metana bersifat eksplosif (mudah meledak) ketika bercampur dengan udara (1 – 8% CH4). Alkana suku rendah lainnya juga mudah meledak apabila bercampur dengan udara. Alkana suku rendah yang berbentuk cairan sangat mudah terbakar. Pentana, heksana, heptana, dan oktana digolongkan sebagai senyawa yang berbahaya bagi lingkungan dan beracun. Isomer rantai lurus dari heksana bersifat neurotoksin. Alkana dengan halogen, seperti kloroform, juga dapat bersifat karsinogenik.
Lihat pula[sunting | sunting sumber]
Referensi[sunting | sunting sumber]
- ^ Rengga, Wara Dyah Pita; Putri, Rr Dewi Artanti. Kimia Organik I: Gugus Fungsi dalam Monomer. Perkumpulan Rumah Cemerlang Indonesia. ISBN 978-623-6478-43-1.
- ^ IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (2006–) "alkanes".
- ^ IUPAC, Commission on Nomenclature of Organic Chemistry (1993). "R-2.2.1: Hydrocarbons". A Guide to IUPAC Nomenclature of Organic Compounds (Recommendations 1993). Blackwell Scientific. ISBN 0632034882. Diakses tanggal 12 February 2007.
- ^ William Reusch. "Nomenclature - Alkanes". Virtual Textbook of Organic Chemistry. Diarsipkan dari versi asli tanggal 2010-04-30. Diakses tanggal 2012-03-04.
- ^ a b c R. T. Morrison; R. N. Boyd (1992). Organic Chemistry (edisi ke-6th). New Jersey: Prentice Hall. ISBN 978-0-13-643669-0.
- ^ Titan: Arizona in an Icebox?, Emily Lakdawalla, 21 January 2004, verified 28 March 2005
- ^ Mumma, M.J. (1996). "Detection of Abundant Ethane and Methane, Along with Carbon Monoxide and Water, in Comet C/1996 B2 Hyakutake: Evidence for Interstellar Origin". Science. 272 (5266): 1310. Bibcode:1996Sci...272.1310M. doi:10.1126/science.272.5266.1310. PMID 8650540.
- ^ Barton, D. H. R.; McCombie, S. W. (1975). "A new method for the deoxygenation of secondary alcohols". J. Chem. Soc., Perkin Trans. 1 (16): 1574–1585. doi:10.1039/P19750001574.
- ^ Crich, David; Quintero, Leticia (1989). "Radical chemistry associated with the thiocarbonyl group". Chem. Rev. 89 (7): 1413–1432. doi:10.1021/cr00097a001.
- ^ Martin, E. L. Org. React. 1942, 1, 155. (Review)
- ^ Buchanan, J. G. St. C.; Woodgate, P. D. Quart. Rev. 1969, 23, 522. (Review)
- ^ Vedejs, E. Org. React. 1975, 22, 401. (Review)
- ^ Yamamura, S.; Nishiyama, S. Comp. Org. Syn. 1991, 8, 309-313.(Review)
Bacaan lebih lanjut[sunting | sunting sumber]
- Virtual Textbook of Organic Chemistry Diarsipkan 2007-10-29 di Wayback Machine.